Нитробензол
advertisement
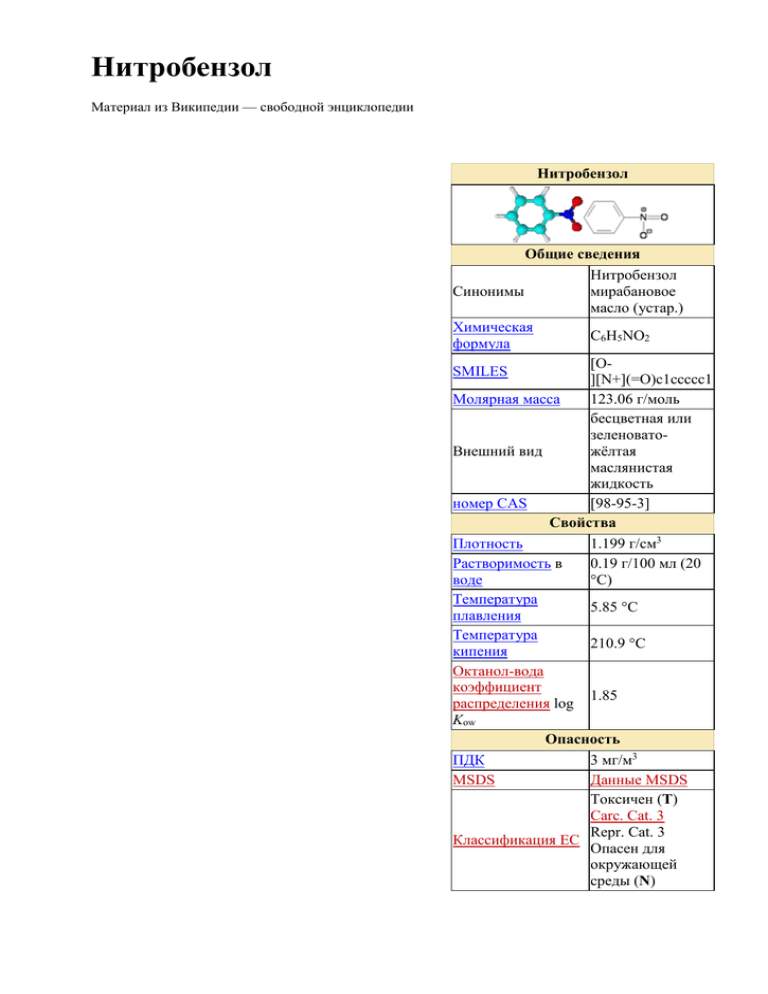
Нитробензол Материал из Википедии — свободной энциклопедии Нитробензол Общие сведения Нитробензол Синонимы мирабановое масло (устар.) Химическая C6H5NO2 формула [OSMILES ][N+](=O)c1ccccc1 Молярная масса 123.06 г/моль бесцветная или зеленоватоВнешний вид жёлтая маслянистая жидкость номер CAS [98-95-3] Свойства Плотность 1.199 г/см3 Растворимость в 0.19 г/100 мл (20 воде °C) Температура 5.85 °C плавления Температура 210.9 °C кипения Октанол-вода коэффициент 1.85 распределения log Kow Опасность ПДК 3 мг/м3 MSDS Данные MSDS Токсичен (T) Carc. Cat. 3 Repr. Cat. 3 Классификация ЕС Опасен для окружающей среды (N) Нитробензол — токсичное органическое вещество, имеющее миндальный запах. Формула C6H5NO2. Внешний вид — ярко-желтые кристаллы или маслянистая жидкость, не растворимая в воде. Применяется как растворитель и мягкий окислитель. В основном используется как полупродукт для производства анилина. NFPA 704 R23/24/25, R40, R-phrases — R48/23/24, обозначения риска R51/53, R62 S-phrases — (S1/2), S28, обозначения S36/37, хранения S45, S61 Твспышки 88 °C Т 525 °C самовоспламенения RTECS номер QJ0525000 Supplementary data page Структура и n, εr, и т. д. свойства Фазовые Термодинамические состояния данные твердое, жидкое, газ УФ, ИК, NMR, Спектральные MS — массданные спектральные данные Related compounds Анилин Родственные Бензол соединения Нитрозобензол Данные приведены для стандартного состояния (25 °C, 100 kPa), если не отмечено иное Infobox disclaimer and references Содержание [убрать] 1 Применение 2 Получение o 2.1 Промышленное o 2.2 Лабораторное 3 Химические свойства o 3.1 Электрофильное замещение o 3.2 Нуклеофильное замещение o 3.3 Восстановление 4 Токсичность 5 Ссылки Применение Исходное сырьё в производстве анилина, ароматических азотсодержащих соединений (бензидин, хинолин, азобензол), растворитель эфиров целлюлозы, компонент полировальных составов для металлов. Получение Промышленное В промышленности нитробензол получают непрерывным нитрованием бензола смесью концентрированых H2SO4 и HNO3 с выходом 96-99 %. Лабораторное Добавление бензола к смеси H2SO4 (1,84 г/см3) и HNO3 (1,4 г/см3) в соотношении 1:1 при 5560 °C (45 мин). Выход 80 %. Химические свойства Электрофильное замещение В связи с сильным электроноакцепторным действием нитрогруппы реакции электрофильного замещения идут в мета-положение и скорость реакции ниже чем у бензола. Нитрование. Образуется смесь изомеров: 93 % м-динитробензола, 6,5 % одинитробензола и 0,5 % п-динитробензола. Сульфирование. Галогенирование. Нуклеофильное замещение Восстановление Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов. Эта реакция была открыта в 1842 году Н. Н. Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %. Иногда в промышленном гидрировании нитробензола до анилина в качестве катализатора используют никель в комбинации с оксидами ванадия и алюминия. Такой катализатор эффективен в интервале 250—300° и легко регенерируется при окислении воздухом. Выход анилина и других аминов составляет 97-98 %. Восстановление нитросоединений до аминов может сопровождаться гидрированием бензольного кольца. По этой причине для получения ароматических аминов избегают использовать в качестве катализаторов платину, палладий или никель Ренея. В промышленности анилин получают каталитическим восстановлением нитробензола на медном или никелевом катализаторе, который вытеснил старинный способ восстановления нитробензола чугунными стружками в водном растворе хлорного железа и соляной кислоты. Восстановление нитрогруппы до аминогруппы сульфидом и гидросульфидом натрия в настоящее время имеет значение только для частичного восстановления одной из двух нитрогрупп, например, в м-динитробензоле или 2,4-динитроанилине. При ступенчатом восстановлении полинитросоединений с помощью сульфида натрия этот неорганический реагент превращается в тетрасульфид натрия, что сопровождается образованием щелочи. Высокая щелочность среды приводит к образованию азокси- и азосоединений в качестве побочных продуктов. Для того чтобы избежать этого в качестве восстановителя следует использовать гидросульфид натрия, где щелочь не образуется. Токсичность Впитывается через кожу, оказывает сильное действие на ЦНС, нарушает обмен веществ, вызывает заболевания печени, окисляет гемоглобин в метгемоглобин Ссылки (на англ языке) International Chemical Safety Card 0065 NIOSH Pocket Guide to Chemical Hazards IARC Monograph: «Nitrobenzene» US EPA factsheet Механизм восстановления нитробензола цинком в щелочной среде и железом в соляной кислоте (реакция Бешама)










