Тема: «Кислотные оксиды» 8 класс
advertisement

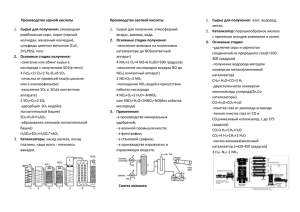
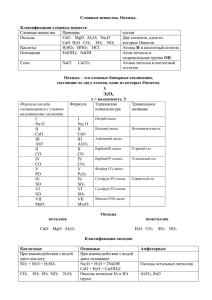
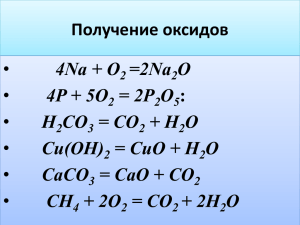
Носачева Наталья Владимировна, учитель химии высшей категории МБОУ СОШ №1 Тема: «Кислотные оксиды» 8 класс. Цель: научить учащихся предполагать химические свойства КО, пользуясь таблицей тренажером; характеризовать химические свойства КО на основе эксперимента и предварительного моделирования; моделировать возможность химической нейтрализации вредных выбросов предприятий, развивать познавательные процессы. Задачи: - Организовать деятельность учащихся по изучению химических свойств КО: взаимодействию КО с водой и основаниями. - Создать условия для повышения познавательной активности и самостоятельности учащихся в приобретении новых знаний на основании выполнения творческих заданий, ученического эксперимента. - сформировать представление о вредном влиянии кислотных оксидов на окружающую природу - Способствовать развитию и совершенствованию практических навыков при соблюдении правил техники безопасности. Оборудование: 1. опорная инструкция 2. таблица тренажер 3. штатив с пробирками 4. трубочка для коктейля для пропускания СО2 через раствор 5. раствор гидроксида кальция 6. сухой оксид фосфора (V) 1 Ход урока: I. Организация класса. II.Сообщение темы и целей урока, обозначение этапов урока. Здравствуйте, ребята! Сегодня мы продолжим работу с таблицей тренажером – постараемся предположить химические свойства кислотных оксидов, повторим классификацию оксидов, проведем 2 эксперимента, подтверждающих наши предположения о химическом поведении КО, рассмотрим негативное действие КО на окружающую среду. III. Актуализация – письменная самостоятельная работа по схеме №1. Необходимо написать примеры оксидов, соответствующие классификации по различным признакам. IV.Изучение нового материала с использованием ученического эксперимента. Всякому действию предшествуют размышления, поэтому сначала мы постараемся спрогнозировать химическое поведение КО. (работа с таблицей - тренажером). Рассмотрим ряд веществ, в котором находятся КО. Мысленно исключим неметаллы и кислоты, оставшиеся классы веществ будут потенциальными реагентами для КО. Соедините стрелками (желательно цветной пастой) КО ----- основные оксиды свойствах КО химических о логическая схема Структурно- возможные пары реагентов. КО ----- основания КО ------ амфотерные оксиды КО ----- амфотерные гидроксиды КО ----- вода Сначала исследуем как КО взаимодействует с водой, проверим, действительно ли образуется кислота. 2 Проводим физкультпаузу: упражнения сидя -руки вверх, руки вниз, потянулись. Учащиеся выполняют опыт №1 по инструкции. Описываем наблюдение: растворение в воде белого порошка оксида фосфора (V) и покраснение лакмуса в образовавшемся растворе. Записываем уравнение реакции и делаем вывод. После проведения опыта рассматриваем задание I и отвечаем на вопросы: 1. КО являются составной частью газообразных продуктов металлургических производств, котельных, ТЭЦ. Предложите способ личной защиты от вредного влияния этих оксидов. 2. В атмосфере КО смешиваются с водяными парами. 3. Во время дождя кислоты возвращаются на землю («кислотный» дождь). Смоделируем влияние такого дождя на растения, почву, постройки из мрамора, известняка, песчаника. CO2 + H2O H2CO3 SO2 + H2O H2SO3 2NO2 + H2O HNO2 + HNO3 В качестве одного из способов улавливания КО проведем лабораторный опыт №2 по инструкции. Для этого опыта используем трубочку для напитков. Через раствор гидроксида кальция пропустим углекислый газ (выдыхая воздух). Наблюдения записываем и составляем уравнения реакций. Делаем вывод. V.Закрепление. (Выполнение тестового задания). Проверь себя: 1. При взаимодействии КО с водой образуется: а) соль в) кислота б) оксид г) основания 2. При взаимодействии неметалла с кислородом образуется а) щелочь в) соль б) кислота г) оксид 3 3. С каким веществом будет взаимодействовать гидроксид натрия. а) SO3 в)CuO б) H2O г) HCl VI. Домашнее задание: § 45.2, задание II по инструкции. Опорная инструкция к теме: «Кислотные оксиды». Рассмотрите схему: ОКСИДЫ Агрегатное несолеобразующие растворимые нерастворимые Состояние в воде в воде Солеобразующие Лабораторный опыт №1. Взаимодействие КО с водой. Н2О Закончите уравнение: Р2О5 + 3Н2О 2НРО4 SO3 + H2O ----- ? Р2О5 ? CO2 + H2O ------ ? Вывод: вода реагирует с КО с образованием … Рассмотрите рисунок и ответьте на вопросы: CO2, NO2, SO2 1. Какие предприятия могут выбрасывать в атмосферу кислотные оксиды. 2. Что с ними происходит в атмосфере? 3. В виде каких соединений КО возвращаются на Землю. Составьте уравнение соответствующих реакций. 4. Предложите свой химический способ улавливания КО. Лабораторный опыт №2. Взаимодействие КО с основаниями. СО2 Закончите уравнения: 4 Ca(OH)2 + CO2 ? NaOH + SO3 KOH + SO2 + H2O ? ? + H2O + H2O Вывод: КО реагирует со щелочами с образованием … Са(ОН)2 ДОМАШНЕЕ ЗАДАНИЕ: II. Рассмотрите рисунок и ответьте на вопросы: I. II. CO2, NO2, SO2 CO2, NO2, SO2 1. Какого цвета выделяющийся газовый «хвост»? 2. Подумайте, как эти газы будут распространяться в атмосфере: по рис. I или II и объясните, почему? 3.Молярная масса воздуха 29 г/моль, вычислите, во сколько раз каждый из этих оксидов 5