: Основные положения теории электролитической диссоциации (ТЭД)
advertisement

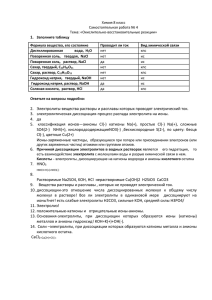
Тема урока: Основные положения теории электролитической диссоциации (ТЭД) Цели урока: Обобщить основы теории электролитической диссоциации в виде четких положений. Обобщить сведения об ионах и их классификациях. 1- положение. Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и неэлектролиты. 2- положение. В растворах электролиты диссоциируют, т.е. распадаются на ионы. Ионы- это (+) или (-) заряженные частички, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединение электронов. По составу ионы бывают простые и сложные. 3- положение.Причиной диссоциации электролита является его взаимодействие с молекулами воды,т.е. гидратация электролита. Электролиты с ионной связью ( соли, щелочи) диссоциируют так: ориентация молекул воды по отношению ионов электролита противоположными полюсами Взаимодействие с ними, т.е. гидратация диссоциация электролита на гидратированные ионы. Электролиты с ковалентной связью (кислоты) диссоциируют так: ориентация молекул воды по отношению диполей электролита противоположными полюсами гидратация ионизация (т.е. превращение ковалентно полярной связи в ионную) диссоциация. По наличию гидратной оболочки ионы могут быть гидратированными и негидратированными. 4- положение. Под действием элетрического тока (+) ионы движутся к катоду и называются катионами, а (-) – к аноду и называются анионами. По заряду ионы делятся на а) положительные, или катионы б) отрицательные, или анионы 5- положение. Разные электролиты по-разному диссоциируют на ионы и потому делятся на: а) сильные ( соли, щелочи, некоторые кислоты), у которых степень диссоциации 1 б) слабые (гидрат аммиака, некоторые кислоты), у которых степень диссоциации 0 6-положение. Свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. По характеру образующихся ионов различают три типа электролитов. Кислоты – это электролиты, которые диссоциируют на катион водорода (общее) и Анионы кислотного остатка (индивидуальное) Одноосновные кислоты диссоциируют в одну ступень: HNO3 H+ + NO3- Многоосновные кислоты диссоциируют в несколько ступеней: H2SO4 HSO4- H+ + HSO4H+ + SO42- Основания – это электролиты, которые диссоциируют на катионы металла (индивидуальные) и анионы гидроксогрупп (общее). NaOH Na+ + OH- Ba(OH)2 BaOH+ + OH- BaOH+ Ba2+ + OH- Соли – это электролиты, которые диссоциируют на катионы металла (индивидуальные) и анионы кислотного остатка (индивидуальные). Al2(SO4)3 2Al3+ + 3SO42-