Тест Химия 11 класс
advertisement
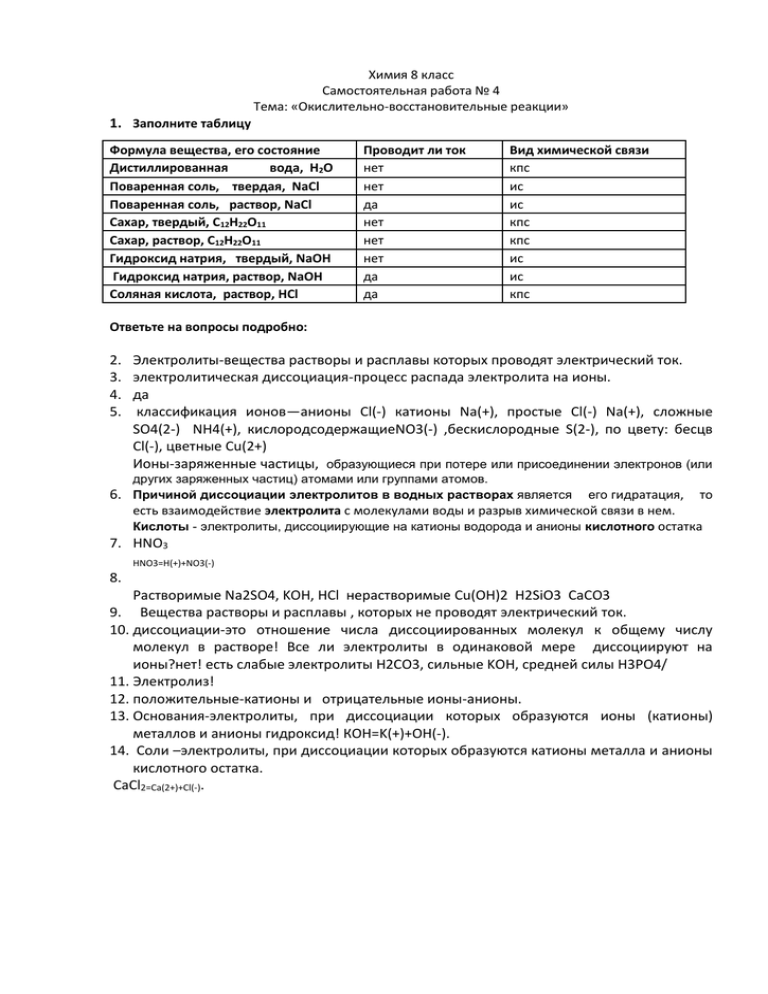
Химия 8 класс Самостоятельная работа № 4 Тема: «Окислительно-восстановительные реакции» 1. Заполните таблицу Формула вещества, его состояние Дистиллированная вода, Н2О Поваренная соль, твердая, NaCl Поваренная соль, раствор, NaCl Сахар, твердый, С12Н22О11 Сахар, раствор, С12Н22О11 Гидроксид натрия, твердый, NaOH Гидроксид натрия, раствор, NaOH Соляная кислота, раствор, HCl Проводит ли ток нет нет да нет нет нет да да Вид химической связи кпс ис ис кпс кпс ис ис кпс Ответьте на вопросы подробно: 2. 3. 4. 5. Электролиты-вещества растворы и расплавы которых проводят электрический ток. электролитическая диссоциация-процесс распада электролита на ионы. да классификация ионов—анионы Cl(-) катионы Na(+), простые Cl(-) Na(+), сложные SO4(2-) NH4(+), кислородсодержащиеNO3(-) ,бескислородные S(2-), по цвету: бесцв Cl(-), цветные Cu(2+) Ионы-заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов. 6. Причиной диссоциации электролитов в водных растворах является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нем. Кислоты - электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка 7. НNO3 HNO3=H(+)+NO3(-) 8. Растворимые Na2SO4, KOH, HCl нерастворимые Cu(OH)2 H2SiO3 CaCO3 9. Вещества растворы и расплавы , которых не проводят электрический ток. 10. диссоциации-это отношение числа диссоциированных молекул к общему числу молекул в растворе! Все ли электролиты в одинаковой мере диссоциируют на ионы?нет! есть слабые электролиты H2CO3, сильные KOH, средней силы H3PO4/ 11. Электролиз! 12. положительные-катионы и отрицательные ионы-анионы. 13. Основания-электролиты, при диссоциации которых образуются ионы (катионы) металлов и анионы гидроксид! КОН=K(+)+OH(-). 14. Соли –электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка. CaCl2=Ca(2+)+Cl(-).