obchaya_harakteristika_galogenov
advertisement

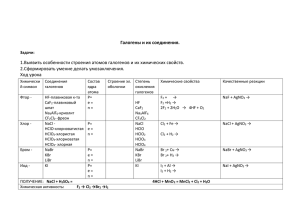
Г Р М Е Т А Л А Ф И Т Л У Р Г И Я Э Л Е К Т Р О Л И О К С И Д Г А З Ж Е Л Е З О Н А Т Р И Й М Ы Л О З МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 1» ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВ 9 класс г. Бородино 2012 г. План изучения темы • Положение подгруппы элементов в • • • • периодической системе Д.И. Менделеева. Характеристика данной подгруппы элементов по положению в периодической системе Физические свойства Химические свойства Применение Получение Характеристика подгруппы элементов • Определите, какие элементы входят в • • • • данную подгруппу Для первых трех элементов изобразите схемы строения атомов Определите, что общего в строении атомов элементов данной подгруппы. В чем различия в строении атомов элементов данной подгруппы? Определите возможные степени окисления атомов галогенов Сравнение строения атомов галогенов Сходство Различие 1. В подгруппу галогенов входят элементы: F, Cl, Br, I, At 2. Схемы строения +9 +17 + 35 2 7 2 8 7 F Cl 2 8 18 7 Br Сравнение строения атомов галогенов Сходство 1. Одинаковое количество электронов на первом энергетическом уровне 2. Одинаковое количество электронов на внешнем энергетическом уровне Отличие 1. Разные заряды ядер 2. 3. 4. 5. атомов Разное количество электронов Разное количество нейтронов Разное количество энергетических уровней Различные степени окисления атомов Электронно–графические формулы атомов галогенов F 1s22s22p5 2p 2s 1s С.О. (F) = -1 Электронно–графические формулы атомов галогенов Cl 1s22s22p63s23p5 3p 2p 3s 2s 1s C.О. -1, +1, +3, +5, +7 Проанализируйте строение атомов галогенов и на этой основе предположите строение их молекул +n 7 Схема строения молекулы галогенов •• •• Г • •• •• • Г•• •• связь ковалентная неполярная Проанализировав строение молекул галогенов, сделайте предположение о физических и химических свойствах галогенов Закономерности изменения физических свойств галогенов С увеличением зарядов ядер атомов галогенов 1. увеличиваются: • температуры плавления • температуры кипения • плотности 2. наблюдается переход от газообразных веществ (фтор, хлор) через жидкое (бром) к твердому (иод) 3. изменяется цвет от светло-зеленого к фиолетовому Используя представленную информацию, выделите направления, освещение которых даст возможность составить представление о галогенах. Подготовьте сообщение по одному из этих направлений Возгонка иода.wmv Химические свойства галогенов Т.к. на внешнем энергетическом уровне у атомов галогенов находится 7 электронов, то, вступая в химические реакции они стремятся принять 1 электрон, т.е. являются окислителями. Значит, простые вещества - галогены способны вступать в реакции с веществами, которые электроны будут отдавать. Такими веществами прежде всего являются металлы. Получение иодида алюминия.wmv Химические свойства галогенов • Взаимодействие галогенов с металлами: 3I2 + 2Al = 2AlI3 3Cl2 + 2Fe = 2FeCl3 Химические свойства галогенов • Кроме этого, галогены вступают в реакции и с неметаллами, которые могут проявлять восстановительные свойства: 3 Cl2 + 2 P = 2 PCl3 или 5 Cl2 + 2 P = 2 PCl5 Взаимодействие хлора с фосфором.wmv Химические свойства галогенов • Галогены вступают в реакции и со • - • сложными веществами, например, c водой: Cl2 + H2O = HClO + HCl Со щелочами: (на холоду) Cl2 + 2 NaOH = NaCl + NaClO + H2O (при нагревании) : 3 Cl2 + 6 KOH = 5 KCl + KClO3 + 3 H2O С галогенидами Cl2 + 2 KBr = 2 KCl + Br2 Получение хлора • В промышленности Электрический ток 2 NaCl ——————→ Cl2↑ + 2 Na В лаборатории: 4 HCl + MnO2 = MnCl2 + Cl2↑ + 2 H2O 2 KMnO4 + 16 HCl = KCl + 3 Cl2↑ + 8 H2O KClO3 + 6 HCl = KCl + 3 Cl2↑ + 3 H2O Получение хлора.wmv