Вода. 8 класс. Учитель химии Е.В. Матвиенко
advertisement

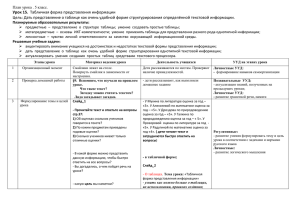
Урок химии в 8 классе по теме «Вода». Пояснительная записка. Данная разработка предназначена для обучающихся 8 класса (УМК Г.Е.Рудзитиса, Ф.Г.Фельдмана) по разделу программы «Растворы. Вода». Интеграция имеющихся у обучающихся знаний по химии и физике и, полученных в результате познавательнопроблемной деятельности на уроке, предлагает обучающимся творчески освоить данный материал, выявив межпредметные, метапредметные связи дисциплины, целостность явлений, охватывающих разные аспекты человеческой деятельности. Цели: актуализировать знания по теме с опорой на полученные ранее на курсах физики, химии, географии; рассмотреть способы очистки воды; изучить физические и химические свойства воды; сформировать у обучающихся первоначального представления о ряде активности металлов. Задачи урока и планируемые умения: Задачи урока Универсальные учебные действия Образовательные: выявить и закрепить основные понятия по Познавательные: знать определение основных теме, изучить практическую значимость процесса очистки воды понятий, уметь систематизировать и структурировать и круговорота воды в природе. результаты. Развивающие: формировать навыки работы в группе, развить Личностно – регулятивные: уметь прогнозировать и общенаучные и метапредметные умения, привить интерес к оценивать результаты практической деятельности, учебному процессу с помощью решения проблемных задач. развивать навык познавательной деятельности, самооценки и саморегуляции. Воспитательные: воспитывать культуру обучения в Коммуникативные: уметь организовывать работу в сотворчестве с преподавателем, классом в целом и малой сотрудничестве, участвовать в обсуждении, группой, формировать навыки учебно-познавательного процесса. аргументировать позицию. Планируемые результаты обучения: Предметные Наблюдать опыты, демонстрируемые учителем, объяснять принцип действия установки для перегонки воды, уметь составлять уравнения изученных химических реакций с участием воды. Метапредметные Уметь устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение и делать выводы, принимать решения. Фиксировать наблюдения и формулировать выводы из наблюдаемых опытов. Личностные: Уметь самостоятельно определять цели своего обучения и планировать пути их достижения, осуществлять осознанный выбор в учебной и познавательной деятельности. Методы и методологические приемы: Данный урок предполагает работу в малых группах с использованием технологии обучения в сотрудничестве и компетентностного подхода, методов активного обучения, которые обеспечивают включение обучающихся в активное взаимодействие и общение в процессе их поисково-познавательной деятельности, с использованием проблемных и моделированием бытовых ситуаций. Литература для учителя и обучающихся: 1. Г.Е.Рудзитис, Ф.Г.Фельдман Химия, 8 класс: учебник для общеобразовательных учреждений. – М.: Просвещение. 2. Т.А.Боровских Рабочая тетрадь по химии: 8 класс: к учебнику Г.Е.Рудзитиса, Ф.Г.Фельдмана. – М.: Экзамен, 2011 3. Основной образовательный стандарт по химии. 4. СD – химия – 8. 5. Гара Н.Н., Зуева М.В. Текущий контроль. Химия. Сборник заданий для проведения промежуточной аттестации в 8 класс. 6. Радецкий А.М. Дидактический материал: 8 классы: Пособие для учителей общеобразовательных учреждений. М.: Просвещение. Оборудование для учителя и обучающихся: Карточки с задачами. Технологическая карточка проблемно – исследовательской деятельности обучающихся. Мультимедийная презентация «Вода». Технологическая карта урока. Этап урока Организационный этап. Проверка домашнего задания. Мотивация к учебной деятельности. Формулировка темы урока. Постановка целей. Усвоение новых знаний. Объяснение домашнего задания. Деятельность учителя Приветствует детей. Деятельность учеников Формируемые УУД Приветствуют учителя. Личностные УУД: смыслообразование. Готовятся к уроку. Фронтальный опрос (беседа): Отвечают на вопросы. Коммуникативные УУД: уметь оформлять Оценивание ответов учащихся с учетом Работают на карточках. Взаимопроверка. свои мысли в устной форме. самооценки и взаимопроверки. Создает проблемную ситуацию. Ученики вспоминают пройденный Личностные УУД: уметь анализировать и Подводит учащихся к определению темы материал, работают по технологическим аргументировать полученные ответы и цели урока. картам. перед классом Представляют полученные ответы перед Коммуникативное УУД: уметь оформлять классом. свои мысли в письменной и устной форме. Используя вопросы технологической Предлагают варианты целеполаганий. Личностные УУД: уметь логически карточки и ранее пройденный материал, Хотят познакомиться со свойствами сопоставлять ранее изученные факты и подводит обучающихся к воды. Выделяют проблему, предлагают понятия с темой и целью данного урока. формулированию темы и цели урока. тему урока, планируют свою работу. Коммуникативное УУД: уметь точно выражать мысль, передавать и фиксировать факты. Регулятивные УУД: уметь самостоятельно обнаруживать и формулировать учебную проблему, определять цель, составлять план решения проблемы. Использует слайды презентации и Принимают участие в дискуссии, Познавательные УУД: уметь добывать материал учебника для актуализации фиксируют изучаемый материал. новые знания: находить ответы на материала. Просматривают материал учебника и вопросы, используя учебник, свой Организует лабораторные опыты по презентации и делают самостоятельные жизненный опыт и информацию, изучению свойств воды. выводы по новой теме. полученную на уроке. Коммуникативные УУД: уметь оформлять свои мысли в устной форме; слушать и понимать речь других (обучение в сотрудничестве). Записывает на доске и комментирует Воспринимают информацию, фиксируют Личностные УУД: прогнозирование домашнее задание. задание для домашнего выполнения, результатов и уровня усвоения. записывают в дневник. Закрепление и проверка полученных знаний. Проводит контроль по технологической карточке. Рефлексия. Подводит обучающихся к обсуждению полученного материала, предлагает вспомнить, какую цель поставили в начале урока, достигли ли цели? Побуждает оценить свою деятельность на уроке Выполняют задание. Применяют знания на практике. Осуществляют контроль и оценку своей деятельности. Регулятивные УУД: уметь систематизировать и оценивать результаты деятельности. Познавательные УУД: уметь ориентироваться в своей системе знаний: отличать новое от уже известного с помощью учителя, преобразовывать информацию из одного вида в другой. Личностные УУД: знать изученный материал; связывать практически полученные факты и явления из повседневной жизни с изученным материалом, объяснять полученные результаты. Осознанно подводят итоги личной работы Личностные УУД: умение точно и на уроке. Оценивают свою деятельность. свободно выражать мысли, трезво оценивать работу на уроке. Коммуникативные УУД: уметь оценивать знания других, уметь вести дискуссию и применять материал урока на практике. Познавательные УУД: уметь анализировать результаты своей деятельности. Регулятивные УУД: уметь оценивать правильность выполнения действия на уровне адекватной ретроспективной оценки. Ход урока. Организационный момент. Приветствие учителя. Проверка готовности к уроку. Проверка домашнего задания. На прошлом уроке вы выполняли практическую работу. Какая цель стояла перед вами? (приготовить раствор с определенной массовой долей растворенного вещества) Что называется раствором? Какие бывают растворы? Как делятся вещества по растворимости в воде? Что называется массовой долей растворенного вещества? (запишите формулу) В чем выражается массовая доля вещества? Посмотрите на условия задач, представленных на доске (слайд 2): Вычислите массовую долю растворенного вещества, если в 10 г раствора содержится 1 г хлорида натрия. Вычислите массовую долю растворенного вещества, если в 10 г воды растворено 1 г хлорида натрия. В чем сходство и в чем различие этих задач? Что надо узнать, чтобы решить вторую задачу? Решите задачи, записав решение на листочках. Поменялись листочками, проверили решение (слайд 2). Если правильное решение на полях поставили плюс, если нет – минус. Посмотрите, где допустили ошибки. Есть вопросы по решению? Мотивация к учебной деятельности. Формулировка темы урока. Постановка целей. Возьмите технологические карточки, прочитайте вопросы и скажите, на все ли вопросы вы можете дать ответы? (Нет). Что вам необходимо знать, чтобы выполнить это задание? (Знать свойства воды, что такое дистиллированная вода, круговорот воды). Сформулируйте тему сегодняшнего урока и цели, которые нам надо решить на нем. Запишите в тетради число и тему урока (слайд 3). На прошлых уроках мы познакомились со сложным веществом – водой, с ее свойством растворять другие вещества. Сегодня мы продолжим изучение этого вещества. Мы знаем, что вода – самое распространенное на земле вещество. Где она встречается? Для чего ее использует человек? ответы учащихся. Послушайте стихотворение русского поэта Льва Николаевича Мартынова (слайд 4): Вода благоволила литься! Она блистала, столь чиста, Что – ни напиться, ни умыться, И это было неспроста. Ей не хватало ивы, тала И горечи цветущих лоз. Ей водорослей не хватало И рыбы, жирной от стрекоз. Ей не хватало быть волнистой, Ей не хватало течь везде, Ей жизни не хватало – Чистой, Дистиллированной Воде! Усвоение новых знаний. Мы знаем, что природная вода всегда содержит растворенные вещества. В зависимости от целей ее использования применяют различные приемы очистки. Питьевая вода не должна содержать нерастворенных примесей и болезнетворных микроорганизмов, которые обычно бывают в водоемах. Посмотрите на рис. 50 стр. 83 учебника (слайд 5). Это схема водоочистительной станции. Рассмотрите внимательно рисунок и скажите, какие методы используются для очистки воды? (отстаивание, фильтрование, хлорирование, озонирование). Представьте себе, что у вас есть морская вода, а вам надо получить питьевую. Предложите способы как вы можете это сделать в домашних условиях. (Для этого ее нагревают до кипения, а потом водяной пар охлаждают. Метод вымораживания – ставят емкость с водой в морозильную камеру и когда половина воды превратиться в лед, незамерзшую воду сливают, а льду дают растаять) В XVI веке королева Англии Елизавета I объявила премию за изобретение дешевого способа опреснения морской воды. Премия пока еще ни кому не вручена. В настоящее время для получения из морской воды 1 км 3 пресной воды требуется 7 млн. т условного топлива или 2,8 т ядерного горючего. В аптеках или химических лабораториях очистку воду проводят в автоматических дистилляторах, где вода нагревается до кипения, а образующийся пар поступает в конденсатор и вытекает в виде дистиллированной воды (слайды 6,7). Все свойства, которые мы сегодня рассмотрим, относятся к чистой, дистиллированной воде. Вода – сложное вещество. Запишите формулу воды (слайд 8). Из каких химических элементов состоит молекула воды? (из двух атомов водорода и одного атома кислорода). О составе воды написал Ефим Ефимовский (слайд 8): Из атомов мир создавала природа Два атома легких взяла водорода, Прибавила атом один кислорода И получилась частица воды, Море воды, океаны и льды… Какие методы используются для определения состава сложного вещества? (анализ, синтез) Что называется анализом? Что называется синтезом? «Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое!». Так говорил о воде Антуан де Сент-Экзюпери (слайд 9). А мы давайте попробуем описать воду, вспомнив из уроков природоведения, географии, окружающего мира физические свойства воды: бесцветная жидкость, без вкуса и запаха, кипит при 100 0С, замерзает при 00С, максимальная плотность при 40С равна 1 г/см3. Лед имеет меньшую плотность, чем вода, поэтому он плавает на поверхности и водоемы не замерзают. Большая теплоемкость, поэтому она медленно нагревается и остывает. Это регулирует температуру на нашей планете. Текучесть, высокое поверхностное натяжение. Единственное вещество, которое существует на планете сразу в трех агрегатных состояниях. Слайд 10 (записать физические свойства в тетрадь). Изучая способы получения водорода, мы познакомились уже с некоторыми свойствами воды. (слайд 11) Химические свойства воды: (ученики у доски записывают реакции, называют тип реакции) 1. С активными металлами (лабораторные опыты) Са + 2Н2О = Са(ОН)2 + Н2↑ гидроксид кальция 2. С металлами средней активности Zn + H2O = ZnO + H2↑ оксид цинка 3. С неметаллами С + Н2О = СО↑ + Н2↑ оксид углерода (II) вода горит в атмосфере фтора 2F2 + 2H2O = 4HF + O2↑ 4. С оксидами металлов ВаО + Н2О = Ва(ОН)2 (образуются щелочи) гидроксид бария 5. С оксидами неметаллов (лабораторный опыт) Р2О5 + Н2О = 2НРО3 метафосфорная кислота при нагревании Р2О5 + 3Н2О = Н3РО4 ортофосфорная кислота SiO2 + H2O = ? (кремниевая кислота нерастворимая) 6. Разложение воды 2Н2О → 2Н2↑ + О2↑ Давайте посмотрим фрагменты из мультфильма «Заяц Коська и Родничок» (слайд 12). Какое явление отражено в этом мультфильме? Круговорот воды – ученики по рисунку характеризуют круговорот воды (слайд 13). Большой круг: из океанов, морей, рек и водоемов вода испаряется в атмосферу, конденсируется в облака, дождем выпадает на Землю и с реками опять попадает в океан. Домашнее задание (слайд 14). §29, вопросы 3-6 стр.87, задача стр. 88. Комментарии к выполнению домашнего задания. Закрепление и проверка полученных знаний (слайд 15). Возьмите технологические карточки и сделайте задание, используя материал урока. Проверка ответов, оценивание своих знаний (слайд 15). Рефлексия. Итог урока (Слайд 16). Вспомните цели нашего урока. Скажите, достигли ли мы их к концу урока? Оцените свою работу на уроке. Выставление отметок за урок. А закончить урок я хочу стихами Константина Дмитриевича Бальмонта: От капли росы, что трепещет, играя Огнем драгоценных камней, До бледных просторов, где, вдаль убегая, Венчается пеною влага морская На глади бездонных морей, Ты – всюду, всегда, неизменно живая… Спасибо за урок. Приложение 1 Задача 1. Вычислите массовую долю растворенного вещества, если в 10 г раствора содержится 1 г хлорида натрия. Решение. _________________________________________________________________ Ответ: ________ Задача 2. Вычислите массовую долю растворенного вещества, если в 10 г воды растворено 1 г хлорида натрия. Решение. _________________________________________________________________ Ответ: ________ Приложение 2 Карта определения уровня знаний учащихся по теме: Обведите верные ответы кружком: 1. Формула воды – Н2О. 2. Дистиллированная вода является смесью веществ. 3. Тип химической реакции образования воды из простых веществ – реакция соединения. 4. Речной песок хорошо растворяется в воде. 5. Максимальная плотность воды при 1000С. 6. Соль можно выделить из раствора фильтрованием. 7. Вода – хороший растворитель. 8. Чтобы выделить соль из раствора, его необходимо выпарить. 9. Вода взаимодействует с менее активными металлами с образованием оксида металла. 10.В воде растворяется железный гвоздь. 11.Вода имеет вкус и запах. 12.Круговорот воды обеспечивает сушу морской водой. 13.Вода может существовать в трех агрегатных состояниях. 14.Вода не имеет вкуса и запаха. 15.Вода взаимодействует с неметаллами. 16. При взаимодействие активного металла натрия с водой образуется растворимое основание.