Заочный тур олимпиады по химии (школьный этап) 9 класс 9
advertisement

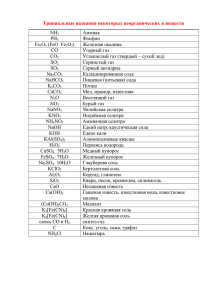
Заочный тур олимпиады по химии (школьный этап) 9 класс 9-1. Приведите формулы веществ, применяющихся в быту и технике, по их тривиальным названиям: нашатырь; купоросное масло; каустическая сода; ляпис; медный купорос; гашеная известь; железный купорос; бертолетова соль; питьевая сода; аммиачная селитра. 9-2. При обжиге навески сульфида металла (AS2) израсходовали 2,24 л кислорода (н.у.). Образовавшееся твердое вещество содержит 69,4% металла А. Определите металл А. Напишите уравнение реакции обжига. Определите массу навески. 9-3. Один из старинных промышленных способов получения водорода заключался в пропускании водяных паров через раскаленные железные стружки. Так, установка созданная в 1803 г. русским химиком Я.Д. Захаровым вмещала 819 кг железных стружек и производила 91 м3 водорода в час. Запишите уравнение реакции получения водорода этим способом. Сколько воды потребляла данная установка в час? Сколько часов могла работать данная установка? 9-4. Напишите уравнения реакций, описывающих следующие превращения: S → Al2S3 → H2S → S → SO2 → SO3 → H2SO4 9-5. Масса одной молекулы белого фосфора — 2,06 · 10-22 г. Установите формулу белого фосфора. 9-6. В двух неполных перечнях приведены переводы названий известных химических элементов. Если вы поймете принцип, по которому элементы объединяются в этих перечнях, то не только обогатите свои знания, но и легко заполните пропуски: а) «рождающий селитру» - «________» - « желтый пигмент» - «не единственный» б) «разрушающий» - «зеленоватый» - «зловонный» - «______» «неустойчивый». Напишите химические знаки каждого элемента и их названия. 9-7. К растворам, содержащим равные по массе навески хлоридов кальция и бария, прилили равные объемы раствора нитрата серебра одной и той же концентрации. Массы образовавшихся осадков различны. В отношении какого хлорида можно утверждать, что он вступил в реакцию полностью, а какого – что он остался в избытке? Ответ поясните. 9-8. Известняк — минерал, основным компонентом которого является карбонат кальция (СаСО3). Прокаливание (длительное нагревание) известняка приводит к разложению его на оксид кальция (негашёная известь) и оксид углерода(IV) (углекислый газ). При прокаливании двух образцов известняка массой 10 г в одном случае выделилось 2,24 л газа, в другом — 2 л. (объёмы измерены при н.у.). Противоречит ли этот факт закону сохранения массы веществ? Ответ поясните следующим образом: 1.запишите уравнение реакции; 2.объясните причину расхождения результатов, произведя необходимые вычисления.