Тема: Ионная и ковалентная связь
advertisement

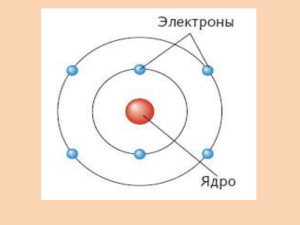
Муниципальное общеобразовательное учреждение – Средняя общеобразовательная школа №13 Ионная и ковалентная связь Фрагмент урока. Проблемно – ориентированное обучение при проведении демонстрационного эксперимента. Учитель: Мишина Тамара Ивановна г. Белгород 2008 г. 0 Тема: Ионная и ковалентная связь. Цель: Продолжить формирование понятий о ковалентной и ионной связи, свойствах ковалентной и ионной связи, степени окисления (положительной и отрицательной) с целью познания строения веществ и их свойств. Метод: Беседа. Эксперимент. Индивидуальная работа. Оборудование и реактивы: 1. ПДГ 2. HCl 3. FeCl 3 4. Ложечка для сыпучих веществ. 5. Zn 6. Штатив (демонстрационный) 7. Пробирки демонстрационные 8. Лабораторный штатив 9. Ионная кристаллическая решетка (Na Cl) Ход урока: I Вступление II Основная часть 1) Объяснение и поэтапное закрепление материала. 1. Тема 2. В: Строение атома Н. В: Почему водород не существет в виде одного атома ? 3. Н2 – молекула. Н·+Н×→ Н·×Н; Н-Н 4.опыт: 2HCl + Zn = ZnCl2 + H 2 ↑ Проблемные вопросы к опыту: 1. Почему в приборе для получения газов происходит изменение окраски FeCl3 от бурой до желтой, изумрудно – зеленой, а затем бесцветной? (При взаимодействии Zn с HCl в первые секунды 1 происходит выделение водорода в виде атомов H∙, которые являются активными частицами с неспаренными электронами. Часть их действует на FeCl3, восстанавливая Fe 3 в Fe 2 , в результате чего и происходит изменение окраски раствора. Другая часть атомов, взаимодействуя друг с другом, образует молекулы. Такой молекулярный водород H2 попадает в химический стакан.) 2. Почему бурая окраска в химическом стакане, обусловленная FeCl3, не изменяется (Это доказывает устойчивость молекул H2, образуется ковалентная неполярная химическая связь.Приставка КО – означает общая или обобществленная.) Н·+Н× →Н·×Н 5. 3 ученика у доски О2; N2; F2 (образование ковалентной связи) Н2О – образование ковалентной связи Свойства ковалентной связи. 1.длина связи 2.энергия связи (прочность) 3.валентный угол (направленность связи) 4.насыщаемость 5.поляризуемость. О2º; N2º; F2º; H2Oˉ² - степень окисления. 6.NaClˉ; Mg²Cl2ˉ ; где прочнее связь? Ионная связь. А) Na +11 Сl +17 Naº- 1e=Na ¹ Clº+1e=Clˉ Na Clˉ Б) Mg ²Oˉ² Mgº – 2е= Mg ² Oº+2e= Oˉ² 2 Свойства. Свойства ионной связи. 1.прочность. 2.длина связи. 3.ненаправленная. 4.ненасыщаемая. Заключение: Д.З. §18.3 NH3; F2; HF; H2S 2.8г 10г хг CaO + 2HNO3= Ca(NO3)2 + H2O Подготовиться к химическому диктанту. 3