Простейшие операции с веществом (химический практикум) Ленинградская область, Волховский район,
advertisement

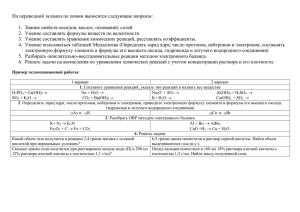
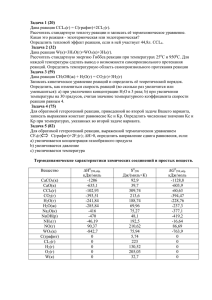
Ленинградская область, Волховский район, МОБУ «Сясьстройская СОШ №2» Простейшие операции с веществом (химический практикум) Составила: учитель биологии и химии высшей квалификационной категории Бочкова Ирина Анатольевна Практическая работа №6 Условия протекания химических реакций между растворами электролитов до конца Цель: Выяснить условия протекания химических реакций между растворами электролитов до конца Оборудование: Посуда: пробирки (4 штуки) Реактивы: сульфат алюминия, хлорид бария, карбонат натрия, азотная кислота, гидроксид натрия, фенолфталеин, соляная кислота, сульфат меди (II), серная кислота Инструкция по ТБ Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края. Работать с соединениями бария нужно так, чтобы не допустить попадания их в рот, так как они токсичны. Для получения тяжёлого отравления достаточно дозы массой менее 0,5г . После завершения работы тщательно помыть руки с мылом под проточной водой. Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки. Наливать кислоту надо так, чтобы при наклоне склянки этикетка, во избежание её порчи, оказывалась сверху. Щёлочи – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки. От щелочей возможна полная потеря зрения. Опыт №1.Условие первое – выпадение осадка В пробирку налейте раствор сульфата алюминия Добавьте раствор хлорида бария Что наблюдаете? Составьте молекулярное и ионные уравнения реакций. Сделайте вывод Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4 э. э. э. н.э. 2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 2Al3+ + 6Cl- + 3BaSO4 3SO42- + 3Ba2+ = 3BaSO4 Вывод: реакция идёт с выпадением осадка Опыт №2.Условие второе – выделение газа Налейте в пробирку раствор карбоната натрия Прилейте раствор азотной кислоты Что наблюдаете? Составьте молекулярное и ионные уравнения реакций. Сделайте вывод Na2CO3 + 2HNO3 = 2NaNO3 + [H2CO3] э э э / CO2 н.э. \ H2O н.э. 2Na+ + СO32- + 2H+ + 2NO3- = 2Na+ + 2NO3- + CO2 + H2O СO32- + 2H+ = CO2 + H2O Вывод: реакция идёт с выделением газа Опыт №3.Условие третье – образование воды, как побочного продукта реакции а) взаимодействие растворимого основания (щёлочи) с кислотой Налейте в пробирку раствор гидроксида натрия Добавьте 2-3 капли фенолфталеина. Фенолфталеин – малиновый, среда – щелочная Прилейте раствор соляной кислоты Что наблюдаете? Составьте молекулярное и ионные уравнения реакций. Сделайте вывод NaOH + HCl = NaCl + H2O э. э. э. н.э. фенолфталеин малиновый бесцветный Na+ + ОН- + H+ + Cl- = Na+ + Cl- + H2O ОН- + H+ = H2O Вывод: реакция идёт с образованием воды, среда раствора нейтральная (реакция нейтрализации) б) взаимодействие нерастворимого основания с кислотой Получите нерастворимое основание: к раствору сульфата меди (II) добавьте гидроксид натрия. Что наблюдаете? Прилейте к осадку серную кислоту. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций. Сделайте вывод Получение нерастворимого основания: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 э. э. н.э. э. Cu2+ + SO42- + 2Na+ + 2OH- = Cu(OH)2 + 2Na+ + SO42Cu2+ + 2OH- = Cu(OH)2 Вывод: нерастворимые основания получаются при взаимодействии растворимой соли малоактивного или неактивного Ме со щёлочью Взаимодействие нерастворимого основания с кислотой Cu(OH)2 + Н2SO4 = CuSO4 + 2H2O н.э. э. э. н.э. Cu(OH)2 + 2Н+ + SO42- = Cu2+ + SO42- + 2H2O Cu(OH)2 + 2Н+ = Cu2+ + 2H2O Вывод: нерастворимые основания взаимодействуют с кислотами с образованием побочного продукта – воды (реакция нейтрализации) Домашнее задание Знать условия, при которых реакции ионного обмена идут до конца Подготовить отчет о проделанной работе