Генетические факторы в развитии диффузного эутиреидного
advertisement

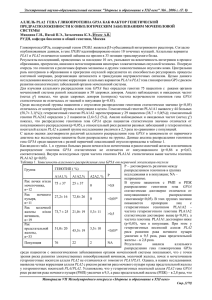
ГЕНЕТИЧЕСКИЕ ФАКТОРЫ В РАЗВИТИИ ДИФФУЗНОГО ЭУТИРЕОИДНОГО ЗОБА Н.В. Галкина, Е.Л. Трошина, Н.В. Мазурина ФГУ "Эндокринологический научный центр Росмедтехнологий " (директор академик РАН и РАМН И. И. Дедов) Представлены результаты изучения ассоциации полиморфных маркеров генов TSHR (rs 3783949, замена — А/С), NIS (rs 7250346, замена - C/G), DUOX1 (rs2467825, замена - A/G), DUOX2 (rs7171366, замена - G/T), ТРО (rs 17091737, замена G/T) с развитием диффузного эутиреоидного зоба. Для анализа ассоциации сравнивались между собой частоты аллелей и ге­ нотипов в двух группах, подобранных соответственно по полу и возрасту: Д Э З (п = 100) и контрольной (п = 100). Повышенный риск развития ДЭЗ имели носители следующих генотипов: GG и CG гена NIS: O R = 2,07 (95% CI = 1,18—3,64); AG и АА гена DUOX1: OR = 1,92 (95%С1 = 1,08-3,39); ТТ гена ТРО. OR = 2,09 (95% CI = 1,19-3,7). Пониженный риск развития Д Э З выяв­ лен у носителей генотипов: СС гена NIS: OR = 0,48 (95% CI = 0,27-0,85); GG гена DUOX1: OR = 0,52 (95%CI = 0,29-0,92); GG j и TG гена ТРО: OR = 0,48; (95%CI = 0,27—0,83). Различия частот аллелей и генотипов генов DUOX2 и TSHR в сравниваемых | группах были выражены слабо и не достигали статистической значимости. Полиморфные маркеры генов NIS, DUOX1, ТРО ас- I социированы с развитием ДЭЗ среди популяции г. Москвы. The Genetic Predisposition for Diffuse Euthyroid Goiter Development in Moscow Population N.V. Galkina, E.A. Iroshina, N.V. Mazurina Federal Endocrinological Research Center, Moscow The aim of the study was to investigate the linkage of diffuse euthyroid goiter ( D E G ) in Moscow population to polymor­ phisms of TSHR (rs 3783949, alleles - A/C), NIS (к 7250346, alleles - C / G ) , DUOX1 (rs2467825, alleles - A/G), DUOX2 > (rs7171366, alleles — G/T), 77 O(rsl7091737, alleles - G/T). To approach the problem, the prevalence of these polymor­ phisms was estimated in two age- and sex-matched groups: in D E G patients (n = 100) and in the control group (n = 100). High risk D E G formation was found in patients with the following genotypes: GG and CG of NIS, OR = 2.07 (95% CI 1.18-3.64); AG and AA of DUOX1, OR = 1.92 (95% CI 1.08-3.39); TT of TPO, OR = 2.09 (95% CI 1.19-3.7). Low risk DEG formation was found in patients with the following genotypes: CC of NIS, OR = 0.48(95% CI 0.27-0.85); GG of DUOX1, OR = 0.52 (95% CI 0.29-0.92); GG and TG of TPO, OR = 0.48 (95% CI 0.27-0.83). No significant difference between genotypes prevalence of DUOX2 and TSHR in two comparable groups was observed. Our results provide the first confirmation of linkage of diffuse euthyroid goiter to polymorphisms of NIS, DUOX1 and TPO in Moscow population. Д и ф ф у з н ы й э у т и р е о и д н ы й зоб ( Д Э З ) — п е р в а я ста­ м е й н ы м и и б л и з н е ц о в ы м и и с с л е д о в а н и я м и [2]. Кро­ дия йододефицитных заболеваний м е того, н е п о с р е д с т в е н н о й п р и ч и н о й Д Э З , напри­ щ и т о в и д н о й ж е л е з ы ( Щ Ж ) . В п о д а в л я ю щ е м боль­ м е р , к а к в а р и а н т а с п о р а д и ч е с к о г о зоба могут быть ш и н с т в е случаев п р и ч и н о й Д Э З я в л я е т с я недоста­ м у т а ц и и т а к и х генов, к а к ТРО, NIS, TG, TSHR [3,4]. формирования т о ч н о е п о с т у п л е н и е в о р г а н и з м йода. О д н а к о ряд за­ В н а с т о я щ е е в р е м я о с н о в н ы м подходом в изучении кономерностей позволяет предположить и влияние г е н е т и ч е с к о й п р е д р а с п о л о ж е н н о с т и к определенной генетических ф а к т о р о в на его ф о р м и р о в а н и е [1]. п а т о л о г и и я в л я е т с я м е т о д и к а и с п о л ь з о в а н и я поли­ Так, в о д н о м и т о м же р е г и о н е п р и о д и н а к о в о м йод­ м о р ф н ы х м а р к е р о в , с ц е п л е н н ы х с р а з л и ч н ы м и гена­ н о м о б е с п е ч е н и и зоб о п р е д е л я е т с я не у всего населе­ ми-кандидатами. н и я , а л и ш ь у части. В а ж н о с т ь г е н е т и ч е с к и х факто­ в п р о в е р к е г и п о т е з ы : с в я з а н о ли н а л и ч и е маркера р о в подтверждена м н о г и м и п о п у л я ц и о н н ы м и , се­ с р а з в и т и е м и / и л и б ы с т р ы м п р о г р е с с и р о в а н и е м за- Сущность подхода заключается Таблица 1. Характеристика параметров в группах ДЭЗ и контрольной Параметр ДЭЗ (п = 100) контрольная (п = 100) Р Пол: мужчины женщины 10% (п = 10) 90% (п = 90) 12% (п = 12) 88% (п = 88) 0,82 2 (X = 0,05) 32,3 ± 10,4 34,3 + 8,2 0,97 Возраст, лет болевания [5]. На с е г о д н я ш н и й д е н ь отсутствуют д а н н ы е об а с с о ц и а ц и и п о л и м о р ф н ы х м а р к е р о в ге­ нов-кандидатов т и р е о и д н о й патологии с й о д о д е ф и ц и т н ы м зобом на п о п у л я ц и о н н о м уровне. Прове­ д е н н о е н а м и исследование д о л ж н о б ы л о дать ответ на вопрос, существуют ли в м о с к о в с к о й п о п у л я ц и и предрасполагающие или защитные генетические ф а к т о р ы (маркеры) для д а н н о й патологии и м о ж н о ли с их п о м о щ ь ю прогнозировать развитие болезни. П о с к о л ь к у в патогенезе Д Э З важную роль играют ф е р м е н т а т и в н ы е с и с т е м ы , о б е с п е ч и в а ю щ и е поступ­ л е н и е йода в щ и т о в и д н у ю железу и его внутрикле­ точные р е а к ц и и , н а и б о л ь ш и й интерес представляет п о и с к генетических м а р к е р о в в генах, к о д и р у ю щ и х о с н о в н ы е к о м п о н е н т ы этих систем: н а т р и й - й о д и д ного симпортера — NIS, т и р е о и д н о й п е р о к с и д а з ы — ТРО, с и с т е м ы г е н е р а ц и и п е р е к и с и в о д о р о д а — DUOX1, DUOX2, Т Т Г - р е ц е п т о р а - TSHR. Целью исследования: изучение з а в и с и м о с т и между распределением аллелей и г е н о т и п о в п о л и м о р ф н ы х м а р к е р о в генов TSHR (rs 3783949, замена — А / С ) , NIS (rs 7250346, замена - C / G ) , DUOX1 (rs 2467825, замена - A / G ) , DUOX2 (rs 7171366, замена - G / T ) , ТРО (rs 17091737, замена — G/T) и р а з в и т и е м диф­ фузного эутиреоидного зоба у взрослых в условиях легкого йодного д е ф и ц и т а . Материал и методы В ходе работы необходимо было в ы п о л н и т ь сравни­ тельное о д н о м о м е н т н о е исследование п о и з у ч е н и ю р а с п р е д е л е н и я аллелей и г е н о т и п о в п о л и м о р ф н ы х м а р к е р о в генов TSHR (rs 3783949, замена - А / С ) , NIS (rs 7250346, замена - C / G ) , DUOX1 (rs 2467825, замена - A / G ) , DUOX2 (rs 7171366, замена - G / T ) , ТРО (rs 17091737, з а м е н а - G / T ) у больных Д Э З и в к о н т р о л ь н о й группе. С р а в н и в а л и с ь между с о б о й частоты аллелей и г е н о т и п о в изучаемых п о л и м о р ф ­ ных маркеров в 2 группах, п о д о б р а н н ы х соответ­ ственно по полу и возрасту: Д Э З (п = 100) и конт­ р о л ь н о й (п = 100). П р и статистической з н а ч и м о с т и р а з л и ч и й частот п р о в о д и л с я расчет р и с к о в (отноше­ н и е ш а н с о в — OR) с 9 5 % - н ы м д о в е р и т е л ь н ы м интер­ валом ( 9 5 % - н ы й C I ) . OR = 1 рассматривали к а к от­ сутствие а с с о ц и а ц и и , OR > 1 — к а к положительную ассоциацию (повышенный риск развития ДЭЗ), OR < 1 — к а к отрицательную а с с о ц и а ц и ю (понижен­ н ы й р и с к р а з в и т и я Д Э З ) . Группа больных с Д Э З бы­ л а с ф о р м и р о в а н а согласно с л е д у ю щ и м к р и т е р и я м : 1) увеличение объема ЩЖ по д а н н ы м пальпа­ ц и и ( к р и т е р и и В О З , 2001) и д а н н ы м У З И (более 18 мл у ж е н щ и н и более 25 мл у м у ж ч и н ) ; 2) отсутствие узловых о б р а з о в а н и й и гипоэхогенности структуры Щ Ж п о д а н н ы м У З И ; 3) антитела к Т П О не определяются; 4) уровень Т Т Г в пределах н о р м а л ь н ы х значе­ ний; 5) отсутствие б е р е м е н н о с т и ; 6) отсутствие в а н а м н е з е д а н н ы х о п а т о л о г и и Щ Ж и / и л и о п о л у ч е н и и п р е п а р а т о в йода, л и т и я , а также т и р е о и д н ы х г о р м о н о в , оральных контрацеп­ тивов в течение последних 6 мес. К о н т р о л ь н у ю группу составили л ю д и , отобран­ н ы е случайным образом из травматологических от­ д е л е н и й м о с к о в с к и х б о л ь н и ц . С р а в н и т е л ь н а я харак­ теристика групп Д Э З и к о н т р о л ь н о й представлена в табл. 1. Ультразвуковое исследование щитовидной железы п р о в о д и л о с ь в отделении ф у н к ц и о н а л ь н о й диагнос­ т и к и Ф Г У " Э Н Ц Р о с м е д т е х н о л о г и й " с использова­ н и е м ультразвукового сканера Hewlett Packard Image Point HX д а т ч и к о м с п е р е м е н н о й частотой 10 МГц, с п о л е м з р е н и я 3,5 с м . Определение уровня ТТГ в с ы в о р о т к е к р о в и вы­ п о л н я л и методом усиленной х е м и л ю м и н е с ц е н ц и и с использованием автоматического анализатора Architect (Abbott). Границы н о р м ы д л я базального уровня Т Т Г — 0,25—3,50 мЕд/л. Определение уровня АТ-ТПО п р о в о д и л и мето­ д о м и м м у н о ф е р м е н т н о г о анализа н а диагностичес­ ких наборах " Т и р е о и д ИФА-антитела Т П О " ("Алк о р - Б и о " ) . Границы н о р м ы для базального уровня А Т - Т П О 0 - 4 0 Ед/л. Генетические методы исследования rs 3783949 (замена - А/С гена TSHR), rs 7250346 (замена - C / G гена NIS), rs 2467825 (замена - A / G гена DUOX1), rs 7171366 (замена - G / T гена DUOX2), rs 17091737, (замена — G / T гена TPO) представляют собой н у м е р а ц и ю нуклеотидов согласно базе д а н н ы х S N P (Database of Single Nucleotide Polymorphisms, http://www.ncbi.nlm.nih.gov/SNP/), где с о д е р ж и т с я п о д р о б н а я и н ф о р м а ц и я о каждом нуклеотиде. Д л я d G T P , d T T P ) ; 5—10 пМ каждого праймера, количест­ во которых варьировало в з а в и с и м о с т и от исследуе­ мого локуса; 0,25 ед. т е р м о с т а б и л ь н о й ДН К - п о л и м е разы (7а<7-полимераза, ф и р м а " С и л е к с " , г. М о с к в а ) ; 0,1—0,2 мк г г е н о м н о й Д Н К и д е и о н и з и р о в а н н о й во­ ды до 20 мкл. Д л я а н а л и з а ф р а г м е н т о в Д Н К , получа­ емых в ходе П Ц Р , п р о в о д и л и в е р т и к а л ь н ы й электро­ ф о р е з в 6% ПААГ, 0,5 х Т В Е . Д л я в ы я в л е н и я сайта рестрикции проводили рестрикционный анализ, в к л ю ч а ю щ и й а м п л и ф и к а ц и ю исследуемого локуса, и н к у б а ц и ю р е а к ц и о н н о й смеси в течение н о ч и п р и соответствующей температуре и э л е к т р о ф о р е з . По о к о н ч а н и и э л е к т р о ф о р е з а гель выдерживали 5 м и н в растворе б р о м и с т о г о э т и д и я . Анализ геля проводи­ ли под ультрафиолетовым светом. Рис. 1. Частоты аллелей и генотипов полиморфного маркера rs 3783949, замена - А/С гена TSHR в группах контрольной и ДЭЗ. т и п и р о в а н и я п о л и м о р ф н ы х в а р и а н т о в изучаемых генов-кандидатов были использованы препараты Д Н К л е й к о ц и т о в , полученных из 5 мл в е н о з н о й кро­ ви больных. Анализ п о л и м о р ф и з м а проводился ме­ тодом п о л и м е р а з н о й ц е п н о й р е а к ц и и ( П Ц Р ) в лабо­ ратории молекулярной генетики наследственных за­ болеваний Института м о л е к у л я р н о й генетики РАН (директор п р о ф е с с о р С В . К о с т р о в ) . Описание метода. Геномную Д Н К в ы д е л я л и ме­ тодом ф е н о л х л о р о ф о р м н о й э к с т р а к ц и и после инку­ б а ц и и образцов п р о т е и н к и н а з о й К в 0,1%-ном раст­ воре додецилсульфата н а т р и я . П Ц Р проводили н а амплификаторе ф и р м ы "ДНК-технология" (Россия) в пробирках Eppendorf по 0,5 мл. С м е с ь для ампли­ ф и к а ц и и объемом 20 мкл содержала 2 мкл 10 х П Ц Р буфера (500 мМ т р и с - H C l , рН 8,8; 150 мМ ( N H 4 ) 2 S 0 4 ; 50 мМ MgCl 2 ; 2 мг/мл BSA; 0 , 1 % tween; 0 , 1 % желатин); 1мМ каждого d N T P (dATP, dCTP, Таблица 2. Частоты аллелей и генотипов полиморфного маркера rs 3783949, замена - А/С гена TSHR в контроль­ ной и ДЭЗ группах Генетический маркер 2 контрольная ДЭЗ X Р Аллель А 0,530 0,495 0,49 0,4838 Аллель С 0,470 0,505 0,49 0,4838 Генотип АА 0,270 0,230 0,43 0,5136 Генотип АС 0,520 0,530 0,02 0,8874 0,240 0,26 0,6115 Генотип СС 0,210 Статистическая обработка полученных д а н н ы х была проведена с и с п о л ь з о в а н и е м пакета приклад­ ных п р о г р а м м statistica (StatSoft Inc., версия 6.0, США,), M E D C A L C , программного обеспечения MS Excel 2000 (Microsoft). О ц е н к у вида распределения в ы п о л н я л и с и с п о л ь з о в а н и е м теста Колмогорова — С м и р н о в а . Д л я с р а в н е н и я о т н о с и т е л ь н ы х частот п р и з н а к о в в н е з а в и с и м ы х выборках п р и м е н я л с я тест 2 X . Статистически з н а ч и м ы м и считали р а з л и ч и я п р и р < 0,05. Расчет о т н о ш е н и я ш а н с о в (OR) с 9 5 % - н ы м д о в е р и т е л ь н ы м интервалом в ы п о л н е н с использова­ нием программы M E D C A L C : OR = a x d / b x c , где а — частота н а л и ч и я исследуемого генотипа в группе Д Э З ; b — частота н а л и ч и я исследуемого ге­ нотипа в к о н т р о л ь н о й группе; e n d — частота отсут­ ствия исследуемого генотипа в Д Э З и к о н т р о л ь н о й группе соответственно. OR = 1 рассматривали к а к отсутствие ассоциа­ ции. OR > 1 свидетельствовало о наличие предраспо­ л о ж е н н о с т и к р а з в и т и ю патологии ( ф а к т о р р и с к а ) , OR < 1 — о п р е д о х р а н я ю щ е м действии генетическо­ го м а р к е р а к р а з в и т и ю патологии ( з а щ и т н ы й фак­ тор). Результаты 1. TSHR (rs 3783949) Различия частот аллелей и генотипов п о л и м о р ф н о г о маркера А/С гена TSHR в с р а в н и в а е м ы х группах бы­ ли в ы р а ж е н ы слабо и не достигали статистической з н а ч и м о с т и (табл. 2, р и с . 1). 2. NIS (rs 7250346) П р и с р а в н е н и и 2 групп между собой выявлено достоверное увеличение д о л и аллеля G в 1,5 раза у л и ц с Д Э З (33,5%) по с р а в н е н и ю с к о н т р о л ь н о й группой (22,5%), ведущее к у в е л и ч е н и ю как гомози- Таблица 3. Частоты аллелей и генотипов полиморфного маркера rs 7250346, замена - C/G гена NISB группах конт­ рольной и ДЭЗ Генетический маркер контрольная ДЭЗ Аллель С 0,775 0,665 6,00 0,0143 Аллель G 0,225 0,335 6,00 0,0143 Генотип СС 0,610 0,430 6,49 0,0109 Генотип CG 0,330 0,470 4,08 0,0433 Генотип GG 0,060 0,100 1,09 0,2972 Р t Таблица 4. Частоты аллелей и генотипов полиморфного маркера rs 2467825, замена - A/G гена DUOX1 в группах контрольной и ДЭЗ Генетический маркер Контроль • ДЭЗ Рис. 2. Распределение аллелей и генотипов полиморфного маркера rs 7250346, замена - C/G гена NIS в группах конт­ рольной и Д Э З . готного его носительства — генотипа G G , т а к и гете­ розиготного — генотипа C G . Так, доля генотипа G G в группе Д Э З составила 10%, а в к о н т р о л ь н о й только 6% (различия отсутствуют), доля генотипа CG — 47 и 3 3 % соответственно (различия статисти­ чески з н а ч и м ы ) . Д о л я же аллеля С и генотипа СС в группе Д Э З (66,5 и 4 3 % соответственно), н а п р о т и в , достоверно н и ж е , чем в к о н т р о л ь н о й группе (77,5 и 61% соответственно). Данные представлены в табл. 3. Таким образом, о с н о в н ы е р а з л и ч и я между группами заключаются в у м е н ь ш е н и и доли аллеля С и генотипа СС на ф о н е увеличения аллеля G и ге­ терозиготного генотипа CG в группе Д Э З (рис. 2), что послужило о с н о в а н и е м о б ъ е д и н е н и я долей гено­ т и п о в C G и G G для с р а в н е н и я с долей генотипа С С в обеих группах с ц е л ь ю расчета о т н о ш е н и я ш а н с о в . И т а к , на о с н о в а н и и полученных д а н н ы х м о ж н о сде­ лать заключение о том, что н о с и т е л и г е н о т и п о в GG и CG имеют п о в ы ш е н н ы й р и с к р а з в и т и я Д Э З (OR = = 2,07; 9 5 % - н ы й CI = 1,18-3,64), а также о том, что носители генотипа С С и м е ю т п о н и ж е н н ы й р и с к раз­ вития Д Э З ( O R = 0,48; 9 5 % - н ы й CI = 0,27-0,85). 3. DUOX1 (rs 2467825) П р и сравнительном анализе частот генотипов выяв­ л е н о в группе Д Э З достоверное увеличение носителей A G - г е н о т и п а (64%), в к о н т р о л ь н о й - максимальное н а к о п л е н и е носителей GG генотипа (49%). В распре­ делении аллелей наблюдается т е н д е н ц и я к увеличе­ 2 контрольная ДЭЗ х Р Аллель А 0,305 0,340 0,56 0,4540 Аллель G 0,695 0,660 0,56 0,4540 Генотип АА 0,100 0,020 5,67 0,0172 Генотип AG 0,410 0,640 10,61 0,0011 Генотип GG 0,490 0,340 4,63 0,0314 н и ю содержания аллеля А в группе Д Э З (34%) относи­ тельно к о н т р о л ь н о й группы (30,5%) на ф о н е умень­ ш е н и я содержания аллеля G в группе Д Э З (66%) от­ н о с и т е л ь н о к о н т р о л ь н о й группы (69,6%) (табл. 4, р и с . 3). Д а н н о е распределение аллелей и генотипов в ы я в и л и , п р и м е н и в способ объединения генотипов для расчета ш а н с о в : АА + AG против G G . На основа­ н и и полученных данных м о ж н о сделать вывод: носи­ тели генотипа G G имеют п о н и ж е н н ы й р и с к развития Д Э З (OR = 0,52; 9 5 % - н ы й CI = 0,29-0,92), а носители генотипа AG и АА — п о в ы ш е н н ы й р и с к ( O R = 1,92; 95%-ный С1 = 1,08-3,39). 4. DUOX2 (rs 7171366) Р а з л и ч и я в р а с п р е д е л е н и и аллелей и г е н о т и п о в п о л и м о р ф н о г о м а р к е р а T / G гена DUOX2 отсутство­ вали (табл. 5, р и с . 4). 5. ТРО (rs 17091737) П р и сравнительном анализе частот в ы я в л е н ы из­ м е н е н и я в виде н а к о п л е н и я аллелей Т и генотипов ТТ на ф о н е у м е н ь ш е н и я содержания аллелей G и геноти­ пов GG в группе л и ц с Д Э З относительно конт­ р о л ь н о й группы (рис. 5). Так, в группе Д Э З от­ носительно контрольной доля аллеля Т увеличилась в 1,7 раза (73 против 59,5%), а генотипа ТТ — в 1,5 ра­ за (53 против 35%). Д о л я аллеля G, наоборот, умень­ ш и л а с ь в 1,5 раза (27 против 40,5%), а генотипа GG в 2,3 раза (7 против 16%). Различия статистически Контроль Щ • ДЭЗ Рис. 3. Распределение аллелей и генотипов полиморфного маркера rs 2467825, замена - A/G гена DUOX1 в группах конт­ рольной и Д Э З . Контроль • ДЭЗ Рис. 4. Распределение аллелей и генотипов полиморфного маркера rs7171366, замена - G/T гена DUOX2 в группах конт­ рольной и Д Э З . Таблица 5. Частоты аллелей и генотипов полиморфного маркера rs 7171366, замена - G/T гена DUOX2 в группах контрольной и ДЭЗ Генетический маркер контрольная ДЭЗ t Р АллельТ 0,865 0,885 0,37 0,5454 Аллель G 0,135 0,115 0,37 0,5454 Генотип ТТ 0,740 0,770 0,24 0,6219 Генотип TG 0,250 0,23 0,11 0,7405 Генотип GG 0,100 0 1,01 0,3161 Таблица 6. Частоты аллелей и генотипов полиморфного маркера rs 17091737, замена - G/T гена ТРО в контроль­ ной и ДЭЗ группах Т G • • ТТ TG GG Контроль ДЭЗ Рис. 5. Распределение аллелей и генотипов полиморфного маркера rs 17091737, замена - G/T гена ТРО в группах конт­ рольной и Д Э З . Генетический маркер контрольная ДЭЗ t Р АллельТ 0,595 0,730 8,15 0,0043 Аллель G 0,405 0,270 8,15 0,0043 Генотип ТТ 0,350 0,530 6,57 0,0103 Генотип TG 0,490 0,400 1,64 0,2004 Генотип GG 0,160 0,070 3,98 0,0461 значимы. Частота носителей гетерозиготного геноти­ па TG в группе с Д Э З (40%) н и ж е , чем в контрольной группе (49%), но различия статистически н е з н а ч и м ы (табл. 6). Д л я расчета о т н о ш е н и я ш а н с о в с р а в н и в а л и с ь доли генотипа ТТ с о б ъ е д и н е н н ы м и д о л я м и геноти­ пов TG и G G , а ш а н с о в - доли генотипа ТТ с объе­ д и н е н н ы м и д о л я м и генотипов TGn G G . Основани­ ем для такого о б ъ е д и н е н и я послужило наличие об­ ратной зависимости между с о д е р ж а н и е м аллеля Т, генотипа ТТ о т н о с и т е л ь н о аллеля G, г е н о т и п о в ТО и GG в сравниваемых группах. Резюмируя д а н н ы е , м о ж н о сделать вывод: гомозиготное носительство аллеля Т — генотипа ТТ, способствует р а з в и т и ю Д Э З (OR = 2,09; 9 5 % - н ы й CI = 1,19-3,70), носительство генотипов GG и TG препятствует р а з в и т и ю изучае­ м о й патологии ( O R = 0,48; 9 5 % - н ы й CI = 0,27-0,83). Обсуждение Возможность влияние генетических факторов на развитие йододефицитного эндемического зоба подтверждена м н о г и м и п о п у л я ц и о н н ы м и и близне­ ц о в ы м и и с с л е д о в а н и я м и . Д л я м о н о з и г о т н ы х близ­ н е ц о в п р о ц е н т к о н к о р д а н т н о с т и по зобу всегда ока­ зывался в ы ш е , чем для дизиготных [6, 7]. С е м е й н ы е исследования п о к а з а л и , что к о э ф ф и ц и е н т наследо­ в а н и я зоба значительно в ы ш е у п о т о м к о в , где оба ро­ дителя и м е ю т зоб [8]. П р и р а с с м о т р е н и и закономер­ ностей развития зоба в п о п у л я ц и и с н о р м а л ь н ы м потреблением йода было в ы я в л е н о , что у 4 1 % обсле­ дуемых и м е ю т с я с е м е й н ы е ф о р м ы зоба [9]. О.В. Н и к о л а е в говорил о том, что наследование й о д о д е ф и ц и т н о г о зоба необходимо изучать с учетом социально-бытовых, с а н и т а р н ы х и других ф а к т о р о в . Действительно, исследование, проведенное в о д н о м из р а й о н о в Мерута, в ы я в и л о достоверные р а з л и ч и я в р а с п р о с т р а н е н н о с т и зоба среди 2611 детей в зави­ симости не только от пола и возраста, но и от т и п а жилого здания, рода з а н я т и й родителей, принадлеж­ ности к религии и о п р е д е л е н н о й касте [10]. Д р у г и м и авторами была п о к а з а н а з а в и с и м о с т ь между уровнем о б р а з о в а н и я , ф и з и ч е с к о й а к т и в н о с т ь ю , потреблени­ ем алкоголя и у в е л и ч е н н ы м о б ъ е м о м ЩЖ [11]. По их м н е н и ю , д а н н ы е факторы реализуют свое действие о п о с р е д о в а н о , в л и я я на уровень потребле­ н и я й о д и р о в а н н о й соли и к у р е н и я сигарет. Также в литературе ш и р о к о обсуждается роль генов-канди­ датов. Б ы л и в ы я в л е н ы мутации в генах NIS, TG, ТРО, TSHR, п р и в о д я щ и е к р а з в и т и ю Д Э З . Е щ е в 1977 г. Perez-Cuvit Е. et al. с о о б щ и л и о 2 близнецах с э у т и р е о и д н ы м зобом. Их родители б ы л и гетерози­ г о т н ы м и н о с и т е л я м и 2 р а з л и ч н ы х н е з н а ч и м ы х мута­ ц и й гена Т П О , п р и о б ъ е д и н е н и и к о т о р ы х у детей в о з н и к л а мутация с н а р у ш е н и е м ф у н к ц и и соответ­ ствующего белка (компаунд-гетерозиготный тип н а с л е д о в а н и я ) [12]. Corral J. и соавт. (1993) проводи­ ли генетическое обследование 56 человек, у которых в семьях встречался Д Э З . П р и этом у 25 из них была выявлена замена G на Т в 2610-м к о д о н е 10-го э к з о на гена TG, п р и в о д я щ а я к замене г и с т и д и н а на глют а м и н в 870-й а м и н о к и с л о т н о й п о з и ц и и [13]. A. Matsuda и S. Kosugi (1997) обнаружили точеч­ н у ю г о м о з и г о т н у ю з а м е н у в 1060-м н у к л е о т и д е (АСА—>ССА) NIS, ставшую п р и ч и н о й з а м е н ы т р е н и на на п р о л и н в 354-м к о д о н е и к л и н и ч е с к и проявля­ ю щ у ю с я н а р у ш е н и е м транспорта йодида в ЩЖ [3]. Hishinuma А. И соавт. п р и о б с л е д о в а н и и эутиреоидн о й ж е н щ и н ы , дважды п о д в е р г а в ш е й с я т и р е о и д э к т о м и и п о поводу д и ф ф у з н о г о зоба, в ы я в и л и замену т и м и н а на ц и т о з и н в 3828-м нуклеотиде гена TG, в результате к о т о р о й происходила з а м е н а ц и т о з и н а на а р г и н и н в 1263-м к о д о н е . И з у ч е н и е р о д о с л о в н о й п о з в о л и л о установить а у т о с о м н о - р е ц е с с и в н ы й т и п н а с л е д о в а н и я д а н н о г о генетического д е ф е к т а [14]. Gonzalez-Sarmiento R-И. соавт. (2001) обследовали 36 п а ц и е н т о в с Д Э З и у 1 из них обнаружили гетеро­ зиготную д е л е ц и ю почти всего п р о м о т о р а и 11 пер­ вых э к з о н о в гена TG. Эутиреоз поддерживался за счет п о в ы ш е н и я уровня Т Т Г и к о м п е н с а т о р н о г о об­ р а з о в а н и я зоба. До сих пор речь ш л а о герминатив­ ных, то есть в р о ж д е н н ы х мутациях, к о т о р ы е м о ж н о обнаружить в соответствующих генах л ю б о й клетки индивидуума. (Для генетического анализа, к а к пра­ вило, используют л е й к о ц и т ы п е р и ф е р и ч е с к о й кро­ ви.) О д н а к о п р и д и ф ф у з н о м зобе б ы л и обнаружены и с о м а т и ч е с к и е , то есть п р и о б р е т е н н ы е мутации, ко­ торые в отличие от г е р м и н а т и в н ы х м о ж н о обнару­ ж и т ь л и ш ь в тиреоцитах. По м н е н и е н е к о т о р ы х ис­ следователей, о н и в о з н и к а ю т из-за х р о н и ч е с к о й ги­ п е р с т и м у л я ц и и Щ Ж в условиях й о д н о г о д е ф и ц и т а на фоне пролиферативной полипотентности тиреоцитов и з а п а з д ы в а н и я р е п а р а т и в н ы х п р о ц е с с о в в ге­ н е т и ч е с к о м аппарате клеток. И з в е с т н о , что сомати­ ческие конститутивные активирующие мутации TSHR — о с н о в н а я п р и ч и н а развития многоузлового т о к с и ч е с к о г о зоба. В результате происходит неконт­ ролируемая а к т и в а ц и я рецептора (без взаимодей­ ствия с л и г а н д о м — Т Т Г ) , п р и в о д я щ а я к у с и л е н н о й пролиферации и гиперфункции тиреоцитов. Н е с м о т р я на то что существует м н о ж е с т в о работ, подтверждающих н а л и ч и е с о м а т и ч е с к и х активирую­ щ и х мутаций TSHR в а в т о н о м н ы х узлах токсическо­ го зоба, а н а л о г и ч н ы е мутации б ы л и н а й д е н ы и в об­ ластях с п о в ы ш е н н ы м захватом р а д и о а к т и в н о г о йо­ да еще на стадии д и ф ф у з н о г о эутиреоидного зоба. Это следующие генетические д е ф е к т ы TSHR: A623I, L629P, F631L и T632I [4]. Впоследствии о н и стано­ вятся п р и ч и н о й ф о р м и р о в а н и я " г о р я ч и х " узлов. В настоящее время о с н о в н ы м подходом в изуче­ н и и генетической п р е д р а с п о л о ж е н н о с т и к опреде­ л е н н о й патологии является методика и с п о л ь з о в а н и я п о л и м о р ф н ы х маркеров, с ц е п л е н н ы х с р а з л и ч н ы м и генами-кандидатами. П о л и м о р ф и з м гена — эволюц и о н н о з а к р е п л е н н а я м н о г о в а р и а н т н о с т ь одного и того же гена (варианты гена — аллели). Иногда поли­ м о р ф и з м может проявляться в качественных или ко­ личественных свойствах своего белкового продукта: в структуре ф е р м е н т а , его с п е ц и ф и ч н о с т и , сродстве к субстрату, а к т и в н о с т и , к о н ц е н т р а ц и и и т.д. Поли­ морфный генетический маркер — вариабельный участок Д Н К , в р а з л и ч н о й степени с ц е п л е н н ы й (ас­ с о ц и и р о в а н н ы й ) с к а к и м - л и б о п р и з н а к о м . Поли­ м о р ф н ы й маркер может быть к а к а н о н и м н ы м , т а к и " а д р е с н ы м " (находиться вблизи и л и внутри конк­ ретного гена). В большинстве случаев генетические полиморфные маркеры не являются собственно этиологическими в а р и а н т а м и , которые определяют предрасположенность к заболеванию, но часто о н и находятся в неравновесии по с ц е п л е н и ю с э т и м и ва­ р и а н т а м и . Таким образом, по н а л и ч и ю а с с о ц и а ц и и или с ц е п л е н и ю п о л и м о р ф н о г о маркера с патологией м о ж н о судить и об а с с о ц и а ц и и или с ц е п л е н и и соот­ ветствующего этиологического варианта конкретно­ го гена. Что касается роли п о л и м о р ф н ы х маркеров генов — кандидатов в развитии Д Э З , то на сегодняш­ н и й день количество проводимых исследований не­ велико. Нам удалось обнаружить работу, в к о т о р о й изучалась взаимосвязь между наследованием Д Э З на уровне одного семейства в разных п о к о л е н и я х и распределением полиморфных маркеров генов TSHR, NIS, Т Р О , TG, M N G - 1 у больных и здоровых л и ц [15]. П р и п о м о щ и анализа с ц е п л е н и я было по­ казано, что маркеры AT и СТ гена TSHR, а также D14S1030 и D14S1054 гена MNG-1 а с с о ц и и р о в а н ы с развитием Д Э З . С у щ н о с т ь анализа с ц е п л е н и я сос­ тоит в сопоставлении наследования патологического п р и з н а к а (болезни) в р о д о с л о в н о й с наследованием различных полиморфных генетических маркеров с точно известной х р о м о с о м н о й л о к а л и з а ц и е й . Если в семье все больные или их значительная часть в от­ л и ч и е от здоровых имеют о д и н и тот же аллель ис­ следуемого маркера, это свидетельствует об отсут­ ствии р е к о м б и н а ц и й между к о н к р е т н ы м геном и маркером, то есть о н а л и ч и и с ц е п л е н и я между н и м и . В д а н н о м исследовании о ц е н к а н а л и ч и я или отсут­ ствия а с с о ц и а ц и и п о л и м о р ф н ы х м а р к е р о в с изучае­ мой патологией проводилась на уровне л и ш ь одного о п р е д е л е н н о г о семейства. Н а п о п у л я ц и о н н о м ж е уровне подобные исследования не п р о в о д и л и с ь , что определило актуальность п р о в е д е н н о й н а м и работы. В а с с о ц и а т и в н ы х исследованиях генетической п р е д р а с п о л о ж е н н о с т и н а п о п у л я ц и о н н о м уровне о б ы ч н о используют методический подход "случай — к о н т р о л ь " , где группа " с л у ч а й " состоит из л и ц с чет­ ко в ы р а ж е н н ы м ф е н о т и п о м б о л е з н и , тогда к а к груп­ па " к о н т р о л ь " — из л и ц с не менее в ы р а ж е н н ы м от­ сутствием такого ф е н о т и п а . А с с о ц и а ц и я ф е н о т и п а с г е н о т и п о м (генетическим м а р к е р о м ) — это досто­ верно н е о д и н а к о в о е распределение частоты встреча­ емости маркера среди индивидуумов с р а з л и ч н ы м и фенотипами. Более высокая распространенность маркера среди л и ц с о п р е д е л е н н о й патологией по с р а в н е н и ю со з д о р о в ы м и указывает на предрасполо­ ж е н н о с т ь ( п о в ы ш е н н ы й р и с к ) , а более н и з к а я — на устойчивость к з а б о л е в а н и ю ( п о н и ж е н н ы й р и с к ) . Изучение генетической п р е д р а с п о л о ж е н н о с т и к па­ тологии на п о п у л я ц и о н н о м уровне с использовани­ ем п о л и м о р ф н ы х м а р к е р о в р а з л и ч н ы х генов-канди­ датов заключается в проверке п р е д п о л о ж е н и я о том, что наличие маркера с в я з а н о с р а н н и м развитием и/или быстрым прогрессированием заболевания. Другими с л о в а м и , это п о и с к ответа на вопрос, суще­ ствуют ли вообще для данной патологии в данной по­ пуляции предрасполагающие и л и з а щ и т н ы е генети­ ческие ф а к т о р ы (маркеры) и м о ж н о ли с их по­ м о щ ь ю п р о г н о з и р о в а т ь развитие болезни. Результа­ ты проведенного н а м и генетического исследования д о к а з а л и , что для д и ф ф у з н о г о эутиреоидного зоба среди м о с к в и ч е й , п р о ж и в а ю щ и х в условиях легкого йодного д е ф и ц и т а , такие ф а к т о р ы (генетические по­ л и м о р ф н ы е маркеры) существуют. В н а ш е м исследовании в группу " с л у ч а й " вошли л и ц а , и м е ю щ и е Д Э З (п = 100), которые были отобра­ ны в результате предварительного обследования 1520 жителей М о с к в ы . О к о н ч а т е л ь н ы й д и а г н о з был уста­ новлен п р и к л и н и ч е с к о м обследовании. В группе " к о н т р о л ь " были представлены п а ц и е н т ы , соответ­ ствующие по полу и возрасту группе с наличием па­ т о л о г и и из о т д е л е н и й т р а в м а т о л о г и и московских больниц. П о в ы ш е н н ы й р и с к развития Д Э З имели носи­ тели следующих генотипов: GG и CG гена N 1 : OR = = 2,07 ( 9 5 % - н ы й CI = 1,18-3,64); AG и АА гена DUOXT. OR = 1,92 ( 9 5 % - н ы й CI = 1,08-3,39); ТТ ге­ на ТРО. OR = 2,09 ( 9 5 % - н ы й CI = 1,19-3,70). Пони­ ж е н н ы й р и с к развития Д Э З был выявлен у носите­ лей следующих генотипов: СС гена NIS: OR = 0,48 ( 9 5 % - н ы й CI = 0,27-0,85); GG гена DUOXT. OR = 0,52 ( 9 5 % - н ы й CI = 0,29-0,92); GG и TG гена Т Р О : OR = 0,48 ( 9 5 % - н ы й CI = 0,27-0,83). Различия час­ тот аллелей и генотипов генов DUOX2vi TSHR в срав­ ни вае мых группах были в ы р а ж е н ы слабо и не дости­ гали статистической з н а ч и м о с т и . Таким образом, п о л и м о р ф н ы е м а р к е р ы г е н о в NIS, DUOXI, ТРО а с с о ц и и р о в а н ы с развитием Д Э З среди популяции г. М о с к в ы .