ХИМИЧЕСКОЕ РАВНОВЕСИЕ
advertisement

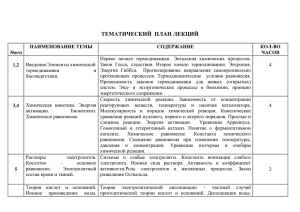
ХИМИЧЕСКОЕ РАВНОВЕСИЕ Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. КОНСТАНТА РАВНОВЕСИЯ 𝑛 ∝ 𝑝𝑗 𝑗 𝐾𝑝 = 𝑗=1 𝑛 ∝ 𝐶𝑗 𝑗 𝐾𝑐 = ИЗОТЕРМА ХИМИЧЕСКОЙ РЕАКЦИИ ИЗОБАРА ХИМИЧЕСКОЙ РЕАКЦИИ ∆𝐺 = 𝑅𝑇(ln(𝐾𝑝′ ) − ln(𝐾𝑝 )) 𝜕ln(𝐾𝑝 ) ∆𝐻 = 𝜕𝑇 𝑅𝑇 2 ∆𝐹 = 𝑅𝑇(ln(𝐾𝐶′ ) − ln(𝐾𝐶 )) 𝐾𝑝′ , 𝐾𝐶′ – константы равновесия. 𝑗=1 𝜕ln(𝐾𝐶 ) ∆𝑈 = 𝜕𝑇 𝑅𝑇 2 𝑛 ∝𝑗 𝐾𝑥 = 𝑥𝑗 𝑗=1 𝑝𝑗 – парциальные давления газообразных реагентов 𝐶𝑗 – молярные концентрации реагентов 𝑥𝑗 – мольные доли реагентов ИЗОХОРА ХИМИЧЕСКОЙ РЕАКЦИИ ∆𝐺 = 0 ∆𝐹 = 0 – Химическое равновесие ∆𝐺 < 0 ∆𝐹 < 0 – Процесс может протекать самопроизвольно ∆𝐺 > 0 ∆𝐹 > 0 – Процесс не может протекать самопроизвольно ∆𝐻 < 0, ∆𝑈 < 0 – Константа равновесия возрастает с увеличением температуры ∆𝐻 > 0, ∆𝑈 > 0 – Константа равновесия убывает с увеличением температуры Принцип Ле-Шателье – Брауна Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация,…), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.