Карточка Взаимодействие веществ, обладающих кислотными и основными свойствми
advertisement

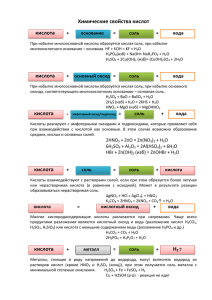
Взаимодействие веществ, обладающих кислотными и основными свойствами Реакция соединения: КИСЛОТА + ЩЁЛОЧЬ = СОЛЬ + ВОДА H2SO4 А + В = АВ Реакция разложения: + 2NaOH = Na2SO4 + 2H2O АВ = А + В Реакция замещения: H2SO4 + Ca(OH)2 = HCl + KOH = HCl + Cu(OH)2 = HNO3 + NaOH = HNO3 + Mg(OH)2 = АВ + С = АС + В Реакция обмена: АВ + СD = АС + ВD КИСЛОТНЫЙ ОКСИД + ЩЕЛОЧЬ = СОЛЬ + ВОДА SO3 + 2NaOH = Na2SO4 + H2O SO2 + KOH = CO2 + NaOH = P2O5 + Fe(OH)3 = ОСНОВНЫЙ ОКСИД + КИСЛОТА = СОЛЬ + ВОДА Na2O + 2HCl = 2NaCl + H2O K2O + H2SO4 = CuO + HNO3 = CaO + HCl = FeO + HSO4 = ОСНОВНЙ ОКСИД + КИСЛОТНЫЙ ОКСИД = СОЛЬ Na2O + SO3 CuO + SO2 = CaO + CO2 = = Na2SO4 Кислотные оксиды 1. Кислотный оксид + вода = кислота (исключение - SiO2) SO3 + H2O = SO2 + H2O = N2O5 + H2O = P2O5 + H2O = CO2 +H2O = SiO2 + H2O = 2. Кислотный оксид + щелочь = соль + вода SO3 + NaOH = P2O5 + KOH = 3. Кислотный оксид + основный оксид = соль CO2 + BaO = SiO2 + K2O = Основные оксиды 1. Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов) CaO + H2O = Na2O + H2O = BaO + H2O = 2. Основный оксид + кислота = соль + вода CuO + HCl = K2O + H3PO4 = 3. Основный оксид + кислотный оксид = соль MgO + CO2 = Na2O + N2O5 = Амфотерные оксиды 1. Амфотерный оксид + кислота = соль + вода Al2O3 + HCl = ZnO + H2SO4 = 2. Амфотерный оксид + кислотный оксид = соль ZnO + CO2 = Кислоты 1. Кислота + основный оксид = соль + вода HNO3 + CuO = H2SO4 + Fe2O3 = 2. Кислота + амфотерный оксид = соль + вода H2SO4 + Cr2O3 = HBr + ZnO = 3. Кислота + основание = соль + вода H2SiO3 + KOH = 2HBr + Ni(OH)2 = 4. Кислота + амфотерный гидроксид = соль + вода HCl + Cr(OH)3 = HNO3 + Zn(OH)2 = 5. Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты 2HBr + CaCO3 = H2S + K2SiO3 = 6. Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород HCl + Zn = H2SO4 (разб.) + Fe = Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому. Амфотерные гидроксиды 1. Амфотерный гидроксид + кислота = соль + вода 2Al(OH)3 + 3H2SO4 = Be(OH)2 + 2HCl = 2. Амфотерный гидроксид + щелочь = соль + вода (при сплавлении) Zn(OH)2 + NaOH = Al(OH)3 + NaOH = Щелочи 1. Щелочь + кислотный оксид = соль + вода Ba(OH)2 + N2O5 = 2NaOH + CO2 = 2. Щелочь + кислота = соль + вода 3KOH + H3PO4 = Bа(OH)2 + 2HNO3 = 3. Щелочь + амфотерный оксид = соль + вода 2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) 4. Щелочь + амфотерный гидроксид = соль (в водном растворе) 2NaOH + Zn(OH)2 = Na2[Zn(OH)4] NaOH + Al(OH)3 = Na[Al(OH)4] 5. Щелочь + растворимая соль = нерастворимое основание + соль Ca(OH)2 + Cu(NO3)2 = 3KOH + FeCl3 = Соли 1. Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота Na2SiO3 + HNO3 = BaCO3 + HCl = 2. Растворимая соль + растворимая соль = нерастворимая соль + соль Pb(NO3)2 + K2S = СaCl2 + Na2CO3 = 3. Растворимая соль + щелочь = соль + нерастворимое основание Cu(NO3)2 +NaOH = FeCl3 + Ba(OH)2 = 4. Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*) Zn + CuSO4 = Cu + 2AgNO3 = Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой. Разложение нитратов Ряд активности металлов • Ряд активности металлов используется на практике для относительной оценки активности металлов в реакциях с водными растворами солей, кислот, а так же для оценки катодных и анодных процессов при электролизе • Свойство отдавать электроны (восстановительная способность) УМЕНЬШАЕТСЯ слева направо, а свойство присоединять электроны (окислительная способность) – УВЕЛИЧИВАЕТСЯ 1. Металлы, стоящие левее водорода, способны вытеснять водород из водных растворов кислот-неокислителей (HCl, разб. H2SO4): Fe + 2HCl → FeCl2 + H2↑ С азотной и конц. серной кислотами реакция идет иначе (водород не выделяется!) 2. Металлы, стоящие после водорода не реагируют с растворами разбавленных кислот (HCl (в т.ч. и конц), разб. H2SO4): Cu + HCl → 3. Каждый впереди стоящий металл вытеснят последующий из растворов его солей: Mg + ZnSO4 → MgSO4 + Zn↓ 4. Чем левее стоит металл в ряду активности, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.