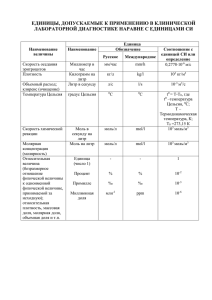
РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ Определить тепловой эффект, изменение изобарно изотермического потенциала, константу равновесия и равновесную степень превращения для реакции: 2Н2+СО СН3ОН в интервале температур от 298 до 1000 К и давлениях Р1 = 0,1; Р2 = 10 МПа, Р2 = 20 МПа Необходимые данные для расчета берутся из таблицы 1 и 2 приложения. Приведем подробный пример расчета при температуре 800 К и давлениях 0,1, 10 МПа. Тепловой эффект при стандартных условиях составит: о Н Ро Н обр Н2 о Н обр С0 о Н обр СН 3OH , Н Ро = 0-(-110,53)-201 = -90,47 кДж/моль=-90470 Дж/моль. 0 , а, в, с. Аналогично рассчитываются ∆СР, S 298 ∆СР= -28,83-29,14+44,13= -13,84 Дж/(моль∙К); 0 S 298 = -130,52-197,55+239,76 = -88,31 Дж/моль; ∆а = -27,28-28,41+15,28 = -40,41; ∆b = (-3,26-4,1-105,2)∙10-3 = 97,84∙10-3; ∆с = (-31,04)∙10-6 = 22,01∙10-6. ∆с’ = (-0,5+0,46)∙105 = -0,04∙105. Тепловой эффект по грубому уравнению Кирхгофа при 800 К рассчитывается по уравнению (5). TP 0p С (Т 298) Р Н Р800 = -90470-13,84∙(800-298) = -97417,68 Дж/моль. Тепловой эффект по точному уравнению Кирхгофа при 800 К рассчитывается по уравнению (13). TP 0p a(T 298) b 2 1 1 2 c 3 3 . T 298 T 298 c' 3 2 298 T 3 (13) Н Р800 = -90470-40,41∙(800-298)+97,84·10-3∙(8002- 2982)/2-31,04∙10-6∙(8003-2983)/3-0,04∙105∙(1/298-800)= -88823,4 Дж/моль. Энергию Гиббса по грубому уравнению рассчитывают по уравнению (21). 0 GТ0 H Р0 TS 298 . G800 = -90470-800∙(-88,31) = -19822 Дж/моль. Энергию Гиббса по приближенному уравнению рассчитывают по уравнению (25). G 800 = -90470-800∙(-88,31) +13,84∙800∙0,3597 = -14993,5 Дж/моль. 0 GТ0 H Р0 TS 298 С Р ТM 0 . Энергию Гиббса по точному уравнению рассчитывают по уравнению (26). G800 =-90470-(-88,31) ∙800-800∙(-40,41∙0,3597-97,84∙10-3∙0,1574∙103+- 31,04∙10-6 0,0733∙106-0,04∙1050,2213∙10-5 = -21214,7 Дж/моль. 0 GТ0 H Р0 TS 298 Т (аМ 0 bМ 1 сМ 2 с М 2 ) , Таб.2 Константу равновесия при 800 К и 0,1 МПа рассчитывают по уравнению (32). К р =К f =e 21214,7 8,314800 24,28 К Р е G /(RT ) , (32) равно где R - универсальная газовая постоянная, ее значение 8,314Дж/(моль·К). Константу равновесия при 800 К и 10 МПа рассчитывают по уравнению (36). Для этого вычисляют приведенную температуру и давление для каждого реагента. = 800/33,2 = 24,09; = 10/1,32 = 7,57; = 10/3,5 = 2,85; СO = 800/132,9 = 6,77; CH3OH = 800/512,6 = 1,75; = 10/8,1= 1,12. Для Н2 Коэффициент активности определяют по графику (см. рисунок 4 методических указаний). Н 2 = 1,0; СО = 1,0; CН OH 3 = 0,9. Рассчитывают Ку по уравнению: К СН OH , 2 Н СO 3 2 Кγ 0,9 0,9, 1,0 1,0 Кр 24,27 26,97 . 0,9 Равновесную степень превращения исходных веществ рассчитывают по уравнению . х 1 1 . КРР 1 . При 0,1 МПа х 1 1 0,8. 1,0 1* 24,27 При 10 МПа х 1 1 0,81. 1 100 * 26,97 Для остальных давлений и температур расчет ведется аналогично, результаты расчета сведем в таблицу 1. По результатам расчета построим вышеуказанные графические зависимости (рисунки 1, 2, 3). Таблица 1 – Сводная таблица термодинамических величин ∆Gгр, ∆Gпр, Дж/моль -64153,62 Дж/моль -64153,62 -63977 63814,2416 -55146 54518,7712 -46315 -37484 -28653 -19822 -10991 -2160 -44957,296 35163,8624 25168,2264 14993,5008 -4653,3872 5818,76 ∆Gточ, Кp Кγ КP Дж/моль 0,1 Мпа 10 МПа 20 МПа 10 МПа -64153,62 1,76E+11 0,210526 0,166667 8,35997E+11 Х 20 МПа 1,056E+12 -63842,876 1,307E+11 0,210526 0,166667 6,21051E+11 7,84485E+11 -54888,606 46013,9354 37381,0441 29092,7147 21214,7051 7513,5472 21136,365 0,1 МПа 1 10 МПа 1 20 МПа 1 1 1 1 14722288 0,342105 0,342105 43034380,81 43034380,81 0,99999997 0,9999988 0,9999977 64152,904 0,6 0,35 106921,5062 183294,0106 0,99999221 0,9995327 0,9994549 1796,497 0,7 0,7 2566,42433 148,25296 0,85 0,75 174,4152477 197,670614 0,99664435 0,7972382 0,7050328 24,278851 0,3663611 0,0786882 0,9 0,98 1 0,85 0,9 0,95 26,97650141 0,373837831 0,078688218 28,56335443 0,98002104 0,4609259 0,3535097 0,407067861 0,51781177 0,0610283 0,0450689 0,082829703 0,27008899 0,0280404 0,0203464 2566,42433 0,9997218 0,9810691 0,9631742 16 Тепловой эффект реакции, кДж/моль -82000 -84000 0 200 400 600 800 1000 1200 -86000 -88000 -90000 -92000 -94000 -96000 -98000 -100000 -102000 Температура, К Решение по грубому уравнению Решение по точному уравнению Рисунок 1 – Графическая зависимость теплового эффекта химической реакции от температуры, вычисленного по грубому (5) и точному (13) уравнениям Кирхгоффа 30000 Энергия Гиббса , Дж/моль 20000 10000 0 -10000 0 200 400 600 800 1000 1200 -20000 -30000 -40000 -50000 -60000 -70000 Решение по грубому уравнению Температура, К Решение по приближенному уравнению Решение по точному уравнению Рисунок -2 – Графическая зависимость изобарно-изотермического потенциала от температуры, вычисленного по уравнениям грубому (21), приближенному (25) и точному (26) Равновесный выход продуктов реакции, доли 17 1,2 1 0,8 0,6 0,4 0,2 0 0 200 400 600 800 1000 1200 Температура, К P=0,1 МПа P=10 МПа P=20 МПа Рисунок 3 – Графическая зависимость равновесного выхода продуктов реакции от температуры и давления Вывод 1 Рассматриваемая реакция протекает с выделением тепла и является экзотермической, т.к. Н < 0. 2 Реакция термодинамически возможна в области температур начиная с 298 К до 800К, т.к. в этой области температур энергия Гиббса G < 0. 3 В диапазоне температур 298 К до 600 К равновесный выход продуктов реакции достигает достаточной для практических целей значений. 4 С увеличением температуры и давления в ходе реакции понижается равновесный выход продуктов реакции. Рекомендации к ведению реакции Исходя из проведенного термодинамического расчета и его анализа можно привести следующие рекомендации к ведению реакции: Реакцию целесообразно проводить в интервале температур 298 – 600 К и давлении равном 0,1 МПа, при этих условиях выход продуктов реакции будет максимален и достаточен для практического осуществления.