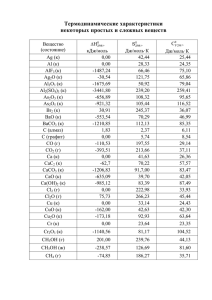
РТ–2017/2018 гг. Этап I Вариант 1 А1. К s-элементам относится: 1) Р; 2) Na; 3) B; 4) Ar. А2. В атоме элемента 13 протонов. В периодической системе он расположен в периоде: 1) 1; 2) 2; 3) 3; 4) 4. А3. В частице 1H+ число электронов и число нейтронов равно соответственно: 1) 0, 0; 2) 0, 1; 3) 1, 0; 4) 1, 1. А4. Электронная конфигурация атома химического элемента Х в основном состоянии 1s2 2s2 2p3. Укажите верное утверждение относительно Х: 1) относится к металлам; 2) простое вещество состоит из одноатомных молекул; 3) имеет переменную валентность; 4) образует несколько простых веществ А5. Ковалентную НЕполярную связь содержит вещество: 1) NaCl; 2) Zn; 3) HI; 4) Br2. А6. Установите соответствие между формулой вещества и степенью окисления в нем атома химического элемента, указанного в скобках. Формула вещества 1) K2SO4 (S) 2) CCl4 (C) 3) NH4I (N) Степень окисления атома а) –4 б) –3 в) +6 г) +4 д) +3 1) 1г, 2а, 3д; 2) 1в, 2г, 3б; 3) 1д, 2г, 3а; 4) 1в, 2а, 3д. А7. С помощью прибора, указанного на рисунке, способом вытеснения воздуха с минимальными потерями можно собрать газ: 1) оксид углерода(IV); 2) сероводород 3) хлор; 4) аммиак. А8. Количество (моль) атомов водорода в метане, объем (н. у.) которого 30,24 дм3 , равно: 1) 4,05; 2) 5,40; 3) 10,80; 4) 13,15. А9. Основным оксидом является: 1) Nа2O2; 2) ZnO; 3) FeO; 4) Mn2O7. А10. При добавлении по каплям раствора NaOH к разбавленному раствору соли сначала наблюдается выпадение осадка, а затем его растворение. Укажите формулу соли: 1) Ba(HCO3)2; 2) Fe(NO3)2; 3) KNO3; 4) Al2(SO4)3. А11. Разбавленный раствор йодоводородной кислоты можно использовать для осуществления в одну стадию превращения: 1) KNO3 → KI; 2) CaO → CaI2; 3) Hg → HgI2; 4) Na2SO4 → H2SO4. А12. Все вещества, формулы которых Na2SO4, CuSO4, MgSO4: 1) можно получить при взаимодействии соответствующих металлов с H2SO4(конц); 2) реагируют с растворенным в воде углекислым газом; 3) вступают в реакцию с водным раствором гидроксида калия; 4) НЕ реагируют с разбавленным водным раствором нитрата серебра(I) . А13. Установите соответствие между химическим элементом и агрегатным состоянием (н. у.) простого вещества, которое образует данный элемент. 1) Не 2) I 3) F 4) Br а) жидкость б) газ в) твердое вещество 1) 1а, 2в, 3б, 4б; 2) 1а, 2б, 3в, 4в; 3) 1б, 2б, 3в, 4а; 4) 1б, 2в, 3б, 4а. А14. C хлором реагируют, а с разбавленной соляной кислотой НЕ реагируют (20 ºC) вещества: а) Li; б) MgBr2; в) Fe; г) С2H6. 1) а, б; 2) а, в; 3) б, г; 4) в, г. А15. Укажите верные утверждения относительно кислорода: а) в молекуле О2 имеется кратная связь; б) НЕ образует аллотропных модификаций; в) можно получить термическим разложением нитрата натрия; г) образует оксиды со всеми неметаллами. 1) а, б; 2) в, г; 3) б, в; 4) а, в. А16. Дано предложение с пропусками. Атом фосфора в основном состоянии имеет электронную конфигурацию ______, может проявлять высшую степень окисления ______ и максимальную валентность ______. Выберите ряд, в котором последовательно указаны недостающие фрагменты предложения: 1) 1s22s22p3; +3; V; 2) 1s22s22p63s2 3p5; +3; IV; 3) 1s22s22p63s23p3; +5; V; 4) 1s22s22p3; +5; III. А17. Сосуд от накипи можно очистить с помощью водного раствора вещества: 1) HCOOH; 2) NaHCO3; 3) K2CO3; 4) NaCl. А18. Масса медной пластинки изменяется при ее погружении в разбавленные водные растворы веществ: а) HNO3; б) FeCl2; в) AgNO3; г) KOH. 1) а, г; 2) а, в; 3) б, г; 4) б, в. А19. Жесткость воде придает растворенное в ней вещество: 1) Ca(HCO3)2; 2) ZnCO3; 3) NaCl; 4) KHCO3. А20. На образец сплава массой 9,2 г, состоящего из меди и алюминия, подействовали избытком разбавленного раствора гидроксида калия. В результате полного протекания реакции выделился водород объемом (н. у.) 11,2 дм3. Массовая доля (%) алюминия в сплаве: 1) 49; 2) 68; 3) 91; 4) 98 А21. Образование HF из простых веществ протекает по термохимическому уравнению: H2(г) + F2(г) = 2HF(г) + Q кДж. При разрыве связей в молекулах H2 количеством 1 моль и F2 количеством 1 моль поглощается теплота количеством 436 кДж и 159 кДж соответственно. При образовании связей в молекулах HF количеством 1 моль выделяется теплота, равная 569 кДж. Укажите общий тепловой эффект (кДж) реакции: 1) 543; 2) 364; 3) 219; 4) 189. А22. Коэффициент перед продуктом окисления в уравнении реакции, протекающей по схеме Na2Cr2O7 + KI + H2SO4 → I2 + Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O, равен: 1) 1; 2) 2; 3) 3; 4) 6. А23. В сосуде установилось равновесие H2(г) + I2(г) → 2HI(г) + Q. Укажите верные утверждения: а) при понижении температуры равновесие смещается в сторону продукта; б) при повышении давления равновесие смещается в сторону исходных веществ; в) при повышении температуры скорость прямой реакции увеличивается; г) в состоянии равновесия скорости прямой и обратной реакции равны. 1) а, в, г; 2) а, г; 3) в, г; 4) б, в. А24. Стакан с насыщенным при 800 С водным раствором K2SO4 охладили до 200 С. При этом образовался осадок. Укажите верное утверждение: 1) масса соли в растворе НЕ изменилась; 2) если нагреть раствор до 50 °С, он останется насыщенным; 3) масса соли в растворе увеличилась; 4) если перемешать раствор, масса осадка уменьшится. А25. Лампочка прибора для измерения электропроводности (см. рис.) НЕ загорится при опускании электродов в: 1) раствор хлорида железа(II); 2) расплав хлорида магния; 3) расплав серы; 4) раствор гидроксида натрия. А26. В растворе, pH которого 14, в значительных количествах НЕ могут присутствовать ионы: а) Na+ ; б) NH4+ ; в) Ва2+; г) Mg2+. 1) а, в; 2) а, б, г; 3) б, в; 4) б, г. A27. Модель молекулы насыщенного углеводорода изображена на рисунке: 1) ; 2) ; 3) ; 4) . А28. Ацетилен обесцвечивает водный раствор вещества: 1) лакмус; 2) Cu(NO3)2; 3) Br2; 4) HBr. A29. Изомеры образуются при гидрировании избытком водорода углеводородов пары: А30. Укажите верное утверждение относительно бензола: 1) вступает в реакции замещения и присоединения; 2) имеет разные длины связей С – С в молекуле; 3) является твердым веществом (25 ºС); 4) имеет структурную формулу (см. рис.) А31. В отличие от этанола глицерин вступает в химическую реакцию с веществом: 1) Na; 2) K2SO4; 3) HCOOH / H+ , t; 4) Cu(OH)2. А32. К фенолу массой 35,7 г добавили водный раствор гидроксида натрия, масса NaOH в котором равна 12,8 г. В результате реакции образовался фенолят натрия массой (г): 1) 44; 2) 33; 3) 30; 4) 37. А33. Потемневшая медная проволока после внесения в сосуд с органическим веществом Х снова заблестела. При этом в сосуде образовался муравьиный альдегид. Укажите вещество Х: 1) этиленгликоль; 2) бутанол-1; 3) метанол; 4) метилэтаноат. А34. При щелочном гидролизе сложного эфира, который является изомером пропановой кислоты, образуются вещества пары: 1) СН3ОNa и СН3СООNa; 2) С2Н5ОН и НСООNa; 3) СН3СН2ОН и СН3СООNa; 4) (СН3)2СНСН2ОK и НСООH. А35. Масса (г) продуктов полного гидролиза сахарозы количеством 1,5 моль равна: 1) 540; 2) 360; 3) 342; 4) 270. А36. Выберите характеристики вещества, формула которого: а) имеет название пропанамин-1; б) реагирует с серной кислотой; в) является органическим основанием; г) плохо растворяется воде. 1) а, в; 2) а, г; 3) б, в; 4) б, г. в А37. Число остатков аминокислот в молекуле, формула которой дана на рисунке, равно: 1) 1; 2) 2; 3) 3; 4) 4. А38. Полимер, формула которого, образован мономером: 1) 3-метилбутин-1; 2) изопрен; 3) бутен-1; 4) пентен-2. Часть В В1. Сложный эфир А образован остатками карбоновой кислоты и спирта. Относительная плотность паров вещества А по водороду равна 44. При кислотном гидролизе А образовались вещества Б и В, которые содержат в молекулах равное число атомов углерода. В реакции Б с калием, кроме органического вещества, образуется газ Д. При взаимодействии В с раствором карбоната калия образуются органическое вещество Г и два оксида. Определите сумму молярных масс (г/моль) веществ Г и Д. В2. Выберите утверждения, верно характеризующие стеариновую кислоту. 1) является гомологом уксусной кислоты 2) является изомером олеиновой кислоты 3) НЕ обесцвечивает водный раствор перманганата калия 4) может быть получена при кислотном гидролизе триглицерида 5) хорошо растворяется в воде (25 °С) 6) представляет собой жидкость (н. у.) Ответ запишите в виде последовательности цифр в порядке возрастания, например: 346. В3. Газообразную смесь алкана с алкеном объемом (н. у.) 16,8 дм3пропустили через сосуд с избытком раствора брома в ССl4. При этом масса сосуда с содержимым выросла на 21 г, а объем (н. у.) газа уменьшился в два раза. Определите молярную массу (г/моль) алкена. В4. Найдите сумму молярных масс (г/моль) органических веществ А и Б,полученных в результате следующих превращений (Х1 – неорганический продукт реакции): X1 СН3СН=СН2 /Н3РО4, t,р →…… HBr, t → A бензол HNO3 / H2SO4 (конц) X2 Fe / HCl (изб) → …… AgNO3 (р-р) → Б. В5. Дан перечень неорганических веществ: графит, гидроксид бария, кремнезем, мел, натриевая селитра, углекислый газ, фтор, хлорид аммония. Укажите число высших оксидов, растворимых оснований, солей и простых веществ соответственно. Ответ запишите цифрами, соблюдая полученную последовательность, например: 1223. В6. Простое газообразное вещество А желто-зеленого цвета с резким запахом реагирует с металлом Б, в результате чего получается вещество В. Газ А имеет плотность (н. у.), равную 3,17 г/дм3 . Химический элемент Б в соединениях имеет постоянную валентность I. При действии на вещество Вмассой 23,05 г концентрированной серной кислоты с выходом 81 % выделяется бесцветный газ Г объемом (н. у.) 5,61 дм3 , который хорошо растворяется в воде. Определите сумму молярных масс (г/моль) веществ В иГ. В7. Для осуществления реакций согласно данной схеме превращений FeS О2 (изб)→ A Б → B H2O → Г Д → SO2 выберите вещества А–Д из предложенных: 1 – О2; 2 – SO2; 3 – SO3; 4 – Cu; 5 – H2; 6 – H2SO4. Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв, например: А1Б4В3Г6Д2. В8. Установите соответствие между формулой вещества и формулой реактива, с помощью которого можно обнаружить данное вещество. Все электролиты взяты в виде разбавленных водных растворов. Формула вещества А) NH4Br Б) H2SO4 В) KHCO3 Г) FeСl3 Формула реактива 1) BaСl2 2) K2SO4 3) NaOH 4) HNO3 Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4В3Г2. Помните, что один и тот же реактив может использоваться несколько раз или НЕ использоваться вообще. В9. В стиральные порошки для предотвращения слеживания добавляют безводный сульфат натрия. Он поглощает воду, образуя кристаллогидрат (Na2SO4 · xH2O), массовые доли элементов в котором w(Na) = 0,143; w(S) = 0,099; w(O) = 0,696; w(H) = 0,062. Вычислите массу (г) поглощенной воды в составе кристаллогидрата массой 415 г. В10. Найдите сумму молярных масс (г/моль) цинксодержащих веществ В иД, образовавшихся в результате превращений: ZnSO4 (1 моль) 2 моль KOH (р-р) → A KOH (конц, изб) → Б HNO3(разб, изб) →В t → Г LiOH (тв), t →Д В11. После поджигания смеси (н. у.) угарного газа и кислорода, и приведения к первоначальным условиям ее объем стал на 14 % меньше, чем до поджигания. Полученная смесь газов может прореагировать с кислородом объемом (н. у.) 174 дм3. Рассчитайте объем (дм3 ) угарного газа в исходной смеси. В12. Пластинку из неизвестного металла массой 50 г поместили в раствор нитрата свинца(II), взятый в недостатке. Масса нитрата свинца(II) в растворе составляла 66,2 г. По окончании реакции масса пластинки увеличилась на 38 %, а в растворе образовалась соль Ме(NO3)2. Найдите относительную атомную массу металла.