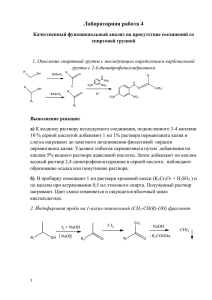
В общем виде для реакции
advertisement

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ имени ШАКАРИМА
Документ СМК 3 уровня
УМКД
УМКД
Учебно-методические
УМКД 042-16-13.1.3 /03-2013
материалы по дисциплине
Редакция № 1 от ___.09.2013
«Неорганическая и
органическая химия»
УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС ДИСЦИПЛИНЫ
«Неорганическая и органическая химия»
для специальности 5В072700 – «Технология продовольственных
продуктов»
для специальности 5В072800 – «Технология перерабатывающих
производств»
УЧЕБНО-МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ
Семей
2013
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
СОДЕРЖАНИЕ
1. Лекции
2. Лабораторные занятия
3. Тестовые вопросы для СРС
.09.2013
стр. 2 из 133
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 3 из 133
Лекция 1 - Введение. Классификация органических соединений.
Содержание:
1. Строение и свойства органических соединений
2. Изомерия органических соединений
3. Классификация органических соединений
1. Органическими соединениями называются соединения углерода, атомы
которого связаны друг с другом или атомами другого элемента ковалентными
связями. Причины выделения в самостоятельную науку органической химии:
1) многочисленность органических соединений,
2)разнообразие использования органических соединений,
3) многонаправленность химических реакций с органическими соединениями.
Типы реакций в органических соединениях: реакции присоединения,
замещения, окисления, полимеризации, изомеризации, карекинга.
2. Изомерией называется такое явление, когда несколько разных химических
соединений обладают одинаковым элементным составом и молекулярной
массой, но отличаются по порядку соединения атомов в молекуле. Виды
измерии: структурная (скелетная)- изомерия углеводородного скелета и
изомерия расположения связей, функциональных групп, заместителей;
пространственная – конформационная, геометрическая, оптическая изомерия;
изомерия между классами органических соединений; динамическая изомерия
(таутомерия) – кето-енольная и цепочно-кольцевая изомерия.
3. по строению скелета органические соединения подразделяются на:
1)алифатические,
2) карбоциклические,
3) гетероциклические.
По характеру связей между углеродными атомами соединения подразделяются
на предельные и непредельные. По наличию в составе молекул тех или иных
атомов органические соединения подразделяются на углеводороды,
галогенопроизводные, кислородсодержащие, азотсодержащие. Эти классы в
свою очередь подразделяются на подклассы.
Вопросы для самоконтроля:
1. Какие виды номенклатуры присущи для органических соединений?
2. Основные положения теории А.М. Бутлерова
3. Типы органических реакций?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 2 – Алканы
Содержание:
1. Номенклатура, изомерия
2. Способы получения
3. Химические свойства
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 4 из 133
1.
Формула
Название
Физическое состояние
СН4
Метан
Газ
С2Н6
Этан
С3Н8
Пропан
С4Н10
Бутан
С5Н12
Пентан
Жидкость
С6Н14
Гексан
С7Н16
Гептан
С8Н18
Октан
С9Н20
Нонан
С10Н22
Декан
Номенклатура:
1.По самой длиной цепочке углеводородной цепи;
2.Нумерация начинается с того конца к которому ближе расположен радикал;
3.С начала указывают место радикала называют его после называют всю
цепочку. Например:
2,4-диметилпентан.
С
Н
3
С
Н
С
Н
2
С
Н
С
Н
3
С
Н
3 С
Н
3
2.Получение алканов:
1.Путем фракционной возгонки природного газа или бензина;
2.Синтез метана из угароного газа;
3.Путем гидрирования алкенов СН3-СН-СН=СН2+Н2---?
СН3
4.Восстановление галогенпроизводных водородом С3Н7Вч+Н2---?
С
Н
3
С
Н
С
I
+
2
N
а
?
5.Реакция Вюрца: 2
С
Н
3
6.Получение из карбоновых кислот:
СН3-СН-СН-СН2-СООNа+NаОН---?
СН3 СН3
3.Химические свойства:
1.Реакция галогенирования;
2.Реакция сульфохлорирования;
3.Реакция сульфоокисления;
4.Реакция нитрования;
5.Реакция оксиления при высоких температурах;
6.Крекинг
Вопросы для самоконтроля:
1. напишите изомерные углеводороды гептана. Назовите их по
систематической и рациональной номенклатуре.
2. какие углеводороды получаются при действии металлического натрия на
бромистый втор-пропил?
3. Какое соединение получится при действии азотной кислоты на изобутан?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 5 из 133
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 3 – Алкены. Алкадиены.
Содержание:
1. Номенклатура. Изомерия
2. Получение алкенов и алкадиенов
3. Химические свойства
1.
Формула
Название
Тривиальное
(историческое) название
Этилен
Пропилен
Бутилен
Пентилен
Гексилен
Гептилен
Октилен
С2Н4
Этен
С3Н6
Пропен
С4Н8
Бутен
С5Н10
Пентен
С6Н12
Гексен
С7Н14
Гептен
С8Н16
Октен
С9Н18
Нонен
С10Н20
Декен
Изомерия алкенов:
1.Изомерия углеводородного скелет;
2.Изомерия расположения двойной связи;
3.Геометрическия или пространственная (Цис- транс- изомерия начинается с
С4 )
СН3
СН3
Цис-изомер
СН3-СН-СН=СН-СН-СН3
Изомерия алкадиенов: 1.Кумулированная;
2.Коньюгированная;
2. Получение алкенов:
1.В составе некоторых видов нефти встречаются не насыщенные углеводороды;
2.Получение из газа получаемых при крекинге нефти;
3.В лаборатории путем дегидратации спирта
4.Из галоген производных путем дегидрогалогенирования;
5.Гидрирование алкинов.
Получение алкадиенов:
1.Дегидрирование алканов или алкенов;
2.Дегидратация гликолей;
3.Дегидратация ненасыщенных спиртов;
4.По методу Лебедева дегидрирование спирта.
Химические свойства алкенов:
1.Реакция гидрирования по Лебедеву чем меньше радикалов тем быстрее идет
СН3-СН-СН=СН2+Н2---?
реакция гидрирования;
СН3
2.Галогенирование: СН3-С=СН-СН2-СН2-СН3+Вч2---?
СН3
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 6 из 133
3.Гидрогалогенирование: СН3-С=СН-СН3+НВч---?
СН3
4.Гидратация: СН3-СН=СН-СН3+НОН---?
5.Окисление
6.Полимеризация
Химические свойства алкадиенов:
1.Гидрирование; Н2С=СН-СН=СН2+Н-Н---?
2.Галогенирование; СН2=С-СН=СН2+2Вч2---?
3.Гидрогалогенирование СН3
4.Полимеризация;
Вопросы для самоконтроля:
1. Выведите все изомерные углеводороды состава С5Н10
2. Какое соединение образуется при действии йодистого водорода на
триметилэтилен?
3. Какие этиленовые углеводороды могут быть получены путем
дегидрирования 2-метилбутана, бутана?
Рекомендуемая литература
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 4 - Алкины
Содержание:
1. Номенклатура. Изомерия
2. Способы получения
3. Химические свойства
1.
Формула
С2Н2
С3Н4
С4Н6
С5Н8
С6Н10
С7Н12
С8Н14
С9Н16
С10Н18
Этин
Пропин
Бутин
Пентин
Гексин
Гептин
Октин
Нонин
Декин
Название
Тривиальное
(историческое) название
Ацетилен
-
Алкины – углеводороды в состав которых входит тройная связь.
Изомерия: 1.углеводородного скелета
2.расположения тройной связи.
2. Методы получения:
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 7 из 133
1.Ацетилен получают и карбида кальция СаС2 + 2Н2О → НС≡СН + Са(ОН)2
2.Из галоген производных
3.Путем алкилирование ацитилена получают другие алкины
3. Химические свойства:
1.Гидрирование:
2.Галогенирование
3.Гидрогалогенирование
4.Гидратация
5.Получение ацетиленидов метала
6.Полимеризация
Вопросы для самоконтроля:
1. Выведите все изомерные ацетиленовые углеводороды состава С5Н8 и С4Н6.
2. Как протекают реакции действия брома на этилацетилен, хлора на 2-бутин?
3. Какое соединение полуится при действии бромистого пропила на
мононатриевый ацетиленид?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекции 5-6 Арены
Содержание:
1. Номенклатура. Изомерия
2. Правила ориентации бензольного кольца
3. Способы получения
4. Химические свойства
1.Аренами или ароматическими углеводородами называют – углеводороды в
состав которых входят бензольные кольца. К ним относятся бензол и его
производные.
Метилбензол, толуол
С
Н
3
о-диметилбензол,
о-ксилол
СН3
СН3
Изомерия зависит от вида радикала, от того как он расположен и от количества.
2. Правила ориентации бензольного кольца:
1.Заместители І-рода с электроифльными реагентами облегчают реакцию и
направляют заместитель в орта и пара положение.
2.Заместители ІІ-рода с нуклеофильными реагентами облегчают реакцию и
направляют заместитель в мета положение.
3. Получение:
1.Из нефти и из каменного угля и смолы;
2.Бензол получают из бензойной кислоты и солей бензойной кислоты;
3.Гомологи бензола получают из галогенпроизводных по методу ВюрцФиттига;
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 8 из 133
4.Гомологи бензола получают по методу Фридель-Крафтс-Густавсона
присоединяя к бензолу алкилгалогены;
4. Химические свойства:
Реакции присоединения происходят при особых условиях;
1.Гидрирование;
2.Галогенирование при УФ до циклогексана, при катализаторе до
галогенпроизводного бензола;
3.Нитрирование С6Н6+НО-NО2→ С6Н5NО2+НОН
4.Сульфирование;
5.Оксиление;
6.С перманганатом калия оксиляется до соли бензойной кислоты.
Вопросы для самоконтроля:
1. Выведите формулы изомерных углеводородов метилэтилбензола.
2. Какое соединение образуется при действии на бензол трех молекул брома.
Какие необходимы условия?
3. напишите схемы полимеризации стирола.
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 7 – Алифатические и ароматические галогенопроизводные
углеводородов
Содержание:
1. Номенклатура. Изомерия.
2. Способы получения
3. Химические свойства
1. Галогенпроизводными алифатических углеводородов – называют
углеводороды в которых несколько атомов водорода замещены галогенами.
Номенклатура: 1.По расположению галогена
Например: СН3-СНСI-СН2-СН3 2-хлорбутан
СН3-СН2-СН2-СН2СI 1-хлорбутан
С
Н
3
С
Н
С
Н
С
I
2
1,1-дихлор 2- метил пропан
С
Н
3
2. Методы получения:
1.Путем замещения из изоалканов
2.Путем присоединения к алкенам галогенводородов.
3.Путем замещения гидроксильной группы в спиртах галогеном
3. Химические свойства:
Очень реакциоспособные соединения
1.Реакция гидрогалогенирования:
2.Рекция гидрирования;
3.Гидролиз;
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 9 из 133
4.Реакция с щелочными металлами;
5.Реакция с солями карбоновых кислот;
6.Реакция со спиртовым раствором гидроксида калия.
Вопросы для самоконтроля:
1. Выведите формулы всех изомеров состава С3Н7I
2. Напишите схемы гидролиза при действии водного раствора щелочи на 1хлор-3-метилбутан. К какому классу соединений относится образующееся
соединение?
3. Какое соединение образуется при хлора и последующего отщепления 1
молекулы хлористого водорода на 3-метилбутен-1?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 8 – Спирты. Простые эфиры.Многоатомные спирты.
Содержание:
1. Номенклатура. Изомерия
2. Способы получения
3. Химические свойства.
Спиртами или алкоголями называют углеводороды в состав которых входит
гидроксильная группа. К ним относятся метиловый спирт, этиловый спирт и
т.д. Различаются первичные, вторичные и третичные спирты. Многоатомными
спиртами называют углеводороды в сотсав которых входят два и более атом
гидроксила. К ним относятся этиленгликоль, глицерин и т.д.
Изомерия:
1. Углеводородного скелета
2. Расположения гидроксильной группы
2. Получение:
1.Из галогенпроизводных при гидролизе;
2.Из угарного газа при восстановлении;
3.Из этилена при гидролизе Н2С=СН2+НОН →;
4.Из глюкозы при брожении
5.Путем восстановления альдегида или кетона
Получение многоатомных спиртов:
1.Из дигалогенпроизводных при гидролизе;
3. Химические свойства:
1.Взаимодействуют с металлическим натрием и получают алкоголят натрия;
2.При взаимодействии с неорганическими и органическиеим кислотами
получают сложные эфиры, этот процесс называется этерификацией;
3.При дегидратации получают алкены;
4.При межмолекулярной дегидратации получают простой эфир;
5.При окислении спирты окисляются до альдегидов, кетонов и карбоновых
кислот;
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 10 из 133
Химические свойства многоатомных спиртов:
1.Взаимодействуют с металлическим натрием и получают алкоголят натрия;
2.Взаимодействуют с гидроксидом меди (ІІ) и получают гликолят меди;
3.При взаимодействии с неорганическими и органическимкислотами
получаются сложны эфиры;
Вопросы для самоконтроля:
1. выведите формулы изомерных спиртов С4Н10О. Назовите по радикальной и
систематической номенклатурам.
2. напишите уравнение реакции пропилового спирта с пентахлоридом фосфора.
3. Какое соединение образуется при действии на 2-метил-2-пентен воды?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 9 – Фенолы. Ароматические спирты
Содержание:
1. Номенклатура. Изомерия.
2. Способы получения
3. Химические свойства
1. Фенолы – гидроксилсодержащие ароматические соединения, в молекулах
которых гидроксил связан непосредственно с углеродным атомом бензольного
ядра. Общая формула Ar-OH. По числу гидроксильных групп различают одно,
двух- и многоатомные фенолы. Изомерия обусловлена положением
гидроксильной группы.
2. Получение:
1. Плавление натриевых солей бензолсульфокислот со щелочами.
2. окислительное хлорирование бензола и его последующий гидролиз в
присутствии солей меди.
3. окисление кумола.
3. Химиеские свойства:
1. образование фенолятов
2. Образование простых эфиров
3. образование сложных эфиров
4. Восстановление
5. Нитрование
6. сульфирование
7. Алкилирование
8. Конденсации
9. Гидрирования
Окисления
Вопросы для самоконтроля:
1. Выведите формулы всех изомерных фенолов и ароматического спирта
состава С7Н8О. Назовите их.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 11 из 133
2. Как относятся к действию водного раствора щелочи резорцин? Назовите
полученные соединения.
3. Из каких сульфокислот методом щелочного плавления можно получить
бетта-нафтол?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 10 – Альдегиды и кетоны. Ароматические альдегиды и кетоны.
Содержание:
1. Номенклатура. Изомерия.
2. Способы получения
3. Химические свойства
1. Альдегидами и кетонами называют углеводородные соединения в состав
которых входит карбонильная группа.
Альдегиды изомерия только скелетная;
Кетоны скелетная изомерия и по расположению карбонильной группы;
2. Получение:
1.Путем окисления спиртов: а)из первичных спиртов получают альдегиды;
б) из вторичных спиртов получают кетоны;
2.Из кальциевых и бариевых солей карбоновых кислот путем пиролиза;
3.При пиролизе карбоновых кислот при 400-4500С над оксидами технеция и
марганца;
4.Из алкинов по Кучерову оксосинтезом;
3. Химические свойства:
1.Гидрирование;
2.Присоединение синильной кислоты;
3.Присоединение бисульфида натрия;
4.Присоединение аммиака
5.Реакции оксиления до карбоновых кислот а)кислородом;
б)реакция серебрянного зеркала
в)присоединение Феллинговой жидкости;
Вопросы для самоконтроля:
1. Выведите формулы всех изомерных альдегидов и кетонов С4Н8О. Назовите
по ситематической и рациональной номенклатурам.
2. Напишите уравнение реакций окисления аммиачным раствором оксида
серебра диметилуксусного альдегида. Почему эта реакция может служить
качественной реакцией на альдегиды?
3. Какое соединение образуется при действии водного раствора щелочи на 1,1дихлор-2-метилбутан?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 12 из 133
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 11 - Карбоновые кислоты. Сложные эфиры. Ароматические
кислоты
Содержание:
1. Изомерия. Номенклатура.
2. Способы получения.
3. Химические свойства
1. Карбоновыми кислотами называют углеводородные соеднинеия в состав
которых входит карбонильная группа.
Формула
Название
Тривиальное
(историческое) название
СН3СООН
Метановая кислота
Муравьиная кислота
С2Н5 СООН
Этановая кислота
Уксусная кислота
С3Н7СООН
Пропановая кислота
Масляная кислота
С4Н90 СООН
Бутановая кислота
Валериановая кислота
С5Н11 СООН
Пентановая кислота
Капроновая кислота
С6Н13 СООН
Гексановая кислота
Энантовая кислота
С7Н15 СООН
Гептановая кислота
С15Н33 СООН
Пальмитиновая кислота
С17Н35 СООН
Стеариновая кислота
Сложные эфиры – производные карбоновых кислот у которых гидроксил
замещен алкоксильной группой.
2. Получение:
1.Оксиление первиных спиртов
2.Окисление альдегидов
3.Гидролиз нитрилов
4.Оксиление алканов кислородом воздуха
5.Оксосинтез альдегидов
6.Муравьиную кислоту в производстве получают из угарного газа
3. Химические свойства:
1.С щелочами образуют соли
2.С хлоридом фосфора образют хлорангидриды
3.Хлорангидриды с солями натрия образуют ангидриды
4.С аммиаком образуют амиды;
5.С о спиртами образют сложные эфиры
Вопросы для самоконтроля:
1. Выведите формулы всех изомерных карбоновых кислот состава С5Н10О2.
Назовите их.
2. Какое соединение образуется при действии на водного раствора едкого натра
на изомасляноэтиловый эфир?
3. Какая образуется карбоновая кислота если окислить трет-изобутилкарбинол?
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 13 из 133
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекции 12, 13 – Аминокислоты
Содержание:
1. Классификация аминокислот
2. Способы синтеза.
3. Химические свойства
1. Соединения, содержащие амино- и карбоксильную группы, называются
аминокислотами. В зависимости от расположения функциональных групп,
различают α, β, γ- аминокислоты.
2. Способы получения аминокислот:
1. Замена галогена в галогензамещенных кислотах на аминогруппу при
действии избытка аммиака
2. действием цианида аммония на альдегиды и кетоны
3. присоединение аммиака к альфа, бетта-непредельным кислотам.
4. действие альдегидов и аммиака на малоновую кислоту
5. восстановление нитрозамещенных кислот.
3. Химические свойства
1. образование соелй с кислотами и основаниями
2. реакции по карбоксильной группе
А) образование сложных эфиров
Б) образование амидов
В) образование аминов
3. Реакции по аминогруппе
А) взаимодействие с хлорангидридами
Б) взаимодействие с алкилами
В) взаимодействие с азотистой кислотой
Г) взаимодействие с бензойным альдегидом.
4. образование дикетопиперазинов, непредельных кислот и лактамов при
нагревании.
Вопросы для самоконтроля:
1. выведите все изомеры аминокислот состава С4Н9О2N. Назовите их
В чем проявляется амфотерность аминокислот? Приведите примеры.
3. напишите схему образования дипептида из молекулы глицина и молекулы
аланина.
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лекция 14 – Углеводы
Содержание
1. Классификация углеводов
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 14 из 133
2. строение углеводов
3. Химические свойства
1.
Моносахариды
Дисахариды С12Н22О11
Полисахариды
Тетрозы С4Н8О4
Сахароза
(С5Н8О4)n
Эритроза
Мальтоза
Пентозаны
Триоза
Лактоза
(С6Н10О5)n
Пентозы С5Н10О5
Целлобиоза
Целлюлоза
Арабиноза
Крахмал
Ксилоза
Гликоген
Рибоза
Гексозы С6Н12О6
Глюкоза
Манноза
Галактоза
Фруктоза
2. Существуют альдегидные и циклические форму углеводов
CHO
H
HO
H
H
OH
H
OH
OH
CH2OH
H
CH2OH
O
H
H
OH
H
OH
OH
H
OH
Д-глюкоза (альдегидная форма)
циклическая форма
3. Химические свойства:
1. восстановление
2. окисление.
3. присоединение синильной кислоты
4. реакция с фенилгидразином
5. алкилирование
6. ацилирование
7. расщепление углеродной цепи
8. эпимеризация моносахаридов
9. действие кислот
Вопросы для самоконтроля:
1. напишите структурные формулы альдогексозы, альдогептозы, кетопентозы,
кетогептозы.
2. Что такое циклическая α-форма и циклическая β-форма моносахаридов?
3. Напишите схему синтеза альдогексоз из L-арабинозы окиснитрильным
способом.
Рекомендуемая литература:
1.Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2.Нейлан О. Органическая химия. Высшая школа. 1990
3.Роберт Дж., Кассерио М. Основы органической химии. М., 1978
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 15 из 133
Лекция 15 - Основные группы биологически активных соединений и
важнейших метаболитов
Содержание:
1. Белки, строение, функции
2. Нуклеиновые кислоты, строение, функции
Белки являются основным органическим веществом, из которого построены
клетки животного организма (в растительных клетках белка содержится
меньше).
Функции белков в организме универсальны: ферментативная, структурная,
рецепторная, сократительная, защитная, транспортная, регуляторная.
При взаимодействии двух молекул α-аминокислот происходит реакция между
аминогруппой одной молекулы и карбоксильной группы - другой.
Молекулярные массы различных белков (полипептидов) составляют от 10 000
до нескольких миллионов. Макромолекулы белков имеют стереорегулярное
строение, исключительно важное для проявления ими определенных
биологических
свойств.
Несмотря на многочисле
аминокислот.
Функции белков в природе универсальны:
каталитические (ферменты);
регуляторные (гормоны);
структурные (кератин шерсти, фиброин шелка, коллаген);
двигательные (актин, миозин);
транспортные (гемоглобин);
запасные (казеин, яичный альбумин);
защитные (иммуноглобулины).
Выделяют 4 уровня структурной организации белков.
Нуклеиновые кислоты осуществляют хранение, воспроизводство и реализацию
генетической информации, управляют точным ходом биосинтеза белков в
клетках. Нуклеиновые кислоты - это биополимеры, макромолекулы которых
состоят из многократно повторяющихся звеньев - нуклеотидов. Поэтому их
называют также полинуклеотидами.
В состав нуклеотида - структурного звена нуклеиновых кислот - входят три
составные части:
1. азотистое основание - пиримидиновое или пуриновое
2. моносахарид - рибоза или 2-дезоксирибоза;
3. остаток фосфорной кислоты.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 16 из 133
Нуклеотид - фосфорный эфир нуклеозида. В состав нуклеозида входят два
компонента: моносахарид (рибоза или дезоксирибоза) и азотистое основание
Вопросы для самоконтроля:
1.
Напишите
проекционные
формулы
оксикарбонильной
формы
моносахаридов, входящих в состав нуклеиновых кислот: D-рибозы, 2-дезоксиD-рибозы.
2. Напишите формулы
дезоксирибонуклеозидов: 2-дезоксицитидина, 2дезокситимидина.
3. напишите схемы образования и формулы аденозина, 2-дезоксигуанозина.
Рекомендуемая литература:
1. Несмеянов А., Несмеянов Н. Начала органической химии. М., Химия, 1974
2. Нейлан О. Органическая химия. Высшая школа. 1990
3. Роберт Дж., Кассерио М. Основы органической химии. М., 1978
Лабораторные занятия
Лабораторное занятие 2 – Алканы
Цель занятия: Изучение свойств алканов
Ход занятия: Опыт 1. Бромирование углеводородов
В сухую пробирку помещают 1 мл исследуемого углеводорода (или смеси
углеводородов) и добавляют по каплям при легком встряхивании раствор
брома. Если желтая окраска не исчезает на холоду, то смесь слегка нагревают.
Устанавливают, сопровождается ли исчезновение окраски, обусловленной
присутствием свободного брома, образованием бромистого водорода — газа,
имеющего резкий запах, дымящего на воздухе (особенно при внесении в пробирку палочки, смоченной аммиаком) и окрашивающего влажную синюю
лакмусовую бумажку в красный цвет. Выделение бромистого водорода
хорошо заметно на темном фоне при встряхивании пробирки, если слегка
подуть над ее отверстием.
Опыт 2. Окисление углеводородов перманганатом калия (реакция Вагнера)
К 1 мл исследуемого вещества добавляют сначала равный объем раствора
соды и затем постепенно по каплям при сильном взбалтывании раствор
перманганата калия до прекращения изменения внешнего вида смеси.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 17 из 133
Опыт 3. Взаимодействие углеводородов с концентрированной серной кислотой
К 1 мл вещества (смеси углеводородов) добавляют 1 мл концентрированной
серной кислоты и сильно, но осторожно взбалтывают несколько минут,
охлаждая пробирку в воде. Отмечают различное отношение насыщенных и
ненасыщенных углеводородов к концентрированной серной кислоте.
Опыт 4. Взаимодействие углеводородов с концентрированной азотной
кислотой
К 1 мл исследуемого вещества добавляют 1 мл концентрированной азотной
кислоты и встряхивают смесь сначала осторожно, затем энергично в течение
нескольких минут. Отмечают различное отношение насыщенных и
ненасыщенных углеводородов к примененному реактиву.
Опыт 5. Образование и свойства метана
Небольшие количества метана и этилена удобно получать в пробирке со
вставленной на пробке (или на резиновом колечке) короткой газоотводной
трубкой. К последней присоединяют каучуковую трубочку длиной 10—12 см
со стеклянным наконечником. Такая гибкая конструкция для отвода газа
облегчает дальнейшую работу.
В сухую пробирку помещают несколько граммов тщательно растертой в
ступке смеси из 1 вес. ч. какого-либо безводного ацетата и 2 вес. ч. натронной
извести. Укрепляют пробирку горизонтально и, присоединив газоотводную
трубку, нагревают смесь в пробирке
пламенем
горелки
сначала
осторожно, затем сильно. Опуская газоотводную трубку в отдельные пробирки
с бромной водой и раствором перманганата калия, устанавливают, изменяется
ли окраска этих реактивов выделяющимися пузырьками газообразного
углеводорода происходит ли бромирование метана или его окисление. Не
прекращая нагревания, собирают метан в наполненную" водой пробирку,
опрокинутую в стакан или ванну с водой. Затем вынимают газоотводную
трубку из воды и прекращают нагревание. Закрыв пробирку пальцем, подносят
ее к пламени горелки и открывают. Метан спокойно сгорает голубоватым
пламенем. После этого можно поджечь метан и у конца газоотводной трубки.
При внесении в пламя горящего метана фарфоровой пластинки (чашки,
крышки от тигля) на ней не образуется черного пятна сажи.
Вопросы для самоконтроля:
1. Какие типы реакции характерны алканам и алкенам?
2. Как протекает реакции галогенирования алканов и алкенов?
3. Какие соединения образуются при окислении алканов и алкенов?
Лабораторное занятие 3 – Алкены
Цель занятия: Изучение образования и свойств алкенов
Ход занятия: Опыт 1. Бромирование углеводородов
В сухую пробирку помещают 1 мл исследуемого углеводорода (или смеси
углеводородов) и добавляют по каплям при легком встряхивании раствор
брома. Если желтая окраска не исчезает на холоду, то смесь слегка нагревают.
Устанавливают, сопровождается ли исчезновение окраски, обусловленной
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 18 из 133
присутствием свободного брома, образованием бромистого водорода — газа,
имеющего резкий запах, дымящего на воздухе (особенно при внесении в пробирку палочки, смоченной аммиаком) и окрашивающего влажную синюю
лакмусовую бумажку в красный цвет. Выделение бромистого водорода
хорошо заметно на темном фоне при встряхивании пробирки, если слегка
подуть над ее отверстием.
Опыт 2. Окисление углеводородов перманганатом калия (реакция Вагнера)
К 1 мл исследуемого вещества добавляют сначала равный объем раствора
соды и затем постепенно по каплям при сильном взбалтывании раствор
перманганата калия до прекращения изменения внешнего вида смеси.
Опыт 3. Взаимодействие углеводородов с концентрированной серной кислотой
К 1 мл вещества (смеси углеводородов) добавляют 1 мл концентрированной
серной кислоты и сильно, но осторожно взбалтывают несколько минут,
охлаждая пробирку в воде. Отмечают различное отношение насыщенных и
ненасыщенных углеводородов к концентрированной серной кислоте.
Опыт 4. Взаимодействие углеводородов с концентрированной азотной
кислотой
К 1 мл исследуемого вещества добавляют 1 мл концентрированной азотной
кислоты и встряхивают смесь сначала осторожно, затем энергично в течение
нескольких минут. Отмечают различное отношение насыщенных и
ненасыщенных углеводородов к примененному реактиву.
Опыт 5. Образование и свойства этилена
Этилен получают в таком же приборе, какой использовали и для получения
метана, но между выходящей из пробки газоотводной трубкой и резиновой
трубкой с наконечником вставляют еще короткую (5—6 см) стеклянную
трубочку с мелкими кусочками натронной извести, помещенной между двумя
неплотными ватными тампонами.
Помещают в пробирку 1 мл спирта и осторожно, при взбалтывании, приливают
4 мл концентрированной серной кислоты. В разогревшуюся смесь бросают
кипятильный камешек, присоединяют газоотводную трубку и начинают
медленно и осторожно нагревать пробирку до начала равномерного выделения
газа. Реакционная смесь при этом чернеет. Далее работу проводят, как описано
в предыдущем опыте. С выделяющимся газом проводят те же операции, что и с
метаном.
Непредельный характер этилена проявляется в быстроте его бромирования и
окисления, а также в несколько более ярком цвете пламени этилена по
сравнению с цветом пламени горящего метана. На внесенной в пламя этилена
фарфоровой пластинке появляется черное пятно сажи.
Вопросы для самоконтроля:
1. Какое соединение образуется при окислении алкенов раствором
перманганата калия?
2. Какое соединение образуется при окислении 2-метилбутена-2?
3. Как обнаруживается наличие непредельных соединений в растворе?
Лабораторное занятие 4 – Алкины
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 19 из 133
Цель занятия: Изучение образования и свойств алкинов
Ход занятия: Опыт 1. Образование и свойства ацетилена
Небольшие количества ацетилена удобно получать в пробирке, имеющей в дне
отверстие. Пробирку вертикально укрепляют за верхнюю часть в лапке
штатива. На дно сухой пробирки помещают немного стеклянной ваты, а на нее
3—4 кусочка карбида кальция, поверх которых также кладут стеклянную вату.
Пробирку закрывают пробкой с газоотводной трубкой и винтовым зажимом.
При закрытом зажиме подводят под пробирку стакан или банку с водой так,
чтобы уровень воды был значительно выше слоя карбида в пробирке. При
открывании зажима вода поступает в пробирку через нижнее отверстие, а
образующийся ацетилен выделяется через газоотводную трубку; при
закрывании зажима реакция в пробирке прекращается. Этим путем легко
регулировать выделение ацетилена.
С газообразным ацетиленом проводят опыты, описанные выше, т. е.
наблюдают его бромирование, окисление и горение. Непредельный характер
ацетилена проявляется в этих опытах еще более резко, чем у этилена.
Опыт 2. Образование металлических производных ацетилена
В пробирки помещают по 1—2 мл аммиачных растворов солей серебра и меди
и пропускают через эти растворы ток газообразного ацетилена. Выделяются
осадки — белый ацетиленид серебра и красный ацетиленид меди.
Ацетиленид меди отфильтровывают при отсасывании на воронке с вкладышем.
Промывают осадок несколькими каплями спирта, переносят влажный фильтр с
осадком на другой, больший листок фильтровальной бумаги и осторожно
подсушивают в чашке на водяной или песочной бане. Если внести щипцами сухой фильтр с ацетиленидом меди в пламя, то происходит громкий,
но безопасный взрыв.
Вопросы для самоконтроля:
1. Какой тип гибридизации характерен для ацетиленовых углеводородов?
2. напишите реакции горения ацетилена.
3. какое соединение образуется при пропускании ацетилена через раствор
перманганата калия? Напишите уравнение реакции.
Лабораторное занятие 5 – Ароматические углеводороды
Цель занятия: Получение и изучение свойств ароматических углеводородов
Ход занятия: Опыт 1. Получение бензола из бензойной кислоты
Тщательно растирают в ступке 5 г бензойной кислоты с 10 г натронной извести
и пересыпают смесь в пробирку, которую затем закрывают пробкой с длинной
отводной трубкой; нижний конец последней опускают в пробирку-приемник,
охлаждаемую водой со льдом.
Пробирку с сухой смесью нагревают пламенем горелки сначала осторожно,
затем сильно. Смесь слегка темнеет и оседает. Когда исчезнут белые участки на
поверхности смеси, нагревание прекращают.
Полученный отгон в приемнике разделяется на два слоя; верхний из них
(бензол) обычно кристаллизуется. Необходимо следить, чтобы эти кристаллы
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 20 из 133
не забили отверстие отводной трубки. Верхний слой отгона отделяют, сушат
кусочком хлорида кальция и перегоняют; он перегоняется полностью при 79—
80 °С. Выход 2—2,5 г.
Опыт 2. Влияние катализаторов на ход бромирования ароматических
углеводородов
Для амальгамирования алюминиевую проволоку или полоску, очищенную наждачной бумагой, погружают на 1 мин в насыщенный раствор хлорида ртути(II),
затем ополаскивают последовательно водой, спиртом и бензолом и сразу же
используют. Опыт проводят параллельно с бензолом и толуолом. В сухой
пробирке смешивают 2—3 мл исследуемого углеводорода с равным объемом
раствора брома и делят смесь на четыре части,
примерно одинаковые по
объему. К трем порциям добавляют катализаторы: в первую — несколько
кристалликов иода, во вторую — кусочек алюминия и в третью —
маленькую щепотку железных опилок. В четвертую порцию катализатор не
добавляют.
Опыт 3. Окисляемость ароматических углеводородов
Опыт проводят одновременно с бензолом и толуолом. Помещают в две
пробирки по 1 мл раствора перманганата калия и по 1 мл разбавленной серной
кислоты и затем добавляют в одну пробирку несколько капель (~0,5 мл)
бензола, а в другую — такое же количество толуола. Сильно встряхивают обе
пробирки в течение нескольких минут. Одна из смесей быстро изменяет
окраску, что прежде всего заметно на поверхностях раздела между каплями
углеводорода и водным слоем. Окраска другой смеси в этих условиях не
изменяется.
Опыт 4. Сульфирование ароматических углеводородов
В пробирки помещают по 0,5—1 мл (для нафталина 0,5—1 г) каждого из
углеводородов и добавляют по 4 мл концентрированной серной кислоты, затем
нагревают обе пробирки до 80 °С на водяной бане при частом и сильном
встряхивании. Нафталин сначала частично затвердевает на стенках пробирки
выше уровня жидкости, и его следует повторно расплавлять, осторожно прогревая эти места. Пробирку, содержащую бензол, нагревают более осторожно,
чтобы бензол не улетучился.
Углеводороды при встряхивании образуют с кислотой эмульсию (тем легче,
чем дольше идет процесс) и постепенно растворяются. Отмечают различие во
времени, которое потребовалось для полного растворения исследуемых
углеводородов при одинаковом режиме нагревания и встряхивания.
Когда растворение закончится, охлаждают все пробирки в стакане с водой,
затем выливают содержимое каждой пробирки в колбочку или стаканчик с 10—
15 мл холодной воды и отмечают, выделяется ли исходный углеводород или
продукт реакции.
Опыт 5. Взаимодействие ароматических углеводородов с концентрированной
азотной кислотой
Работу проводят параллельно с тремя веществами. В три пробирки помещают
по 2 мл концентрированной азотной кислоты, добавляют в них соответственно
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 21 из 133
по 5—7 капель одного из углеводородов и сильно встряхивают. Жидкости во
всех пробирках образуют нестойкую, быстро расслаивающуюся эмульсию.
Продолжая часто встряхивать, нагревают смеси почти до кипения. Отмечают
различие хода процесса в разных пробирках; эмульсии во всех случаях
постепенно становятся все более стойкими. После 5—10 мин нагревания со
встряхиванием охлаждают пробирки и приливают в каждую по 6—7 мл
холодной воды. Отмечают характерный запах продуктов реакции. В двух
пробирках выделяются продукты реакции в виде тяжелого окрашенного масла.
Вопросы для самопроверки:
1. Почему гомологи бензола легко вступают в реакции замещения?
2. Каково отношение бензола и его гомологов к окислению? Напишите
уравнения реакции.
3. Какой тип гидридизации характерен для атомов углерода в молекуле
бензола?
Лабораторное занятие 6 – Алифатические и ароматические
галогенопроизводные
Цель занятия: Получение и изучение свойств галогенопроизводных
Ход занятия: Опыт 1. Получение бромистого этила
Реакцию проводят в широкой пробирке с пробкой, снабженной отводной
трубкой. В пробирку вливают 3 мл спирта и затем добавляют при встряхивании 3 мл серной кислоты. Охладив сильно разогревшуюся смесь,
добавляют 2 мл воды, снова охлаждают и при легком встряхивании всыпают 3
г бромида калия. Затем присоединяют отводную трубку и укрепляют пробирку
наклонно в лапке штатива. Конец отводной трубки погружают в другую
пробирку — приемник, содержащую 1 мл воды с кусочком снега (льда) и
помешенную в стаканчик со смесью воды и снега. Осторожно нагревают до
кипения реакционную смесь пламенем горелки, прогревая сначала верхние
слои жидкости. Смесь кипит спокойно и равномерно. Перегонку ведут в
течение 10—12 мин и прекращают ее, когда исчезнут кристаллы бромистого
калия, а в приемник перестанут поступать тяжелые капли бромистого этила.
Сливают из приемника большую часть верхнего водного слоя. К остатку
добавляют чистой холодной воды и, плотно закрыв пробирку, взбалтывают ее,
после чего дают отстояться тяжелому нижнему слою бромистого этила. Выход
около 1 —1,5 мл. Полученный бромистый этил отбирают пипеткой и
непосредственно применяют для последующих опытов или переносят в чистую
сухую пробирку с отводной трубкой, высушивают кусочком хлорида кальция и
перегоняют (с термометром и прямо поставленным холодильником), охлаждая
приемник. Выход около 1,5 г, т. е. 50—60% от теоретического, считая на
бромид калия. При внесении капли бромистого этила на палочке в пламя горелки оно окрашивается по краям в зеленый цвет. Эта окраска пламени
характерна для алкилгалогенидов.
Опыт 2. Отщепление галогена под действием щелочи.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 22 из 133
Опыт
проводят
параллельно
с
несколькими
различными
галогенопроизводными. Около 0,5 мл каждого из исследуемых соединений
взбалтывают р. пробирке с 2—3 мл дистиллированной воды и после
отстаивания сливают большую часть водного слоя в другую пробирку.
Добавляя туда же несколько капель раствора азотнокислого серебра,
устанавливают, появились ли в воде галогенид-ионы. Если с АgNO3 образуется
осадок, то повторяют промывание галогенпроизводного новыми порциями
дистиллированной воды еще 1—2 раза, снова контролируя появление
галогенид-ионов. Затем добавляют в пробирку с галогенпроизводным и
остатками водного слоя 1—2 мл раствора щелочи и осторожно, при частом
взбалтывании, нагревают смесь до начала кипения. Во избежание чрезмерно
быстрого испарения галогенпроизводного нагревание ведут медленно и
сначала прогревают верхний слой жидкости. Дают смеси остыть и отстояться,
сливают часть водно-щелочного слоя, подкисляют его разбавленной азотной
кислотой и добавляют несколько капель раствора АgNO3 Различие
подвижности атомов галогена з исследуемых соединениях обнаруживается
весьма четко при сравнении количеств образующихся осадков галогенидов
серебра.
Опыт 3. Отщепление галогена действием нитрата серебра в спиртовом
растворе
Опыт
проводят
параллельно
с
несколькими
различными
галогенопроизводными, предварительно промытыми водой для удаления
возможных примесей. К 1-2 мл раствора нитрата серебра в сухой пробирке
добавляют 1 каплю исследуемого галогенопроизводного. Если в течение1-2
мин не выделяется осадок галогенида серебра, то раствор нагревают до
кипения, охлаждают и отмечают, выпадает ли осадок.
Опыт 4. Взаимодействие хлорофома и четыреххлористого углерода со
щелочью
Помещают в пробирку несколько капель хлороформа и 2—3 мл разбавленного
раствора щелочи, осторожно нагревают смесь 1 — 2 мин до начала кипения
хлороформа при частом взбалтывании, после чего охлаждают пробирку в воде.
Полученный щелочной раствор сливают с остатка хлороформа, если он
имеется, и делят на три части.
А. К одной порции гидролизата приливают разбавленную азотную кислоту до
кислой реакции и несколько капель раствора нитрата серебра.
Б. К I мл раствора нитрата серебра (в отдельной пробирке) добавляют
концентрированный водный аммиак по каплям до растворения первоначально
образующегося осадка окиси серебра. Полученный раствор приливают ко
второй порции гидролизата.
В. К третьей порции гидролизата добавляют несколько капель раствора
марганцовокислого калия. Во всех случаях отмечают, наблюдаются ли
изменения и какие именно.
Повторяют опыт, заменив хлороформ четыреххлористым углеродом.
Опыт 5. Получение йодоформа
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 23 из 133
В маленький стаканчик или колбочку помещают 1 г иода, 1 мл спирта и
встряхивают смесь, после чего добавляют 10 мл воды; при этом
расширившийся в спирте иод выпадает в осадок. Затем приливают по каплям
разбавленный раствор щелочи, взбалтывая смесь и слегка нагревая ее (до 60—
70 °С). Щелочь прибазляют до исчезновения кристаллов иода; этрт момент
наступает очень быстро. Одновременно из жидкости начинает выделяться
светло-желтый осадок йодоформа.
Оставляют теплую смесь отстаиваться в течение 5—10 мин, после чего
охлаждают ее, отсасывают осадок в воронке с вкладышем и высушивают
полученный йодоформ, отжимая его в фильтровальной бумаге. Выход почти
теоретический. Для очистки йодоформ перекристаллизовывают из ацетона или
спирта. Йодоформ имеет характерный запах; при нагревании выше
температуры плавления он легко разлагается с выделением свободного иода.
Опыт 6. Влияние катализаторов на ход бромирования ароматических
углеводородов
Для амальгамирования алюминиевую проволоку или полоску, очищенную наждачной бумагой, погружают на 1 мин в насыщенный раствор хлорида ртути (II),
затем ополаскивают последовательно водой, спиртом и бензолом и сразу же
используют. Опыт проводят параллельно с бензолом и толуолом. В сухой
пробирке смешивают 2—3 мл исследуемого углеводорода с равным объемом
раствора брома и делят смесь на четыре части,
примерно одинаковые по
объему. К трем порциям добавляют катализаторы: в первую — несколько
кристалликов иода, во вторую — кусочек алюминия и в третью —
маленькую щепотку железных опилок. В четвертую порцию катализатор не
добавляют.
Вопросы для самоконтроля:
1. Напишите структурные формулы следующих соединений: 2-хлор-3метилпентан, 3-хлор-2,2-диметилгексан, 3-хлорбутен-1
2. Напишите уравнение реакции получения 2-йод-2-метилпентана из
соответствующего этиленового углеводорода.
3. Напишите уравнения реакции получения 2-хлор-2-метилпропана из 1-хлор-2метилпропана.
Лабораторное занятие 7 – Спирты
Цель занятия: Изучение свойств спиртов
Ход занятия: Опыт 1. Обнаружение воды в спирте и обезвоживание спирта.
В фарфоровой чашке или тигле нагревают на пламени горелки ,1,5—2 г СиSO45Н20, перемешивая соль медной проволочкой, до полного исчезновения
голубой окраски соли и прекращения выделения паров воды. Дают остыть
полученному белому порошку, пересыпают его в сухую пробирку и добавляют
2—3 мл этилового спирта. При встряхивании и слабом нагревании
содержимого пробирки белый порошок быстро окрашивается в голубой цвет.
Полученный обезвоженный спирт осторожно сливают и используют для
следующего опыта.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 24 из 133
Опыт 2. Образование и гидролиз алкоголята.
Полученный в предыдущем опыте обезвоженный этиловый спирт осторожно
сливают с осадка в сухую пробирку и погружают в него кусочек чистого
(свежеотрезанного, очищенного от корочек и отжатого от керосина)
металлического натрия размером с горошину. Охлаждая пробирку в стакане с
водой, предотвращают разогревание смеси и выкипание спирта. Когда газ
станет выделяться спокойно, подносят пробирку отверстием к пламени
горелки. Выделяющийся водород образует с воздухом смесь, вспыхивающую с
характерным резким звуком. Жидкость постепенно густеет, натрий
покрывается слоем твердого алкоголята, и реакция замедляется настолько, что
для ее ускорения требуется слегка нагревать пробирку. Если выделение
водорода почти прекратится, а натрий полностью не растворится, подогревают
смесь до разжижения, удаляют из нее оставшийся кусочек натрия при помощи
изогнутой проволочки и помещают его в банку для остатков натрия.
Полученный концентрированный раствор алкоголята при охлаждении
закристаллизовывается. Добавляют в ту же пробирку 5—6 мл воды и
испытывают фенолфталеином реакцию полученного раствора.
Опыт 3. Окисление этилового спирта хромовой смесью
Смешивают в пробирке 2 мл раствора бихромата калия, 1 мл разбавленной
серной кислоты и 0,5 мл этилового спирта и осторожно нагревают смесь.
Течение реакции окисления обнаруживается по изменению окраски раствора, а
образование ацетальдегида — по его характерному запаху.
Опыт 4. Окисление этилового спирта перманганатом калия
В пробирку с заранее подогнанной пробкой с отводной трубкой помещают 0,5 г
перманганата калия, 3 мл воды и 0,5 мл этилового спирта. При слабом
нагревании начинается энергичная реакция, поэтому пробирку со смесью
охлаждают в стакане с водой. Затем снова осторожно нагревают смесь до
начала кипения и кипятят 1—2 мин, после чего добавляют 3 мл разбавленной
серной кислоты, вносят кипятильный камешек, присоединяют отводную трубку
и отгоняют около 0,5 мл жидкости в пробирку-приемник. Отмечают запах
отгона и реакцию его на лакмус.
Опыт 5. Образование йодоформа из спирта
Опыт проводят одновременно с этиловым и другими спиртами. Смешивают в
пробирке 3—4 капли исследуемого спирта и 2— 3 мл воды. Полученный
раствор слегка нагревают (лучше всего на водяной бане при 60 °С), добавляют
к нему 0,5—1 мл раствора иода и затем приливают разбавленный раствор
щелочи по каплям до исчезновения окраски. В случае образования йодоформа
выделяется светло-желтая муть или осадок и появляется характерный запах.
Опыт 6. Дегидратация глицерина.
При отсутствии бисульфата калия его получают непосредственно во время
опыта, смешивая в сухой пробирке перед добавлением глицерина 0,5—0,6 г
средней сернокислой соли калия (или натрия) и 5—6 капель
концентрированной серной кислоты. К нескольким каплям глицерина в сухой
пробирке добавляют около 1 г кислой сернокислой соли; встряхнув смесь,
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 25 из 133
осторожно нагревают ее и обнаруживают образование акролеина по появлению
характерного, очень едкого запаха.
Опыт 7. Комплексообразование многоатомных спиртов.
А. В пробирке получают гидроокись меди, для чего в разбавленный раствор
сульфата меди вводят раствор едкой щелочи в небольшом избытке.
Отфильтровав большую часть жидкости через маленький фильтр, вносят
стеклянной палочкой или лопаткой небольшие количества осадка с фильтра в
несколько пробирок. Затем в пробирки добавляют по 0,5—1 мл воды и по 3—5
капель жидкого спирта или ~0,1 г твердого спирта (маннит). Для сравнения в
одну из пробирок с гидроокисью меди и водой не добавляют спирт. Встряхнув
все пробирки, дают их содержимому отстояться и отмечают появление
характерной окраски жидкости в некоторых пробирках. Затем добавляют к
этим растворам избыток разбавленной соляной кислоты и наблюдают
изменение окраски.
Б. В пробирке встряхивают около 0,5—1 г кристаллической буры с 10—15 мл
воды. Дав осесть нерастворившейся буре (избыток), добавляют к полученному,
почти насыщенному раствору буры 1— 2 капли раствора фенолфталеина. В
нескольких пробирках готовят при встряхивании растворы испытуемых
спиртов (5—7 капель или 0,1—0,2 г их на 2—3 мл воды). В каждый из
приготовленных растворов спиртов добавляют по 1 капле раствора
фенолфталеина и по 1 капле разбавленного раствора щелочи. При этом
содержимое пробирок окрашивается в ярко-малиновый цвет. Затем в каждую
пробирку добавляют небольшой объем окрашенного раствора буры.
Исчезновение окраски жидкости в некоторых пробирках при смешении двух
щелочных растворов свидетельствует о том, что образуется жидкость с кислой
реакцией; для перевода ее в щелочную приходится добавить довольно много
раствора буры.
Опыт 8. Образование эфира борной кислоты
Нагревают в пробирке 1,5—2 г борной кислоты, при этом пробирку держат
горизонтально и прогревают время от времени ее стенки пламенем горелки для
удаления капель воды. Кислота постепенно обезвоживается и плавится. Когда
последние кристаллики исчезнут, дают пробирке остыть в горизонтальном
положении; густой прозрачный плав затвердевает, частично растрескиваясь.
Затем добавляют 4—5 мл спирта, 2 мл концентрированной серной кислоты и
вносят кипятильный камешек. Пробирку закрывают заранее подготовленной
пробкой с отводной трубкой, присоединяют холодильник и отгоняют 1—2 мл
жидкости в сухую пробирку. Часть отгона выливают на часовое стекло и
поджигают; отмечают характерную окраску пламени и выделение негорючих
продуктов, образующих белый налет на поднесенном холодном стекле. К
другой части отгона при встряхивании добавляют по каплям воду.
Вопросы для самоконтроля:
1. Напишите реакцию образования этилата натрия.
2. Напишите реакцию образования глицерата меди.
3. Какое соединение образуется при окислении этилового спирта?
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 26 из 133
Лабораторное занятие 8 – Фенолы
Цель занятия: получение и изучение свойств фенолов
Ход занятия: Опыт 1. Образование и разложение фенолятов
Опыты проводят одновременно с фенолом и нафтолом.
А. К 0,3—0,5 г исследуемого вещества добавляют 1 мл воды, а затем
разбавленный раствор щелочи до полного растворения. Из полученных
прозрачных растворов при подкислении разбавленной серной кислотой
выделяется в осадок исходное вещество.
Б. Помещают в две пробирки по 0,2—0,3 г фенола, добавляют при
встряхивании в одну из них 1—2 мл водного раствора карбоната натрия, а в
другую — такой же объем раствора бикарбоната натрия. Полное растворение
фенола в результате образования фенолятов наблюдается лишь в растворе
углекислой соли.
Опыт 2. Бромирование фенола в безводной среде
В сухую пробирку помещают несколько кристалликов фенола добавляют 0,5 мл
раствора брома. Наблюдается моментальное обесцвечивание раствора при
комнатной температуре и обильное выделение бромистого водорода.
Опыт 3. Действие брома на фенолы в водном растворе
Опыт проводят одновременно с растворами различных фенолов и нафтолов.
Растворы пирокатехника и пирогаллола изменяют окраску. Раствор
гидрохинона сначала краснеет, затем из него выделяется темно-зеленый
кристаллический осадок. Из растворов фенола и нафтолоф выделяются белые и
желтоватые осадки.
Б. К 1 мл водного раствора фенола С6Н5ОН добавляют по каплям бромную
воду. Образующаяся сначала муть при встряхивании исчезает; при дальнейшем
прибавлении бромной воды (3—4 мл) выделяется обильный белый осадок
трибромфенола с характерным запахом. Продолжают добавлять бромную воду
при встряхивании до превращения белого осадка в светло-желтый. Полученную
смесь нагревают до кипения и кипятят (в вытяжном шкафу) 1—2 мин для
удаления избытка свободного брома. Затем охлаждают реакционную смесь, при
этом осадок, растворившийся при нагревании, снова выделяется. К
охлажденной смеси добавляют несколько капель раствора иодида калия, 1 мл
бензола и сильно встряхивают. Осадок растворяется в бензоле, слой которого
окрашивается в фиолетовый цвет выделяющимся иодом.
Опыт 4. Реакция фенолов и нафтолов с хлоридом железа
А. Опыт проводят одновременно с растворами различных фенолов и нафтолов.
К 5—6 каплям каждого из исследуемых растворов добавляют 1 —1,5 мл воды и
затем несколько (3—5) капель раствора хлорида железа (III). Растворы фенола
и резорцина дают при этом интенсивное фиолетовое окрашивание, раствор
пирогаллола — буровато-красное. Раствор пирокатехина дает интенсивное
оливково-зеленое окрашивание, переходящее при сильном
разбавлении
водой в фиолетово-синее. Раствор гидрохинона
сначала
зеленеет, затем
буреет и при стоянии из него выпадают красивые темно-зеленые игольчатые
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 27 из 133
кристаллы хингидрона. Раствор нафтола при действии хлорида железа тоже
сначала слегка зеленеет, а
затем из него быстро выделяется белый
хлопьевидный осадок, при стоянии из его выпадают красивые темно-зеленые
игольчатые кристаллы хингидрона.
Б. Полученные в опыте А окрашенные растворы, содержащие фенол, резорцин
и пирогаллол, делят каждый на три части; к одной из них добавляют равный
объем спирта, к другой — несколько капель раствора щелочи. Эти реактивы
вызывают исчезновение первоначальной интенсивной окраски растворов.
В. Из смесей, содержащих гидрохинон и нафтолы (проба А), отливают немного
раствора, отслоившегося над осадком, и добавляют к нему несколько капель
раствора красной кровяной соли; образуется синий осадок (турнбулева синь).
Опыт 5. Окисляемость фенола и нафтола
К 0,5—1 мл водного раствора фенола или нафтола добавляют равный объем
раствора карбоната натрия и затем приливают по каплям при встряхивании
раствор перманганата калия. В обоих случаях обесцвечивание раствора и
выделение двуокиси марганца происходит при комнатной температуре весьма
быстро.
Опыт 6. Окисление пирогаллола кислородом воздуха
В пробирку или склянку емкостью 20—25 мл помещают 0,3— 0,4 г
пирогаллола и 2—3 мл концентрированного раствора щелочи. Сосуд плотно
закрывают пробкой с отводной трубкой, конец которой опускают до дна в
другую пробирку, содержащую 5 — 6 мл подкрашенной воды. При
встряхивании реакционного сосуда наблюдается всасывание воды из пробирки
в отводную трубку, так как первоначальный объем воздуха в приборе
уменьшается примерно на 20%. При этом смесь пирогаллола и щелочи чернеет.
Опыт 7. Сульфирование фенола и нафтола
В пробирку помещают 2 г исследуемого вещества и 3 мл концентрированной
серной кислоты. При встряхивании кристаллы исходного вещества
растворяются; однако при смешении нескольких капель этого раствора с 1 мл
воды в отдельной пробирке и фенол, и нафтол выделяются в виде мути.
Проведя эту пробу, нагревают основную часть реакционной смеси в кипящей
водяной бане 3—5 мин, после чего охлаждают содержимое пробирки и
осторожно выливают в другую пробирку с 10—12 мл холодной воды.
Образуется однородный раствор, и исходное вещество уже не выделяется.
Раствор смеси, содержавшей фенол, почти совершенно не имеет его
характерного запаха.
Вопросы для самоконтроля:
1. Почему фенол проявляет кислотные свойства?
2. Отношение фенола и одноатомного спирта к щелочам?
3. Ориентантом какого рода является –ОН группа?
Лабораторное занятие 9 – Альдегиды, кетоны
Цель занятия: получение и изучение свойств альдегидов и кетонов
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 28 из 133
Ход занятия: Опыт 1. Образование альдегидов из спиртов при отщеплении
водорода (дегидрировании)
Опыт желательно проводить параллельно с метиловым и этиловым спиртами. К
обычной пробирке подбирают корковую пробку. Затем полоску тонкой медной
сетки сворачивают в плотный цилиндр длиной 4—5 см, свободно входящий в
ту же пробирку, но заполняющий почти весь ее просвет. Помещают в сухую
пробирку 3 мл исследуемого спирта и 2 мл воды. Затем сильно, накаливают
свернутую сетку, держа ее тигельными щипцами в пламени горелки, при этом
медь чернеет. Быстро вкладывают горячую сетку в пробирку со спиртом и
тотчас же неплотно закрывают пробирку пробкой. Спирт бурно вскипает, появляется характерный запах альдегида, а медная сетка становится ярко-красной.
Когда бурное кипение спирта прекратится, вставляют пробку плотнее и
охлаждают пробирку в стакане с холодной водой. Затем вынимают пробку,
переливают жидкость в другую пробирку и добавляют к ней примерно равный
объем воды, которой предварительно ополаскивают свернутую сетку в первой
пробирке. Получают водно-спиртовой раствор формальдегида (из метило
вого спирта) или ацетальдегида (из этилового спирта), который
дает все характерные для альдегидов реакции.
Опыт 2. Восстановление альдегидами соединений двухвалентной меди
К 1 мл раствора исследуемого альдегида добавляют 0,5 мл разбавленного
раствора щелочи и затем по каплям раствор сульфата меди до образования
осадка. Полученную смесь нагревают до начала кипения, при этом осадок
изменяет свою окраску.
Опыт 3. Восстановление альдегидами соединений серебра
Предварительно готовят аммиачный раствор окиси серебра, добавляя к 4—5 мл
раствора нитрата серебра разбавленный водный аммиак по каплям до
растворения первоначально образующегося осадка. Раствор альдегида
наливают (по 1 мл) в две пробирки и добавляют в каждую пробирку по 1 мл
свежеприготовленного аммиачного раствора окиси серебра. В одну из
пробирок добавляют еще 2—3 капли разбавленного раствора щелочи.
Встряхнув пробирки, ставят их в штатив. Отмечают, в какой пробирке
изменение наблюдается раньше. Если серебро не выделяется, то нагревают
пробирки с жидкостью несколько минут на водяной бане до 50—60°С. Чтобы
получить осадок серебра в виде зеркального слоя на стенках пробирки, перед
проведением опыта следует тщательно вымыть пробирку горячим раствором
щелочи и затем ополоснуть дистиллированной водой.
Опыт 4. Образование и реакции акролеина
Дегидратацию глицерина проводят в пробирке с присоединенной отводной
трубкой, конец которой погружают почти до дна во вторую пробирку-приемник с 1—2 мл холодной воды, охлаждаемую в стакане с водой. Смесь
глицерина и бисульфата калия (или натрия) нагревают 2— 3 мин до
прекращения заметного образования белых паров, после чего разбирают
прибор, а реакционную пробирку оставляют в вытяжном шкафу и заполняют
ее щелочным раствором перманганата калия для уничтожения остатков
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 29 из 133
акролеина. Отгон в приемнике имеет резкий запах акролеина. Полученную
жидкость делят на несколько частей и проводят с ними реакции, характерные
для альдегидов и для непредельных соединений. В соответствии со строением
его молекулы акролеин быстро вступает в реакцию с бромом, окисляется
перманганатом калия в щелочном растворе и дает четкие реакции на
альдегиды.
Опыт 5 – Получение оксима ацетона
В широкую пробирку наливают 7 мл воды и растворяют в ней 2 г
солянокислого гидроксиламина и 1,5 г безводной соды, при этом выделяется
много двуокиси углерода. Полученный раствор хорошо охлаждают (лучше в
ледяной воде) и при встряхивании добавляют к нему 1,5 мл ацетона.
Наблюдается
разогревание смеси и снова обильное выделение пузырьков
двуокиси углерода; одновременно из раствора выпадают легкие белые
кристаллы оксима ацетона, имеющие слабый своеобразный запах. Смесь
охлаждают еще несколько минут, после чего отсасывают и отжимают
кристаллы в маленькой воронке с вкладышем, промывают их 2—3 каплями
холодного спирта и сушат между листами фильтровальной бумаги. Выход ~1.
Опыт 6. Образование бисульфитного соединения бензойного альдегида
В пробирку помещают 0,5 мл бензальдегида и 2 мл раствора бисульфита
натрия и сильно встряхивают. Запах бензальдегида быстро исчезает, и
выделяются кристаллы бисульфитного соединения. Если при дальнейшем
встряхивании количество осадка больше не увеличивается, приливают к смеси
6—8 мл воды и помещают пробирку в горячую водяную баню. Кристаллы
быстро исчезают, обнаруживается характерный запах бензальдегида, а в
растворе появляются маслянистые капли.
Вопросы для самоконтроля:
1. Реакция серебряного зеркала?
2. Напишите уравнение взаимодействия ацетона с бисульфитом натрия.
3. С помощью каких реактивов можно обнаружить альдегидную группу?
Лабораторное занятие 10 – Карбоновые кислоты
Цель занятия: Получение и изучение свойств карбоновых кислот
Ход занятия: Опыт 1. Растворимость в воде карбоновых кислот и их солей
Несколько капель или кристалликов (0,05—0,1 г) каждой из исследуемых
кислот взбалтывают с 1—2 мл воды в пробирке; если кислота не растворяется
при обычной температуре, смесь нагревают. Для всех параллельных проб
следует брать примерно одинаковые количества кислоты и воды. Охладив
нагретые смеси, отмечают, выделяются ли снова кристаллы кислоты,
растворившейся лишь при нагревании. Пробы, содержащие осадок
малорастворимой кислоты, взбалтывают, затем часть суспензии отливают в
другие пробирки и добавляют по 2—3 капли разбавленного раствора щелочи;
при встряхивании кристаллы кислоты растворяются.
Опыт 2. Вытеснение кислот из их солей другими кислотами
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 30 из 133
Для получения раствора янтарнокислого натрия (сукцината) смешивают 1 г
янтарной кислоты с 3 мл воды и добавляют маленькими каплями при
встряхивании концентрированный раствор едкого натра до растворения
кислоты. В отдельные пробирки помещают небольшие количества каждой из
солей уксусной, угольной и янтарной кислот и добавляют по нескольку капель
раствора исследуемой органической кислоты, а также, для сравнения,
разбавленной серной, кислоты. Вытеснение угольной кислоты обнаруживается
по выделению двуокиси углерода, уксусной кислоты — по запаху при
кипячении смеси, а янтарной кислоты — по образованию мути или осадка
(сразу или при стоянии в течение 5—10 мин).
Опыт 3. Получение муравьиной кислоты из щавелевой кислоты
В широкую пробирку с пробкой, в которую вставлена изогнутая стеклянная
трубка
(длина отогнутого конца 12—15 см), помещают 5 г щавелевой
кислоты и 5 мл глицерина. Закрепив пробирку наклонно в лапке штатива,
осторожно нагревают смесь; щавелевая кислота растворяется, затем начинается
обильное выделение газа. Когда в отводной трубке появятся первые капли
перегоняющейся жидкости, приостанавливают нагревание и вводят в пробирку
еще 2 г щавелевой кислоты. Слова присоединяют отводную трубку и
погружают ее конец (почти до дна) в пробирку-приемник с 1—2 мл воды,
охлаждаемую в стакане с водой. Продолжают нагревать смесь, следя, чтобы ее
не перебрасывало, и собирают в приемнике отгоняющуюся муравьиную
кислоту. Нагревание ведут до тех пор, пока смесь глицерина и щавелевой
кислоты не почернеет, после чего разбирают прибор.
Опыт 4. Образование и гидролиз ацетата железа
В пробирке растворяют 0,1—0,2 г ацетата натрия в 2—3 мл воды и добавляют
5—6 капель раствора хлорида железа (III) при встряхивании; жидкость,
оставаясь прозрачной, окрашивается в буровато-красный цвет. Затем раствор
нагревают до кипения и кипятят 1—2 мин, при этом выделяется краснокоричневый хлопьевидный осадок. Прекратив нагревание, лают жидкости
отстояться, после чего осторожно, не взмучивая осадка, отбирают пипеткой
немного прозрачного обесцветившегося раствора, переносят его в другую
пробирку и добавляют несколько капель раствора желтой кровяной соли —
реактива на ионы трехвалентного железа. Этот опыт можно проводить также и
с уксусной кислотой. В этом случае растворяют несколько капель кислоты в
2—3 мл воды, тщательно нейтрализуют раствором щелочи по лакмусу и затем
уже добавляют FеС13.
Опыт 5. Изомеризация олеиновой кислоты в элаидиновую
Около 1—2 г щавелевой кислоты нагревают в пробирке с газоотводной
трубкой, оттянутый конец которой опущен в другую пробирку, содержащую
1—2 мл известковой (или баритовой) воды. Когда начнется непрерывное
выделение пузырьков газа, образующего в известковой воде осадок, трубку
вынимают из жидкости и поджигают у ее отверстия выделяющийся газ.
Содержащаяся в нем окись углерода сгорает характерным голубым пламенем.
Опыт 6. Разложение лимонной кислоты концентрированной серной кислотой
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 31 из 133
В пробирку помещают 2 мл олеиновой кислоты и кусочек очи-_
щенной и смятой в комок медной проволоки (около 0,1—0,2 г)
и добавляют 1 мл концентрированной азотной кислоты. Закрывают пробирку
пробкой и осторожно встряхивают, чтобы выделяющиеся при взаимодействии
азотной
кислоты
с
медью
окислы
азота лучше поглощались олеиновой кислотой. Содержимое про
бирки разогревается; время от времени приоткрывают пробку,
чтобы не допустить возрастающей давления внутри пробирки. Через
несколько минут, когда вспенивание от выделения газов почти
прекратится, плотно закрывают пробирку и оставляют ее в штативе.
Примерно через 1 ч вспенившийся слой олеиновой кислоты над посиневшим
водно-кислотным слоем сильно загустевает или затвердевает и при
опрокидывании пробирки не выливается.
Опыт 6. Омыление жиров щелочью в водном растворе
Опыт проводится одновременно с различными жирами. В широкую пробирку
помещают 3 г. жира и 3мл. спирта и 3мл концентрированный раствор щелочи.
Перемешивают смесь встряхивая или при помощи палочки и нагревают
приборку в водяной бане до начало кипения. Смесь быстро становится
однородной и, через 3-5 мин омыления полностью заканчивается.
К
полученной густой жидкости добавляют горячий насыщенный раствор
поваренной соли. Жидкость мутнеет и выделяется слой мыла. Всплывающей на
поверхность раствор соли заполняет почти всю пробирку. Чтобы в слоенный
слой мыла поднялся до ее отверстие , дают смеси отстоятся в течении
несколько мин. в водяной бане, затем погружают пробирку почти до краев в
стакан с холодной водой на 5-10 мин. при этом слой мыла затвердевает.
Полученное мыло извлекают из пробирки палочкой или шпателем. В
оставшемся растворе обнаруживается присутствие глицерина.
Опыт 7. Выделение жирных кислот из мыла
В пробирке растворяют при нагревании около 1 г полученного высаливанием
мыла в 5-6 мл дистиллированной воды, добавляют 3-4 мл разбавленной серной
кислоты и пробирку помещают в кипящую водяную баню. Выделяющиеся
свободные жирные кислоты всплывают в виде жидкого слоя, а водный раствор
осветляется. Когда четкое разделение слоев достигнуто, вынимают пробирку,
доливают в нее столько воды, чтобы слой жирных кислот поднялся почти до
края пробирки, и ставят пробирку в стакан с холодной водой.
Опыт 8. Оценка степени непредельности жиров
Опыт проводится одновременно с несколькими различными жирами. Твердые
жиры предварительно нагревают. Каплю каждого из исследуемых жиров в 1 мл
четыреххлористого углерода, после чего добавляют при встряхивании раствор
брома из бюретки со стеклянным краном или градулированной пипетки до
прекращения исчезновении окраски. Встряхивают объем раствора брома
необходимые для достижения одинакового светло-оранжевого окрашивания
раствором различных жиров, и располагают исследуемые жиры в ряд
возрастающей степени не определенности.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 32 из 133
Опыт 9. Образование акролеина при разложении жира
В сухую пробирку помещают около 0,5 бисульфата и каплю жидкого жира.
Встряхивая пробирку и слегка нагревая смесь, перемешивают, затем нагревают
смесь на пламени горелки более сильно, держа пробирку горизонтально. При
этом смесь чернеет, выделяются пары воды и другие летучие продукты,
имеющие резкий, характерный запах акролеина.
Вопросы для самоконтроля:
1. Напишите реакции: а) образования амилового эфира уксусной кислоты, б)
взаимодействия олеиновой кислоты с бромом.
2. Напишите уравнение образования мыла.
3. Какие реакции характерны для непредельных карбоновых кислот?
Лабораторное занятие 11 – Оксикислоты
Цель занятия: Изучение свойств оксикислот
Ход занятия: Опыт 1. Разложение молочной кислоты концентрированной
серной кислотой
Смесь равных объемов (по 0,5—1 мл) молочной кислоты и концентрированной
серной кислоты осторожно нагревают в пробирке с газоотводной трубкой.
Выделяющуюся окись углерода собирают над водой в пробирки и поджигают
сначала в пробирках, затем у отверстия газоотводной трубки (ср. опыт 83).
Опыт 2. Окисление молочной кислоты в кислой среде
В пробирку с газоотводной трубкой помещают 0,5—1 мл молочной кислоты,
равный объем разбавленной серной кислоты и 1—2 мл раствора перманганата
калия. Закрепив пробирку наклонно в лапке штатива, погружают конец
газоотводной трубки в пробирку-приемник с 1—2 мл воды, охлаждаемую в
стакане с водой; конец трубки должен быть погружен в воду. Осторожно
нагревают быстро обесцвечивающуюся смесь почти до кипения.
Выделяющийся газ проходит через воду в приемник. Через несколько минут
прекращают нагревание и разбирают прибор.
Опыт 3. Образование кислой и средней калиевых солей винной кислоты
К 1 мл водного раствора винной кислоты добавляют каплю раствора
фенолфталеина и приливают из бюретки по каплям при постоянном
взбалтывании раствор едкого кали. Довольно быстро, еще при кислой реакции
смеси выпадает обильный кристаллический осадок. При дальнейшем введении
щелочи осадок постепенно растворяется и при достижении щелочной реакции
нацело исчезает. К части полученного раствора добавляют по каплям разбавленную серную кислоту; при этом скова появляются осадок или муть,
исчезающие при дальнейшем добавлении кислоты. Оставшийся слегка
щелочной раствор средней виннокислой соли используют для опыта
Опыт 4. Взаимодействие виннокислой соли с гидроокисью меди
Осаждают в пробирке голубую гидроокись меди, действуя на раствор медного
купороса небольшим избытком разбавленного раствора щелочи. Затем
добавляют раствор средней виннокислой соли. Гидроокись меди растворяется и
образуется темно-синяя прозрачная жидкость.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 33 из 133
Опыт 5. Разложение лимонной кислоты концентрированной кислотой
В пробирку с газоотводной трубкой помещают 1 г лимонной кислоты и
приливают 2: мл концентрированной серной кислоты. Пробирку закрепляют
наклонно в лапке штатива; готовят еще две пробирки: в одну из них (А)
наливают 2—3 мл прозрачной известковой (или баритовой) воды, в другую (Б)
—такое же количество раствора иода с добавлением нескольких капель раствора щелочи до почти полного обесцвечивания раствора иода. Осторожно
нагревают пламенем горелки смесь лимонной и серной кислот. Масса начинает
пениться; при приближении горелки к отверстию отводной трубки
выделяющиеся летучие продукты загораются голубым пламенем, характерным
для окиси углерода. Не прекращая нагревания, погружают газоотводную
трубку сначала в пробирку А, где образуются муть и осадок углекислой соли,
а затем в пробирку Б, и наблюдают образование йодоформа при комнатной
температуре.
Вопросы для самоконтроля:
1. Какое соединение образуется при разложении молочной кислоты серной
кислотой?
2. Какой вид изомерии характерен для оксикислот?
3. Каково отношение оксикислот к нагреванию?
Лабораторное занятие 12, 13 - Аминокислоты. Белки.
Цель занятия: Изучение свойств белков. Качественные реакции.
Ход занятия: Опыт 1. Осаждение белков реактивами на алкалоиды
Исследуемый раствор белка наливают в пробирки по 1 —1,5 мл. В одну
пробирку добавляют равный объем раствора пикриновой кислоты; выделяется
желтый осадок, а при малой концентрации белка раствор мутнеет. В другую
пробирку добавляют 1—2 капли концентрированной уксусной кислоты и 3—4
капли раствора таннина: образуется объемистый хлопьевидный осадок. В
третью пробирку добавляют 1—2 капли разбавленной соляной кислоты и
несколько капель раствора ртутноиодистого калия; выпадает осадок.
Опыт 2. Денатурация белков фенолов и формалином
А. К 1—2 мл раствора яичного белка или желатина добавляют по каплям
раствор фенола и отмечают наблюдаемые изменении.
Б. В пробирку наливают 1 —1,5 мл формалина и равный объем воды.
Встряхнув полученный раствор, помещают в него полоску сухого желатина так,
чтобы лишь нижняя ее половина была погружена в жидкость. Через 15—20 мин
сливают жидкость, а оставшуюся в пробирке полоску желатина заливают
(полностью) горячей водой. Отмечают различие характера набухания и
растворения верхней и нижней частей полоски.
Опыт 3. Биуретовая реакция белков
А. К 1—2 мл раствора белка добавляют равный объем концентрированного
раствора щелочи и затем каплю раствора сульфата меди. Жидкость
окрашивается в ярко-фиолетовый цвет, который заметен даже в окрашенной
водной вытяжке из мяса.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 34 из 133
Б. При малом содержании белка (растворы лейкозина или молочного
альбумина) и недостаточной яркости и отчетливости получаемой окраски
снова смешивают в другой пробирке растворы белка и щелочи, наклоняют
пробирку и осторожно приливают по ее стенке из пипетки 0,5—1 мл раствора
сульфата меди так, чтобы он образовал в пробирке верхний слой, не
смешиваясь с остальной жидкостью. В этом случае на границе слоев
появляется очень отчетливое фиолетовое прозрачное кольцо.
Опыт 4. Азотнортутная реакция белков
Для приготовления азотнортутного реактива растворяют при нагревании 2 г
(0,15 мл) металлической ртути в 3 мл концентрированной азотной кислоты,
полученный раствор разбавляют водой до объема 10 мл и через несколько
часов сливают с осадка (если он образовался). К 6,5—1 мл водного раствора
белка добавляют равный объем азотнортутного реактива и нагревают смесь (не
встряхивая ее) в кипящей воде. Выпавший первоначально белый хлопьевидный
осадок при нагревании собирается в комки и окрашивается в характерный
кирпично-красный цвет; иногда краснеет и раствор.
Опыт 5. Ксантопротеиновая реакция белков
К 1 мл раствора белка добавляют 0,2—0,3 мл концентрированной азотной
кислоты; появляется белый осадок или раствор мутнеет (ср. опыт 278). Затем
нагревают смесь на горелке до кипения и кипятят ее 1—2 мин; при этом
раствор и осадок окрашивается в ярко-желтый цвет. При кипячении осадок
может частично или полностью раствориться в результате гидролиза, но
характерная желтая окраска раствора сохраняется. Охладив смесь, осторожно,
по каплям, добавляют к кислой жидкости избыток (1— 2 мл)
концентрированного раствора щелочи. Выпадает осадок кислотного
альбумината, образующий с избытком щелочи ярко-оранжевый раствор.
Вопросы для самоконтроля:
1. Дайте определение аминокислотам
2. Почему аминокислоты являются амфотерными соединениями?
3. Качественные реакции белков
Лабораторное занятие 14 – Монозы
Цель занятия: Изучение свойств моносахаридов
Ход занятия: Опыт 1. Общая реакция на углеводы α-нафтолом
Опыт проводят одновременно с несколькими различными углеводами.
Помещают в пробирку 0,5—1 мл воды и вносят в нее очень немного
исследуемого углевода (например, несколько крупинок сахара или крахмала,
или же маленький кусочек фильтровальной бумаги размером 2—3 мм). Затем
добавляют 2 капли раствора α-нафтола; если применяют спиртовый его
раствор, то смесь становится слегка мутной вследствие выделения
малорастворимого в воде нафтола. После этого, наклонив пробирку, осторожно приливают по стенке (лучше из пипетки) 1—1,5 мл концентрированной
серной кислоты; тяжелый слой кислоты должен опуститься на дно пробирки,
почти не смешиваясь с водным слоем. На границе слоев быстро образуется
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 35 из 133
красно-фиолетовое кольцо; при взбалтывании смесь разогревается и
окрашивается по всему объему, а при разбавлении ее водой выделяются окрашенные хлопья. В отсутствие углеводов фиолетового кольца не образуется,
хотя жидкость может позеленеть или пожелтеть.
Опыт 2. Образование озазона глюкозы
Перед опытом смешивают 2 вес. ч. солянокислого фенилгидразина с 3 вес. ч.
ацетата натрия и хорошо растирают в ступке. Растворяют около 0,2 г глюкозы в
4 мл дистиллированной воды, добавляют около 1 г приготовленной смеси
солей и нагревают 5—10 мин на кипящей водяной бане при частом встряхивании. Когда появятся желтые кристаллы озазона, ставят пробирку в штатив и
дают ей медленно остыть. Постепенно образуются красивые желтые иглы
озазона глюкозы.
Опыт 3. Взаимодействие сахаров с солями двухвалентной меди в щелочном
растворе
Опыт проводят одновременно с несколькими различными сахарами, растворяя
0,05—0,1 г каждого из них в 2—3 мл воды. К 2—3 мл раствора сахара
добавляют 1 мл разбавленного раствора щелочи и 2—3 капли раствора
сульфата меди. Выделяющийся осадок гидроокиси меди при встряхивании
растворяется, и жидкость окрашивается в интенсивно синий цвет. Затем
осторожно нагревают в пламени горелки верхнюю часть жидкости до начала
кипения. Если сахар окисляется, то синяя окраска раствора при нагревании
переходит в зеленую и затем исчезает. Одновременно появляется желтый,
красный или коричневый осадок.
Вопросы для самоконтроля:
1. Почему углеводы проявляют свойства характерные для альдегидов?
2. Что такое явление мутаротации?
3. Напишите уравнение образования озазона глюкозы.
Лабораторное занятие 15 – Диозы. Полиозы.
Цель занятия: Изучение свойств ди- и полисахаридов
Ход занятия: Опыт 1. Взаимодействие сахаров с медновиннокислым
комплексом (фелинговым раствором)
Опыт проводят одновременно с растворами различных Сахаров. Точно
отмеривают и смешивают равные объемы растворов А и Б и наливают в
пробирки по 2 мл полученной темно-синей жидкости. Число пробирок
соответствует числу исследуемых растворов Сахаров. Нагревают жидкость в
каждой пробирке до начала кипения и добавляют к ней по каплям (при
продолжающемся кипячении) 0,5—1,5 мл исследуемого раствора сахара до
полного исчезновения синей окраски смеси и выделения красного осадка окиси
одновалентной меди. Приливая раствор сахара из градуированной пипетки или
бюретки, можно во многих случаях оценить его концентрацию.
Опыт 2. Взаимодействие сахаров с аммиачным раствором окиси серебра
В тщательно вымытой горячим раствором щелочи и ополоснутой водой
пробирке смешивают 1 мл аммиачного раствора окиси серебра и 1 мл раствора
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 36 из 133
сахара и пробирку помещают на несколько минут в горячую (60—80 °С) воду.
Если пробирка была чистой, то выделяющееся при окислении сахара
металлическое серебро осаждается на стенках в виде зеркального слоя; в ином
случае выпадает черный осадок.
Опыт 3. Реакция Селиванова на кетозы
Опыт проводят одновременно с растворами различных сахаров. В пробирки
помещают по 0,5—1 мл каждого из исследуемых растворов сахаров и
добавляют 2 мл реактива Селиванова, после чего погружают все пробирки на 2
мин в кипящую водяную баню. Растворы некоторых сахаров быстро
окрашиваются в ярко-красный цвет. При последующем нагревании их на
пламени горелки до начала кипения красные растворы мутнеют и выделяют
окрашенный осадок. Растворы других сахаров в этих условиях лишь
слегка желтеют или розовеют.
Вопросы для самоконтроля:
1. Напишите уравнение гидролиза сахарозы.
2. Какое соединение образуется при взаимодействии сахаров с фелинговым
раствором?
3. Объясните, почему при нагревании с соляной кислотой кетоз образуется
ярко-красное окрашивание раствора?
Тестовые вопросы:
1. Какой тип реакции характерен для алканов?
А. замещения
Б. Обмена
В. присоединения
Г. Расщепления
2. Какая геометрическая форма присуща молекулам предельных
углеводородов?
А. Тетраэдра
Б. Линейная
В. Объемная
Г. Пространственная
3. Какой тип гибридизации характерен для алканов?
А. sp
Б. sp2
В. sp3
Г. s-s и p-p
4. Какие реакции характерны для метана:
А. Горения
Б. Изомеризации
В. Каталитического окисления
Г. Гидрирования
5. Какие из приведенных соединений относятся к насыщенным углеводородам?
А. С4Н4
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 37 из 133
Б. С3Н8
В. С10Н22
Г. С12Н24
6. отличие бутен -1 от бутен-2:
А. По количеству атомов углерода
Б. По разветвлению углевоводоной цепи
В. По расположению двойной связи
Г. По относительной молекулярной массе
7. Какой тип реакции характерен для алкенов?
А. замещения
Б. расщепления
В. Обмена
Г. присоединения
8. С помщью какой реакции можно получить из этилена уксусный альдегид?
А. Гидратации
Б. Окисления
В. Гидрирования
Г. Нитрования
9. Какой углеводород является алкеном?
А. С4Н10
Б. С6Н6
В. С2Н2
Г. С4Н8
10. Какое соединение получится при взаимодействии бутадиена-1,3 с бромом?
А. 1,4-дибромбутен-2
Б. 1,2-дибромбутан
В. 2-бромбутан
Г. 1,4-дибромбутан
11. Общая формула ацетиленовых углеводородов:
А. CnH2n
Б. CnH2n+2
В. CnH2n-2
Г. CnH2n-6
12. Тип реакции, характерный для ацетилена:
А. Расщепления
Б. Присоединения
В. Замещения
Г. Обмена
13. С помощью какой реактива можно отличить этилен от ацетилена?
А. Бромной воды
Ә. Раствора перманганата калия
Б. галогеноводорода
В. Амиачным раствором оксида серебра
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 38 из 133
14. Какое соединение образуется при пропускании ацетилена через амиачный
раствор оксида серебра?
А. Ацителенид серебра
Б. Метан
В. Этан
Г. Реакция не протекает
15. Какое соединение образуется при окислении бутина-1?
А. Метановая кислота
Б. Пропановая кислота
В. Этановая кислота
Г. Бутановая кислота
16. Какое соединение образуется в присутствии алюминия при взаимодействии
бензола и этилхлорида?
А. Хлорбензол
Б. Этилбензол
В. Дихлорбензол
Г. Метилбензол
17. Общая формула ароматических углеводородов?
А. CnH2n
Б. CnH2n+2
В. CnH2n-2
Г. CnH2n-6
18. Как можно различить бензол, толуол и пентен?
А. С помощью бромной воды
Б. С помощью нитрующей смеси
В. С помощью раствора перманганата калия
Г. С помощью водорода
19. Какие признаки характерны для бензола и его гомологов?
А. Тетраэдрическая форма молекулы, sp3-гибридизация
Б. Линейная форма молекулы, sp2-гибридизация
В. Шестичленный углеводородный цикл, ароматиность
Г. Пространственная форма макромолекулы, sp2- гибридизация
20. Какое соединение образуется при взаимодействии метилбензола с азотной
кислотой?
А. м-нитротолуол
Б. м-динитротолуол
В. о-аминобензол
Г. п-нитротолуол
21. Какое соединение образуется при взаимодействии бутана с хлором?
А. 2-хлорбутан
Б. 2-хлорбутен-1
В. 3-хлорбутен-1
Г. Хлорбензол
22. Как можно получить пропен из бромпропана?
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 39 из 133
А. Добавлением щелочи
Б. Нагреванием
В. Добавлением брома
Г. Добавлением бромоводорода
23. Какое соединение образуется при взаимодействии бутен-1 с
хлороводородом?
А. 3-хлорбутан
Б. 1-хлорбутан
В. 2-хлорбутен-1
Г. 2-хлорбутан
24. Какое соединение образуется при взаимодействии этана с хлором?
А. Этилен
Б. Этанол
В. Хлорэтан
Г. Хлорэтен
25. При взаимодействии этилового спирта с бромоводородом образовалось 30 г
бромистого этила. Сколько грамм спирта вступило в реакцию?
А. 24,2 г
Б. 12,7 г
В. 48,3 г
Г. 30 г
26. Общая формула одноатомных спиртов
А. CnH2n-1
Б. CnH2n-1OH
В. CnH2nO
Г. CnH2n-2
27. Как можно получить из этилена этанол?
А. Гидрированием
Б. Нитрованием
В. Гидратацией
Г. Галогенированием
28. Какое соединение образуется при дегидрировании пропанола-1?
А. Пропан
Б. Пропен
В. Пропаналь
Г. Пропанон
29. Сколько гидроксильных групп имеется в молекуле глицерина?
А. 1
Б. 2
В. 3
Г. 4
30. Свойства каких соединений проявляет фенол?
А. Спиртов
Б. Альдегидов
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 40 из 133
В. Кетонов
Г. Алкенов
31. С помощью какого реактива можно обнаружить альдегидную группу?
А. Йодной воды и щелочного раствора
Б. Раствора бромной воды
В. Аммиачного раствора оксида серебра
Г. Раствора хлорного железа (ІІІ)
32. Какое соединение образуется при взаимодействии уксусного альдегида с
водородом?
А. Этаналь
Б. Пропанон -2
В. Этанол
Г. Пропанол – 2
33. Какой атом углерода альдегидной цепочки в первую очередь обменивается
на водород?
А. бетта
Б. Альфа
В. дельта
Г. Гамма
34. С помощью какой реакции можно получить из этилена уксусный альдегид?
А. Гидратации
Б. Окисления
В. Сульфирования
Г. Гидрирования
35. К какому типу реакции относится реакция взаимодействия формальдегида с
аммиачным раствором оксида серебра?
А. Замещения
Б. Конденсации
В. Гидратации
Г. Окисления
36. Как классифицируются карбоновые кислоты?
А. Одноосновные, многоосновные
Б. Насыщенные, ненасыщенные, ароматические, одно- и многоосновные
В. Высшие и низшие предельные кислоты
Г. Водорастворимые, водонерастворимые
37. Каким образом можно различить уксусную, акриловую и стеариновую
кислоты?
А. По запаху и агрегатному состоянию
Б. С помощью лакмуса
В. С помощью раствора щелочи
Г. С помощью йодной воды
38. Напишите структурные формулы следующих кислот
А. 3,3-диметилбутановая кислота
Б. 2,4-диметилпентановая кислота
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 41 из 133
В. Изомасляная кислота
Г. 2-метил-3-этилпентановая кислота
39. Какая реакция лежит в основе получения сложных эфиров?
А. Гидратации
Б. Этерификации
В. Дегидрирования
Г. Гидрирования
40. С каким веществом взаимодействует стераиновая кислота для полуения
мыла?
А. Аммиаком
Б. Водородом
В. Гидроксидом натрия
Г. Спиртом
41. Каким методом можно различить аминоуксусную кислоту от уксусной?
А. Раствором лакмуса
Б. Реакцией нейтрализации
В. Реакцией этерификации
Г. Взаимодействием с соляной кислотой
42. С помощью какого реактива можно обнаружить растворы глицерина и
белков?
А. Раствора лакмуса
Б. Раствора азотной кислоты
В. Раствора гидроксида меди (ІІ)
Г. Известковой воды
43. Какие свойства обнаруживает аланин?
А. Основные
Б. Окислительные
В. Восстановительные
Г. Амфотерные
44. Какое соединение образуется при взаимодействии глицина с валином?
А. Соль
Б. Аминокислота
В. Дипептид
Г. Кислота
45. Какие функциональные группы участвуют в образовании пептидной связи?
А. Кислотные
Б. Амино и карбоксильная
В. Две аминогруппы
Г. Карбонильная и гидроксильная
46. Общая формула углеводов:
А. CnH2n
Б. CnH2n+2
В. CmH2nOn
Г. CmHnOn
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 42 из 133
47. Какие из указанных веществ дают реакцию серебряного зеркала?
А. Глюкоза, глицерин, этиленгликоль
Б. Глицерин, глюкоза, сахароза
В. Глюкоза, формальдегид, метановая кислота
Г. Глюкоза, молочная кислота, фруктоза
48. Какие из указанных веществ являются друг другу изомерами?
А. Глюкоза и мальтоза
Б. Глюкоза и фруктоза
В. Крахмал и целлюлоза
Г. Мальтоза и сахароза
49. Какие из указанных веществ относятся к кетозам?
А. Глюкоза
Б. Фруктоза
В. Галактоза
Г. Манноза
50. Какие соединения относятся к полисахаридам?
А. Крахмал, глюкоза, мальтоза
Б. Глюкоза, фруктоза, лактоза
В. Крахмал, гликоген, клетчатка
Г. Сахароза, клетчатка, мальтоза.
Учебно-методические материалы по неорганической химии
Глоссарий
Аллотропия – это свойство атомов одного вида образовывать несколько простых веществ,
различных по строению и свойствам.
Атомная орбиталь – это часть пространства, окружающего атомное ядро, в котором
вероятность нахождения данного электрона максимальная (90%).
Амфотерность – это способность вещества проявлять кислотные и основные свойства.
Анод – это электрод, на котором протекает окисление.
Валентность – это способность атомов элементов образовывать химические связи с атомами
других элементов.
Волновая функция – это амплитуда трехмерной электронной волны или амплитуда
вероятности присутствия данного электрона в данной области пространства.
Водородный показатель (рН) – величина, характеризующая концентрацию ионов водорода
в водном растворе, численно равна отрицательному десятичному логарифму активности
водородных ионов в растворе.
Восстановитель – это частицы (атомы, молекулы, ионы), отдающие электроны.
Гальванические элементы – это химические источники тока, представляющие устройства
из двух электродов в которых энергия самопроизвольно протекающей ОВР преобразуется в
электрическую энергию.
Гомогенная система – это реакции при котором исходные реагенты и продукты реакции
находятся в одной фазе.
Гидролиз – это процесс разложения соединения водой.
Диполь – это молекула, в которой не совпадают центры положительного и отрицательного
зарядов.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 43 из 133
Изотопы – это разновидности атомов одного и того же элемента, отличающие друг от друга
массой ядра; ядра таких элементов содержат одинаковое число протонов, но разное число
нейтронов.
Катализатор – это вещество, которые, участвуя в химическом процессе, остаются
неизменными по химическому составу и количеству.
Катод – это электрод, на котором протекает восстановление.
Коррозия – это самопроизвольный процесс разрушения металлов и сплавов под действием
окружающей среды.
Лиганды – это частицы, которые координируются вокруг ионов комплексообразователя,
ими могут быть электронейтральные молекулы или заряженные ионы.
Моль – это количество вещества, которое независимо от агрегатного состояния, содержит
столько же структурных единиц, сколько их содержится в 12г углерода С12 .
Сродство к электрону – это энергия, которая выделяется при присоединении к атому
одного электрона, является мерой неметалличности элемента.
Эквивалент вещества – это количество вещества, которое соединяется с одним молем
атомов водорода или замещает это количество атомов водорода в химических реакциях;
масса одного эквивалента вещества называется эквивалентной массой.
Электролиты – это вещества, растворы и расплавы, которых проводят электрический ток.
Электролиз – это ОВР, протекающие на электродах, при прохождении постоянного
электрического тока через раствор или расплав электролита.
Энтальпия – характеризует тепловой эффект реакции в изобарном процессе.
Энтропия – количественная мера беспорядка состояния системы.
1 Лекции
Модуль 1. Основные законы.
Введение. Основные понятия и законы химии
1. Введение. Атомно - молекулярное учение
2. Основные стехиометрические законы химии
3. Законы газового состояния.
Введение. Атомно-молекулярное учение.
Химия является одной из естественных наук.
Весь окружающий нас мир представляет собой движущуюся материю в ее бесконечно
разнообразных формах и проявлениях.
Две такие формы проявления материи – это вещества и поля.
Вещество – это вид материи, состоящей из дискретных частиц, имеющих массу покоя.
Например, молекул, атомов, электронов, атомных ядер. Поле – это такая форма
существования материи, которая характеризуется, прежде всего, энергией. Посредством поля
осуществляется связь и взаимодействие между частицами вещества.
Химия изучает качественный и количественный состав вещества. Качественный
состав показывает из каких химических элементов состоит данное вещество,
количественный состав указывает в каких количественных соотношениях находятся
составляющие его элементы.
Задачей химии является изучение строение вещества, т.е. выяснение, из каких частиц
состоит данное вещество, с помощью каких сил связаны между собой эти частицы и как они
расположены в пространстве.
Химия изучает также физические и химические свойства веществ. Физические
свойства: внешний вид вещества, его температуры плавления и кипения, способность
проводить тепло и электрический ток, агрегатное состояние (твердое, жидкое, газообразное).
Химические свойства вещества характеризуют его способность превращаться в другие
вещества. Такие превращения называются химическими реакциями.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 44 из 133
Важной задачей химии является разработка методов получения веществ, обладающих
необходимыми свойствами, т.е. методов синтеза химических веществ.
Таким образом, химия изучает состав, строение, свойства и превращения веществ.
Также она занимается разработкой методов их получения и очистки.
В настоящее время известно около 10 млн. различных природных и искусственно
полученных веществ.
В истории химии можно выделить несколько периодов.
Первый период. Зарождение и развитие химического искусства (с древнейших времен
до середины XVII века).
Второй период. Становление химии как науки (со второй половины XVII в. до конца
XVIII в.).
Третий период. Развитие химической науки на основе кислородной теории и атомномолекулярного учения (с конца XVIII в. до 60-х гг. XIX в.)
Четвертый период. Превращение химии в современную науку (с 60-х годов XIX в.).
В конце XIX в. внимание химиков все больше привлекается к исследованию
химических реакций и законов, которым они подчиняются. Развивается физическая химия,
основы которой были заложены М.В. Ломоносовым. Появилась химическая теория
растворов Д.И. Менделеева, были исследованы свойства разбавленных растворов, была
создана теория электролитической диссоциации, развивались стереохимия и термодинамика,
учение о скорости химических реакций и катализе.
Как одна из отраслей естествознания химия тесно связана с другими науками
(биохимия, геохимия, физическая химия, космохимия, электрохимия и др.)
В настоящее время не существует ни одной отрасли техники и технологии, где не
используются химические вещества и не осуществляются химические процессы.
Применение законов химии позволяет совершенствовать существующие и создавать новые
процессы, технологии и материалы.
Вот несколько актуальных направлений применения химии:
1) новые источники энергии (получение ракетного топлива, ядерного горючего,
создание устройств для преобразования солнечной энергии в электрическую, разработка
новых химических источников электрического тока);
2) новые материалы (производство синтетических материалов; создание новых
оптико-волокнистых материалов; разработка микроэлектроники и молекулярной
электроники, основанных на физико-химических процессах);
3) проблемы сельскохозяйственного производства (повышение урожайности
сельскохозяйственных культур за счет развития производства минеральных удобрений,
разработки средств борьбы с болезнями растений и их вредителями; увеличение
продовольственных ресурсов и сырья для легкой промышленности за счет производства
синтетических тканей, красителей, заменителей жиров и т.д.);
4) охрана окружающей среды (разработка методов обнаружения и количественного
определения вредных примесей; создание безотходных или малоотходных производств;
разработка способов обезвреживания и утилизации промышленных и бытовых отходов).
Атомно - молекулярное учение
Атомы – мельчайшие химические частицы, являющиеся пределом химического
разложения любого вещества.
Химический элемент представляет собой вид атомов с одинаковым положительным
зарядом ядра.
Другими словами, атом – это наименьшая частица химического элемента,
сохраняющая все его химические свойства.
В настоящее время известно 117 химических элементов, из которых 92 встречаются в
природе.
Абсолютное большинство различных веществ состоит из молекул.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 45 из 133
Молекула – наименьшая частица вещества, способная существовать самостоятельно и
сохраняющая его основные химические свойства.
Массы атомов химических элементов чрезвычайно малы: ~ 10-27 – 10-25 кг. В химии
пользуются относительными значениями масс атомов (Ar, где r – «относительный», от англ.
relative).
Относительная атомная масса – это масса атома, выраженная в атомных единицах
массы. За атомную единицу массы принята 1/12 часть массы атома нуклида
12
6
С:
1
1,993 10 26 кг
mа (С )
1,661 10 27 кг .
1 а.е.м. =
12
12
Относительная атомная масса – величина безразмерная.
Соответственно, относительная молекулярная масса Mr вещества – это масса его
молекулы, выраженная в а.е.м.
Единицей измерения количества вещества (n) является моль.
Моль – количество вещества, содержащее столько структурных элементарных единиц
(атомов, молекул, ионов, электронов и т.д.), сколько содержится атомов в 0,012 кг изотопа
углерода 12С.
Число атомов NA в 0,012 кг углерода, или в 1 моль, легко определить следующим
образом:
NA
0,012 кг / моль
6,02 10 23 моль 1 .
26
1,993 10 кг
Величина NAназываетсяпостоянной Авогадро.
Вещество – это конкретный вид материи, обладающий определенными физическими
и химическими свойствами, состав которого может быть выражен химической формулой.
Химической реакцией называется процесс превращения одних веществ в другие.
Способность вещества участвовать в тех или иных химических реакциях
характеризует его химические свойства.
Простое вещество состоит из атомов одного и того же химического элемента.
Химические соединения состоят из атомов нескольких элементов.
2 Основные стехиометрические законы химии
Стехиометрия – раздел химии, рассматривающий количественные соотношения
между реагирующими веществами.
Закон сохранения массы: масса веществ, вступающих в химическую реакцию, равна
массе веществ, образующихся в результате реакции.
Закон постоянства состава: всякое чистое вещество, независимо от способа его
получения, имеет постоянный качественный и количественный состав.
Закон применим только к соединениям с молекулярной структурой.
Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы
продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Например, в условной реакции
А + 2В = 3С + Д
mА : mВ : mС : mД = ЭА : ЭВ : ЭС : ЭД,
где m – масса веществ, а Э – молярная масса эквивалентов.
Другими словами можно сказать, что вещества реагируют и образуются в
эквивалентных количествах. Один эквивалент одного вещества всегда взаимодействует с
одним эквивалентом другого.
Эквивалент – реальная или условная частица, которая может присоединять,
высвобождать или быть каким–либо другим образом эквивалентна одному иону водорода в
кислотно–основных реакциях или одному электрону в окислительно–восстановительных
реакциях.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 46 из 133
При использовании понятия «эквивалент» всегда необходимо указывать, к какой ионной
реакции оно относится.
H 3 PO4 3NaOH Na3 PO4 3H 2O
M
ЭH 3 PO4
;
3
H 3 PO4 2 NaOH Na2 HPO4 2 H 2 O
ЭH 3 PO4
M
;
2
H 3 PO4 NaOH NaH 2 PO4 2 H 2O
ЭH 3 PO4 M .
.3 Законы газового состояния
Закон объемных отношений (Гей–Люссака): при неизменных температуре и давлении
объемы вступающих в реакцию газов относятся друг к другу, а также к объемам
образующихся газообразных продуктов как небольшие целые числа.
Закон Авогадро: в равных объемах любых газов при одинаковых условиях (Т, р)
содержится равное количество молекул.
Следствия из закона Авогадро:
1.При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
2.При н.у. 1 моль различных газов занимает объем 22,4 л (молярный объем газа,
л/моль).
3.Отношение масс равных объемов различных газов равно отношению их
молекулярных масс:
m1 M r1
,
m2 M r2
где m1 и m2 – массы, а M r1 и M r2 – молекулярные массы первого и второго газов.
m1
Д - относительная плотность первого газа по второму.
m2
Тогда Д M r
1
M r2
М r1 M r2 Д .
Объединенный газовый закон:
pV p 0V0
,
T
T0
р0 = 101325 Па, Т0 = 0 ºС (273,15 К),
где р0, V0, Т0 – соответственно давление, объем, температура при н.у.; р, V, Т – те же
параметры данного количества газообразного вещества при других условиях.
Для 1 моль любого газа при н.у.:
РV
R - универсальная газовая постоянная.
T
R = 8,314 Дж/(мольК)
Для 1 моля газа тогда имеем:
pV RT .
Это уравнение состояния идеального газа.
Если количество газа другое, то получим уравнение Менделеева – Клапейрона:
m
pV
RT nRT (n – число молей данного вещества).
M
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 47 из 133
Закон парциальных давлений: общее давление смеси газов, химически не
взаимодействующих друг с другом, равно сумме парциальных давлений газов,
составляющих смесь:
p p1 p2 ...,
где р – общее давление; р1, р2 … - парциальные давления газов 1, 2 …
Парциальное давление газа в смеси – давление, которое производило бы это же
количество данного газа, если бы он один занимал при этой же температуре весь объем,
занимаемый смесью.
Основные понятия, которые необходимо знать после изучения материала данной
лекции: вещество, моль, эквивалент, эквивалентная масса, закон эквивалентов, закон
Авогадро, парциальное давление, закон парциальных давлений.
1.
2.
3.
4.
5.
Вопросы для самоконтроля
Что называется молекулярной массой вещества? В каких единицах он выражается?
Каково соотношение между атомной единицей массы и граммом?
Что называется молем? Какое количество молекул вещества содержится в одном моле?
Сформулируйте закон эквивалента.
Что называется относительной плотностью газа?
Рекомендуемая литература: 1. Кулажанов К.С., Сулейменова М.Ш.Неорганическая
химия,2012 с.17-26;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с.7-23;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Модуль 2. Строение атома.
Лекция №2. Строение атома и систематика химических элементов.
1.Модели строения атома: модели Томсона, Резерфорда, Бора.
2.Квантово-механическая модель строения атомов: атомные орбитали, квантовые
числа, принцип Паули, правила Хунда и Клечковского.
3.Строение атомных ядер и изотопов. Ионы, энергия ионизации и сродство к
электрону.
4.Структура периодической системы элементов. Периодичность свойств химических
элементов.
1 Модели строения атома: модели Томсона, Резерфорда, Бора.
Долгое время в науке господствовало мнение, что атомы не делимы. Однако в конце ΧΙΧ –
начале ΧΧ века был установлен ряд фактов свидетельствующих о сложном составе атомов.
Сюда относятся открытие электрона, а также открытия и изучение радиоактивности.
Изучение радиоактивности подтвердило сложность состава атомов. Теперь встал вопрос о
строении атома, о его внутренней структуре. Согласно модели предложенной в 1903 году
Томсоном атом состоит из положительного заряда, равномерно распределенного по всему
объему атому и электрона колеблющегося внутри этого заряда. Для проверки гипотезы
Томсона и более точного определения внутреннего строения атома Резерфорда провел серию
опытов по рассеянию α-частиц тонкими металлическими пластинками. По результатам этих
опытов в 1911 году Резерфорд предложил схему строения атома. Согласно этой схеме атом
состоит из положительно заряженного ядра, в котором сосредоточено преобладающая часть
массы атома и вращающихся вокруг него электронов. Положительный заряд ядра
нейтрализуется суммарным отрицательным зарядом электрона, следовательно, атом в целом
электронейтрален. Модель Резерфорда в некоторых отношениях противоречива твердоустановленным фактам. В настоящее время существует две модели структуры атома: 1 –
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 48 из 133
модель Бора; 2 – квантово-механическая модель строения атома. Согласно теории Бора
электроны в атоме вращаются вокруг ядра не по любым, а только по определенным
круговым орбитам, соответствующим разным значениям энергии. Он утверждал, что энергия
электрона изменяется скачками, то есть энергетические состояния электронов в атоме
квантованы. Энергия электроны вращающегося вокруг ядра зависит от радиуса орбиты.
Электрон обладает минимальной энергией, находясь на ближайшей к ядру орбите. При
поглощении кванта энергии электрон переходит на менее стабильный уровень с более
высокой энергией. При этом энергия атома увеличивается, и он перейдет в возбужденное
состояние. Переход электрона в обратном направлении приведет к уменьшению энергии
атома и освобождению поглощенной им энергии. Бор пронумеровал уровни энергии
электрона, также обнаружил, что на разных энергетических уровнях может находиться
разное количество электронов: 1 уровень содержит до 2 электронов; 2 уровень - до 8 и т.д.
Теория Бора хорошо подходила для простых атомов, например водород, но не для атомов с
более сложной структурой.
2 Квантово-механическая модель строения атома: атомные орбитали, квантовые
числа, принцип Паули, правила Хунда и Клечковского.
В 20-х годах ΧΧ века появилась новая теория строения атомов, основанная на
представлениях квантовой механики – квантово-механическая модель атома. В основу этой
модели положена квантовая теория, согласно которой электрон имеет двойственную
природу, т.е. обладает свойствами частицы и также волны. Следовательно, нельзя говорить о
какой-либо определенной траектории движения электрона. Можно лишь судить о той или
иной вероятности пребывания его в данной точке пространства - это принцип
неопределенности. По современным представлениям состояние электрона в атоме
описывается с помощью 4 чисел, которые называются квантовыми.
n – описывает среднее расстояние от орбитали до ядра, а также энергетическое состояние
электрона находящегося в атоме. n может принимать положительные целочисленные
значения. Чем больше значение n, тем выше энергия электрона и больше размер
электронного облака. Электроны, характеризующиеся одним и тем же значением n, образуют
в атоме электронные облака одинакового размера, которые называются электронными
оболочками.
l – также называется побочным и описывает форму орбитали, которая зависит от n. l может
принимать целочисленные значения от 0 до n-1. Например, при n=3 возможны l=0,1,2.
Орбитали имеющие одинаковые значения n, но разные значения l принято называть
энергетическими подуровнями. Энергетические подуровни обозначаются разными буквами.
Обозначение энергетических подуровней
m – описывает ориентацию в пространстве различных орбиталей, может принимать любое
целочисленное значение как положительное так и отрицательное в пределах от –l до +l.
Следовательно значение m зависит от значений l. Например, для l=1 возможны m= -1,0,+1.
Это значит, что p-орбиталь имеет 3 разные пространственные ориентации. Энергия этих
орбиталей одинакова, а ориентация в пространстве разная.
ms – описывает направление вращения электронов в магнитном поле: по часовой стрелке или
против. ms может принимать только 2 значения - -1/2 и +1/2, и на каждой орбитали может
находится только 2 электрона: один со спиной +1/2, а другой со спиной -1/2. Для
определения состояния электрона в многоэлектронном атоме, важное значение имеет
положение Паули (принцип Паули), согласно которому в атоме не может быть двух
электронов, у которых все 4 квантовых числа были бы одинаковыми. Из этого следует, что
каждая атомная орбиталь характеризуется определенными значениями n, l и m может быть
занята не более чем двумя электронами, спины которых имеют противоположные знаки. Два
таких электрона находящиеся на одной орбитали и обладающие противоположно
направленными спинами, называются спаренными в отличие от одиночного, то есть
неспаренного электрона, занимающего какую-либо орбиталь. Таким образом, квантовые
числа используют для описания состояния электрона в вакууме. Однако существуют и более
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 49 из 133
простые способы описания состояния электрона: 1 – диаграммы уровня энергии атома; 2 –
электронные конфигурации.
Диаграмма уровня энергии атома
Последовательность заполнения атомных орбиталей:
1) вначале электроны заполняют максимально низкие из свободных уровней энергии;
2) если конкретный энергетический уровень имеет более одного подуровня, то каждый из
подуровней будет заполняться только одним электроном до тех пор, пока все уровни этого
уровня не будут иметь по одному электрону и лишь затем эти подуровни начинают
заполняться вторым электроном. Это называется правилом Хунда;
3) последовательность заполнения атомных электронных орбиталей в зависимости от
значения главного и орбитального квантовых чисел была исследована Клечковским, который
установил, что энергия электронов возрастает по мере увеличения суммы этих двух
квантовых чисел (n+l). В соответствии с этим им было сформулировано следующее
положение:
а) первое правило Клечковского – при увеличении заряда ядра атома последовательное
заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы
(n+l) к орбиталям с большим значением этой суммы;
б) второе правило Клечковского – согласно которому при одинаковых значениях суммы (n+l)
заполнение орбиталей происходит последовательно в направлении возрастания значения
главного квантового числа.
3 Строение атомных ядер и изотопов. Ионы, энергия ионизации и сродство к
электрону.
Атом любого элемента состоит из одних и тех же частиц единственное что меняется это
количество различных субатомных частиц: протон, электрон, нейтрон.
Основные характеристики трех основных субатомных частиц
По сравнению с остальной частью атома ядро имеет крайне малый размер и большую
плотность. В основном диаметр атомов равен примерно 10-10 м, а диаметр ядер
приблизительно 10-15 м. В атоме все протоны и нейтроны находятся внутри ядра. Ядро
составляет большую часть массы атома, поэтому при расчетах массу атома можно считать
равной сумме масс протонов и нейтронов. Целое число равное сумме протонов и нейтронов
в ядре атома называется массовым числом ядра, а количество в атоме одних только протонов
называется порядковым номером (атомный номер или заряд ядра). Для обозначения атомных
ядер применяют структурный символ элемента.
A – массовое число (p++ n0); Z – порядковый номер (p+):
Количество электронов в атоме равно количеству протонов ядра всех атомов данного
элемента имеют одинаковый заряд, то есть содержат одинаковое число протонов, но число
нейтронов в ядрах этих атомов может быть различным. Атомы, обладающие одинаковым
зарядом ядра, но разным числом нейтронов, называется изотопами. Для обозначения
изотопов пользуются обычными символами соответствующих элементов, добавляя к ним
слева вверху индекс, указывающий массовое число изотопа: 1H; 2H; 3H
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 50 из 133
Атомы элементов способны отдавать, присоединять электроны и образовывать общие
электронные пары. Атомы, лишившиеся одного или не нескольких электронов, становится
заряженным положительно, так как заряд ядра атома превышает сумму зарядов оставшихся
электронов. Наоборот атомы, присоединившие к себе лишние электроны, заряжаются
отрицательно, образующиеся заряженные частицы называются ионами. Ионы обозначают
теми же символами, что и атомы, указывая справа вверху их заряд, например
положительный трех зарядный ион Al обозначают Al3+, отрицательный – Cl-. Для отрыва
электрона от атома с превращением последнего в положительный ион нужно затратить
некоторую энергию называемую энергией ионизации. Энергию ионизации можно
определить путем бомбардировки атомов электронами, ускоренными в электрическом поле.
То наименьшее напряжение поля, при котором скорость электрона становится достаточной
для ионизации атомов, называется потенциалом ионизации атомов данного элемента и
выражается в вольтах (В). Величина потенциала ионизации может служить мерой большей
или меньшей металличности элемента: чем меньше потенциал ионизации, чем легче
оторвать электрон от атома. Тем сильнее должны быть выражены металлические свойства
элемента. Атомы могут также присоединять электроны. Энергия, выделяющаяся при
присоединении электрона к свободному атому, называется сродством атома к электрону.
Сродство к электрону, как и энергия ионизации обычно выражается в электрон-вольтах (эВ).
Сродство к электрону атомов металлов, как правило, близко к нулю или отрицательно. Из
этого следует, что для атомов большинства металлов присоединение электронов
энергетически невыгодно. Сродство к электрону атомов неметаллов всегда положительно.
4 Структура периодической системы элементов. Периодичность свойств
химических элементов.
Периодичный закон, открытый Д.И. Менделеевым в 1869 г., в современной формулировке
гласит:свойства химических элементов, а также формы и свойства образуемых ими
соединений находятся в периодической зависимости от величины заряда ядер их
атомов.
Заряд ядра (число протонов) равен атомному номеру элемента, определяет число электронов
в атоме и, как следствие этого, строение его электронной оболочки в основном состоянии.
Графическим изображением периодического закона является таблица периодической
системы элементов. Формы такого изображения различны.
Принципиальный подход к построению таблиц единый – элементы располагаются в порядке
возрастания заряда ядер их атомов. Физической основой структуры периодической системы
элементов служит определенная последовательность формирования электронных
конфигураций атомов по мере роста порядкового номера элемента Z.
В зависимости от того, какой энергетический подуровень заполняется электронами
последним, различают 4 типа элементов:
1.
s–элементы – последним заполняется s-подуровень внешнего энергетического уровня;
2.
p–элементы – p–подуровень внешнего энергетического под-уровня;
3.
d – элементы – d–подуровень предпоследнего энергетического уровня.
4.
f–элементы – f–подуровень третьего снаружи уровня.
Элементы со сходной электронной конфигурацией (заполняются однотипные подуровни)
внешних энергетических уровней обладают и сходными химическими свойствами.
Периодом называется последовательный ряд элементов, электронная конфигурация
внешнего энергетического уровня которых изменяются от ns1 до ns2np6 (для первого
периода s1 и s2). При этом номер периода совпадает со значением главного квантового числа
и внешнего энергетического уровня.
Каждый из периодов (исключая первый) начинается типичным металлом и заканчивается
благородным газом, которому предшествует неметалл, то есть в периоде с увеличением
заряда ядра атомов наблюдается постепенное изменение свойств от металлических к
типично неметаллическим, что связывается с увеличением числа электронов на внешнем
энергетическом уровне.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 51 из 133
Первые три периода создают s- и p- элементы. Четвертый и последующие - включают в свой
состав также элементы, у которых происходит заполнение d- и f-подуровней
соответствующих внутренних энергетических уровней. f-элементы объединяются в
семейства, называемые лантанидами (4f-элементы) и актинидами (5f-элементы).
В вертикальных колонках, называемых группами, объединены элементы, имеющие сходное
электронное строение. В короткопериодном варианте таблицы всего 8 групп, каждая из
которых состоит из главных и побочных подгрупп. У элементов главных подгрупп
последними заполняются s- и p- подуровни внешних энергетических уровней, электронные
конфигурации которых являются основным фактором, определяющим химические свойства
элементов. У элементов побочных подгрупп происходит заполнение внутренних (n-1)d- и (n2)f-подуровней при наличии на внешнем энергетическом уровне 1 – 2 электронов.
Элементы-аналоги имеют одинаковое строение внешних электронных оболочек атомов при
разных значениях главного квантового числа n и поэтому проявляют сходные химические
свойства.
Таким образом, при последовательном увеличении зарядов атомных ядер периодически
повторяется конфигурация электронных оболочек и, как следствие, периодически
повторяются химические свойства элементов. В этом заключается физический смысл
периодического закона.
Элементы главных и побочных подгрупп различаются своими химическими свойствами,
однако им присуще и общее, что объединяет их в одну группу - номер группы. Он, как
правило, указывает на число электронов, которое может участвовать в образовании
химических связей. В этом состоит физический смысл номера группы.
Таким образом, у элементов главных подгрупп валентными (то есть участвующими в
образовании химических связей) являются электроны внешнего энергетического уровня, а у
элементов побочных подгрупп – и электроны предпоследних уровней. Это основное
различие между элементами главных и побочных подгрупп.
Поскольку электронная конфигурация атомов химических элементов изменяется
периодически с ростом заряда
их ядер, все свойства, определяемые электронным
строением, закономерно изменяется по периодам и группам периодической системы. К
таким свойствам относятся прежде всего различные химические и физические
характеристики элементов: атомные и ионные радиусы, сродство к электрону, степень
окисления, атомный объем и др. Периодически изменяются также многие химические и
физические свойства простых и сложных веществ, образованных элементами–аналогами.
Атом не имеет строго определенную границу, поэтому установить его абсолютные размеры
невозможно. Различают следующие радиусы ато-мов.
Ковалентный радиус представляет собой половину межъядерного расстояния в молекулах
или кристаллах соответствующих простых ве-ществ.
Металлический радиус равен половине расстояния между центрами двух соседних атомов
кристаллической решетки металла.
Кроме того, различают ионные радиусы катионов, которые всегда меньше атомных радиусов
соответствующих элементов, и радиусы анионов, которые больше атомных радиусов.
Орбитальный радиус – теоретически рассчитанное расстояние от ядра до главного
максимума электронной плоскости главной орбитали.
Закономерности изменения рассматриваемых параметров в системе элементов имеет
периодический характер. Наиболее общие из них следую-щие:
1.
в периодах по мере роста заряда ядер радиусы атомов уменьшаются;
2.
в группах с ростом заряда ядер радиусы атомов увеличиваются, при этом в группах А
такое увеличение происходит в большей степени, чем в группах В.
Химическая активность элемента определяется способностью его ато-мов терять или
приобретать электроны. Количественно это оценивается энергией ионизации Еион атомов
(или потенциалом ионизации I) и его сродством к электрону Еср.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 52 из 133
Энергия ионизации – минимальная энергия, необходимая для отрыва наиболее
слабосвязанного электрона от невозбужденного атома (э - элемент):
Энергия ионизации выражается в килоджоулях на моль (кДж/моль) или в электрон-вольтах
на атом (эВ/ат).
Наименьшее напряжение электрического поля, при котором происходит отрыв электрона,
называется потенциалом ионизации I (выражается в вольтах - В). Численное значение I в
вольтах равно энергии ионизации Еион. в электрон-вольтах.
Отрыву первого электрона соответствует первый потенциал ионизации I1, второго – I2, и т.д.
При этом I1<I2<…
Потенциал ионизации является сложной функцией некоторых свойств атома: заряда ядра,
радиуса атома, конфигурации внешних электронных оболочек.
Способность атома образовывать отрицательно заряженные ионы характеризуется сродством
к электрону, под которым понимается энергетиский эффект присоединения электрона к
нейтральному атому в процессе:
Наибольшим сродством к электрону характеризуются элементы группы VIIA. У
большинства металлов и благородных газов сродство к электрону невелико или даже
отрицательно. Присоединение двух или большего числа электронов к атому вообще
невозможно.
Электроотрицательность - условная величина, характеризующая способность атома в
химическом соединении притягивать к себе электроны.
Для практической оценки этой способности атома введена условная относительная шкала
электроотрицательности (ЭО). По такой шкале наиболее электроотрицательным среди
элементов, способных образовывать химические соединения, является фтор, а наименее
электроотрицательным – франций.
В периоде с ростом порядкового номера элемента ЭО возрастает, а в группе, как правило убывает.
Основные понятия, которые необходимо знать после изучения материала данной
лекции:
Модели атома Томсона, резерфорда, Бора; Атомные орбитали; квантовые числа; Принцип
Пауля; Правила Хунда, Клечковского; Знергия ионизации; Сродство к электрону.
Вопросы для самоконтроля
1.Каков смысл понятия атомная орбиталь?
2.Укажите число орбиталей, которые характеризуются следующими значениями
орбитального квантового числа: 2; 1; 0.
3.Какое число электронов может находиться в энергетических состояниях 2s; 3p; 4d;
5f?
4.Составьте электронные формулы для атомов элементов: хлора, ванадия, олова.
5.Чему равен суммарный спин электронов в невозбужденном атоме хрома?
Рекомендуемая литература: 1. Кулажанов К.С., Сулейменова М.Ш.Неорганическая
химия,2012 с.33-51;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 40-54;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Модуль 3. Основные закономерности протекания реакций.
Лекция №3 Энергетика химических процессов.
1. Термохимические законы.
2. Энтальпии образования химических соединений.
3. Энтропия. Энергия Гиббса.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 53 из 133
1 Термохимические законы
Химическое превращение – это качественный скачок, при котором исчезают одни
вещества и появляются другие. Происходящая при этом перестройка электронных структур
атомов, ионов и молекул сопровождается выделением или поглощением тепла, света,
электричества и т.д. – превращением химической энергии в другие виды энергии.
Энергетические эффекты химических реакций изучает термохимия. Данные об
энергетических эффектах используются для выяснения направленности химических
процессов, для расчета энергетических балансов технологических процессов и т.д. С их
помощью можно рассчитать температуру горения различных веществ и материалов,
температуру пожаров и т.п.
Состояние системы (вещества или совокупности рассматриваемых веществ)
описывают с помощью ряда параметров состояния – t, p, m. Для характеристики состояния
системы и происходящих в ней изменений важно знать также изменение таких свойств
системы, как ее внутренняя энергия U, энтальпия Н, энтропия S, энергия Гиббса (изобарноизотермический потенциал) G. По изменению этих свойств системы можно судить, в
частности, об энергетике процессов.
Химические реакции обычно протекают при постоянном объеме V = const, V = 0
(например, в автоклаве) или при постоянном давлении p = const (например, в открытой
колбе), т.е. является соответственно изохорными или изобарными процессами.
Энергетический эффект химического процесса возникает за счет изменения в системе
внутренней энергии U или энтальпии H. Внутренней энергией системы называют энергию
всех видов движения и взаимодействия тел или частиц, составляющих систему
(кинетическая энергия межмолекулярного взаимодействия, вращательная энергия,
колебательное движение атомов и групп в молекуле, энергия взаимодействия электронов
между собой и с ядрами).
Предположим, что некоторая система за счет поглощения теплоты q переходит из
состояния 1 в состояние 2. В общем случае эта теплота расходуется на изменение внутренней
энергии системы U и на совершение работы против внешних сил А: q U A или
U q A .
Приведенное уравнение выражает закон сохранения энергии (который называется
также первым законом термодинамики), т.е. означает что сумма изменения внутренней
энергии и совершенной системой работы равна сообщенной (или выделенной
ею)теплоте.
2 Энтальпии образования химических соединений.
Для химических реакций под работой против внешних сил в основном подразумевается
работа против внешнего давления. В первом приближении (при p = const) она равна
произведению давления р на изменение объема системы V при переходе ее из состояния 1
в состояние 2:
A pV2 V1 pV .
При изохорном процессе (V = const), поскольку изменения объема системы не
происходит, А = 0. Тогда переходу системы из состояния 1 в состояние 2 отвечает равенство:
qV U 2 U 1 U . Таким образом, если химическая реакция протекает при постоянном
объеме, то выделение или поглощение теплоты qv связано с изменением внутренней энергии
системы.
При изобарном процессе (p = const) тепловой эффект qр равен:
q p U pV ; q p U 2 U 1 pV2 V1 или
q p U 2 pV2 U 1 pV1 .
Введем обозначение U pV H .
Тогда
qp = H2 – H1 = H.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 54 из 133
Величину Н называют энтальпией. Энтальпию можно рассматривать как энергию
расширенной системы. Таким образом, если при изохорном процессе энергетический эффект
реакции равен изменению внутренней энергии системы qV U , то в случае изобарного
процесса он равен изменению энтальпии системы q p H .
Химические и физические изменения в системе, как правило, сопровождаются
выделением и поглощением теплоты. Наибольшую теплоту, которую можно получить при
химическом процессе при данной температуре, называют тепловым эффектом процесса.
Процессы в химии, при которых теплота выделяется, называются экзотермическими, а
процессы, при которых теплота поглощается, - эндотермическими. Тепловые эффекты
экзотермических реакций в термохимии принято считать положительными, а
эндотермических функций – отрицательными. В отличие от термохимии в химической
термодинамике, наоборот, положительные значения принимаются для тепла (Q),
поглощенного системой. С целью согласовать систему знаков, будем тепловой эффект
процесса обозначать через Q и считать, что
Q = -q, т.е. QV= -U; QP = -H.
(В химической термодинамике: q – поглощаемая энергия - положительна; q отдаваемая (излучаемая) энергия – отрицательна.)
Энергетический эффект реакции, протекающей при постоянном давлении, отличается
от энергетического эффекта реакции, протекающей при постоянном объеме, на величину
pV. Для химического процесса, протекающего изобарически, V представляет собой
разность между суммой объемов исходных веществ и продуктов реакции. Так, для реакции,
записанной в общем виде:
aA bB ... dD eE ... ,
V Vпрод Vисх dVD eVe ... aV A bVB ...,
где VA, VB, …, VD, VE… - молярные объемы веществ A, B, …, D, E…; Vпрод – сумма
молярных объемов продуктов реакции; Vисх – сумма молярных объемов исходных веществ.
Следует отметить, что подавляющее большинство химических реакций происходит
при постоянном давлении. Поэтому таким реакциям в дальнейшем будет уделено
наибольшее внимание.
Тепловые эффекты реакций определяют как экспериментально, так и с помощью
термохимических расчетов. Абсолютные значения внутренней энергии и энтальпии
определить невозможно. Однако для термохимических расчетов это несущественно, т.к.
здесь представляет интерес энергетический эффект процесса, т.е. изменение состояния
системы – изменение значений U и H (U и Н).
При экзотермических реакциях теплота выделяется, т.е. уменьшается энтальпия, или
внутренняя энергия системы, и значения Н и U для них отрицательны.
При эндотермических реакциях теплота поглощается, т.е. Н и U системы возрастают,
а Н и U имеют положительные значения (это значит, что продукт реакции менее устойчив,
чем исходное вещество).
Для того, чтобы можно было сравнивать энергетические эффекты различных
процессов, термохимические расчеты обычно относят к 1 моль вещества и условиям,
принятым за стандартные. За стандартные принимают давление 101325 Па и температуру 25
0
0
о
(U 298
).
С (298,15 К). Стандартные тепловые эффекты принято обозначать H 298
Уравнения химических реакций с указанием тепловых эффектов называют
термохимическими уравнениями.
Термохимическое уравнение реакции синтеза 1 моля воды имеет вид:
кДж
H 2 r 1/2O 2 r H 2 O ж , ΔH 0298 285,83
.
моль
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 55 из 133
В термохимических уравнениях указывается также агрегатное состояние и
полиморфная модификация реагирующих и образующихся веществ: г – газовое, ж – жидкое,
к – кристаллическое и т.д.
В основе термохимических расчетов лежит закон, сформулированный Гессом
Г.И. (1841):
Тепловой эффект зависит только от вида (природы) и состояния исходных веществ
и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера
промежуточных стадий.
Так, образование оксида углерода (IV) из графита и кислорода можно рассматривать
или как непосредственный результат взаимодействия простых веществ:
С графит О 2(r) СО 2(r) , ΔН1 ,
или как результат процесса, протекающего через промежуточную стадию образования и
сгорания оксида углерода (II):
С графит 1 / 2О 2(r) СО (r) , ΔН 2 ,
СО г 1 / 2О 2(r) СО 2 (r) , ΔН 3 ,
или суммарно
С графит О 2(r) СО 2 (r) , ΔН 2 Н 3 .
Согласно закону Гесса, тепловые эффекты образования СО2 как непосредственно из
простых веществ, так и через промежуточную стадию образования и сгорания СО равны
Н1 ΔН 2 Н 3 .
По приведенному равенству нетрудно вычислить одну из величин Н, зная две
другие. Как известно, тепловые эффекты образования СО2 (Н1) и горения СО (Н3)
определяются экспериментально. Тепловой же эффект образования СО (Н2) измерить
невозможно, т.к. при горении углерода в условиях недостатка кислорода образуется смесь
СО и СО2. Но теплоту образования СО можно рассчитать по известным значениям
кДж
кДж
кДж
ΔН 1 (393,5
) и ΔН 3 (283,0
.
) : ΔН 2 ΔН1 ΔН 3 ; ΔН 2 110,5
моль
моль
моль
Следствия из закона Гесса:
1. Тепловой эффект обратной реакции равен тепловому эффекту прямой реакции с
обратным знаком, т.е. для реакций
A В Н 1 ,
В А Н 2 ,
отвечающие им тепловые эффекты Н1 и ΔН 2 связаны равенством
Н1 ΔН 2 .
2. Если в результате ряда последовательных химических реакций система приходит в
состояние, полностью совпадающее с исходным (круговой процесс), то сумма
тепловых эффектов этих реакций равна нулю, т.е. для ряда реакций
A В Н 1
В С Н 2
С D Н 3
D А Н 4
сумма их тепловых эффектов
Н1 Н 2 Н 3 Н 4 0 .
В термохимических расчетах широко используют энтальпии (теплоты) образования
веществ.
Под энтальпией образования понимают тепловой эффект реакции образования 1
моля вещества из простых веществ. Обычно используют стандартные энтальпии
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 56 из 133
образования. Их обозначают ΔH 0обр. 298 или ΔH 0f 298 (часто один из индексов опускают; f – от
англ. formation).
Стандартные энтальпии образования простых веществ, устойчивых в
стандартных условиях (газообразный кислород, жидкий бром, кристалллический иод,
ромбическая сера, графит и т.д.), принимают равными нулю.
Согласно закону Гесса тепловой эффект реакции равен сумме энтальпий
образования продуктов реакции за вычетом суммы энтальпий образования исходных
веществ. Для реакций вида
aA bB ... dD eE...
тепловой эффект Нх.р. определяется равенством
H x.p. dH 0f , D eH 0f , E ... aH 0f , A bH 0f , B ...
или
H x.p. H 0f ,прод H 0f ,исх .
Примеры.
1. Для реакции взаимодействия кристаллического оксида алюминия и газообразного
оксида серы (VI)
Al 2 O3 3SO3 Al 2 SO4 3
кДж
H 0f ,.298
- 167,0
- 396,1
- 3442,2
моль
Н х0. р. H 0f , Al2 SO4 3 H 0f , Al2O3 3H 0f , SO3
кДж
3442,2 1676,0 3 396,1 577,9
моль
2. Реакция термического разложения СаСО3:
CaCO3 CaO CO2
H 0f , 298
кДж
моль
1206 ,9
-635,5
-393,5
Н х0. р. 635,5 393,5 1206,9 177,9
кДж
моль
3. Реакция разложения бертолетовой соли
2K Cl O 3 2 KCl 3O2
H 0f .298
- 391,2
- 435,9
0
кДж
моль
Энтальпии образования известны примерно для 4000 веществ в различных
агрегатных состояниях. Это позволяет чисто расчетным путем установить энергетические
эффекты самых разнообразных процессов.
H х0. р. 2 435,9 0 2 391,2 89,4
3 Энтропия. Энергия Гиббса.
Большинство процессов представляет собой два одновременно происходящих
явления: передачу энергии и изменение в упорядоченности расположения частиц
относительно друг друга.
Частицам (атомам, ионам) присуще стремление к беспорядочному движению,
поэтому система стремится перейти из более упорядоченного состояния в менее
упорядоченное.
Так, если, например, баллон с газом соединить с сосудом, то газ из баллона будет
распределяться по всему объему сосуда. При этом система из более упорядоченного
состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с
большим беспорядком).
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 57 из 133
Количественной мерой беспорядка является энтропия S.
Или другими словами: энтропия – мера неупорядоченности системы. Ее представляют как
логарифмическое выражение вероятности существования вещества или различных его форм:
S к ln W ,
где S – энтропия, к
R
- коэффициент пропорциональности (к – постоянная Больцмана), W
N
– термодинамическая вероятность существования вещества или какой-либо его формы, т.е.
число возможных микросостояний, соответствующих данному макросостоянию вещества.
При переходе системы из более упорядоченного состояния в менее упорядоченное
энтропия возрастает (S> 0). Чтобы оценить изменение энтропии при переходе из состояния
1 в состояние 2 необходимо, как обычно, из величины какого-либо свойства,
характеризующего конечное состояние, вычесть величину того же свойства,
характеризующего начальное состояние:
W
S S 2 S1 к ln W2 к ln W1 к ln 2 .
W1
II закон термодинамики: в изолированных системах энтропия самопроизвольно
протекающего процесса возрастает, т.е. S> 0.
Переход же системы из менее упорядоченного состояния в более упорядоченное
связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее
вероятно. Так, ясно, что в рассматриваемом примере невероятно, чтобы газ самостоятельно
собрался в баллоне.
В случае перехода системы из менее упорядоченного состояния в более
упорядоченное энтропия системы уменьшается (S< 0).
Нетрудно понять, что энтропия возрастает при переходе жидкости в пар, при
растворении кристаллического вещества, при расширении газов и т.д. Во всех этих случаях
наблюдается уменьшение порядка в относительном расположении частиц. Наоборот, в
процессах конденсации, кристаллизации веществ энтропия уменьшается.
Вероятность существования различных соединений вещества (газ, кристаллическое,
жидкое) можно описать как некоторое свойство и количественно выразить значением
энтропии S. [Энтропия может измеряться в энтропийных единицах 1 э.е. = 1 кал/(мольград.)
= 4,1868 Джмольград.] Энтропии веществ, как и энтальпии их образования, принято
относить к определенным условиям. Обычно это стандартные условия. Энтропию в этом
0
случае обозначают S 298
и называют стандартной.
В соответствии со степенью беспорядка энтропия вещества в газовом состоянии
значительно выше, чем в жидком, а тем более – в кристаллическом. Например,
0
S 298
,H
2Oж
0
69,96 э.е., S 298
,H
2Oпар
188,74 э.е.
При данном агрегатном состоянии энтропия тем значительнее, чем больше атомов в
молекуле. Например,
0
0
;
S 298
,O ( r) 238,8 э.е., S 298,O ( r) 205,03 э.е.
3
0
S 298,CO
2
197,7 э.е.
0
S 298
,CO2
213,6 э.е.
Чем больше твердость вещества, тем меньше его энтропия. Энтропия возрастает с
увеличением степени дисперсности частиц вещества.
Для химических реакций в целом
aA bB ... dD eE ...
изменение энтропии будет
S х. р. Sпрод. Sисх. dSD eS E ... aS A bS B ....
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 58 из 133
Об изменении энтропии в химической реакции можно судить по изменению объема
в ходе реакции:
С ( графит) 1 / 2О2 СО( г ) , V 0
3 / 2 Н 2 ( г ) 1 / 2 N 2 ( г ) NH 3( г )
и
0
S 298
87,7 э.е. 0 ;
0
90,1 э.е. 0 .
V 0 и S298
Если в реакции участвуют только твердые и образуются только твердые вещества
или число молей газообразного вещества не изменяется, то изменение энтропии в ходе ее
очень незначительно.
В стандартных условиях энтропия простого вещества не равна нулю.
III закон термодинамики: энтропия чистых веществ, существующих в виде
идеальных кристаллов при температуре 0 К, равна нулю.
Стремление системы к возрастанию энтропии называют энтропийным фактором.
Этот фактор тем больше, чем выше температура. Количественно энтропийный фактор
оценивается произведением Т· S .
Стремление системы к понижению потенциальной энергии называют
энтальпийным фактором. Количественно эта тенденция системы выражается через
тепловой эффект процесса, то есть значением Н .
Самопроизвольно, то есть без затраты работы извне, система может переходить из
менее устойчивого состояния в более устойчивое.
В химических процессах одновременно действуют две тенденции: стремление
частиц объединиться за счет прочных связей в более сложные, что уменьшает энтальпию
системы, и стремление частиц разъединяться, что увеличивает энтропию. Иными словами,
проявляется действие двух прямо противоположных факторов – энтальпийного ( Н ) и
энтропийного (Т· S ). Суммарный эффект этих двух противоположных тенденций в
процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса G (или
изобарно–изотермического потенциала):
G H TS .
Характер изменения энергии Гиббса позволяет судить о принципиальной
возможности или невозможности осуществления процесса. Условием принципиальной
возможности являются неравенство:
G 0 (условие самопроизвольности).
Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в
исходном состоянии системы больше, чем в конечном.
Увеличение энергии Гиббса ( G 0 ) свидетельствует о невозможности
самопроизвольного осуществления процесса в данных условиях.
G 0 , то система находится в состоянии химического равновесия.
соответствии с уравнением G H TS
самопроизвольному
Если же
В
протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы,
то есть когда
Н 0
S 0 .
сочетаниях Н
и
S
При других
и
энтальпийный, либо энтропийный фактор.
Рассмотрим две следующие реакции:
1)
возможность процесса определяют либо
СаО СО2 СаСО3
Н х0. р. 177,88
кДж
Дж
кДж
0
; S 298
160,48
; G 130,22
;
моль
град моль
моль
УМКД 042-16-13.1.3 /03-2013
2)
Редакция №1 от
.09.2013
стр. 59 из 133
СаСО3 СаО СО2
Н х0. р. 177,88
кДж
Дж
кДж
0
; S 298
160,48
; Gк0. р.1500 62,84
.
моль
град моль
моль
Первая реакция экзотермическая, протекает с уменьшением объема. Возможность
этой реакции ( G 0 ) определяется действием энтальпийного фактора, которое
перекрывает противодействие энтропийного фактора: Н TS .
Вторая реакция эндотермическая. Протекает с увеличением объема. Возможность
этой реакции ( G 0 ), наоборот, определяется энтропийным фактором. При высокой
температуре энтропийный фактор перекрывает энтальпийный фактор:
Реакция протекает самопроизвольно.
Согласно
уравнению
G H TS
S .
влияние
Н TS .
температуры
на G
определяется знаком и величиной
Для реакции с S 0 (2C + O2 2CO) повышение температуры приводит к
увеличению отрицательного значения G . Для реакции с S 0 (2Hg + O2 2HgO) с
повышением температуры отрицательное значение G уменьшается; в этом случае
высокотемпературный режим препятствует протеканию процесса. При соответствующей
температуре G приобретает положительное значение, и реакция должна протекать в
обратном направлении. Если же при протекании процесса энтропия системы не изменяется
С О2 СО2 , то значение G реакции от температуры практически не зависит.
При высоких температурах самопроизвольно можут протекать реакции,
сопровождающиеся увеличением энтропии, при низких температурах – только
экзотермические реакции.
Процессы, протекающие с уменьшением энтальпии ( Н 0 ) и увеличением
энтропии ( S 0 ), практически необратимы. В этом случае G всегда будет иметь
отрицательное значение, какую бы температуру не применяли. Так, для реакции
2КClO3 = 2KCl+3O2
Н х0. р. 89,4
кДж
кДж
0
, S 298
494,3
, G 0 при любой температуре.
моль
моль град
Под стандартной энергией Гиббса образования G f понимают изменение энергии
Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых
веществ, находящихся в стандартном состоянии.
Стандартная энергия Гиббса образования простого вещества, устойчивого в
стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии системы, не зависит от пути
процесса. Поэтому для реакции вида
0
аА вВ ... dD eE...
изменение стандартной энергии Гиббса G х. р. равно разности между суммой стандартных
энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса
образования исходных веществ:
0
Gх0. р. Gt0,прод. Gt0,исх. dGt0,D eGt0,E ... aGt0,A bGt0,B
Для реакции NO + 1/2О2 = NO2
.
УМКД 042-16-13.1.3 /03-2013
G 0f
86,58
0
Редакция №1 от
.09.2013
стр. 60 из 133
51,5 Gх. р. 51,5 (86,58 0) 35,08 кДж/моль.
0
0
При пользовании значениями G f
критерием принципиальной возможности
процесса в нестандартных условиях следует принять условие G 0 0 , а критерием
принципиальной невозможности осуществления процесса - неравенство
Равенство Gх0. р. 0 означает, что система находится в равновесии.
G 0 0 .
Во многих случаях значениями Gх0. р. можно пользоваться лишь для приближенной
оценки направления протекания реакций.
0
Чем отрицательнее значение Gt вещества, тем данное химическое соединение
0
устойчивее. И наоборот, чем положительней Gt , тем менее устойчиво данное вещество.
Gt0 известны для немногих соединений, но вместе с тем с помощью
Н 0f , 298 и
S 0f , 298 можно вычислить Gх0. р. для десятков тысяч реакций, в том числе предполагаемых и
не изученных экспериментально.
Основные понятия, которые необходимо знать после изучения материала данной
лекции: энтальпия, энтропия, внутренняя энергия, энергия Гиббса, закон Гесса и
следствия из закона Гесса.
Вопросы для самоконтроля
1. Сформулируйте закон Гесса.
2. Что называется теплотой образования химического соединения?
3. Что такое энтропия?
4. Чему равна стандартная энергия Гиббса образования?
5. Опишите законы термодинамики.
Рекомендуемая
литература:
1.
Кулажанов
К.С.,
М.Ш.Неорганическая химия,2012 с. 104-121;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 74-90;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Сулейменова
Лекция №4,5 Химическая кинетика и равновесие в гомогенных системах
1. Факторы, влияющие на скорость химической реакции.
2. Энергия активации химических реакций.
3. Обратимые химические реакции. Химическое равновесие.
1 Факторы, влияющие на скорость химической реакции
Химической кинетикой называется учение о скорости химических реакций и ее
зависимости от различных факторов (концентрации реагентов, t, Р, катализатора и т.д.).
Химические реакции протекают с различной скоростью. Одни реакции
заканчиваются в течение долей секунды (разложение взрывчатых веществ), другие –
продолжаются минутами, часами, сутками, третьи – длятся десятки, сотни, тысячи лет
(процессы, протекающие в земной коре).
Скорость конкретной реакции тоже может изменяться в широких пределах в
зависимости от условий ее протекания (смесь водорода и кислорода при обычной
температуре может сохраняться без изменений неограниченное время; при введении в нее
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 61 из 133
соответствующего катализатора она реагирует весьма бурно; при 630 °С она реагирует и без
катализатора).
Фазой называется часть системы, отличающаяся по своим физическим и
химическим свойствам от других частей системы и отделенная от них поверхностью раздела,
при переходе через которую свойства системы резко меняются.
Системы, состоящие из одной фазы, называются гомогенными, из нескольких фаз
– гетерогенными. Соответственно реакции, в которых взаимодействующие вещества
находятся в одной фазе, называются гомогенными, а реакции, в которых вещества
соединяются в различных фазах – гетерогенными.
Скорость гомогенной химической реакции принято выражать изменением
концентрации реагирующих веществ или образовывающихся продуктов реакции в
единицу времени. Концентрации исходных веществ в ходе реакции уменьшаются, а
концентрации продуктов реакции возрастают во времени. Скорость гомогенной химической
реакции по мере израсходования исходных веществ уменьшается.
Средняя скорость реакции vср в интервале времени от t1 до t2 определяется
соотношением:
C C
v моль .
;
v 2 1
cp
лс
t 2 t1
C
С1
С2
t1
t2
t
Рис. 5.1. Изменение концентрации исходных веществ во времени.
Мгновенная скорость – это скорость реакции в данный момент времени t. Она
определяется производной от концентрации по времени:
dc
v
.
t
dt
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 62 из 133
С
Продукты реакции
Исходные вещества
t
Рис. 5.2. Изменение концентрации реагирующих веществ во времени.
Скорость реакции всегда считается положительной. Если при расчетах берем
изменение концентрации исходных веществ, то в указанном выражении ставится знак «-»;
если это касается продуктов реакции, то следует принимать знак «+».
Факторы, влияющие на скорость химической реакции:
1. природа реагирующих веществ;
2. концентрация реагентов;
3. температура;
4. катализаторы;
5. дисперсность (для твердых веществ);
6. кислотность среды (для реакции в растворах);
7. форма реактора (для цепных реакций);
8. интенсивность освещения видимыми или УФ-лучами (для фотохимических
реакций);
9. интенсивность облучения -лучами (для радиационно – химических реакций) и
т.д.
Природа реагирующих веществ
2NO + O2 = 2NO2 – идет при стандартных условиях.
2CO + O2 = 2CO2 – не реагирует при стандартных условиях, хотя чисто внешне уравнения
данных реакций похожи, но природа веществ различна.
Концентрация реагентов
Необходимой предпосылкой взаимодействия веществ является столкновение
молекул. Число столкновений, а значит и скорость химической реакции, зависит от
концентрации реагирующих веществ: чем больше молекул, тем больше и столкновений.
Закон действующих масс
Для реакции аА + вВ сС скорость прямой реакции
пр. k [ A]a [ B]b ,
где [А], [В] – молярные концентрации реагирующих веществ А и В; k – константа скорости
химической реакции (данной).
Физический смысл константы скорости: она равна скорости реакции, когда [А]=1
моль/л и [В]=1 моль/л .
Гомогенная реакция: 2NO(г) + O2(г) = 2NO2(г)
v=k[NO]2·[O2].
Гетерогенная реакция: С(тв.) + О2(г) = СО2(г)
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 63 из 133
v=k[O2].
Считается, что площадь поверхности угля, на которой происходит реакция, остается
постоянной в течение длительного времени и ее учитывает коэффициент к.
Влияние температуры на скорость гомогенных реакций
Повышение температуры увеличивает скорость движения молекул и вызывает,
соответственно, возрастание числа столкновений между ними. Последнее влечет за собой и
повышение скорости химической реакции.
В количественном отношении влияние температуры на скорость гомогенных
химических реакций может быть выражено в приближенной форме правилом Вант-Гоффа:
повышение температуры на 10° увеличивает скорость гомогенных химических
реакций примерно в 2÷4 раза.
v
t
Рис. 5.3. Изменение скорости реакции в зависимости от повышения
температуры реакции.
Математически это будет выглядеть следующим образом:
k
v
2
k
1
где
n
;
t t
2 1
t
v
2
10
,
t
1
- температурный коэффициент скорости реакции, равный примерно 2÷4.
2 Энергия активации химических реакций.
Если бы каждое столкновение приводило к акту взаимодействия, все реакции должны
были бы протекать со скоростью взрыва. На самом деле к актам взаимодействия приводит
лишь незначительное число столкновений. К реакции приводят столкновения только
активных молекул, запас энергии которых достаточен для совершения элементарного акта
реакции. Число активных соударений при данной температуре пропорционально общему
содержанию реагирующих молекул. С ростом температуры число активных соударений
возрастает гораздо сильнее, чем общее число столкновений.
Для того, чтобы при столкновении молекулы успели прореагировать, химические
связи должны быть «расшатаны». Для этого молекула должна обладать повышенным
запасом энергии. Молекулы, обладающие этим необходимым запасом энергии, называются
активированными. При нагревании веществ активизация молекул происходит благодаря
ускорению их поступательного движения, а также вследствие усиления колебательного
движения атомов и атомных групп в самих молекулах. Все это приводит к ослаблению
связей внутри молекул. Таким образом, для того, чтобы молекулы прореагировали, им
необходимо преодолеть некоторый энергетический барьер.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 64 из 133
В соответствии с изложенным изменение энергии системы А+В при ее превращении
в S может быть графически представлено следующим образом (рис. 5.4.)
Молекула S образуется из А и В в результате перераспределения атомов и
химических связей. Для образования молекулы S активированные молекулы А и В при
столкновении вначале образуют активированный комплекс АВ, внутри которого и
происходит перераспределение атомов. Энергия, необходимая для возбуждения молекулы до
энергии активирования комплекса, называется энергией активации Еа.
Н
АВ
S
Еа
ΔH
Н
А+В
Н
прод
исх
а)
Путь реакции
СД
Н
Еа
С+Д
Н
ΔH
исх
Р
Н
б)
прод
Путь реакции
Рис. 5.4.
Диаграмма
изменения энтальпий
для
эндотермических (а)
и
экзотермических
(б) процессов.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 65 из 133
На рисунке а) видно, что продукты реакции обладают большим запасом энергии,
чем исходные вещества, то есть реакция А + В S эндотермическая. Разность между
энергией продуктов реакции и исходных веществ является тепловым эффектом реакции Н .
Соответствующий график для экзотермической реакции С + Д → Р представлен на
рисунке б).
Взаимосвязь между константой скорости реакции k и энергией активации Еа
определяется уравнением Аррениуса:
k
A e
Е /
RT
a
,
где А – предэкспоненциальный коэффициент, связанный с вероятностью и числом
столкновений.
Логарифмирование уравнения Аррениуса:
Ea
или lg k lg A Ea 1
RT
2,3R T
дает уравнение прямой линии. Знание констант скорости при нескольких температурах
позволяет определить энергию активации данной реакции:
ln k ln A
3 Обратимые химические реакции. Химическое равновесие.
Химически необратимые реакции при данных условиях идут практически до конца,
до полного расхода одного из реагирующих веществ (NH4NO3 → 2H2O + N2O – никакая
попытка получить нитрат из Н2О и N2O не приводит к положительному результату).
Химически обратимые реакции протекают одновременно при данных условиях как в
прямом, так и в обратном направлении. Необратимых реакций меньше, чем обратимых.
Примером обратимой реакции служит взаимодействие водорода с иодом:
Н2 I2
2HI
2
v пр k пр Н 2 I 2 ; vобр k обр НI .
Через некоторое время скорость образования HI станет равной скорости его
разложения:
v пр v обр ;
2 .
k пр Н 2 I 2 k обр НI
Иными словами, наступит химическое равновесие:
v
1
v пр v обр
2
t
Рис. 5.7. Изменение скорости прямой (1) и обратной (2) реакций
с течением времени.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 66 из 133
Химическим равновесиемназывается состояние системы, при котором скорость
образования продуктов реакции равна скорости их превращения в исходные реагенты.
Химическое равновесие являетсядинамическим, то есть его установление не
означает прекращения реакции.
Признаки истинного химического равновесия:
1. состояние системы остается неизменным во времени при отсутствии внешних
воздействий;
2. состояние системы изменяется под влиянием внешних воздействий, сколь
малы бы они ни были;
3. состояние системы не зависит от того, с какой стороны она подходит к
равновесию.
На основании равенства скоростей прямой и обратной реакций при равновесии можно
записать:
Таким образом видим, что при установившемся равновесии произведение
концентраций продуктов реакции, деленное на произведение концентраций исходных
веществ, в степенях, равных соответствующим стехиометрическим коэффициентам, для
данной реакции при данной температуре представляет собой постоянную величину,
называемую константой равновесия.
В общем виде для реакции
аА вВ
dD eE
выражение для константы равновесия должно быть записано:
d
e
D E
Kc
Aa Bb .
Концентрации реагентов при установившемся равновесии называются равновесными
концентрациями.
В случае гетерогенных обратимых реакций в выражение Кс входят только
равновесные концентрации газообразных и растворенных веществ. Так, для реакции СаСО3
↔ СаО + СО2
Кс=[СО2].
При неизменных внешних условиях положение равновесия сохраняется сколь угодно
долго. При измении внешних условий положение равновесия может измениться. Изменение
температуры, концентрации реагентов (давления для газообразных веществ) приводит к
нарушению равенств скоростей прямой и обратной реакций и, соответственно, к нарушению
равновесия. Через некоторое время равенство скоростей восстановится. Но равновесные
концентрации реагентов в новых условиях будут уже другими. Переход системы из одного
равновесного состояния к другому называется смещением или сдвигом равновесия.
Химическое равновесие можно сравнить с положением коромысла весов. Подобно тому, как
оно изменяется от давления груза на одну из чашек, химическое равновесие может
смещаться в сторону прямой или обратной реакции в зависимости от условий процесса.
Каждый раз при этом устанавливается новое равновесие, соответствующее новым условиям.
Численное значение константы обычно изменяется с изменением температуры. При
постоянной температуре значения Кс не зависят ни от давления, ни от объема, ни от
концентраций веществ.
Зная численное значение Кс, можно вычислить значения равновесных концентраций
или давлений каждого из участников реакции.
Например, допустим, что необходимо вычислить равновесную концентрацию HI,
получающуюся в результате реакции Н2 + I2 ↔ 2HI. Обозначим исходные концентрации Н2 и
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 67 из 133
I2 через С, а их изменение к моменту равновесия через х (моль/л). Тогда равновесные
концентрации реагентов составляют:
[I2] = (C – x); [H2] = (C – x) = [I2]; [HI] = 2x.
Имеем
K
HI 2 2 x 2 .
H 2 I 2 C x 2
Исходя из этого выражения, можно рассчитать х и,
значит, равновесные концентрации реагентов.
Для реакций с участием газов удобнее пользоваться парциальными давлениями
веществ. Константу равновесия в этом случае обозначают через Кр.
Существует связь между Кс и Кр. На примере реакции синтеза аммиака найдем ее.
N3+ 3H2 ↔ 2NH3;
NH 3 2 .
Кс
N 2 H 2 3
Концентрации веществ в газовой среде можно выразить как отношение числа молей n
вещества к объему системы V:
С
n
.
V
Значение n можно найти из уравнения Менделеева – Клапейрона:
РV = nRT
Получаем
C
=>n =
рV
.
RT
pV
p
.
RT V RT
Выражаем через полученное значение величину Кс:
Kc
p NH3
RT
2
3
p H 2 p N2
RT RT
2
p NH
3
pH
3
pN
2
2
312
RT
2
p NH
3
pH
3
pN
2
2
Или можно записать другим образом:
2
p NH
nисхnкон
3
Kc 3
RT
pH pN
2
2
После незначительных преобразований получим:
nкон nисх
К с К р RT
или
К
где
n
р
К
с
RT
n
- разность коэффициентов в уравнении реакции
n ( d c ) ( а в ) .
Для реакций, протекающих без изменения объема получаем:
,
RT 2 .
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 68 из 133
Кс К р .
Существует связь между изменением изобарно–изотермического потенциала
химической реакции и константой равновесия, выраженной через парциальное давление
компонентов А, В, С, D, Е при равновесии.
Для температуры 298 она выглядит следующим образом:
0
G298 RT ln K p .
кДж
7
, то K p 10 и
моль
0
прямая реакция практически необратима в стандартных условиях: если G298 41,8кДж ,
Если
0
G298
0,
то
K p 1;
если G 298 41,8
0
то К р 10 7 и обратная реакция практически необратимая.
Направление смещения положения химического равновесия в результате изменения
внешних условий определяется принципом Ле Шателье:
если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в
системе усиливаются те процессы, которые стремятся свести это воздействие к
минимуму.
Основные понятия, которые необходимо знать после изучения материала данных
лекций: химическая кинетика, химическое равновесие, принцип Ле Шателье, скорость
реакций, константа скорости реакций, энергия активации, закон действующих масс,
катализатор.
Вопросы для самоконтроля
1. Сформулируйте закон действия масс.
2. Что называется температурным коэффициентом скорости химической реакций?
3. Какова зависимость между скоростью химической реакции и температурой?
4. Что называется химическим равновесием?
5. Как связаны между собой концентрации реагирующих веществ при состоянии
равновесия?
Рекомендуемая
литература:
1.
Кулажанов
К.С.,
Сулейменова
М.Ш.Неорганическая химия,2012 с. 121-138;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 90-108;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Модуль 4. Растворы.
Лекция №6. Растворы.
1. Водные растворы. Способы выражения состава растворов.
2. Разбавленные растворы неэлектролитов.
1 Водные растворы. Способы выражения состава растворов.
В широком смысле растворы бывают газообразными, жидкими, твердыми. Примером
газообразного раствора может служить воздух, жидкого – раствор сахара в воде, твердого –
многочисленные сплавы металлов.
Раствором называется гомогенная система, состоящая из двух или более независимых
компонентов, соотношение между которыми может изменяться.
Один из компонентов раствора считается растворителем, остальные – растворенными
веществами.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 69 из 133
Растворителем считается то
вещество, количество которого
преобладает в данной системе. С
этой точки зрения, воздух – это
раствор кислорода, паров воды,
углекислого газа и благородных
газов
в
азоте,
так
как
содержание азота в воздухе
составляет 78% (об.). Этиловый
или
метиловый
спирты
неограниченно смешиваются с
водой. Поэтому в зависимости
от соотношения количества
спирта и воды эта система
может быть раствором спирта в
воде или раствором воды в
спирте. Электролиты (вещества,
растворы или расплавы которых
проводят электрический ток) в
растворах, например, серная
кислота
в
воде,
всегда
рассматриваются
как
растворенные
вещества
независимо от их количества.
Вода остается пока наиболее важным и распространенным растворителем, хотя в
последние годы все большее значение приобретают неводные растворители.
Вода – химическое соединение кислорода с водородом, отвечающее в парообразном
состоянии формуле Н2О (11,9 % масс. водорода и 88,81 % масс. кислорода).
Природная вода, как правило, содержит те или иные примеси. Наиболее чистой
природной водой считается дождевая. Однако и она содержит растворенные атмосферные
газы (О2, СО2 и т.д.), некоторые твердые вещества (NaCl, нитраты и т.д.), микроорганизмы,
частички пыли и т.п. В среднем в 1 литре дождевой воды растворено около 34 мг примесей
(солей соляной, азотной, сернистой кислот, аммониевых солей).
В морской воде в 1 литре в среднем находится около 35 г растворенных солей (NaCl,
MgCl2, MgSO4, CaSO4, KCl).
Вода, очищенная от нелетучих
растворенных
веществ
перегонкой,
называется
дистиллированной.
Вода – самое распространенное огнетушащее вещество, что связано с ее
особенностями:
1. Н2О – высший оксид водорода, не подвергающийся дальнейшему окислению.
2. Процесс фазового перехода жидкость-пар является эндотермическим, что вызывает
значительное снижение температуры в зоне горения при ее испарении.
3. Аномально высокая теплоемкость требует значительного подвода тепла для ее
нагревания до 100°, т.е. до температуры кипения.
4. Вода обладает хорошей смачивающей способностью по отношению ко многим
поверхностям, хорошей растворяющей способностью по отношению ко многим веществам,
что дает возможность улучшать ее огнетушащие свойства введением в ее состав различных
веществ (ПАВов, солей, щелочных металлов и т.д.).
5. Основным механизмом огнетушащего действия воды является охлаждение зоны
горения.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 70 из 133
Свойства воды, ограничивающие ее использование.
1. Расширение воды при замерзании. При давлении в 1 атм. вода при 0 °С превращается
в лед. Наибольшая плотность воды при 4 °С. Плотность воды при этой температуре и
давлении 1 атм. принята за единицу плотности жидких и твердых веществ. Плотность льда
при 0 °С составляет 0,9168 г/см3, т.е. он легче жидкой воды.
2. Термическая деструкция, сопровождающаяся выделением кислорода и водорода (при
температуре выше 1000 °С).
3. Химическая активность по отношению к щелочным металлам и некоторым другим
веществам.
4. Электропроводность воды (совершенно чистая вода электрический ток не проводит).
Молекула воды имеет угловое строение: входящие в состав ядра образуют
равнобедренный треугольник, в основании которого находятся два протона, а в вершине –
ядро атома кислорода. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды
..
Н:О:Н
две электронные пары образуют две ковалентные связи О-Н,
остальные четыре электрона представляют собой две неподеленные электронные пары.
Атом кислорода в молекуле воды находится в состоянии sp3–гибридизации. Поэтому
валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°). Электроны, образующие
связи О-Н, смещены к более электроотрицательному атому кислорода. В результате атомы
водорода приобретают эффективные положительные заряды, и на этих атомах создаются два
положительных полюса. Центры отрицательных зарядов неподеленных электронных пар
атома кислорода, находящиеся на гибридных sp3-орбиталях, смещены относительно ядра
атома и создают два отрицательных полюса.
В жидкой воде происходит ассоциация молекул за счет образования водородных
связей. В воде атом кислорода каждой
молекулы участвует в образовании двух
водородных связей с соседними молекулами
воды согласно схеме
В окислительно–восстановительных реакциях вода играет, как правило, роль среды.
Под действием сильных восстановителей при обычной температуре, а в остальных случаях
при повышенной температуре, вода проявляет окислительные свойства, например, окисляет
щелочные и щелочноземельные металлы (на холоду), железо, углерод и др. (при температуре
накаливания). При взаимодействии с сильными окислителями (фтор, хлор, электрический
ток и т.д.) вода склонна проявлять восстановительные свойства.
Растворы однородны в различных частях объема. Растворение вещества часто
происходит с выделением или поглощением тепла, иногда с изменением объема (при
смешении 1 л С2Н5ОН и 1 л Н2О объем полученного раствора равен 1,93 л при 25 °С). В
водном растворе происходит образование гидратов, которые являются сравнительно
непрочными соединениями растворенных частиц и растворителя (например, безводный
CuSO4 – белое вещество, при его растворении в воде образуется голубой раствор. Окраска
раствора обусловлена гидратированными ионами меди). Гидратированные частицы иногда
настолько прочны, что при выделении растворенного вещества из раствора в твердую фазу
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 71 из 133
молекулы воды входят в состав кристаллов (так, при выпаривании водного раствора
сульфата меди в твердую фазу выделяется соль CuSO4·5H2O, в которой вода называется
кристаллизационной). Гидратация обусловлена силами межмолекулярного воздействия
между растворенным веществом и растворителем.
Наибольшая взаимная растворимость достигается тогда, когда эти силы имеют
подобный характер. Неполярные или малополярные соединения хорошо растворимы в
неполярных и малополярных растворителях и менее растворимы в высокополярных
растворителях (так, СО (малополярное соединение) хорошо растворим в бензоле
(неполярное соединение) и ограниченно растворим в воде (полярное соединение)). Вода
является хорошим растворителем полярных соединений (NH3, C2H5OH).
Растворение – процесс обратимый: в зависимости от условий происходит или
растворение, или выделение из раствора растворенного вещества. Вследствие обратимости
процесса растворения к нему применим принцип Ле Шателье. Если растворение вещества
происходит с поглощением теплоты, то повышение температуры приводит к увеличению
растворимости. Наоборот, если при растворении вещества теплота выделяется, то
повышение температуры приведет к уменьшению растворимости. В большинстве случаев
растворимость солей возрастает с повышением температуры, для одних умеренно (NaCl), а
для других весьма сильно (KNO3, AgNO3), и лишь в отдельных случаях растворимость
уменьшается.
Насыщенным называется раствор, находящийся в равновесии с твердой фазой
растворенного вещества и содержащий максимально возможное при данных условиях его
количество (имеет место динамическое равновесие).
Раствор, концентрация которого ниже концентрации насыщенного раствора,
называется ненасыщенным. В таком растворе можно при тех же условиях растворить
дополнительное количества вещества. Существуют и пересыщенные растворы, которые
содержат вещества больше, чем это следует из его растворимости при данных условиях
(получаются путем охлаждения растворов, полученных при более высоких температурах.
Такие растворы метастабильны. «Затравки» в виде кристаллов или потирание стеклянной
палочки о стенку сосуда вызывают бурную кристаллизацию вещества).
Растворы, содержащие большое количество растворенного вещества, называются
концентрированными, а с малым содержанием растворенного вещества – разбавленными.
Способы выражения состава растворов
1. Массовая доля – отношение (обычно процентное) массы растворенного вещества к
массе раствора. Например, 15% (масс.) водный раствор NaCl на 100 единиц массы содержит
15 единиц массы NaCl и 85 единиц массы Н2О.
w
mвва
.
m р ра
2. Мольная доля – отношение химического количества растворенного вещества (или
растворителя) к сумме химических количеств всех веществ, составляющих раствор. В случае
раствора одного вещества в другом мольная доля растворенного вещества (N2) равна
N2
n2
n1 n2
,
а мольная доля растворителя (N1)
n1
N1
,
n1 n2
где n1 и n2 – соответственно количество растворителя и растворенного вещества.
3. Молярная концентрация (молярность) – отношение химического количества
растворенного вещества к объему раствора. Обычно молярность обозначается С м или (после
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 72 из 133
численного значения молярности) М. Так, 2 М Н2SO4 означает раствор, в каждом литре
которого содержится два моля серной кислоты, то есть См = 2 моль/дм3.
С
n
в ва .
M V р ра
4. Моляльность (моляльная концентрация) – отношение химического количества
растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m.
Так, для раствора H2SO4 запись m=2 моль/кг (Н2О) означает, что в этом растворе на каждый
килограмм растворителя (воды) приходится два моля Н2SO4. Моляльность раствора в
отличие от молярности не изменяется при изменении температуры.
n
Cm вва .
m р ра
5. Нормальность (нормальная или эквивалентная концентрация) – отношение числа
эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим
способом, обозначается Сn или (после численного значения нормальности) буквой н. Так, 2
н. Н2SO4 означает раствор, в каждом литре которого содержится 2 эквивалента Н2SO4, то
есть 98 г Н2SO4.
Cn
Э
.
V р ра
Эквивалент кислоты – это её количество, содержащее один эквивалент водорода,
способного замещаться металлом.
Эк ты
М к ты
Основность кислоты
Эквивалент основания – это его количество, которые реагирует с эквивалентами
кислот.
Эоснования
М осния
Кислотность основания
Эквивалент соли может быть вычислен как частное от деления ее молярной массы на
произведение числа ионов металла и его валентности:
Эсол и
М сол и
nB
Пользуясь растворами, состав которых выражен нормальностью, легко рассчитать, в
каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества
прореагировали без остатка. Пусть V1 раствора вещества 1 с нормальностью N1 реагирует с
V2 раствора вещества 2 с нормальностью N2. Это означает, что в реакцию вступило N1V1
эквивалентов вещества 1 и N2V2 эквивалентов вещества 2. Но вещества реагируют в
эквивалентных количествах, следовательно
N1V1 =N2V2 и
V1 N 2
V2 N1
Т.е. объемы растворов реагирующих веществ обратно пропорциональны их
нормальностям.
2 Разбавленные растворы неэлектролитов.
Первый закон Рауля
Над каждой жидкостью (растворителем или раствором) устанавливается
определенное давление пара, насыщающего пространство. Это давление характеризует
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 73 из 133
состояние равновесия между жидкой фазой и находящимися над нею молекулами
растворителя.
Рассмотрим растворы нелетучих
веществ, такие, над которыми
давление пара обусловлено
определенной
концентрацией
молекул
растворителя,
а
концентрация
молекул
растворенного
вещества
практически равна нулю или
имеет
ничтожно
малую
величину,
которой
можно
пренебречь. Давление пара над
такими растворами меньше, чем
давление пара над чистыми
растворителями при той же
температуре.
Поверхность раствора, в отличие от поверхности чистого растворителя, частично
занята молекулами нелетучего растворенного вещества. Это приводит к уменьшению числа
молекул растворителя, испаряющихся в единицу времени. Следует также учитывать силы
сольватационного воздействия между молекулами растворителя и растворенного вещества,
которые могут быть прочнее сил сцепления молекул растворителя друг с другом.
Таким образом, добавление к растворителю любого растворимого в нем нелетучего
вещества и образование раствора вызывает нарушение состояния равновесия между
растворителем и его насыщенным паром и установление нового равновесия, при котором
давление пара раствора будет несколько меньше давления пара растворителя при той же
температуре.
Если обозначить давление пара растворителя через p0, давление пара раствора через p,
то разность p0 – p = p показывает величину понижения давления пара. Отношение этой
разности к давлению пара растворителя показывает относительное понижение давления пара растворителя
р0 р
р
или
.
р0
р0
Согласно Первому закону Рауля относительное понижение давления насыщенного
пара растворителя над раствором равно мольной доле растворенного вещества:
р0 р
n2
р
N2 ,
или
р0
р0
n1 n2
где n2 и n1 – количества растворенного вещества и растворителя, соответственно.
После некоторых преобразований закон Рауля можно записать и таком виде:
р р0 N1
и
р р0 N 2 .
Второй закон Рауля
Наряду с понижением давления пара изменяются также температуры кипения и
замерзания указанных растворов. Растворы кипят при более высокой температуре, а
замерзают – при более низкой, по сравнению с соответствующими температурами для
чистого растворителя.
При кипении давление пара
жидкости становится равным
внешнему
давлению.
Из-за
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 74 из 133
понижения
давления
пара
раствора его надо нагреть до
более высокой температуры, чем
растворитель, чтобы давление
его пара достигло внешнего
давления
и
раствор
мог
закипеть.
Для выделения кристаллов льда
из раствора последний должен
быть охлажден до некоторой
температуры, лежащей ниже
температуры замерзания воды.
Таким образом, при растворении в воде вещества пределы жидкого состояния
раствора расширены по сравнению с растворителем на число градусов, равное сумме
повышения температуры кипения раствора tкип. и понижения его температуры замерзания
tзам.. Значения величинtкип. иtзам пропорциональны моляльности раствора. Одномоляльные
растворы различных веществ (неэлектролитов) характеризуются определенной для данного
растворителя величиной повышения температуры кипения и, соответственно, понижения
температуры замерзания.
Повышение температуры кипения одномоляльного раствора называется
эбулиоскопической постоянной растворителя Екип, а понижение температуры замерзания –
криоскопической постоянной растворителя Езам. Таким образом, в соответствии со вторым
законом Рауля повышение температуры кипения или понижение температуры замерзания
разбавленных растворов неэлектролитов пропорциональны числу частиц растворенного
вещества и не зависят от его природы:
tкип = Екип · m,
tзам = Езам · m;
где Екип иЕзам – коэффициенты пропорциональности, соответственно - эбулиоскопическая и
криоскопическая константы, зависящие только от природы растворителя. Для воды Е зам =
1,86; Екип = 0,516; m – моляльность раствора.
Для случая, когда g г неэлектролита, молярная масса которого М, растворены в А г
растворителя можно записать:
m
g 1000
M A
и
t кип Eкип
g 1000
g 1000
t
Е
зам
зам
M A ;
M A .
Из этого выражения видно, что в соответствии с
эмбулиоскопической и криоскопической констант
tкип = Екип. и tзам. = Езам, когда g = М и А = 1000 г.
физическим
смыслом
Осмотическое давление
Если раствор и растворитель разделены полупроницаемой (т.е. проницаемой только
для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное
давление, до достижения равновесного его значения – осмотического давления.
Осмотическое давление не зависит от природы растворителя и растворенного
вещества, оно пропорционально молярной концентрации раствора С М и абсолютной
температуре Т:
р осм = СМ RT,
где R – универсальная газовая постоянная. Подставляя в это выражение СМ=n/V, где n –
химическое количество растворенного вещества, моль; V – объем раствора , л, получаем
уравнение, аналогичное уравнению газового состояния:
росмV = nRT.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 75 из 133
Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое
оказывало бы растворенное вещество, если бы оно при данной температуре находилось в
состоянии идеального газа и занимало объем равный объему расвтора.
При определении молярной массы растворенного вещества по величине
осмотического давления используют соотношение:
m R T
,
M2 2
pосм V
где m2 масса растворенного вещества, г; V – объем раствора, л.
Основные понятия, которые необходимо знать после изучения материала данной
лекции: осмос, осмотическое давление, криоскопическая и эбуллиоскопическая константы,
молярная, нормальная, моляльная, процентная концентраций.
Вопросы для самоконтроля
1. Что называется плотностью раствора?
2. Назовите способы выражения концентрации растворов.
3. Что называется нормальной концентрацией раствора?
4. Что называется молярной концентрацией раствора?
5. Что называется моляльной концентрацией раствора?
Рекомендуемая
литература:
1.
Кулажанов
К.С.,
Сулейменова
М.Ш.Неорганическая химия,2012 с. 138-154;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 108-125;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Лекция №7,8 Растворы электролитов. Гидролиз солей
1.Электролитическая диссоциация. Сильные и слабые электролиты.
2.Водородный показатель. Гидролиз солей.
1 Электролитическая диссоциация. Сильные и слабые электролиты.
Электролитами называются вещества, которые в расплавленном или растворенном
состоянии проводят электрический ток.
Теорию электролитической диссоциации разработал Сванте Аррениус. Предложенная
им теория объяснила поведение и многие свойства электролитов.
Согласно этой теории молекулы электролита в воде или другой среде,
характеризующейся большой диэлектрической проницаемостью*, распадаются на ионы –
положительные (катионы) и отрицательные (анионы).
Процесс распада вещества на ионы получил название электролитической
диссоциации. Для слабых электролитов она протекает обратимо и выражается следующим
примерным уравнением
КА К++А-.
К электролитам относятся вещества, в молекулах которых атомы связаны сильно
полярной или ионной химической связью.
По современным представлениям электролитическая диссоциация в растворе
происходит в результате сложного физико–химического взаимодействия молекул
электролита с полярными молекулами растворителя.
Взаимодействие ионов с полярными молекулами растворителя называется
сольватацией (для водных растворов - гидратацией) ионов. Сольватация приводит к
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 76 из 133
образованию в растворе ассоциаций между ионами (катионами и анионами) и молекулами
растворителя. Процесс растворения вещества К+А- в воде, являющегося соединением с
типичной ионной связью, может быть записан следующим образом:
К А хН2О
твердое
вещество
жидкий
растворитель
К ( Н 2О)к А ( Н 2О) а .
раствор
Электролитическая диссоциация полярных молекул (КА) в растворе происходит
вследствие ослабления связи, вызванного действием полярных молекул растворителя:
КА + хН2О К+(Н2О)к + А-(Н2О)а.
Ассоциации
К+(Н2О)к
и
А-(Н2О)а
представляют
собой
гидратированные катионы и
анионы.
Немаловажное
значение имеет величина
диэлектрической проницаемости растворителя: чем больше последняя, тем больше
ослабляются связи между ионами электролита. Это вытекает из формулы закона Кулона
l l
F 1 2 , где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами
2
r
ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть
сила притяжения ионов в водном растворе ослабляется в 80 раз.
Если в растворе дополнительно могут возникнуть еще и водородные связи между
молекулами растворителя и атомом водорода растворенного вещества, то процесс
диссоциации протекает еще более эффективно.
С точки зрения теории электролитической диссоциации кислотой называется
соединение, диссоциирующее в водном растворе с образованием гидратированных
водородных ионов (гидроксоний-ионов) и кислотного остатка:
НА Н 2О Н 3О А ( Н 2О) А ,
где Н3О+ - ион гидроксония.
Все общие свойства кислот (кислый вкус, способность изменять окраску индикаторов
и т.д.) принадлежат иону гидроксония.
Основанием называется соединение, диссоциирующее в водном растворе с
образованием отрицательных гидроксид–ионов ОН-:
МеОН + хН2О Ме+(Н2О)к + ОН- + (х-к)Н2О,
+
где Ме - одновалентный катион.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 77 из 133
Все общие свойства растворимых оснований (щелочно–мыльный вкус, способность
определенным образом изменять окраску индикаторов и т.д.) принадлежат гидроксид–иону.
С точки зрения электролитической диссоциации соли можно рассматривать как
продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и
оснований.
В зависимости от соотношения х и у различают следующие виды солей,
диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
2H2SO4 + Mg(OH)2Mg(HSO4)2 + 2H2O;
Mg(HSO4)2 Mg2+ + 2HSO4- ;
при х = у – средние (нормальные) соли
H2SO4 + Mg(OH)2 MgSO4 + 2H2O;
MgSO4Mg2+ + SO42-;
при х < у – основные соли
H2SO4 + 2Mg(OH)2 (MgOH)2SO4 + 2H2O;
(MgOH)2SO4 2MgOH+ + SO42-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются
полностью гидратированные катионы и анионы сильного электролита. Электростатическое
взаимодействие между ионами ослабляется до минимума большими расстояниями между
ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает
обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин:
степенью электролитической диссоциации , константой электролитической диссоциации К
и др.
Степень электролитической диссоциации – это отношение числа молекул,
распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
может измеряться в долях единицы или в процентах. = 0, если диссоциация
отсутствует; = 1 или = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно
применять принцип Ле Шателье и выявить влияние внешних факторов на состояние
равновесия, приводящее к изменению значения .
Для смещения равновесия
К+А- + хН2О К+(Н2О)к + А-(Н2О)а
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя.
Это означает, что:
1.
диссоциация слабых электролитов проходит эффективнее в разбавленных
растворах, чем в концентрированных. Иными словами, возрастает с уменьшением
концентрации электролита в растворе и принимает максимальное значение = 1 в
бесконечно разбавленном растворе.
2.
так как процесс диссоциации является эндотермическим, то степень
диссоциации слабого электролита в водных растворах будет увеличиваться с повышением
температуры.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 78 из 133
Константой электролитической диссоциации К называется постоянная химического
равновесия в растворе электролита:
К КА
К А
КА
где [К+], [A-] и [KA] - концентрации в растворе ионов
недиссоциированного соединения КА (в моль/л).
,
К и А (в г-ион/л) и
Чем больше К, тем электролит
лучше распадается на ионы. Для
данного электролита значение К
постоянно при определенной
температуре и в отличие от не
зависит от концентрации.
Связь между константой К и степенью диссоциации может быть найдена
следующим образом. Концентрация ионов К+ и А- в растворе равна
[К+] = [А-] = С,
где С – исходная молярная концентрация; – степень электролитической диссоциации
электролита. Концентрация недиссоциировавших молекул КА в растворе равна
[КА]=(1- )С.
Откуда
2
К
С .
1
Данное уравнение выражает закон разбавления Оствальда.
Если мала, то 1- ≈ 1 и тогда
К
С
.
Видно, что с уменьшением концентрации электролита в растворе степень
электролитической диссоциации возрастает.
Диссоциация слабого электролита, молекула которого может диссоциировать не на
два, а на большее количество ионов (электролиты с разновалентными ионами), протекает по
стадиям (ступенчатая диссоциация). Например, при диссоциации слабой угольной кислоты
Н2СО3 в водном растворе имеют место следующие равновесия:
I стадия: Н2СО3 Н+ + НСО3К1
[ Н ] [ НСО 3 ]
[ Н 2 СО3 ]
4, 45 10
7
( 25
o
С)
.
II стадия: НСО3- Н+ + СО32
2
[ Н ] [СО3 ]
11
o
К1
4,70 10
( 25 С ) .
[ НСО3 ]
Как видно из этих данных, процесс диссоциации слабого электролита с
разновалентными ионами определяется главным образом первой ступенью.
Для примера приведем константы электролитической диссоциации некоторых слабых
кислот и оснований (25 °С):
СН3СООН
H+ + CH3COO1,76·10-5
NH4OH
NH4+ + OH1,79·10-5
HNO2
H+ + NO2- (18 °C)
4·10-4
+
H2S
H + HS
6·10-8
УМКД 042-16-13.1.3 /03-2013
H3PO4
HF
HCN
Редакция №1 от
H+ + H2PO4H+ + FH++CN-
.09.2013
стр. 79 из 133
7,52·10-3
6,61·10-4
7,9·10-10
Ионообменные реакции
Реакции в растворах электролитов, при которых не происходит изменения зарядов
ионов, входящих в соединения, называются ионообменными реакциями.
Правило Бертолле: равновесие в ионообменных реакциях смещается в сторону
образования наименее диссоциированных соединений.
В соответствии с этим направление реакций ионного обмена определяется
следующим эмпирическим правилом: ионные реакции протекают в сторону образования
осадков, газов, слабых электролитов, комплексных ионов.
При написании уравнений ионных реакций сильные электролиты пишут в
диссоциированном виде, слабые – в недиссоциированном.
Образование осадков:
AgNO3 + NaCl AgCl + NaNO3
+
Врастворе:
Ag + NO3- + Na+ + Cl- AgCl + Na+ + NO3-.
Исключим ионы, которые не взаимодействуют, тогда уравнение имеет вид:
Ag+ + Cl- AgCl.
Уравнения такого вида называются ионными.
Ионное уравнение получение гидроксида железа запишется следующим образом:
Fe3+ + 3OH- Fe(OH)3.
Образование газов:
Na2S + H2SO4 H2S + Na2SO4;
2Na+ + S2- + 2H+ + SO42- H2S + 2Na+ + SO42-;
2H+ + S2- H2S.
Образование слабых электролитов:
а. образование воды. Реакция, протекающая с образованием воды при взаимодействии
ионов водорода (точнее, ионов гидроксония) и гидроксид–ионов, называется реакцией
нейтрализации.
NaOH + HCl H2O + NaCl
OH- + H+ H2O
(H3O+ + OH- 2H2O).
в. образование слабого основания.
NH4+ + Cl- + K+ + OH- NH4OH + K+ + ClNH4+ + OH- NH4OH.
с. образование слабой кислоты.
2СH3COO- + 2Na+ + 2H+ + SO42- 2CH3COOH + 3Na+ + SO42CH3COO- + H+ CH3COOH.
2 Водородный показатель. Гидролиз солей.
Процесс электролитической диссоциации воды протекает в две стадии:
1.
образование водородных ионов и гидроксид–ионов:
Н2О Н+ + ОН2. гидратация водородного иона с образованием гидроксония–иона:
Н+ + Н2О Н3О+.
Первая стадия этого процесса протекает с поглощением тепла, вторая – с выделением
его значительного количества. Поэтому практически все ионы водорода гидратированны и
диссоциация воды должна изображаться следующим уравнением:
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 80 из 133
2Н2О Н3О+ + ОН-.
При 22 оС степень электролитической диссоциации воды равна 1,8·10-9, то есть из
555000000 молекул воды диссоциирует одна. Следовательно, вода – очень слабый
электролит, и для описания процесса ее диссоциации применим закон действующих масс:
Н 3О Н
К
Н 2О2 ,
где К - константа диссоциации воды.
[Н3О+]·[ОН-] = К·[Н2О]2
Так как [Н2О] = const, то получим:
[Н3О+][ОН-] = Кw.
Постоянная Кw называется ионным произведением воды.
В 1 л воды, массу которой можно принять равной 1000 г, находится 1000 г/18 г = 55,5
моль вещества (ее молярная концентрация).
Следовательно, при 22 °С концентрации ионов гидроксония и гидроксид–ионов равны:
[Н3О+][ОН-] = 55,5·1,8·10-9 = 1,000·10-7 г-ион/л.
Величина Кw возрастает с повышением температуры, так как при этом увеличивается
степень
электролитической
диссоциации:
К w25 1,008 1014 ; K w50 5,474 1014 ;
K w1000 59,0 1014 .
При
комнатной
-14
температуре принимают округленное значение ионного произведения воды 10 .
Водородный показатель
Водные растворы различных соединений могут давать кислую, щелочную или
нейтральную реакцию. Реакция среды зависит от соотношения концентраций ионов
гидроксония и гидроксид–ионов в растворе.
Если концентрации этих ионов равны между собой, то есть [Н3О+] = [ОН-], то реакция
среды нейтральная. Следовательно, вода принадлежит к типичным амфотерным
соединениям, совмещающим кислотные и основные свойства, выраженные в одинаковой
степени.
Если концентрация ионов гидроксония больше концентрации гидроксид–ионов, то
есть [Н3О+] > [ОН-], то реакция среды становится кислой. Кислотность тем выше, чем
больше концентрация ионов гидроксония. Если наоборот, концентрация ионов гидроксония
меньше концентрации гидроксид–ионов, то есть [Н3О+] < [ОН-], то реакция среды становится
щелочной. Следовательно, по значению концентрации этих ионов можно количественно
охарактеризовать реакцию среды.
Кислотность или основность раствора можно выразить, взяв вместо концентрации
ионов водорода ее десятичный логарифм. Чтобы избавиться от отрицательной степени в
значении концентрации ионов водорода, предложено пользоваться отрицательным
значением логарифма величины [Н+], названным водородным показателем или рН:
рН = -lg[Н+];
pH
[ H ] 10
В практике принимается Kw = 10-14 (22 °С), отсюда [Н+] = 10-7 г-ион/л и рН = 7.
Соотношения между реакцией среды, концентрациями ионов и значением
водородного показателя получаются следующие:
Нейтральная среда [Н3О+] = [ОН-] = 10-7 г-ион/л, рН = 7.
Кислотная среда [Н3О+] > [ОН-] > 10-7 г-ион/л, рН < 7.
Щелочная среда [Н3О+] < [ОН-] < 10-7 г-ион/л, рН > 7.
Это можно представить в виде схемы:
УМКД 042-16-13.1.3 /03-2013
0
1
2
3
4
5
6
Усиливается кислотная
реакция среды
Редакция №1 от
7
8
9
10
11
12
.09.2013
13
стр. 81 из 133
14
Усиливается щелочная
реакция среды
Гидролиз – процесс взаимодействия ионов соли с водой, приводящий к образованию
слабого электролита.
Если соль рассматривать как продукт взаимодействия кислоты с основанием, то в
зависимости от их силы все соли можно разделить на четыре типа по приведенной схеме.
Таблица: 1
Кислоты
Сильные
Слабые
Сильные
I: NaCl, KNO3; pH=7 II: Na2CO3, K2S;
Основания
гидролиз не идет
рH > 7
Слабые
III: ZnCl2, Al(NO3)3;
IV: CH3COONH4, Al2S3
pН 7
Соли первого типа гидролизу не подвергаются, так как при их взаимодействии с
водой слабые электролиты не могут быть получены. В системе Н2О ↔ Н+ + ОН- не
нарушается равновесие. рН в растворах этих солей будет равно 7.
Рассмотрим гидролиз солей оставшихся трех типов. Соли, образованные
многоосновными кислотами или многокислотными основаниями, гидролизируются
ступенчато, переходя в первой фазе в кислотные или основные соли.
Гидролиз Na2CO3:
I ступень 2Na+ + CO32- + HOH Na+ + HCO3- + Na+ + OHCO32- + HOH HCO3- + OH-;
II ступень Na+ + HCO3- + HOH H2CO3 + Na+ + OHHCO3- + HOH H2CO3 + OH-.
При гидролизе Na2CO3 и других солей этого типа в растворе накапливаются ионы OH, сообщающие ему щелочную реакцию с рН > 7. Более сильно выражена первая ступень
гидролиза, чем вторая.
Гидролиз ZnCl2:
I ступень: Zn2+ + 2Cl- + HOH ZnOH+ + Cl- + H+ + ClZn2+ + HOH ZnOH+ + H+;
II ступень: ZnOH+ + HOH + Cl- Zn(OH)2 + H+ + ClZnOH+ + HOH Zn(OH)2 + H+.
При гидролизе ZnCl2 и других солей этого типа в растворе накапливаются ионы H+,
сообщающие ему кислотную реакцию с рН < 7.
Гидролиз СН3СООNH4:
NH4 + CH3COO- + HOHNH4OH + CH3COOH.
Соли этого типа подвергаются гидролизу относительно легко. Реакция и рН раствора
определяется относительной силой образующихся оснований и кислот. В рассматриваемом
случае константы электролитической диссоциации NH4OH и CH3COOH при 25 ºС
соответственно равны 1,79·10-5 и 1,76·10-5, а поэтому реакция раствора практически
нейтральна (рН = 7).
Процесс гидролиза солей количественно может быть охарактеризован с помощью
двух величин: степени гидролиза h, константы гидролиза Кгидр.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 82 из 133
Степенью гидролиза называется отношение количества молекул соли, подвергшихся
гидролизу, к общему количеству молекул соли в растворе.
Очевидно, степень гидролиза h может изменяться в следующих пределах:
гидролиз
полный
отсутствует
гидролиз
0 h 1
в долях единицы
0 h 100 в %
Константа гидролиза определяет состояние химического равновесия в растворе
гидролизированной соли.
Например, для равновесного состояния I ступени гидролиза Na2CO3 и ZnCl2 Кгидр
выразится уравнениями:
НСО3 ОН
ZnOH H
К гидр.
; К гидр.
.
2
2
СО3 Н 2О
Zn
H 2O
В общем случае Кгидр изменяется в следующих пределах:
гидролиз
полный
отсутствует
гидролиз
0 Кгидр .
На состояние равновесия гидролиза сильно влияют различные факторы: главным
образом концентрация воды в растворе и температура системы.
Как видно из общего уравнения гидролиза
соль + вода основание + кислота
и уравнения константы гидролиза
К гидр
основание кислота
соль вода
увеличение концентрации воды (или изменение концентрации соли) в растворе в силу
постоянства Кгидр смещает равновесие слева направо. Поэтому разбавленные растворы солей
гидролизируются полнее и быстрее, чем концентрированные, и степень гидролиза
возрастает с разбавлением раствора.
Изменение температуры также резко влияет на состояние гидролитического
равновесия: при повышении температуры степень гидролиза увеличивается, что
объясняется резким возрастанием ионного произведения воды.
Основные понятия, которые необходимо знать после изучения материала
данных лекций: электролитическая диссоциация, электролиты, константа и степень
диссоциации, гидролиз, рН и рОН.
Вопросы для самоконтроля
1. Что такое электролитическая диссоциация?
2. Что такое сильные и слабые электролиты? Приведите примеры.
3. Что такое ионное произведение воды? Каким образом оно было вычислено?
4. Что такое рН?
5. Какие возможные случаи гидролиза существуют?
Рекомендуемая
литература:
1.
Кулажанов
К.С.,
Сулейменова
М.Ш.Неорганическая химия,2012 с. 154-183;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 125-158;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 83 из 133
Модуль 5. Электрохимические процессы.
Лекция №9 Окислительно-восстановительные реакции.
1. Характерные особенности окислительно-восстановительных реакций
2. Важнейшие окислители и восстановители. Типы окислительно-восстановительных
реакций.
3. Методика составления окислительно–восстановительных
реакций на основе электронного баланса
1 Характерные особенности окислительно-восстановительных реакций
Существует
обширный
класс химических реакций, в
ходе которых степень окисления
у атомов или ионов изменяется.
Например, это реакция
Zn+2HCl=ZnCl2+H2↑.
В ней участвуют атомы цинка, водорода и хлора; измененная в ходе реакции
степень окисления (СО) цинка повышается от 0 до +2, а ионов водорода – понижается от +1
до 0.
Реакции,
сопровождающиеся
изменением степени окисления
элементов,
называются
окислительновосстановительными.
Окислением называется процесс отдачи электронов, сопровождающийся
повышением СО.
Вещество, в состав которого
входит элемент, способный
отдавать электроны, называется
восстановителем. В процессе
отдачи
электронов
восстановитель окисляется.
Присоединение электронов, сопровождающееся понижением степени окисления,
называется восстановлением.
Вещество, в состав которого входит элемент, способный присоединить электроны,
называется окислителем. В процессе
присоединения электронов
окислитель
восстанавливается.
Известно, что атомы металлов
имеют
на
внешнем
энергетическом уровне мало
электронов (1-3) и способны
отдавать их при химических
реакциях, то есть окисляются, а
неметаллы
(на
внешнем
энергетическом уровне от 4 до 7
электронов)
склонны
присоединять
электроны
и
восстанавливаться,
следовательно, атомы металлов
–
восстановители
(отдавая
электроны, сами окисляются), а
атомы неметаллов – окислители
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 84 из 133
(присоединяя электроны, сами
восстанавливаются).
Приведем примеры окислительно–восстановительных реакций.
1. Горение магния на воздухе (или в кислороде):
2Mg0+O20=2Mg+2O-2.
Атом магния отдает два электрона атому кислорода. У последнего СО понижается от
0 до -2, а степень окисления магния повышается от 0 до +2. Следовательно, магний
окисляется, а кислород
восстанавливается; магний – восстановитель, а кислород окислитель.
2. Горение меди в хлоре:
Cu0+Cl20=Cu+2Cl2-1.
Атом меди отдает два электрона двухатомной молекуле хлора. СО хлора понижается
от 0 до -1, а СО меди повышается от 0 до +2. Хлор восстанавливается и выступает в роли
окислителя. Медь окисляется и является восстановителем.
1. Окисление хлорида железа (II) в водном растворе хлора:
2Fe+2Cl2-1+Cl20=2Fe+3Cl3-1.
Двухзарядный ион железа отдает один электрон атому хлора. При этом СО
повышается от +2 до +3, СО хлора понижается от 0 до -1. Хлорид железа (II)
окисляется, превращаясь в хлорид железа (III), и является восстановителем. Хлор при
этом восстанавливается и выступает в роли окислителя.
2 Важнейшие окислители и восстановители. Типы окислительно-восстановительных
реакций.
Важнейшие окислители и восстановители
К числу сильных окислителей, широко используемых на практике, относятся
галогены (Fe2, Cl2, Br2, I2), оксид марганца Mn+4O2, перманганат калия KMn+7O4, манганат
калия K2Mn+6O4, оксид хрома (хромовый ангидрид) Cr+6O3, хромат калия K2Cr+6O4,
бихромат калия K2Cr2+6O7, азотная кислота HN+5O3 и ее соли, кислород О2, озон О3, перекись
водорода Н2О2, концентрированная серная кислота Н2S+6О4, оксид меди (II) Сu+2О, оксид
серебра Ag2+1O, оксид свинца Рb+4О2, гипохлориты (например, NaCl-1O) и другие
соединения.
Щелочные и щелочноземельные металлы являются сильными восстановителями. К
числу других восстановителей относятся: водород, углерод, оксид углерода С +2О,
сероводород Н2S-2, оксид серы S+4О2, сернистая кислота Н2S+4О3 и ее соли, галогенводороды
(кроме HF), хлорид олова (II) Sn+2Cl2, сульфат железа (II) Fe+2SO4.
Типы окислительно-восстановительных реакций.
Окислительно–восстановительный эквивалент
Различают три типа окислительно–восстановительных реакций: межмолекулярные,
внутримолекулярные и реакции самоокисления–самовосстановления.
A.
Межмолекулярные – это такие реакции, в которых молекулы, атомы или
ионы элементов, входящие в состав одного вещества и являющиеся
окислителем, взаимодействуют с молекулами, ионами, атомами, входящих в
состав другого вещества (восстановителя): например:
Mn+4O2 + 4HCl-1 = Mn2+Cl2 + Cl20 + 2H2O.
B.
Во внутримолекулярных реакциях изменяется СО элементов одного и того
же вещества таким образом, что одни из них окисляются, а другие восстанавливаются. К таким реакциям относится, например, разложение
бертолетовой соли и оксида ртути (II):
2KCl+5O3-2 = 2KCl-1 + 3O20;
2Hg+2O-2 = 2Hg0 + O20.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 85 из 133
В реакциях самоокисления–самовосстановления (диспропорционирования)
атомы одного и того же вещества так взаимодействуют друг с другом, что одни
отдают
электроны
(окисляются),
а
другие
их
присоединяют
(восстанавливаются). Например, растворение хлора в воде:
Cl20 + H2O = HCl+1O + HCl-1 или
(Cl0Cl0 + H2O = HCl+1O + HCl-1).
В обиход химиков, изучающих рассматриваемые процессы, наряду с химическими
эквивалентами вошли окислительный и восстановительный эквиваленты. Это частное
от деления молярной массы вещества на число приобретаемых (или теряемых)
электронов. Так, в реакции
5H2S + 2KMnO4 + 3H3SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
для
KMnO4
окислительный эквивалент равен 158,15/5, а для сероводорода
восстановительный эквивалент – половине его молярной массы.
C.
Методика составления окислительно–восстановительных реакций на основе
электронного баланса
С точки зрения электронной теории окислительно–восстановительными реакциями
называются такие реакции, при протекании которых происходит переход электронов от
одних атомов, молекул или ионов к другим. Поскольку электроны в окислительно–
восстановительных реакциях переходят только от восстановителя к окислителю, а молекулы
исходных веществ и продуктов реакции электронейтральны, то число электронов, отданных
восстановителем всегда равно числу электронов, принятых окислителем. Это положение
называется принципом электронного баланса и лежит в основе нахождения коэффициентов в
уравнениях окислительно–восстановительных реакций.
Согласно этому принципу число
молекул окислителя и число
молекул
восстановителя
в
уравнении
окислительновосстановительных
реакций
должны быть такими, чтобы
количество принимаемых и
отдаваемых электронов было
одинаковым.
Рассмотрим применение принципа электронного баланса при нахождении
коэффициентов в уравнениях окислительно–восстановительных реакций на конкретных
примерах.
1.
При каталитическом окислении аммиака NH3 кислородом О2 образуется
оксид азота NO и вода Н2О. Запишем схему процесса с помощью формулы:
NH3 + O2 NO + H2O.
Над символами элементов, изменяющих в процессе реакции СО, подпишем их значения:
N-3H3 + O20N+2O-2 + H2O-2.
Из изменения величины СО видно, что азот в молекуле аммиака окислился, а
молекула кислорода – восстановилась, то есть аммиак является восстановителем, а кислород
– окислителем. Из этой схемы также вытекает, что атом азота, изменяя СО от -3 до +2, отдает
кислороду пять электронов. Поскольку водород СО не меняет, то молекула аммиака будет
отдавать всего 5 электронов. Атом кислорода принимает 2 электрона (СО меняется от 0 до 2), следовательно, молекула кислорода будет принимать 4 электрона. Запишем указанные
процессы в виде схемы:
4 окисление – восстановитель
N-3 - 5ē N+2
5
20
0
-2
5 восстановление - окислитель
O2 + 4ē 2O
4
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 86 из 133
Согласно принципу электронного баланса количества молекул окислителя и
восстановителя нужно взять такими, чтобы числа принимаемых и отдаваемых электронов
были равными. Для этого находится общее кратное, а затем делится на число отдаваемых
или приобретаемых электронов; полученные коэффициенты ставятся соответственно перед
молекулой восстановителя и окислителя. Из этой схемы видно, что 4 молекулы NH3 отдают
20 электронов, которые принимаются 5 молекулами О2. Коэффициенты электронного
баланса называются основными коэффициентами. Они никаким изменениям не подлежат:
4NH3 + 5O2 NO + H2O.
Все остальное уравнивается в соответствии с их величиной:
4NH3 + 5O2 4NO + 6H2O.
2. При окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются
мышьяковистая кислота H3AsO4, серная H2SO4 и оксид азота NO.
Составим
схему
реакции,
указывая СО над символами тех
элементов, у которых в процессе
реакции они изменяются:
+3 -2
+5
+5
+6
As2 S3 + HN O3 H3As O4 + H2S O4 + N+2O.
Подсчитаем количество электронов, отдаваемых молекулой восстановителя и
принимаемых молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2
электрона. Два атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2
до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего
одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО
от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3 электрона. Запишем это в
виде схемы:
As2+3S3-2 - 28ē = 2As+5 + 3S+6 (окисление)
3
84
N+5 + 3ē = N2+ (восстановление)
28
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3
(3·28=84) и 28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в
соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6H3AsO4 + 9H2SO4 + 28NO.
Подсчет атомов водорода показывает, что в левой части их 28, а в правой – 36.
Кислорода в правой части 84 атома, в правой – 88. Если водород или кислород не входят в
уравнение реакции в виде простых веществ, то они уравниваются добавлением нужного
количества молекул воды в ту часть уравнения, где их недостает. Поэтому подсчет атомов
кислорода или водорода проводят в последнюю очередь, причем уравнивание водорода
добавлением молекул воды приводит к автоматическому уравниванию кислорода и
наоборот. Если водород или кислород входят в уравнение реакции в виде простых веществ,
то их необходимо уравнивать независимо друг от друга.
Окончательно рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6H3AsO4+ 9H2SO4 + 28NO.
3.
Если числа электронов, отдаваемых молекулой восстановителя и
принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить
основные коэффициенты, например:
HCl 5 O3 H 2 S 2 HCl 1 H 2 S 6 SO4
4
(восстановление)
Cl 5 6e Cl 1 8
2
6
24
(окисление)
S 8e S
6
3
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3H2S = 4HCl + 3H2SO4.
Электронный баланс в данном случае 4 6e 3 8e .
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 87 из 133
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно
получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то
основные коэффициенты удваиваются:
Fe 2 SО4 HN 5 O3 H 2 SO4 Fe23 ( SO4 ) 3 N 2 O
3
6
(окисление)
Fe 2 1e Fe 3
3
5
2
1
2
(восстановление)
N 3e N
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O.
В рассмотренном примере в протекании окислительно-восстановительной реакции
принимает участие серная кислота. Она необходима для связывания образовавшегося
трехвалентного железа. Нужное количество молекул H2SO4 определяется после расстановки
коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в
левой части уравнения. Водород или кислород уравниваются в последнюю очередь
добавлением молекул воды.
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной
реакции, расходуется также на связывание образующихся продуктов реакции. Например:
K 2 Cr26 O7 HCl 1 Cr 3Cl3 Cl20 KCl
(восстановление)
2Cr 6 6e 2Cr 3 1
1
0
3 группы по два иона (окисление)
2Cl 2e Cl2
хлора, всего шесть ионов
хлора
K2Cr2O7 + 6HCl
2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо
8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl).
Таким образом:
K2Cr2O7 + 6HCl + 8HCl 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды H2O,
и получим окончательно:
K2Cr2O7 + 14HCl 2CrCl3 + 3Cl2 + 2KCl + 7H2O.
0
5
6. Сa HN O3 разб Сa 2 ( NO3 ) 2 N 3 H 4 NO3
8
4 (окисление)
Ca 0 2e Ca 2
5
3
2
1 (восстановление)
N 8e N
Основные коэффициенты 4 и 1:
4Сa + HNO3
4Ca(NО3)2 + NH4NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9
молекул HNO3:
4Сa + HNO3 + 9HNO3
4Ca(NО3)2 + NH4NO3 + 3H2O.
на окисление на связывание
7. Оба элемента - и отдающий и принимающий электроны - находятся в одной
молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как
бы идущими справа налево:
KCl 5 O32 KCl 1 O20
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 88 из 133
4
2
(окисление)
Cl 1 6e Cl 5 6
24
0
2
6
3
(восстановление)
O2 4e 2O 4
Основные коэффициенты 2 и 3 ставятся в правой части уравнения, левая часть
уравнивается по правой части:
2KСlO3 = 2KCl + 3O2.
8. Один и тот же элемент окисляется и восстанавливается. Такие реакции называются
реакциями диспропорционирования. В этом случае, так же как и в предыдущем,
электронный баланс составляется справа налево:
4K2SO3+4 = 3K2SO4+6 + K2S-2
S+6 + 2ē = S+4
6
3 (восстановление)
2
1 (окисление)
12
S-2- 6ē = S+4
Рассмотренный способ подбора коэффициентов в окислительно–восстановительных
реакциях не является единственным. Существуют и другие способы. Однако во всех случаях
главным остается нахождение основных коэффициентов электронного баланса.
Основные понятия, которые необходимо знать после изучения материала
данной лекций: окислитель, восстановитель, окисление, восстановление, степень
окисления, диспропорционирование, эквиваленты окислителей и восстановителей.
Вопросы для самоконтроля
1. Чем отличаются реакции окисления – восстановления от других химических
реакций?
2. Какие вещества называются окислителями и какие восстановителями?
3. В каких группах периодической системы элементов Д.И. Менделеева
расположены элементы с ярко выраженными восстановительными свойствами?
4. В каких группах периодической системы элементов Д.И. Менделеева
расположены элементы с ярко выраженными окислительными свойствами?
5. Как изменяется окислительное число окислителя и восстановителя в реакциях
окисления - восстановления?
Рекомендуемая литература: 1. Кулажанов К.С., Сулейменова М.Ш.Неорганическая
химия,2012 с. 183-193;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 158-178;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Лекция №10 Электрохимические процессы.
1. Электродные потенциалы и механизм их возникновения.
2. Водородный электрод. Стандартные электродные потенциалы металлов. Ряд
стандартных электродных потенциалов.
3. Электролиз с нерастворимыми и растворимыми электродами.
4. Законы Фарадея.
1 Электродные потенциалы и механизм их возникновения.
Для
определения
направления
и
полноты
протекания
окислительновосстановительных реакций между окислительно-восстановительными системами в водных
растворах используются значения электродных потенциалов этих систем.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 89 из 133
Механизм возникновения электродных потенциалов, их количественное определение,
процессы, которые сопровождаются возникновением электрического тока или вызваны
электрическим током, изучаются особым разделом химии – электрохимией.
К электрохимическим относятся явления, возникающие на границе двух фаз с
участием заряженных частиц (ионов и электронов), например, при погружении
металлической пластинки в воду.
Для всех металлов характерно свойство в большей или меньшей степени
растворяться в воде. При этом в воду переходят положительно заряженные ионы металла, в
результате чего пластинка (из-за появления в ней избыточных электронов) заряжается
отрицательно. Гидратированные катионы металла скапливаются возле поверхности
пластинки на границе раздела двух фаз (металл-раствор). Возникает двойной электрический
слой, характеризующийся некоторой разностью электростатических потенциалов. Как
известно, энергию, которую необходимо затратить (положительный потенциал) или которую
можно получить (отрицательный потенциал) при переносе единицы электричества из
бесконечности в данную точку, называют электрическим потенциалом. Между пластинкой и
раствором устанавливается окислительно-восстановительное равновесие:
Ме mH 2O MeH 2O m ne . (9.1)
пластинка
пластинка
n
раствор
При погружении металла в раствор его соли также возникает двойной
электрический слой, но в этом случае возможны два механизма его образования. Если
концентрация катионов металла в растворе мала или металл довольно активный,
вследствие чего равновесие процесса, указанного выше, сдвинуто вправо, то металлическая
пластинка заряжается отрицательно:
В том случае, когда концентрация катионов металла в растворе велика или металл
малоактивный, равновесие указанного процесса сдвигается влево и металлическая
пластинка заряжается положительно:
В любом случае на границе раздела двух фаз образуется двойной электрический слой.
Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой,
называетсяэлектродным потенциалом Е. Потенциалу металла приписывается тот
знак, который возникает на его поверхности в двойном электрическом слое.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 90 из 133
2 Водородный электрод. Стандартные электродные потенциалы металлов. Ряд
стандартных электродных потенциалов.
Для
определения
направления
и
полноты
протекания
окислительновосстановительных реакций между окислительно-восстановительными системами в водных
растворах используются значения электродных потенциалов этих систем.
Механизм возникновения электродных потенциалов, их количественное определение,
процессы, которые сопровождаются возникновением электрического тока или вызваны
электрическим током, изучаются особым разделом химии – электрохимией.
К электрохимическим относятся явления, возникающие на границе двух фаз с
участием заряженных частиц (ионов и электронов), например, при погружении
металлической пластинки в воду.
Для всех металлов характерно свойство в большей или меньшей степени
растворяться в воде. При этом в воду переходят положительно заряженные ионы металла, в
результате чего пластинка (из-за появления в ней избыточных электронов) заряжается
отрицательно. Гидратированные катионы металла скапливаются возле поверхности
пластинки на границе раздела двух фаз (металл-раствор). Возникает двойной электрический
слой, характеризующийся некоторой разностью электростатических потенциалов. Как
известно, энергию, которую необходимо затратить (положительный потенциал) или которую
можно получить (отрицательный потенциал) при переносе единицы электричества из
бесконечности в данную точку, называют электрическим потенциалом. Между пластинкой и
раствором устанавливается окислительно-восстановительное равновесие:
n
Ме mH 2O MeH 2O m ne . (9.1)
пластинка
пластинка
раств ор
При погружении металла в раствор его соли также возникает двойной
электрический слой, но в этом случае возможны два механизма его образования. Если
концентрация катионов металла в растворе мала или металл довольно активный,
вследствие чего равновесие процесса, указанного выше, сдвинуто вправо, то металлическая
пластинка заряжается отрицательно:
В том случае, когда концентрация катионов металла в растворе велика или металл
малоактивный, равновесие указанного процесса сдвигается влево и металлическая
пластинка заряжается положительно:
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 91 из 133
В любом случае на границе раздела двух фаз образуется двойной электрический слой.
Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой,
называетсяэлектродным потенциалом Е. Потенциалу металла приписывается тот
знак, который возникает на его поверхности в двойном электрическом слое.
Лекция 11 Электролиз с нерастворимыми и растворимыми электродами.
Электролиз – окислительно-восстановительный процесс, протекающий при
прохождении постоянного электрического тока через раствор или расплав электролита.
При электролизе энергия электрического тока превращается в химическую энергию,
иначе говоря, осуществляется процесс, обратный по характеру происходящему в
гальваническом элементе. Как и в случае гальванического элемента, на аноде происходит
окисление, а на катоде – восстановление. Но при электролизе анодом является
положительный электрод, а катодом – отрицательный.
Характер протекания электродных процессов при электролизе зависит от многих
факторов, важнейшими из которых являются состав электролита, материал электродов и
режим электролиза (температура, плотность тока и т.д.).
Различают электролиз расплавов и растворов электролитов.
Электролиз расплавов электролитов.
Электролиз расплава соли с использованием инертных электродов показан на
следующей схеме:
Анод
При высоких температурах расплав соли диссоциирует на ионы:
MgCl2 Mg 2 2Cl .
Прохождение электрического тока через расплав обусловлено тремя одновременно
протекающими процессами:
1) направленное движение катионов Мg2+ к катоду, а анионов Cl- - к аноду;
2) восстановление, происходящее на катоде:
Mg 2 2e Mg ;
3) окисление, происходящее на аноде:
2Cl Cl2 2e .
Суммарное уравнение электролиза после уравнивания числа отдаваемых и
присоединенных электронов принимает вид:
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 92 из 133
Mg 2 2Cl Mg Cl2 .
Схематически весь процесс можно представить следующим образом:
MgCl2 Mg 2 2Cl
Катод (-)
Анод ( + )
2+
2Cl-
Mg
Mg2+ + 2e- = Mg
2Cl- - 2e- = Cl2
MgCl2 Mg Cl2
Электролиз растворов электролитов
Электролиз растворов электролитов более сложен из-за возможности участия в
электродных процессах молекул воды в восстановлении на катоде:
2 H 2O 2e H 2 2OH
и окислении на аноде:
2H 2O O2 4 H 4e .
В тех случаях, когда на одном и том же электроде возможно протекание двух или
большего числа процессов, наиболее вероятен тот, осуществление которого связано с
минимальной затратой энергии. Это означает, что на катоде восстанавливаются в первую
очередь окисленные формы окислительно-восстановительных систем с наибольшим
электродным потенциалом, а на аноде окисляются восстановленные формы с наименьшим
электродным потенциалом.
Для определения порядка протекания окислительно-восстановительных процессов на
электродах при электролизе водных растворов можно руководствоваться следующими
практическими правилами.
Катод.
1. В первую очередь восстанавливаются катионы металлов, имеющих стандартный
электродный потенциал больший, чем у водорода, в порядке уменьшения Ео.
2. Катионы металлов с малым стандартным электродным потенциалом (от Li+ до Al3+
включительно) не восстанавливаются, а вместо них восстанавливаются молекулы
воды (в кислой среде – ионы Н+).
3. Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у
водорода, но больший, чем у алюминия, восстанавливаются одновременно с
молекулами воды.
Анод.
Характер окислительных процессов зависит также от материала электродов.
Различают нерастворимые(инертные) и растворимые(активные)электроды.
Инертные электроды изготавливаются обычно из графита, угля, платины; в процессе
электролиза они химически не изменяются, а служат лишь для передачи электронов во
внешнюю цель.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 93 из 133
При использовании инертных анодов следует учитывать следующее:
1. В первую очередь окисляются простые анионы в порядке возрастания их Е о, не
превышающих + 1,5 В (S2-, J-, Br-, Cl-).
2. При электролизе водных растворов, содержащих анионы кислородосодержащих
кислот (CO32-, NO3-, SO42-, PO43- и др.), на аноде окисляются не эти анионы, а
молекулы воды.
3. В щелочных растворах на аноде окисляются ионы ОН-:
4OH O2 2H 2O 4e .
При использовании растворимых анодов (из Cu, Zn, Ag, Ni и др. металлов) электроны во
внешнюю цель посылает сам анод за счет окисления атомов металла, из которого сделан
анод:
Me Me n ne
анод
в
р р
во
.
внешнюю
цепь
Рассмотрим конкретные примеры.
Электролиз водных растворов солей (инертные электроды)
NaCl Na Cl
1)
( - ) Катод
Анод ( + )
Na+, Н2О
Cl-, H2O
2 H 2O 2e H 2 2OH
2Cl Cl2 2e
2 H O 2Cl H 2OH Cl
2
2
2
2H 2 O 2 NaCl H 2 2 NaOH Cl2
2 K 2 SO4 4 K 2SO4
2)
2
( - ) Катод
Анод ( + )
4К+, 4Н2О
SO42-, Н2О
2H 2O O2 4H 4e
4 H 2O 4e 2 H 2 4OH
6H 2O 2H 2 O2 4OH 4H
2 H 2O 2 H 2 O2 E o 0,76 В
ZnSO4 Zn 2 SO4
3)
( - ) Катод
2
Анод ( + )
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
Zn2+, H2O
стр. 94 из 133
SO42-, H2O
Zn 2 2e Zn
2 H 2O 2e H 2 2OH
2H 2O O2 4H 4e
Zn 2 4H 2O Zn H 2 O2 2OH 4H
Zn 2 2H 2O Zn H 2 O2 2 H
ZnSO4 2H 2O Zn H 2 O2 2H
4)
Электролиз водного раствора CuCl2 (активный медный анод)
CuCl2 Cu 2 2Cl
( - ) Катод
Анод ( + )
Cu2+, H2O
2Cl-, H2O
Cu Cu 2 2e
Cu 2 2e Cu
Законы Фарадея.
Количественные характеристики электролитических процессов устанавливаются
двумя законами Фарадея:
Масса веществ, выделившихся на электродах при электролизе, прямо
пропорциональна количеству электричества, прошедшего через раствор
или расплав электролита.
II.
При пропускании одинакового количества электричества через растворы
или расплавы различных элементов масса веществ, выделяющихся на
электродах, пропорциональна молярным массам их эквивалентов.
Экспериментально установлено, что для выделения на электроде одной молярной
массы эквивалента вещества необходимо затратить одно и то же количество электричества,
равное ~96500 Кл. Оно получило название постоянной Фарадея F.
I.
Оба закона можно объединить общей формулой:
m
Э J t Э Q
кQ ,
F
F
где m – масса окисленного или восстановленного вещества, г; Э – молярная масса его
эквивалента, г/моль; Q – количество электричества, прошедшее через элемент (Q = Jt, где J –
сила тока, А; t – время, с).
Если Q = Jt = 1 Кл, то
mк
Э
Э
.
F 96500
Величина К называется электрохимическим эквивалентом вещества. Она
представляет собой массу вещества, окисляющегося или восстанавливающегося на
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 95 из 133
электродах при прохождении через элемент 1 Кл электричества. Видно, что химический
эквивалент связан с электрохимическим эквивалентом соотношением:
к
Э
.
F
Показателем эффективности электролиза является выход по току η, %, определяемый
как отношение массы вещества, фактически полученной в данных условиях электролиза
mпракт, к массе вещества, теоретически вычисленной на основании закона Фарадея mтеор:
mпракт
mтеор
100%
mпракт 96500
Э J t
100% .
Вопросы для самоконтроля
1. Что называется электродным потенциалом металла?
2. Что представляют собой водородный электрод?
3. Что называется стандартным электродным потенциалом?
4. Какое явление называется поляризацией гальванического элемента?
5. Какие процессы протекают у катода при электролизе?
Коррозия и защита металлов и сплавов.
1. Виды коррозии.
2. Механизм коррозии. Защита металлов от коррозии.
1 Виды коррозии
Под коррозией металла понимают его разрушение под воздействием окружающей среды.
Основные виды коррозии: 1) сплошная; 2) местная; 3) интеркристаллитная; 4)
транскристаллитная; 5) избирательная; 6) подповерхностная. По механизму протекания
коррозионного разрушения различают два типа коррозии – химическую и
электрохимическую. Химической коррозией называется разрушение металла окислением его
в окружающей среде без возникновения электрического тока в системе. В этом случае
происходит взаимодействие металла с составными частями спуды – газами и
неэлектролитами. Электрохимической коррозией называется разрушение металла в среде
электролита с возникновением внутри системы электрического тока. Электрохимическую
коррозию вызывают загрязнение, примеси, содержащиеся в металлах. В этих случаях при
соприкосновении металла с электролитом на его поверхности возникает множество
короткозамкнутых гальванических микроэлементов. При этом анодами являются частицы
металла, катодами – загрязнения, примеси. На аноде происходит процесс окисления: Me – né
→ Men+, на катоде происходит процесс восстановления водорода или кислорода: 2H+ + 2é →
2H0 – H2 (pH<7); O2 + 4é + 2H2O → 4OH- (pH>7).
2 Механизм коррозии. Защита металлов от коррозии.
Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных
электродных потенциалов металлы, из которых образовался гальванический элемент и чем
больше влажность воздуха. Металлы высокой чистоты (метеоритное железо) коррозии не
подвергаются.
Вещества, ускоряющие коррозию (хлориды, фториды, сульфиды, нитраты, бромиды,
йодиды), называются стимуляторами или активаторами. Вещества, замедляющие
коррозию, называются ингибиторами. Полностью предотвратить коррозию невозможно,
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 96 из 133
возможно лишь уменьшить скорость коррозирования. Для этого используют следующие
методы: защита поверхности металла покрытиями, создание сплавов с антикоррозионными
свойствами, электрохимические методы, изменение состава среды.
Методы защиты от коррозии
1. Изоляция металла от воздействия воздушной среды: покрытие маслами, лаками,
пленками.
2.Металлические покрытия: анодное и катодное.
Цинк, покрывающий железо является анодом, если обнажаются оба слоя. Цинк, как
более активный, будет разрушаться, а на железе будет происходить восстановление
электролита, в частности катионов водорода.
Zn0-2e=Zn+2 Это покрытие безопасное, поскольку разрушается металл,
2H++2e=H20предназначенный для защиты.
3.Оксидирование металлов. Существуют металлы, которые образуют тонкую,
эластичную, беспористую пленку с хорошей адгезией, т.е. плилипаемостью, как лаковая
пленка. И эта пленка оксида нацело защищает металл от разрушения, поскольку она
препятствует доступу кислорода к свежей поверхности металла. Такие металлы очень
устойчивы к коррозии:
Zn – ZnO, Cr – Cr2O3, Al – Al2O3, Ti – TiO2 и т.д.
4.Протекторная защита. Применяется в тех случаях, когда защищаемая конструкция
находится в среде электролита или морской, почвенной воде. Для этого в качестве
протектора используют специальный анод-протектор, с более отрицательным потенциалом,
т.е. более активный металл, который в первую очередь разрушается, защищая конструкцию.
Можно изменить коррозионную среду, вводя в электролит замедлители – ингибиторы
коррозии. Эти вещества сдвигая потенциал в ту или иную сторону, уменьшают скорость
коррозии. Например: альдегиды, нитриты, белки, гетероциклические соединения и т.д.
Ингибиторы могут замедлять коррозию в сотни и тысячи раз.
Основные понятия, которые необходимо знать после изучения материала
данных лекций: электродные потенциалы, водородный потенциал, гальванический элемент,
ряд напряжения металлов, электролиз, анод, катод, коррозия.
Вопросы для самоконтроля
1. Что такое коррозия металлов?
2. Кратко сформулируйте отличие электрохимической коррозии от химической?
3. Что такое катодный и анодный процессы в явлениях электрохимической коррозии?
4. Для каких металлов может представлять опасность щелочная среда? Почему?
5. Какова роль продуктов коррозии в коррозионных процессах? Приведите пример.
Рекомендуемая литература: 1. Кулажанов К.С., Сулейменова М.Ш.Неорганическая
химия,2012 с. 193-209;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 178- 198;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Модуль 6. Координационные соединения.
Лекция №12. Химическая связь.
1.Виды химических связей, характеристики и свойства связей.
2.Механизмы образования связей.
3.Типы взаимодействия молекул.
4.Водородная связь.
5.Метод ВС и метод МО.
1 Виды химических связей, характеристики и свойства связей.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 97 из 133
Мельчайшей частицей вещества является молекула, образующаяся в
результате взаимодействия атомов, между которыми действуют химические связи или
химическая связь. Учение о химической связи составляет основу теоретической химии.
Химическая связь возникает при взаимодействии двух (иногда более) атомов. Образование
связи происходит с выделением энергии.
Химическая связь – это взаимодействие, которое связывает отдельные
атомы в молекулы, ионы, кристаллы.
Химическая связь по своей природе едина: она имеет электростатическое
происхождение. Но в разнообразных химических соединениях химическая связь бывает
различного типа; наиболее важные типы химической связи – это ковалентная (неполярная,
полярная), ионная, металлическая. Разновидностями этих типов связи являются донорноакцепторная, водородная и др. Между атомами металлов возникает металлическая связь.
Химическая связь, осуществляемая за счет образования общей, или поделенной, пары
или нескольких пар электронов, называется ковалентной. В образование одной общей пары
электронов каждый атом вносит по одному электрону, т.е. участвует «в равной доле»
(Льюис, 1916 г.). Ниже приведены схемы образования химических связей в молекулах H2, F2,
NH3 и CH4. Электроны, принадлежащие различным атомам, обозначены различными
символами.
C
В результате образования химических связей каждый из атомов в молекуле имеет
устойчивую двух- и восьмиэлектронную конфигурацию.
При возникновении ковалентной связи происходит перекрывание электронных
облаков атомов с образованием молекулярного электронного облака, сопровождающееся
выигрышем энергии. Молекулярное электронное облако располагается между центрами
обоих ядер и обладает повышенной электронной плотностью по сравнению с плотностью
атомного электронного облака.
Осуществление ковалентной связи возможно лишь в случае антипараллельных
спинов неспаренных электронов, принадлежащих различным атомам. При параллельных
спинах электронов атомы не притягиваются, а отталкиваются: ковалентная связь не
осуществляется. Метод описания химической связи, образование которой связано с общей
электронной парой, называется методом валентных связей (МВС).
1.Ковалентная химическая связь образуется двумя электронами с
противоположно направленными спинами, причем эта электронная пара принадлежит двум
атомам.
2.Ковалентная связь тем прочнее, чем в большей степени перекрываются
взаимодействующие электронные облака.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 98 из 133
При
написании
структурных
формул
электронные
пары,
обусловливающие связь, часто изображаются черточками (вместо точек, изображающих
обобществленные электроны).
Важное значение имеет энергетическая характеристика химической связи. При
образовании химической связи общая энергия системы (молекулы) меньше энергии
составных частей (атомов), т.е. ЕABЕА+ЕB.
Валентность – это свойство атома химического элемента присоединять или замещать
определенное число атомов другого элемента. С этой точки зрения валентность атома проще
всего определять по числу атомов водорода, образующих с ним химические связи, или
числом атомов водорода, замещаемых атомом этого элемента.
С развитием квантовомеханических представлений об атоме валентность стали
определять числом неспаренных электронов, участвующих в образовании химических
связей. Кроме неспаренных электронов, валентность атома также зависит от числа пустых и
полностью заполненных орбиталей валентного электронного слоя.
Энергия связи – это энергия, которая выделяется при образовании молекулы из
атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это одна из
важнейших характеристик химической связи. Более устойчива та система, которая содержит
меньше энергии. Известно, например, что атомы водорода стремятся объединиться в
молекулу. Это означает, что система, состоящая из молекул Н2 содержит меньше энергии,
чем система, состоящая из такого же числа атомов Н, но не объединенных в молекулы.
Высокая энергия
Энергия
отталкивание
2
r0
0
Изолированные атомы
Есв
r
1
притяжение
Рис. 2.1 Зависимость потенциальной энергии Е системы из двух атомов водорода от
межъядерного расстояния r: 1 - при образовании химической связи; 2 – без ее образования.
На рисунке 2.1 показана энергетическая кривая, характерная для
взаимодействующих атомов водорода. Сближение атомов сопровождается выделением
энергии, которое будет тем больше, чем больше перекроются электронные облака. Однако в
обычных условиях, вследствие кулоновского отталкивания, невозможно достичь слияния
ядер двух атомов. Значит, на каком-то расстоянии вместо притяжения атомов, будет
происходить их отталкивание. Таким образом, расстояние между атомами r0, которому
отвечает минимум на энергетической кривой, будет соответствовать длине химической связи
(кривая 1). Если же спины электронов у взаимодействующих атомов водорода одинаковы, то
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 99 из 133
будет происходить их отталкивание (кривая 2). Энергия связи для различных атомов
изменяется в пределах 170–420 кДж/моль (40–100 ккал/моль).
Процесс перехода электрона на более высокий энергетический подуровень или
уровень (т.е. процесс возбуждения или распаривания, о котором говорилось ранее) требует
затраты энергии. При образовании химической связи происходит выделение энергии. Для
того, чтобы химическая связь была устойчивой, необходимо, чтобы увеличение энергии
атома за счет возбуждения было меньше энергии образующейся химической связи. Иными
словами, необходимо, чтобы затраты энергии на возбуждение атомов были
скомпенсированы выделением энергии за счет образования связи.
Химическая связь, кроме энергии связи, характеризуется длиной, кратностью и
полярностью. Для молекулы, состоящей более чем из двух атомов, существенными являются
величины углов между связями и полярность молекулы в целом.
Кратность связи определяется количеством электронных пар, связывающих два
атома. Так, в этане Н3С–СН3 связь между атомами углерода одинарная, в этилене Н2С=СН2 –
двойная, в ацетилене НССН – тройная. С увеличением кратности связи увеличивается
энергия связи: энергия связи
С–С составляет 339 кДж/моль, С=С - 611 кДж/моль и CC 833 кДж/моль.
Химическая связь между атомами обусловливается перекрыванием электронных
облаков. Если перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая
связь называется сигма-связью (σ-связь). Она может быть образована за счет двух sэлектронов, s- и p-электронов, двух px-электронов, s и d электронов (например d
):
(x2 z 2 )
Химическая связь, осуществляемая одной электронной парой,
называется одинарной. Одинарная связь – всегда σ-связь. Орбитали типа s могут
образовывать только σ-связи.
Связь двух атомов может осуществляться более чем одной парой электронов. Такая
связь называется кратной. Примером образования кратной связи может служить молекула
азота. В молекуле азота px-орбитали образуют одну σ-связь. При образовании связи pzорбиталями возникают две области
перекрывания – выше и ниже оси х:
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 100 из 133
Такая связь называется пи-связью (π-связь). Возникновение π-связи
между двумя атомами происходит только тогда, когда они уже связаны σ-связью. Вторую πсвязь в молекуле азота образуют ру-орбитали атомов. При образовании π-связей электронные
облака перекрываются меньше, чем в случае σ-связей. Вследствие этого π-связи, как
правило, менее прочны, чем σ-связи, образованные теми же атомными орбиталями.
р-орбитали могут образовывать как σ-, так и π-связи; в кратных связях одна из них
обязательно является σ-связью:
NσN.
Таким образом, в молекуле азота из трех связей одна - σ-связь и две - π-связи.
Длиной связи называется расстояние между ядрами связанных атомов. Длины связей
в различных соединениях имеют величины десятых долей нанометра. При увеличении
кратности длины связей уменьшаются: длины связей N–N , N=N и NN равны 0,145; 0,125 и
0,109 нм (10-9 м), а длины связей C-C, C=C и CC равны, соответственно, 0,154; 0,134 и
0,120 нм.
Между разными атомами чистая ковалентная связь может проявляться,
если
электроотрицаельность
(ЭО)1
атомов
одинакова.
Такие
молекулы
электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных
зарядов электронов совпадают в одной точке, поэтому их называют неполярными.
l=0
Если соединяющиеся атомы обладают различной ЭО, то электронное облако,
находящееся между ними, смещается из симметричного положения ближе к атому с большей
ЭО:
l1
Смещение электронного облака называется поляризацией. В
результате односторонней поляризации центры тяжести положительных и отрицательных
зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое
расстояние (l). Такие молекулы называются полярными или диполями, а связь между
атомами в них называется полярной.
Полярная связь – разновидность ковалентной связи, претерпевшей незначительную
одностороннюю поляризацию. Расстояние между «центрами тяжести» положительных и
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 101 из 133
отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше
поляризация, тем больше длина диполя и больше полярность молекул. Для оценки
полярности молекул обычно пользуются постоянным дипольным моментом (М р),
представляющим собой произведение величины элементарного электрического заряда (e) на
длину диполя (l), т.е.
M p el .
Дипольные моменты измеряют в дебаях Д (Д = 10-18 эл. ст. ед. см, т.к. элементарный
заряд равен 4,810-10 эл. ст. ед., а длина диполя в среднем равна расстоянию между двумя
ядрами атомов, т.е. 10-8 см) или кулонометрах (Клм) (1 Д = 3,33·10-30 Клм) (заряд электрона
1,6·10-19 Кл умноженный на расстояние между зарядами, например, 0,1 нм, тогда М р = 1,6·1019
110-10 = 1,6·10-29 Кл · м). Постоянные дипольные моменты молекул имеют значения от
нуля до 10 Д.
У неполярных молекул l= 0 и Мр = 0, т.е. они не обладают дипольным моментом. У
полярных молекул Мр> 0 и достигает значений 3,5 – 4,0 Д.
При очень большой разности ЭО у атомов имеет место явная односторонняя
поляризация: электронное облако связи максимально смещается в сторону атома с
наибольшей ЭО, атомы переходят в противоположно заряженные ионы и возникает ионная
молекула:
К+
l2
Ковалентная связь становится ионной. Электроасимметрия молекул возрастает, длина
диполя увеличивается, дипольный момент возрастает до 10 Д.
Суммарный дипольный момент сложной молекулы можно считать равным векторной
сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать
направленным от положительного конца диполя к отрицательному.
Предсказать полярность связи можно с помощью относительной ЭО атомов. Чем
больше разность относительных ЭО атомов, тем сильнее выражена полярность: ЭО = 0 –
неполярная ковалентная связь; ЭО = 0 – 2 – полярная ковалентная связь;ЭО = 2 – ионная
связь. Правильнее говорить о степени ионности связи, поскольку связи не бывают ионными
на 100%. Даже в соединении CsF связь ионная только на 89%.
Химическая связь, возникающая за счет перехода электронов от атома к атому,
называется ионной, а соответствующие молекулы химических соединений – ионными. Для
ионных соединений в твердом состоянии характерна ионная кристаллическая решетка. В
расплавленном и растворенном состоянии они проводят электрический ток, обладают
высокой температурой плавления и кипения и значительным дипольным моментом.
Если рассматривать соединения элементов какого-либо периода с одним и тем же
элементом, то по мере передвижения от начала к концу периода преимущественно ионный
характер связи сменяется на ковалентный. Например, у фторидов 2-го периода LiF, BeF2,
CF4, NF3, OF2, F2 степень ионности связи от фторида лития постепенно ослабевает и
заменяется типично ковалентной связью в молекуле фтора.
Таким образом, природа химической связи едина: принципиального различия в
механизме возникновения ковалентной полярной и ионной связей нет. Эти виды связи
отличаются лишь степенью поляризации электронного облака молекулы. Возникающие
молекулы отличаются длинами диполей и величинами постоянных дипольных моментов. В
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 102 из 133
химии значение дипольного момента очень велико. Как правило, чем больше дипольный
момент, тем выше реакционная способность молекул.
2.Механизмы образования связей.
В методе валентных связей различают обменный и донорно-акцепторный
механизмы образования химической связи.
Обменный механизм. К обменному механизму образования химической связи
относятся случаи, когда в образовании электронной пары от каждого атома участвует по
одному электрону.
В молекулах Н2, Li2, Na2 связи образуются за счет неспаренных s-электронов атомов.
В молекулах F2 и Cl2 – за счет неспаренных р-электронов. В молекулах HF и HCl связи
образуются s-электронами водорода и p-электронами галогенов.
Особенностью образования соединений по обменному механизму является
насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество
связей. Их число, в частности, зависит от количества неспаренных валентных электронов.
Принцип насыщаемости указывает на то, что устойчивым соединением должен быть
NH3, а не NH2, NH или NH4. Однако существуют молекулы, содержащие нечетное число
электронов, например, NO, NO2, ClO2. Все они характеризуются повышенной реакционной
способностью.
На отдельных стадиях химических реакций могут образовываться и валентно
ненасыщенные группы, которые называются радикалами, например, H, NH2, O, CH3.
Реакционная способность радикалов очень высока и поэтому время их существования, как
правило, мало.
Донорно-акцепторный механизм
Известно, что валентно насыщенные соединения аммиак NH3 и трифторид бора BF3
реагируют друг с другом по реакции
NH3 + BF3 = NH3BF3 + 171,4 кДж/моль.
Рассмотрим механизм этой реакции:
2s
2p
2s
2p
B*
+N
NH3
BF3
2s
2p
B*
F
F
F
N
H
H
H
F3B·NH3
Видно, что из четырех орбиталей бора три заселены, а одна - остается вакантной. В
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 103 из 133
молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному
механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона
которой принадлежат азоту. Такая электронная пара называется неподеленной электронной
парой. Образование соединения H3N·BF3 происходит за счет того, что неподеленная
электронная пара аммиака занимает вакантную орбиталь фторида бора. При этом
уменьшается потенциальная энергия системы и выделяется эквивалентное количество
энергии. Подобный механизм образования называют донорно-акцепторным, донором –
такой атом, который отдает свою электронную пару для образования связи (в данном случае
атом азота); а атом, который предоставляя вакантную орбиталь, принимает электронную
пару, называется акцептором (в данном случае атом бора). Донорно-акцепторная связь
является разновидностью ковалентной связи.
В соединении H3N·BF3 азот и бор – четырехвалентны. Атом азота повышает свою
валентность от 3 до 4 в результате использования неподеленной электронной пары для
образования дополнительной химической связи. Атом бора повышает валентность за счет
наличия у него свободной орбитали на валентном электронном уровне. Таким образом,
валентность элементов определяется не только числом неспаренных электронов, но и
наличием неподеленных электронных пар и свободных орбиталей на валентном электронном
уровне.
Более простым случаем образования химической связи по донорно-акцепторному
механизму является реакция аммиака с ионом водорода: NH3 H NH4 .
Роль
акцептора электронной пары играет пустая орбиталь иона водорода. В ионе аммония NH4+
атом азота четырехвалентен.
3 Типы взаимодействия молекул.
Важной характеристикой молекулы, состоящей более чем из двух
атомов, является ее геометрическая конфигурация. Она определяется взаимным
расположением атомных орбиталей, участвующих в образовании химических связей.
Перекрывание электронных облаков возможно только при определенной взаимной
ориентации электронных облаков; при этом область перекрывания располагается в
определенном направлении по отношению к взаимодействующим атомам.
При образовании ионной связи электрическое поле иона обладает сферической
симметрией и поэтому ионная связь не обладает направленностью и насыщаемостью.
NaCl
CsCl
к.ч. = 6
к.ч. = 6
Угол между связями в молекуле воды составляет 104,5о. Величину его можно
объяснить на основании квантово-механических представлений. Электронная схема атома
кислорода 2s22p4. Две неспаренные p-орбитали расположены под углом 90о друг к другу максимум перекрывания электронных облаков s-орбиталей атомов водорода с p-орбиталями
атома кислорода будет в том случае, если связи расположены под углом 90о. В молекуле
воды связь О – Н полярна. На атоме водорода эффективный положительный заряд δ +, на
атоме кислорода - δ-. Поэтому увеличение угла между связями до 104,5о объясняется
расталкиванием эффективных положительных зарядов атомов водорода, а также
электронных облаков.
Электроотрицательность серы значительно меньше, чем ЭО кислорода. Поэтому
полярность связи H –S в H2S меньше полярности связи Н–О в Н2О, а длина связи H–S (0,133
нм) больше, чем Н–О (0,56 нм) и угол между связями приближается к прямому. Для H2S он
составляет 92о, а для H2Se – 91o.
По этим же причинам молекула аммиака имеет пирамидальное строение и угол между
валентными связями H–N–H больше прямого (107,3о). При переходе от NH3 к PH3, AsH3 и
SbH3 углы между связями составляют соответственно 93,3о; 91,8о и 91,3о.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 104 из 133
Гибридизация атомных орбиталей
Возбужденный атом бериллия имеет конфигурацию 2s12p1, возбужденный атом бора 2s12p2 и возбужденный атом углерода - 2s12p3. Поэтому можно считать, что в образовании
химических связей могут участвовать не одинаковые, а различные атомные орбитали.
Например, в таких соединениях как BeCl2, BeCl3,CCl4 должны быть неравноценные по
прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более
прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные
условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих
центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны.
Объяснение этому дали Слейтер и Полинг. Они пришли к выводу, что различные орбитали,
не сильно отличающиеся по энергиям, образуют соответствующее число гибридных
орбиталей. Гибридные (смешанные) орбитали образуются из различных атомных орбиталей.
Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации.
Гибридные орбитали одинаковы по форме электронного облака и по энергии. По сравнению
с атомными орбиталями они более вытянуты в направлении образования химических связей
и поэтому обусловливают лучшее перекрывание электронных облаков.
Гибридизация атомных орбиталей требует затрат энергии, поэтому гибридные
орбитали в изолированном атоме неустойчивы и стремятся превратиться в чистые АО. При
образовании химических связей гибридные орбитали стабилизируются. Вследствие более
прочных связей, образованных гибридными орбиталями, из системы выделяется больше
энергии, и поэтому система становится более стабильной.
sp–гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и
Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем
энергетическом уровне s и p-неспаренные электроны. При образовании молекулы одна s- и
одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II)
линейны и обе связи имеют одинаковую длину.
sp2-гибридизация. В результате гибридизации одной s-орбитали и двух pорбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под
углом 120о друг к другу.
sp3-гибридизация характерна для соединений углерода. В результате
гибридизации одной s-орбитали и трех р-орбиталей образуются четыре гибридные sp3орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о.
Гибридизация проявляется в полной равноценности связей атома углерода с
другими атомами в соединениях, например, в CH4, CCl4, C(CH3)4 и др.
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp3d2-гибридизации образуется 6 равноценных облаков. Она наблюдается в таких
соединениях как [SiF6], [Fe(CN)6].
Представления о гибридизации дают возможность понять такие особенности строения
молекул, которые не могут быть объяснены другим способом.
Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в
направлении образования связи с другими атомами. В результате области перекрывания
гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи
увеличивается.
Поляризуемость и поляризующее действие ионов и молекул
В электрическом поле ион или молекула деформируются, т.е. в них происходит
относительное смещение ядер и электронов. Такая деформируемость ионов и молекул
называется поляризуемостью. Поскольку наименее прочно в атоме связаны электроны
внешнего слоя, то они испытывают смещение в первую очередь.
Поляризуемость анионов, как правило, значительно выше поляризуемости катионов.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 105 из 133
При одинаковой структуре электронных оболочек поляризуемость иона уменьшается
по
мере
увеличения
положительного
заряда,
например,
в
ряду:
2
3
4
F Ne Na Mg Al Si
Для ионов электронных аналогов поляризуемость увеличивается с ростом числа
электронных слоев, например: Li Na K Rb Cs или F Cl Br I .
Поляризуемость молекул определяется поляризуемостью входящих в них атомов,
геометрической конфигурацией, количеством и кратностью связей и др. Вывод об
относительной поляризуемости возможен лишь для аналогично построенных молекул,
различающихся одним атомом. В этом случае о различии в поляризуемости молекул можно
судить по различию в поляризуемости атомов.
Электрическое поле может быть создано как заряженным электродом, так и ионом.
Таким образом, ион сам может оказывать поляризующее действие (поляризацию) на другие
ионы или молекулы. Поляризующее действие иона возрастает с увеличением его заряда и
уменьшением радиуса.
Поляризующее действие анионов, как правило, значительно меньше, чем
поляризующее действие катионов. Это объясняется большими размерами анионов по
сравнению с катионами.
Молекулы обладают поляризующим действием в том случае, если они полярны;
поляризующее действие тем выше, чем больше дипольный момент молекулы.
Поляризующая способность увеличивается в ряду Li Na K Rb Cs , т.к.
радиусы увеличиваются и электрическое поле, создаваемое ионом, уменьшается.
4 Водородная связь.
Водородная связь является особым видом химической связи. Известно, что
соединения водорода с сильно электроотрицательными неметаллами, такими как F, О, N,
имеют аномально высокие температуры кипения. Если в ряду Н2Тe – H2Se – H2S температура
кипения закономерно уменьшается, то при переходе от H2S к Н2О наблюдается резкий
скачок к увеличению этой температуры. Такая же картина наблюдается и в ряду
галогенводородных кислот. Это свидетельствует о наличии специфического взаимодействия
между молекулами Н2О, молекулами HF. Такое взаимодействие должно затруднять отрыв
молекул друг от друга, т.е. уменьшать их летучесть, а, следовательно, повышать температуру
кипения соответствующих веществ. Вследствие большой разницы в ЭО химические связи
H–F, H–O, H–N сильно поляризованы. Поэтому атом водорода имеет положительный
эффективный заряд (δ+), а на атомах F, O и N находится избыток электронной плотности, и
они заряжены отрицательно (-). Вследствие кулоновского притяжения происходит
взаимодействие положительно заряженного атома водорода одной молекулы с
электроотрицательным атомом другой молекулы. Благодаря этому молекулы притягиваются
друг к другу (жирными точками обозначены
водородные связи).
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 106 из 133
Водородной называется такая связь, которая образуется посредством атома
водорода, входящего в состав одной из двух связанных частиц (молекул или ионов). Энергия
водородной связи (21–29 кДж/моль или 5–7 ккал/моль) приблизительно в 10 раз меньше
энергии обычной химической связи. И тем не менее, водородная связь обусловливает
существование в парах димерных молекул (Н2О)2, (HF)2 и муравьиной кислоты.
В ряду сочетаний атомов НF, HO, HN, HCl, HS энергия водородной связи падает. Она
также уменьшается с повышением температуры, поэтому вещества в парообразном
состоянии проявляют водородную связь лишь в незначительной степени; она характерна для
веществ в жидком и твердом состояниях. Такие вещества как вода, лед, жидкий аммиак,
органические кислоты, спирты и фенолы, ассоциированы в димеры, тримеры и полимеры. В
жидком состоянии наиболее устойчивы димеры.
5 Метод ВС и метод МО.
Ранее рассматривались связи, обусловливающие образование молекул из
атомов. Однако между молекулами также существует взаимодействие. Оно является
причиной конденсации газов и превращения их в жидкие и твердые тела. Первую
формулировку силам межмолекулярного взаимодействия дал в 1871 г. Ван-дер-Ваальс.
Поэтому они получили название вандерваальсовых сил. Силы межмолекулярного
взаимодействия можно подразделить на ориентационные, индукционные и
дисперсионные.
Полярные молекулы вследствие электростатического взаимодействия разноименных
концов диполей ориентируются с пространстве так, что отрицательные концы диполей
одних
молекул повернуты
к положительным концам диполей других молекул
(ориентационное межмолекулярное взаимодействие).
Энергия такого взаимодействия определяется электростатическим притяжением
двух диполей. Чем больше диполь, тем сильнее межмолекулярное притяжение (Н2О, HCl).
Тепловое движение молекул препятствует взаимной ориентации молекул, поэтому с
ростом температуры ориентационный эффект ослабевает.
Индукционное
взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно
обычно значительно слабее ориентационного.
Полярная молекула может увеличивать полярность соседней молекулы. Иными
словами, под влиянием диполя одной молекулы может увеличиваться диполь другой
молекулы, а неполярная молекула может стать полярной.
Дипольный момент, появляющийся в результате поляризации другой молекулой
или ионом, называется индуцированным дипольным моментом, а само явление – индукцией.
Таким образом, на ориентационное взаимодействие всегда должно накладываться
индукционное взаимодействие молекул.
В случае неполярных молекул (например, Н2, N2 или атомов благородных газов)
ориентационное и индукционное взаимодействие отсутствует. Однако известно, что водород,
азот и благородные газы сжигаются. Для объяснения этих фактов Лондон ввел понятие
дисперсионных сил межмолекулярного взаимодействия. Эти силы взаимодействуют
между любыми атомами и молекулами независимо от их строения.
В каждый данный момент времени направление диполей может быть иным.
Однако их согласованное возникновение обеспечивает слабые силы взаимодействия,
приводящие к образованию жидких и твердых тел. В частности, оно обусловливает переход
благородных газов при низких температурах в жидкое состояние.
Таким образом, наименьшей составляющей среди сил, действующих между
молекулами, является дисперсионное взаимодействие. Между молекулами с малой
полярностью или не имеющими полярности (CH4, H2, HI) действующими силами являются в
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 107 из 133
основном дисперсионные. Чем больше собственный дипольный момент молекул, тем больше
ориентационные силы взаимодействия между ними.
В ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением
размеров атомов, составляющих молекулы этих веществ. Например, в HCl на долю
дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, для НВr эта
величина составляет 95%, а для HI – 99,5%.
Метод молекулярных орбиталей (МО)
Метод ВС широко используется химиками. В рамках этого метода большая и сложная
молекула рассматривается как состоящая из отдельных двухцентровых и двухэлектронных
связей. Принимается, что электроны, обусловливающие химическую связь, локализованы
(расположены) между двумя атомами. К большинству молекул метод ВС может быть
применен с успехом. Однако имеется ряд молекул, к которым этот метод неприменим или
его выводы находятся в противоречии с опытом.
Установлено, что в ряде случаев определяющую роль в образовании химической
связи играют не электронные пары, а отдельные электроны. На возможность химической
связи при помощи одного электрона указывает существование иона Н 2 . При образовании
этого иона из атома водорода и иона водорода выделяется энергия в 255 кДж (61 ккал).
Таким образом, химическая связь в ионе Н 2 довольно прочная.
Если попробовать описать химическую связь в молекуле кислорода по методу ВС, то
придем к заключению, что, во-первых, она должна быть двойной (σ- и -связи), во-вторых, в
молекуле кислорода все электроны должны быть спарены, т.е. молекула О2 должна быть
диамагнитна. [У диамагнитных веществ атомы не обладают постоянным магнитным
моментом и вещество выталкивается из магнитного поля. Парамагнитным веществом
называется то, атомы которого или молекулы обладают магнитным моментом, и оно
обладает свойством втягиваться в магнитное поле]. Экспериментальные данные показывают,
что по энергии связь в молекуле кислорода действительно двойная, но молекула является не
диамагнитной, а парамагнитной. В ней имеется два неспаренных электрона. Метод ВС
бессилен объяснить это факт.
Наилучшим способом квантовомеханической трактовки химической связи в
настоящее время считается метод молекулярных орбиталей (МО). Однако он гораздо
сложнее метода ВС и не столь нагляден, как последний.
Метод МО рассматривает все электроны молекулы находящимися на молекулярных
орбиталях. В молекуле электрон находится на определенной МО, описываемой
соответствующей волновой функцией ψ.
Типы МО. Когда электрон одного атома при сближении попадает в сферу действия другого
атома, характер движения, а следовательно, и волновая функция
ψ АВ c1 ψ А c 2 ψ В ;
ψ АВ c 3 ψ А c 4 ψ В .
В простейшем графическом виде МО, как ЛКАО, можно получить, складывая или
вычитая волновые функции
АО могут образовывать МО, если энергии соответствующих АО близки по
величине и АО имеют одинаковую симметрию относительно оси связи.
Волновые функции, или орбитали, водорода 1s могут дать две линейные
комбинации – одну при сложении, другую - при вычитании
Когда волновые функции складываются, то в области перекрывания плотность
электронного облака, пропорциональная ψ2, становится больше, между ядрами атомов
создается избыточный отрицательный заряд и ядра атомов притягиваются к нему. МО,
полученная сложением волновых функций атомов водорода, называется связывающей.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 108 из 133
Если волновые функции вычитаются, то в области между ядрами атомов
плотность электронного облака становится равной нулю, электронное облако
«выталкивается» из области, находящейся между атомами. Образующаяся МО не может
связывать атомы и называется разрыхляющей.
Поскольку s-орбитали водорода образуют только σ-связь, то полученные МО
обозначаются σcв и σр. МО, образованные 1s-атомными орбиталями, обозначаются σcв1s и
σр1s.
На связывающей МО потенциальная (и полная) энергия электронов оказывается
меньше, чем на АО, а на разрыхляющей – больше. По абсолютной величине возрастание
энергии электронов на разрыхляющих орбиталях несколько больше уменьшения энергии на
связывающих орбиталях. Электрон, находящийся на связывающих орбиталях, обеспечивает
связь между атомами, стабилизируя молекулу, а электрон на разрыхляющей орбитали
дестабилизирует молекулу, т.е. связь между атомами ослабевает. Еразр. Есв.
МО образуются и из 2р-орбиталей одинаковой симметрии: связывающая и
разрыхляющая σ-орбитали из 2р-орбиталей, расположенных по оси х. Они обозначаются
σcв2р и σр2р. Связывающая и разрыхляющая -орбитали образуются из 2рz-орбиталей.
Обозначаются они соответственно πсв2рz, πp2pz. Аналогично образуются πсв2ру и πр2руорбитали.
Основные понятия, которые необходимо знать после изучения материала
данной лекции: ковалентная, ионная, водородная связи, полярная и неполярная связь,
гибридизация, сигма- и пи- связи, метод молекулярных орбиталей, связывающие и
разрыхляющие орбитали.
Вопросы для самоконтроля
1.
Какова причина возникновения межатомных связей?
2.
Что такое энергия связи? Каково значение этой характеристики для оценки свойств
соединений? Приведите примеры менее и более прочных связей.
3.
Какие связи называют полярными? Приведите примеры.
4.
Дайте характеристику различных типов межмолекулярных связей.
5.
Назовите отличительные черты неполярных, полярных и ионных веществ. Приведите
примеры.
Рекомендуемая литература: 1. Кулажанов К.С., Сулейменова М.Ш.Неорганическая
химия,2012 с. 70-86;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 54- 72;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Лекция 13. Комплексные соединения
1. Координационная теория Вернера
2. Природа химической связи в комплексных соединениях
3. Устойчивость комплексов
1. Строение комплексов раскрыл швейцарский ученый А.Вернер в 1893г. В молекулах
комплексных соединений выделяют центральный атом или ион М и непосредственно
связанных с ним n – молекул (или ионов) лигандов.
Центральный атом с окружающими его лигандами образуют внутренную сферу
комплекса, которая заключена в квадратные скобки; непосретственно не связанные другие
частицы образуют внешную сферу. Центральный атом координирует лиганды ,
геометрически правильно располагая их в пространстве. Поэтому комплексные соединение
часто называют координационными. Число n лигандов соответственно называется
координационным число. Наиболее прочные комплексы образуют переходные металлы. Для
жизнедеятельности человека особенно важны комплексные соединения марганца, цинка,
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 109 из 133
кобальта, меди, железа, молибдена. Амфотерные р-элементы алюминий, олова, свинец
также образуют различные комплексы.
2. Образование химической связи в комплексных соединениях может быть рассмотрено
как с позиций метода ВС, так и на основе метода МО. Согласно методу ВС при
взаимодействии с лигандами происходит возбуждение центрального атома или иона и
гибридизация его орбиталей.
Конфигурация валентной оболочки иона меди +2 в основном состоянии описывается
формулой 3d24s04p0 , поэтому имеются 4 свободные орбитали: 4s, 4px, 4py, 4pz . При
взаимодействии лигандами, напимер аммиаком , эти орбитали подвергаются гибридизации
sp3, в молекулах аммиака атом азота также находится в sp3 – гибридном состоянии. Три sp3
– АО азота используются для связи с атомами водорода. На четвертой sp3 – АО находится
неподеленная пара электронов. Таким образом четыре sp3 – АО азота с неподеленной парой
электронов перекрываются с 4 пустыми sp3 – АО иона меди. Образуются в соответствии с
методом ВС 4 равноценные двухэлектронные - связи: азот – ионы меди.
Поскольку атомы азота отдают пару электронов в «общие пользование», их называют
донорными атомами. Соответственно центральный ион меди(ІІ) используют электронную
пару азота для образования связи. Такой атом называют акцептором. Образующиеся
описанным способом химические связи называются донорно-акцепторными. Формула
комплекса меди CuSO44NH3 можно записать Cu(NH3)4SO4 .
4. В рассмотренном комплексном соединений лиганда – аммиак имеет один атом –
донор азот . Широко распространены ,особенно в живой природе , лиганды с
несколькими донорными атомами. Такие лиганды называют полидентатными. Для
определения устойчивости (прочности) комплексов определяют константы
устойчивости комплексов. Химическая связь между внешней и внутренней сферами
ионная, а связь внутренней сфере между центральным ионом и лигандами донорноакцепторная. Внутренняя сфера диссоцирует очень мало: Cu(NH3)42+ Cu2+ + 4
NH3 . На основе закона действующих масс определяют константу. Обратная величина
константе устойчивости называют константой нестойкости.
Основные понятия, которые необходимо знать после изучения материала данной
лекции: лиганды, комплексообразователь, внутренняя сфера, внешняя сфера,
координационное число, дентантность, катионный, анионный, нейтральный
комплексы, константа нестойкости.
Вопросы для самоконтроля:
1.Что такое комплексные соеднинения?
2.Как определяют координационное число?
3.Какая связь между внутренней и внешней сферами?
4.Какая связь между комплексбразователем и лигандами?
5.Применение комплексных соединений,
Рекомендуемая литература:
1. Кулажанов К.С., Сулейменова М.Ш.Неорганическая химия,2012 с. 92-104;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 198- 214;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Лекция №14,15. Общие свойства металлов и неметаллов
1. Расположение металлов и неметаллов в периодической системе
2. Физические и химические свойства металлов и неметаллов
1 Расположение металлов в периодической системе.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 110 из 133
Большинство химических элементов относится к металлам. В атомах металла внешние
электроны удерживаются значительно слабее, чем в атомах неметаллических элементов.
Металлы имеют низкие потенциалы ионизации и выступают в качестве восстановителей. В
соответствии с особенностями электронной структуры и положением в периодической
системе различают s,p,d,f-металлы. К s-металлам относятся элементы, у которых происходит
заполнение внешнего s-уровня, это элементы главных подгрупп 1 и 2 группы периодической
системы химических элементов Менделеева – щелочные и щелочноземельные металлы. Они
наиболее сильные восстановители среди металлов. К числу p-металлов относятся элементы 3
и 4 группы находящиеся в главных подгруппах и расположенные левее диагонали бор-астат.
Металлические свойства этих элементов выражены гораздо слабее. Металлы 4, 5, 6 групп
примыкающие к диагонали бор-астат являются типичными полупроводниками (то есть их
электронная проводимость с повышением температуры увеличивается). Характерная черта
этих элементов образование амфотерных гидроксидов. Наиболее многочисленны dэлементы. В периодической системе химических элементов они расположены между s и pэлементами и получили название переходных металлов. У атомов d-элементов происходит
достройка d-орбиталей. Каждое семейство состоит из 10 d-элементов. Известны 4dсемейства: 3d, 4d, 5d, 6d. Кроме скандия и цинка, все переходные металлы могут иметь
несколько степени окисления. Максимально возможная степень окисления d-металла +8
(Например, у осмия OsO4). С ростом порядкового номера максимальная степень окисления
возрастает от III группы до первого элемента VIII группы, а затем убывает. Эти элементы
типичные металлы. Элементы разных периодов с аналогичной электронной структурой dслоев образуют побочные подгруппы периодической системы (например, Cu-Ag-Au; Zn-CdHgи т.д.). Самая характерная особенность d-элементов исключительная способность к
комплексообразованию. Металлы с достраивающимися f-слоями образуют 2 группы очень
похожих между собой элементов – лантаноидов актиноидов. Каждое семейство f-элементов
состоит из 14 элементов. Лантаноиды (4f- элементы) называют редкоземельными
элементами из-за малой их распространенности и рассеянности в природе. В химическом
отношении они чрезвычайно похожи и могут быть разделены с очень большим трудом.
Типичная степень окисления лантаноидов +3. Среди актиноидов (5f-элементы) большинство
радиоактивные элементы. В виду энергетической близости 5f, 6d, 7s слоев актиноиды
способны проявлять несколько степеней окисления. Небольшое число металлов (Ag, Au, Pt,
Hg) встречаются в природе в свободном состоянии. Большинство металлов находятся в
природе в форме минералов и руд. Среди наиболее распространенных соединений металла
это оксиды, сульфиды, силикаты, карбонаты, сульфаты. В промышленности металлы
получают восстановлением соответствующих руд. Железы и сплавы на его основе
традиционно называют черными металлом. Медь, цинк, свинец и некоторые другие
относятся к цветным металлам. В жидком состоянии (расплаве) металлы полностью
сохраняют свои электрические и оптические свойства. В расплаве сохраняется примерно
такое же взаимное расположение атомов, как и в твердом состоянии. При нормальных
условиях все металлы твердые кристаллические вещества за исключением ртути – тяжелой
подвижной жидкости (tплавления = -39 0C). Многие металлы способны реагировать друг с
другом. Продукты взаимодействия металлов между собой относят к сплавам. Структура
сплавов во многом подобно струкуре чистых металлов. При плавлении и последующей
кристаллизации металлы способны образовывать либо химические соединения
(интерметалиты), либо твердые растворы. Ртуть с некоторыми металлами образует жидкие
сплавы, называемые омальгамами.
2 Физические и химические свойства металлов
Физические свойства металлов. К общим физическим свойствам металлов относятся
их высокая электрическая проводимость и теплопроводность, а также пластичность, т.е.
способность подвергаться деформации при обычных и при повышенных температурах, не
разрушаясь. Пластичность металлов имеет очень большое практическое значение. Благодаря
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 111 из 133
этому свойству металлы поддаются ковке, прокатке, вытягиванию в проволоку, штамповке.
Металлам также характерен металлический блеск.
Максимальную электрическую проводимость имеют серебро, медь, золото,
алюминий. Плотность металлов находится в периодической зависимости от порядкового
номера элемента. К легким (5 г/см3) относятся s-металлы и алюминий, скандий и титан,
минимальную плотность имеет литий (=5 г/см3), к тяжелым относятся в основном dметаллы 5-7 периодов. Максимальную плотность имеет осмий (=22,6 г/см3).
Температура плавления металлов также находится в периодической зависимости от
порядкового номера элемента. К легкоплавким относятся в основном s- и р-металлы, а также
d-металлы II группы. К тугоплавким (tпл выше 15000) принадлежат, в основном, d-металлы
IV-VIII групп.
Химические свойства металлов. Все металлы в свободном состоянии –
восстановители, в соединениях их степени окисления всегда положительны.
Восстановительная активность металла, т.е. его способность отдавать электроны
количественно характеризуется величиной энергии ионизации I и стандартным электродным
потенциалом 0: чем меньше I и чем отрицательнее 0, тем активнее металл.
Большинство ионов металлов, особенно d-элементов, образуют многочисленные
координационные соединения.
Основные типы химических реакций, в которые вступают металлы, можно
классифицировать следующим образом.
I. Реакции с участием атомов металлов. В этих реакциях металл всегда выступает в
роли восстановителя.
1. Реакции с неметаллами: кислородом, галогенами, серой, азотом. В результате
реакций образуются оксиды, галогениды, сульфиды, нитриды. Самые активные металлы – sэлементы вступают в реакцию с водородом, образуя гидриды.
2. Реакция с катионами других металлов, например:
Fe + Cu2+ = Cu + Fe2+
Возможность протекания таких реакций определяется относительным положением
металлов в ряду напряжений.
3. Реакция с кислотами. Хлороводородная и разбавленная серная кислоты могут быть
окислителями только за счет ионов Н+.
Zn + 2HCl = ZnCl2 + H2
С данными кислотами взаимодействуют только металлы, расположенные в ряду
напряжений до водорода.
Концентрированная серная кислота является окислителем за счет S 6+. В зависимости
от активности металла серная кислота восстанавливается до SO2 (Cu, Sn) или до H2S (Zn,
Mg).
Азотная кислота может быть окислителем только за счет N5+. В зависимости от
концентрации кислоты и активности металла продуктами восстановления могут быть NO 2,
NO, NH4NO3.
4. Реакция с водой. Взаимодействуют только s-элементы:
2Na + 2H2O = 2NaOH + H2
5. Реакция со щелочами. Металлы, гидроксиды которых обладают амфотерными
свойствами (Zn, Sn, Al, Be, Cr) со щелочами образуют гидроксокомплексы:
2Al + 6NaOH + 6H2O = 2Na3Al(OH)6 + 3H2
II. Реакции с участием одноатомных катионов.
1. Взаимодействие с катионами других металлов:
2Fe3+ + Sn2+ = 2Fe2++ Sn4+
Возможность
протекания
этой
окислительно-восстановительной
реакции
определяется соотношением окислительно-восстановительных потенциалов.
2. Реакция комплексообразования:
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 112 из 133
Ni2+ + 6NH4OH = Ni2+(NH3)62+ + 6H2O
3. Взаимодействие с молекулами растворителя. Это процессы гидратации, гидролиза,
образования оксоанионов и оксокатионов.
Вопросы для самоконтроля
1. Охарактеризуйте физические и химические свойства, характерные для всех металлов.
2. Напишите электронные формулы одноатомных катионов, образуемых магнием,
марганцем, цезием, железом, галлием, серебром.
3. Какой из перечисленных катионов может окислить железо до Fe2+:Sn2+, Ni2+, Cu2+, K+,
Al3+, Ag+.
4. Составьте уравнения реакций: а) окисления меди разбавленной и концентрированной
азотной кислотой; б) окисления цинка концентрированной серной кислотой; в)
взаимодействия олова с концентрированным раствором щелочи; г) восстановления
оксида меди(II) углем.
5. Почему явление комплексообразования для d-элементов характернее, чем для s- и pэлементов?
Рекомендуемая литература:
1. Кулажанов К.С., Сулейменова М.Ш.Неорганическая химия,2012 с. 209-226;
2. Глинка Н.С. Задачи и упражнения по общей химии,1988,с. 215- 255;
3. Угай Я.А. Общая и неорганическая химия, 1997, с.
Модуль 1.
3 ЛАБОРАТОРНЫЕ ЗАНЯТИЯ
Лабораторное занятие № 1. Химические свойства кислот, оснований, солей, оксидов
и их получения
Цель занятия: Изучить основные химические свойства классов неорганических
соединений
Оксиды
ОПЫТ №1
Получение оксидов непосредственным окислением элементов. Поместить
на металлическую ложечку кусочек серы и нагреть в пламени спиртовки. Как только сера
загорится внести ложечку в банку, не касаясь дна и стенок. Когда сера сгорит, ложечку
вынуть, в банку налить немного дистиллированной воды и взболтать. Испытать раствор
лакмусом. Написать уравнение реакции. Каков характер оксида? Сделайте вывод.
ОПЫТ №2 Получение оксидов разложением солей. В сухую пробирку поместить
немного основного карбоната меди ((СиОН)2С03). Держа пробирку в наклонном положении,
нагреть до полного разложения
соли. Какого цвета вещество остается? Что выделяется
на холодных стенках пробирки? Написать уравнение реакции. Сделайте вывод.
ОПЫТ №3 Получение оксидов разложением гидроксидов.
На раствор сульфата меди действуем избытком щелочи, получаем гидроксид
Полученный
осадок
нагреть.
реакции. Сделайте вывод.
ГИДРОКСИДЫ
меди.
Объяснить почернение осадка и написать уравнение
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 113 из 133
ОПЫТ №4 Взаимодействие с кислотами. В пробирку налейте несколько капель раствора
гидроксида натрия. Добавьте 1 -2 капли фенолфталеина, затем по каплям приливайте
раствор соляной кислоты. Что наблюдается? Напишите уравнение реакции. Сделайте
вывод.
К ислоты
ОПЫТ №5 Взаимодействие кислот с металлами. В пробирку с 3-4 мл. серной кислоты
(разб.) опустить кусочек цинка, пробирку нагреть до кипения. Что наблюдается? Написать
уравнение реакции. Сделайте вывод.
Соли
ОПЫТ №6 Взаимодействие двух различных солей. К 1 мл. раствора сульфата натрия
прилить 1 мл. раствора хлорида бария. Что наблюдается? Написать уравнение реакции.
Сделайте вывод.
Вопросы для самопроверки и защиты лабораторной работы:
1. Дайте определения с позиций теории электролитической диссоциации кислотам,
основаниям и солям.
2. Классифицируйте неорганические соединения по составу (бинарные и
многоэлементные) и по свойствам (функциональным признакам)
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 2
Определение эквивалентной массы металла
Цель работы: Определить эквиваленты активных металлов, способных вытеснять
водород из разбавленных кислот: магния, цинка, алюминия, хрома, марганца и др.
Определение эквивалента металла производится в приборе,
собранном из
двух бюреток (см. рисунок), закрепленных в лапках
штатива. Бюретки соединяют между собой резиновой
трубкой. Перед опытом бюретки заполняются водой так,
чтобы уровень воды был чуть ниже нулевого деления.
Собранный прибор проверяют на герметичность. Для этого
к бюретке присоединяют пробирку, а бюретку с открытым
концом опускают вниз на 15-20 см, если прибор
герметичен, то уровень в закрытой бюретке, после
незначительного понижения, остается без изменения.
Убедившись в герметичности прибора, бюретки
устанавливают так, чтобы вода в них была на одном уровне, и приступают к опыту.
В пробирку налить через воронку 4-5 мл разбавленной соляной кислоты /1:3/ и
добавить 3 капли раствора сульфата меди. Следите, чтобы верхняя часть пробирки была
сухой. Получите у лаборанта навески металла и запишите массу в лабораторную тетрадь.
Металл поместите в верхнюю часть пробирки (пробирку при этом держать возможно ближе к
горизонтальному положению). Закройте пробирку резиновой пробкой, слегка смоченной
водой, и снова проверьте герметичность прибора. Закрепите бюретки так, чтобы положение
воды в них было на одном уровне. Отметьте уровень воды в бюретке с пробиркой и
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 114 из 133
запишите в тетрадь. Чтобы правильно замерить уровень воды в бюретке, глаз наблюдателя
должен находится на одном уровне с нижним менисом воды.
Наклоните пробирку так, чтобы металл упал в кислоту. Выделяющийся газ при
воздействии металла с кислотой (водород) вытесняет воду из бюретки. Когда весь металл
растворится , отметьте уровень воды в бюретке с пробиркой и запишите его в таблицу.
Отметить показания барометра и термометра и записать их в тетрадь.
ФОРМА ЗАПИСИ
1. Масса металла ______________ m (г)
2. Уровень воды в бюретке с пробиркой:
а) до опыта V1_______________ (мл)
б) после опыта V2____________ (мл)
в) температура опыта t0________
Атмосферное давление Р aтм______(мм рт. ст.)
3. Давление насыщенного пара Р ПАР_____(мм рт. ст.)
ВЫЧИСЛЕНИЯ
1.
2.
3.
4.
Объем выделившегося водорода V, H2 = V2 –V1 (мл)
Абсолютная температура Т=273 + t0
Давление водорода РН 2 = Р aтм - РПАР (мм рт. ст.)
Объем эквивалента водорода при нормальных условиях:
V Н2 = 22,4л/2 = 11,2 л = 11200 (мл)
5. Объем выделившегося водорода, приведенный к нормальным условиям:
V0*P0 = V*P
Т0
Т
V0 = PH2 * VH2* 273 = PH2 * VH2
760* Т
2,78*Т
6. Эквивалентная масса металла:
M = V0
Эмет = m*Vэ H2 = m*11200
Эмет VэН2
V0
V0
7. Показав результаты преподавателю и узнав точное значение
эквивалентной массы металла, рассчитайте относительную ошибку опыта в процентах:
П = (Этеор.-Э эксп.).100%
Этеор.
Вопросы для самопроверки и защиты лабораторные работы:
1.. От чего зависит эквивалент химического элемента?
2. Как находят эквиваленты сложных веществ?
3. Что такое эквивалент и эквивалентная масса вещества?
4. Одинакова ли эквивалентная масса железа в хлоридах железа (ІІ, ІІІ)?
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 115 из 133
5. На нейтрализацию 25 мл соляной кислоты с титром 0,036 израсходовано 1,3 г соды, найти
эквивалент соды. Ответ: 53г/моль
Модуль 3
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №3
Определение энтальпии нейтрализации.
Цель занятия: Определение энтальпии реакции нейтрализации для
реакции нейтрализации:
Оборудование и реактивы:
1. Калориметр с мешалкой,
2. Термометр Бекмана или термометр с ценой деления 0,1°С
3. 2н. растворы: NaOН, КОН, HNO3, HC1, NH4OH, CH3COOH
4. Секундомер (таймер).
5. Мерные цилиндры на 50 мл для каждого раствора.
6. Технохимические (аптечные) весы с разновесами
Ход работы:
Упрошенный калориметр состоит из двух стаканов. В большой стакан вставляют
другой стакан меньшего размера. Стаканы не должны между собой соприкасаться Во
избежание потерь теплоты через стенки внутреннего стакана калориметра между ними
помещают прокладки, внутренний стакан закрывают крышкой с тремя отверстиями в
которые вставлены термометр {цена деления 0,1 оС}- мешалка и воронка для вливания
растворов. Выполняется 2 опыта с сильными электролитами и 1 со слабыми.
Взвесить внутренний калориметрический стакан на технохимических весах и налить в
него 50 мл 2 н. раствора щелочи, отметить температуру раствора с точностью до 0,1 °С (t°
шелочи ). Вставить внутренний стакан с раствором шелочи во внешний стакан, закрыть его
крышкой, в отверстие крышки поместить мешалку, термометр и воронку. Отмерить
цилиндром 50 мл 2 н. раствора кислоты и измерить его температуру ( кислоты).
При непрерывном помешивании быстро прилить через воронку раствор кислоты к раствору
щелочи, отметить самую высокую температуру раствора -1 и конечную, которую
показывает термометр после смешивания растворов. Вычислить среднюю температуру
растворов до реакций -t° начальную (среднее арифметическое из температур растворов
кислоты и щелочи), затем рассчитать разницу; t° = t° кон. – t0 нач
Принимая плотность раствора и его удельную теплоемкость равными единице, а
удельную теплоемкость стекла равной 0,18 кал/гград, вычисляют по формуле
q = ( t2 – t1) c количество выделившегося теплоты, где t2 и t1 конечная и начальная
температуры в калориметре; c – теплоемкость системы – сумма теплоемкостей
калориметрического сосуда и находящегося в нем вещества, равная c1m1 + c2m2 ; с1 и с2 удельные теплоемкости стекла и жидкости;
m1 и m2 – массы калориметрического
стакана и жидкости, находящейся в калориметрическом сосуде.
Для пересчета теплового эффекта на моль вещества пользуются формулой: H = qM/m,
где H – тепловой эффект, рассчитанный на моль; m – навеска вещества, взятого для
калориметрического опыта; М – молекулярная масса вещества. Тепловой эффект реакции
нейтрализации равен – 57кДж/моль, рассчитайте относительную ошибку опыта в процентах:
П = (H теор.- H эксп.)100%
Hтеор.
Вопросы для самопроверки и защиты лабораторной работы:
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 116 из 133
1. Что называется теплотой образования химического соединения?
2. Привести примеры применения закона Гесса для химических реакций, протекающих
через промежуточные стадии
3. Теплоты образования NO и NO2 равны соответственно +21,6 и 7,43 ккал. Будет ли
реакция 2NO + O2 = 2NO2 экзотермической или эндотермической и чему равен ее
тепловой эффект? Ответ:- 14,13 ккал.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №4
Химическая кинетика. Влияние температуры, катализатора и концентрации на скорость
реакции
Цель работы заключается в исследовании влияния различных факторов ( степени
измельчения веществ, концентрации и температуры) на скорость реакций
ОПЫТ 1. Влияние концентрации реагирующих веществ на скорость химических
реакций.
Зависимость скорости реакции от концентрации реагирующих веществ можно изучить
на примере реакции взаимодействия тиосульфата натрия Na2S2О3 и серной кислоты
при различных концентрациях тиосульфата натрия.
Na2S203 + H2S04 -> Na2S04 + S02 + H20 + S Скорость реакции измеряется временем от
начала смешивания растворов до появления мути во всех опытах / растворы серной кислоты
и тиосульфата натрия отмеряют разными цилиндрами /. В три химических стаканчика
налить: В 1-й - 5 мл тиосульфата натрия и 10 МЛ ВОДЫ / мерным цилиндром /. Во 2-ой - 10 МЛ
тиосульфата натрия и 5 МЛ ВОДЫ В 3-ю - 15 МЛ тиосульфата натрия и воды не добавлять.
Затем другим мерным цилиндром влить в каждый стаканчик по 10 мл серной кислоты.
Отметить, через какой промежуток времени появится муть в указанном стаканчике
Результаты записать в таблицу № 1.
№
пробир
ки
Объем, мл
Тиосульфат
натрия
Общий
Вода объем
а+б+в
1. 10
5
10
25
2.
10
10
5
25
3.
10
15
0
25
Кисло
та
Концен
трация,
С= б/
25
а+б+в
Время появл. Скорость
V= 1
мути (сек)
Начертить график зависимости скорости реакции от концентрации реагирующих веществ. На
оси абсцисс отложить в определенном масштабе условные концентрации тиосульфата
натрия (три точки, отстоящие от начала координата на С. 2С. ЗС). На оси ординат
соответсвующие им скорости в условных единицах. Линия, соединяющая верхние концы
перпендикуляров, будет выражать графическую зависимость реакции от концентрации.
ОПЫТ 2. Влияние температуры на скорость химической реакции.
При комнатной температуре налить в пробирку 5 мл раствора тиосульфата натрия и прилить
5 мл серной кислоты разными мерными цилиндрами. Отметить время появления мути. В две
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 117 из 133
другие пробирки налить по 5 мл раствора серной кислоты, 5 мл тиосульфата натрия и
поместить в водяную баню, где температура должна быть на 10 ° выше комнатной. Спустя 710 минут, не вынимая пробирки с тиосульфатом натрия из стакана с горячей водой добавить
в нее содержимое пробирки с серной кислотой, отметить время с момента сливания
растворов при помешивании до появления легкого помутнения (опалесценция). Повторить
опыт еще два раза, увеличивая температуру на 10 ° С. Сделать вывод о влиянии
температуры на скорость реакции.
Результаты записать в таблицу № 2.
№ опыта
Температура
раствора
Время до начала
появления мути
1.
T1
1
2.
T2
2
2
3.
T3
3
3
Температурный
коэффициент
1
Рассчитать температурный коэффициент скорости реакции.
Опыт 3. Уравновешивают на весах маленький кусочек мрамора (около 0,2г) и мрамора в
виде порошка. Приготовляют две пробирки с равным количеством раствора НСІ (около 1/3
пробирки). Одновременно стряхивают с бумажек кусочек в одну пробирку, порошок – в
другую. В какой из пробирок реакция протекает быстрее и почему?
Вопросы для самопроверки и защиты лабораторной работы:
1.Сформулируйте закон действия масс и рассмотрите его применение на каком либо
конкретном примере.
2. Какие реакции называются обратимыми?
3.Чем измеряется скорость химической реакции? Какие факторы влияют на скорость
реакции?
4.Что показывает температурный коэффициент скорости реакции?
5.Что такое энергия активации? Как она изменяется в присутствии катализатора?
6.В чем сущность гомогенного и гетерогенного катализа?
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 5
Химическое равновесие. Основные факторы влияющие на смещение равновесия
Цель работы: изучение влияние концентрации реагирующих веществ на химическое
равновесие
ОПЫТ 1. Влияние изменения концентрации реагирующих веществ на химическое
равновесие.
Реакция между хлоридом железа(ІІІ) и роданистым калием(или аммонием) протекает по
уравнению: FeCl3 + 3 KCNS = Fe(CNS)3 + 3KC1. Различная окраска исходных и
получающихся веществ дает возможность наблюдать смещение химического равновесия в
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 118 из 133
зависимости от концентрации веществ. В пробирку на 1/4 ее объема налить очень
разбавленного раствора хлорида железа (ІІІ) и прибавить равный объем очень разбавленного
раствора роданида калия. Затем, полученный раствор разбавить до цвета бледного чая и
разбить поровну в четыре пробирки.В первую добавить несколько капель
концентрированного раствора хлорида железа, во вторую концентрированного раствора
роданистого калия, в третью несколько капель кристалликов хлорида калия, а четвертую
оставить для сравнения. Объяснить результаты опыта, исходя из принципа Ле-Шателье.
Написать выражение константы химического равновесия данного процесса.
Вопросы для самопроверки и защиты лабораторной работы:
1. Что называется константой химического равновесия? От каких факторов она зависит?
2. В чем сущность принципа Ле Шателье?
3. В какую сторону сместится равновесие при понижении температуры и при увеличении
давления в системах: А. С + СО2 2СО; Б. 2NO2 N2O4 , H = - 56,9 кДж.
Напишите выражение константы равновесия для равновесных систем.
Модуль 4
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 6
Определение электропроводности растворов
электролитов. Электролитическая диссоциация
электролитов
Цель работы: определить силу электролитов по
электропроводности растворов электролитов
Согласно теории электролитической диссоциации, молекулы солей, кислот и оснований в
водном растворе распадаются на положительно и отрицательно заряженные ионы, поэтому они
пропускают электрический ток. Электропроводность электролитов зависет от числа ионов, на
которые распадаются электролиты.
Опыт 1. В мерных колбах на 50 мл приготовляют 0,1М растворы хлорида натрия, соляной
кислоты, гидроксида натрия, уксусной кислоты, раствора аммиака, ацетата натрия, хлорида
аммиака и измеряют электровроводность растворов. По яркости света лампы определяют силу
электролитов.
Опыт 2. Смешивают растворы аммиака и уксусной кислоты и измеряют электропроводность
полученной соли. Как отличается электропроводность раствора аммиака и уксусной кислоты от
электропроводности полученной соли при их смешивании?
Опыт 3. 0,1М растворы аммиака и уксусной кислоты разбавляют и получают 0,05М растворы
и сравнивают электропроводности растворов. Чем объясняется различие в
электропроводностях этих растворов?
Вопросы для самопроверки и защиты лабораторной работы:
1. Дать понятие концентрации раствора.
2. Что показывает: Массовая доля; Молярная концентрация; Молярная концентрация
эквивалента?
3. Определить весовое количество сульфата натрия для приготовления 100см3 0,1 М
раствора.
4. В 200см воды раствор или 20г нитрата калия. Определить массовую долю KN03 (%).
5. Что показывает титр раствора?
6. Перечислите известные вам сильные и слабые кислоты и основания.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 119 из 133
7. Объясните, почему соли слабых кислот являются, как правило, сильными электролитами.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 7
Гидролиз солей
Цель работы: Изучить влияние силы электролитов, температуры и разбавление на
степень гидролиза солей
ОПЫТ 1. Определение характера гидролиза при помощи универсальной индикаторной
бумаги .
Несколько полосок рН-индикаторной (универсальной) бумаги положите на
предметные стекла и на них поместите по 1-2 кристалла солей, указанных в
нижеследующей таблице, и смочите каплей дистилированной воды.
Испытуемая соль
Цвет индикаторной
бумаги
рН
Сульфат алюминия
Хлорид цинка
Карбонат натрия
Силицид натрия
Хлорид аммония
Хлорид калия
Одну полоску оставьте для сравнения. Полученные окраски сравните с цветной шкалой.
Результаты внесите в таблицу. Составьте уравнения гидролиза солей в молекулярной
и молекулярно-ионной форме. Объясните наблюдаемые изменения окраски рНиндикаторной бумаги.
ОПЫТ 2. Влияние температуры на степень гидролиза
В пробирку возьмите 2-3 капли раствора ацетата натрия и 1 каплю фенолфталеина и
нагрейте до кипения. Что наблюдаете? Составьте уравнение реакции гидролиза
ацетата натрия в молекулярной и молекулярно-ионной форме. Объясните, почему
окраска при нагревании усиливается, а при охлаждении ослабевает.
ОПЫТ З. Необратимый гидролиз.
Налейте в пробирку 4-5 капель раствора сульфата алюминия и столько же раствора
карбоната натрия (не перемешивать). Что происходит на границе раствора? Составьте
уравнение реакции в молекулярной и молекулярно-ионной формах.
ОПЫТ 4. Гидролиз кислых солей
В две пробирки налейте 2-3 мл раствора солей: в первую карбонат натрия, во вторую
гидрокарбонат натрия. В обе пробирки добавьте по 1-2 капли фенолфталеина. В какой
пробирке цвет изменяется больше? Какая соль гидролизуется больше, значит, в
каком растворе преобладают ионы ОН.почему? Напишите реакции гидролиза.
Вопросы для самопроверки и защиты лабораторной работы:
1. Показать на примере значения рН для водных растворов средней соли.
2. В каком случае водный раствор средней соли имеет кислую среду.
3. Покажите, как взаимосвязаны между собой рН, рОН.
4. Вычислите концентрацию инов водорода и рН среды, если концентрация гидроксид иона
равна 10-8 моль/л и определите характер среды.
Модуль 5
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 120 из 133
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 8
Окислительно-восстановительные реакции (ОВР)
Цель работы: Показать оксилительные и восстановительные свойства веществ, показать
влияние среды на ход протекания реакций
Опыт № 1. Окислительные свойства бихромата калия.
Налить в пробирку 1-2 мл бихромата калия (К2Сг207), добавить к нему около 1 мл
разбавленной серной кислоты (H2S04) и прилить равный объем раствора KI. Наблюдайте
пожелтение раствора вследствии выделение йода. Напишите уравнение ОВР.
Составьте электронные схемы, обозначив окислитель и восстановитель.
Опыт №2. Восстановительные свойства сульфата желез(ІІ)
Налить в пробирку 1-2 мл перманганатата калия (КМп04). добавить к нему около 2-х мл
разбавленной серной кислоты (H2S04) и прилить равный объем раствора FeS04. Наблюдайте
обесцвечивание раствора. Напишите уравнение ОВР. Составьте электронные схемы,
обозначив окислитель и восстановитель.
Опыт №3. Вытеснение меди из раствора
Налить в пробирку 3-4 мл сульфата меди (CuS04). Зачистить наждачной бумагой
железную гвоздь и опустить его в раствор CuS04 Наблюдайте появление
выделяемого медно-красного осадка на железном гвозде. Напишите уравнение ОВР.
Составьте электронные схемы, обозначив окислитель и восстановитель.
Опыт №4. Окислительные свойства марганцевогокислого калия в зависимости от
реакции среды.
A) реакция в кислой среде. Налейте в пробирку 1-2 мл раствора КМп04 и около
2 –х мл разбавленной серной кислоты. Прилейте раствор сернисто-кислого натрия Na2S03 и
наблюдайте полное обесцвечивание окраски вследствие образования MnS04. Составьте
уравнение реакции, пользуясь таблицей окислителей - восстановителей и принимая во
внимание, что Na2S03 окисляется в Na2S04.
Б) реакция в щелочной среде. Налейте в пробирку 1-2 мл раствора КМп04 и около 2-х мл
КОН. Прилейте раствор сернисто-кислого натрия Na2S03 и наблюдайте появление зеленой
окраски вследствие образования марганцовистого калия К2Мп04. Составьте уравнение
реакции.
B) реакция в нейтральной среде. Налейте в пробирку 1-2 мл раствора КМпО4 и прибавьте
около 2-х мл Н20. Прилейте раствор сернисто- кислого натрия Na2S03. Наблюдайте
выделение бурого осадка диоксида марганца - Мп02. Составьте уравнение реакции,
учитывая, что в число исходных веществ входит вода а в число продуктов реакциигидроксид калия, почему? До каких продуктов восстаноавливается КМп04 в
зависимости от реакции среды?
Вопросы для самопроверки и защиты лабораторной работы:
1. Приведите примеры, где элементы в молекулах могут быть только окислителем, только
восстановителем, и окислителем, и восстановителем.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 121 из 133
2. Дайте определение ОВР, окислитель, восстановитель, окисление, восстановление.
3. Назовите методы для уравнивания ОВР, покажите на примере реакции между соляной
кислотой и диоксидом марганца.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 9
Гальванический элемент
Цель работы: На основе таблицы окислительно-восстановительных
потенциалов составить гальванические элементы и рассчитать э.д.с.
Устройство для непосредственного преобразования энергии химической реакции в
электрическую энергию называется гальваническим элементом. Рассмотрим работу медноцинкового гальванического элемента. Элемент составлен из цинковой пластины,
погруженной в раствор сульфата цинка и медной пластины ,погруженной в раствор сульфата
меди. Оба раствора соприкасаются друг с другом. Рисунок: Схема медно-цинкового
гальванического элемента
Они разделены перегородкой из пористого материала, пропускающего сульфат-ионы. При
работе гальванического элемента протекает суммарная реакция:
Zn + CuSO4 = ZnS04 + Сu
Здесь процессы окисления и восстановления разделены в пространстве, и чтобы осуществить
процесс восстановления ионов меди, электроны от окислителя переходят по проводнику,
т.е. создают ток по внешней цепи. Цинковый электрод источник электронов, поступающих
во внешнюю цепь, принято называть отрицательным (анод), а медный электрод положительным (катод). Уравнения электродных процессов, протекающих при работе
гальванического элемента: анодный процесс, окисление:
Zn - 2ё = Zn
+2
катодный процесс, восстановление: Си + 2ё = Си °
Гальванический элемент можно записать в виде краткой электрохимической схемы:
А(-) Zn/ ZnS04// CuSO, /Cu
(+) К
2
2
А (-) Zn / Zn+ // Си+ / Си °
(+) К
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 122 из 133
где одна черта означает границу между электродами и раствором, две черты -границу
между растворами, в скобках знаки электродов, причем анод записывается слева, катод справа. Необходимое условие работы гальванического элемента -разность потенциалов
его электродов. Электрод с меньшим потенциалом является анодом. Электродвижущая сила
гальванического элемента (Э.Д.С.) - величина положительная и определяется как разность
потенциалов катода и анода.
Э.Д.С = ЕК-Еа
ХОД РАБОТЫ:
Опыт 1. Составление гальванических элементов.
Один из микростаканчиков заполнить I M раствором сульфата цинка, другой -I M
раствором сульфата меди. Соединить стаканчики электролитным мостиком, заполненным
насыщенным раствором хлорида калия в смеси с агар-агаром. Опустить в раствор сульфата
цинка узкую цинковую пластинку, а в раствор сульфата меди - медную. Соединить
электрическим проводом опущенные пластинки с гальванометром или другим
регистрирующим прибором. Наблюдать отклонение стрелки гальванометра, указывающее
на возникновение электрического тока.
Опыт 2. Составление концентрационного гальванического элемента. Наполнить
микростаканчики раствором сульфата цинка разной концентрации: первый стаканчик -1 M
ZnS04, второй - 0,01 M ZnS04.Соединить стаканчики электролитным мостиком. Опустить в
каждый стаканчик цинковые полоски и соединить их проводом с гальванометром.
Отклоняется ли стрелка гальванометра? Написать уравнения химических реакций,
протекающих на электродах гальванических элементов, и суммарное уравнение
химической реакции в результате которой возникает электрический ток в данном
элементе. В каком направлении перемещаются электроны во внешней цепи? Выписать
из приложения к лабораторному практикуму числовые значения стандартных
электродных потенциалов меди и цинка и вычислить ЭДС медно -цинкового
элемента.Какие ионы и в каком направлении перемещаются в растворе? Вычислить
ЭДС серебрянного концентрационного гальванического элемента. Представить
преподавателю отчет письменный на утверждение о проделанной работе.
Вопросы для самопроверки и защиты лабораторной работы:
1. Гальванический элемент (ГЭ) состоит из металлического цинка, погруженного в 0,1М
раствора нитрата цинка, и металлического свинца, погруженного в 0,02М раствора свинца.
Составьте схему ГЭ, запишите уравнения электродных процессов и вычислите
электродвижущую силу (ЭДС) этого процесса.
2. Дайте определение электродному потенциалу, водородному электроду, электродвижущей
силе, гальваническому элементу.
3. Никелевые пластины опущены в водные растворы солей: сульфата магния, хлорида
натрия, хлорида цинка, нитрата свинца. С какими солями никель будет реагировать?
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 10
Электролиз растворов
Цель работы: Записывать схему электродных процессовна катоде и аноде при электролизе
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 123 из 133
В электролизер с раствором КІ , NaCl опустите графитовые углероды и присоедините их к
источнику постоянного тока. В около катодное пространство прилейте несколько капель
фенолфталеина . Объясните изменение цвета раствора около катода и анода (в случае
электролиза КІ), а в случае элктролиза NaCl выделение газа у анода.
По окончании опыта анод промойте раствором тиосульфата натрия для удаления иода, а
затем дистиллированной водой. Иодные остатки слейте в специальную банку. В лабораторном
журнале нарисуйте электролизер, напишите уравнения электролиза.
Модуль 6
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №11
Комплексные соединения
Цель занятия: Изучить свойства комплексных соединений.
Опыт № 1. Получение комплексных солей
Налить в пробирку 2 мл
сульфата меди и по каплям прибавить
раствор аммиака.
Наблюдать образование
осадка основной соли меди (CuOH)2S04 . Написать
молекулярное и ионное уравнения реакции. К полученному осадку прилить избыток
раствора аммиака. Получается раствор,
содержащий
комплексный
ион
2+
[Cu(NH3)4] . .Написать молекулярное и ионное уравнение реакции образования комплексной
соли.
Опыт №2. Диссоциация железоаммониевых квасцов
Налить в три пробирки по 2 мл раствора железоаммониевых квасцов (NH4)2Fe2(S04)4 В одну
пробирку добавить несколько капель роданистого калия. Наличие какого иона в растворе взятой
соли указывает появление красно-бурой окраски. В другую пробирку добавить несколько
капель концентрированного раствора щелочи. Слегка нагреть. На наличие, какого иона
указывает запах аммиака. В третью пробирку добавить 1 мл раствора хлорида бария. Какое
вещество выпадает в осадок? На присутствие, какого иона в растворе указывает образование
этого осадка? Составить уравнение диссоциации железоаммониевых квасцов. Написать
молекулярные и ионные уравнения реакций, происходящих во всех трех пробирках. Какой
солью, двойной или комплексной является данная соль?
Опыт №3. Диссоциация гексациано - феррата (III) калия.
Налить в две пробирки по 2мл раствора красной кровяной соли K3[Fe (CN)6]. В одну из них
добавить несколько капель щелочи, в другую роданистого калия. Сравнить результаты
опытов №2 и №3 и указать, какой солью, двойной или комплексной является гексацианоферрат (III) калия. Составить уравнение диссоциации этой соли.
Опыт №4. Комплексные соединения в реакциях обмена
Налить в пробирку 1 мл раствора сернокислого железа (ІІ) и добавить несколько
капель раствора красной кровяной соли. Наблюдать образование осадка турнбулевой
сини Fe 3[Fe (CN)6] 2. Написать молекулярное и ионное уравнение реакции. Присутствие
каких ионов - железа определяется с помощью этой химической реакции.
Опыт №5. Устойчивость комплексных ионов
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 124 из 133
Реакцией обмена получить гидроксид меди (II), растворить его в избытке раствора
аммиака. К полученному аммиакату меди [Cu(NH3)4](OH)2 добавить раствор сульфида
натрия, записать константу нестойкости комплексного иона. Дать объяснение
происходящему процессу. Написать уравнения химических реакций.
Вопросы для контроля и самостоятельной работы
1. Определите заряд комплексного иона, координационное число и степень окисления
комплексообразователя в соединениях:
[Ag (N02)2] ;
Na3[Co(NO2)6]
2. Напишите выражения Кнест. для этих комплексных соединений.
3. Составьте координационные формулы следующих комплексных соединений кобальта:
СоС13 6NH3; CоCI3 5NH3; CоCI3 4NH3; Координационное число кобальта (III) равно шести.
Напишите уравнения диссоциации этих соединений в водных растворах.
Модуль 7
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 12
Общие свойства металлов. Элементы ІВ и ІІВ подгрупп
периодической системы, химические свойства металлов и их
соединений
Цель занятия: Ознакомление общими свойствами металлов и
свойствами элементов ІВ и ІІВ подгрупп и его соединений
Опыт №1. Взаимодействие цинка с кислотами
Возьмите 4 пробирки, опустите туда по кусочку металлического цинка и прилейте по 11,5 мл раствора: в первую разб. Н2S04, во вторую конц. Н2S04 , в третью разб. HN03 и в
последнюю конц. HN03. Пробирку с конц. раствором Н2SO4, нагрейте осторожно до кипения.
Наблюдайте выделение во всех пробирках газообразного вещества. Написать уравнение
реакции.
Опыт № 2. Взаимодействие меди с кислотами
Как и в предыдущем опыте возьмите 4 пробирку опустите по кусочку металлической
меди и прилейте в первую пробирку 1-1,5 мл разб. раствора Н2S04, во вторую конц. Н2S04, в
третью разб. раствора HNO3 в четвертую конц. раствора HN03. Нагрейте вещества
осторожно до кипения. В пробирках пойдут реакции. Какие вещества выделяются в
газообразном состоянии? Напишите уравнение реакций.
Опыт № 3. Взаимодействие металлов с солями.
Возьмите пробирку с 3-4 мл раствора сернокислой меди СuS04 и опустите туда 2
кусочка металлического цинка. Раствор нагрейте до кипения. В течении 3-4 минут, затем
сравните окраску раствора в пробирке и окраску раствора сернокислой меди в склянке. Какое
вещество выделяется в пробирке. Дайте объяснение. Напишите уравнение реакции.
Получение меди и свойства соединений меди
Оборудование и реактивы. Пробирки, штатив, спиртовка, тигель. Азотная, серная,
соляная кислоты, едкий натр. Сульфат меди, глицерин, глюкоза, аммиак.
Выполнение работы.
Опыт 1. Получение оксида меди (I).
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 125 из 133
Растворить 2,5г сульфата меди (II) в 5мл теплой воды и добавить 1,5г глюкозы. Нагреть
раствор и быстро прилить к нему 2,5мл 20% раствора гидроксида натрия. Смесь перемешать
и оставить стоять на 1 час. Выделившийся осадок промыть водой и сохранить для
следующего опыта. Написать уравнения реакции.
Опыт 2. Свойства оксида меди (I).
Оксид меди поместить в 4 пробирки. В первую пробирку прилить концентрированную
серную кислоту, нагреть. Во вторую пробирку прилить концентрированной соляной кислоты
до растворения появляющегося белого осадка. Раствор сохранить для следующего опыта.
Оксид меди в третьей и четвертой пробирке растворить в концентрированном растворе
аммиака. Одну из них оставить открытой, а другую закрыть пробкой, обе сильно встряхнуть.
Объяснить наблюдаемые явления. Написать уравнения реакций.
Опыт 3. Получение и свойства гидроксида меди (I).
К хлористоводородному раствору оксида меди (I) (из опыта 2) медленно по каплям, прилить
20%-ный раствор гидроксида натрия. Что наблюдается? Слить раствор с осадка и к осадку
добавить раствор аммиака. Что происходит? Написать уравнения реакции.
Опыт 4. Получение оксида меди (II).
К горячему раствору гидроксида натрия прилить горячий раствор сульфата меди. Смесь
нагревать в течение10-15 минут. Что наблюдается? Испытать отношение оксида меди к
разбавленным и концентрированным растворам кислот, а также гидроксиду натрия на
холоду и при нагревании.
Опыт 5. Получение и свойства гидроксида меди (II).
К раствору сульфата меди добавить 0,5мл глицерина, чтобы не произошло обезвоживание
гидроксида меди. Перемешивая раствор прилить гидроксид натрия. Полученный осадок
гидроксида меди разделить в несколько пробирок. Испытать отношение к соляной кислоте, к
концентрированной щелочи, к аммиаку, к нагреванию. Объяснить наблюдаемые явления.
Написать уравнения реакций.
Опыт 6. Гидролиз соли меди. Испытать раствор сульфата меди индикатором. Разбавить
раствор водой, нагреть до кипения и снова испытать индикатором. Написать уравнение
реакции гидролиза соли.
Опыт7. Получение комплексной аммиачной соли меди.
К раствору сульфата меди по каплям прилить раствор аммиака. Наблюдать образование
осадка. Затем прибавить избыток аммиака до растворения осадка. Написать уравнения
реакций.
Контрольные вопросы:
1. Как реагирует медь с кислотами?
2. При взаимодействии сульфата меди (II) с йодидом калия выпадает белый осадок йодида
меди (I). Напишите уравнение реакции. Чем объясняется неустойчивость йодида меди (II)?
3. Напишите уравнение реакции взаимодействия меди с цианистым калием.
4. Как можно в лаборатории получить медь?
Серебро и свойства соединений серебра
Оборудование и реактивы. Пробирки, штатив, спиртовка, фарфоровый стакан. Азотная,
серная, соляная кислоты, едкий натр, аммиак, формалин. Нитрат серебра, тиосульфат
натрия, хлорид натрия, бромид натрия, йодид натрия.
Выполнение работы.
Опыт 1. Получение оксида серебра.
Взять в пробирку 1мл нитрата серебра, прилить 1мл едкого натра. Испытать растворимость
осадка в азотной кислоте и аммиаке. Написать уравнение реакции.
Опыт 2. Получение галогенидов серебра.
В три пробирки взять раствора нитрата серебра. В одну прилить хлорид, в другую - бромид,
в третью – йодид натрия. Наблюдать образование осадков. Испытать действие на них
раствора аммиака, тиосульфата натрия, света. Написать уравнения реакций.
Опыт 3. Получение серебра из хлорида серебра.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 126 из 133
Поместить в фарфоровый стакан 1г хлорида серебра, 1,8мл 40%-ного раствора формалина и
прибавить при интенсивном перемешивании 2мл 30%-го раствора едкого натра.
Выделившееся серебро промыть разбавленным раствором серной кислоты, водой, раствором
аммиака, снова водой, высушить между листами фильтровальной бумаги.
Контрольные вопросы:
1. Какие степени окисления характерны для серебра?
2. Почему в фотографии применяется бромид серебра, а не йодид?
3. Какие известны соединения серебра в высшей степени окисления?
4. Растворяются ли бромид и йодид серебра в цианиде калия?
5. Почему йодид серебра не растворяется в аммиаке?
Цинк, кадмий, ртуть и свойства их соединений
Оборудование и реактивы. Пробирки, штатив, спиртовка, тигель. Азотная, серная,
соляная кислоты, едкий натрий. Цинк, сульфат цинка, нитрат кадмия, нитрат ртути, хлорид
олова, аммиак.
Выполнение работы.
Опыт 1. Растворение цинка в кислотах и щелочах.
Налить в пробирку 4-5 капель 2н. раствора серной кислоты, добавить 1 микрошпатель
цинковой пыли и слегка подогреть. То же проделать с концентрированной серной кислотой и
по запаху определить выделение сернистого газа. Почему разбавленная и концентрированная
серная кислота по разному реагирует с цинком? Написать уравнения реакций.
Опыт 2. Гидроксиды цинка и кадмия и их свойства.
Налить в две пробирки по 3-4 капли раствора соли цинка, в две другие – столько же раствора
соли кадмия. В каждую пробирку добавлять по каплям 2н. раствор едкой щелочи до
появления белых студенистых осадков гидроксидов. Испытать отношение полученных
гидроксидов к кислотам и щелочам. Написать уравнения реакций в молекулярной и
ионной форме. Объяснить различие в свойствах гидроксидов.
Опыт 3. Гидролиз солей цинка и кадмия.
Поместить в одну пробирку несколько кристалликов соли цинка, в другую -столько же соли
кадмия и растворить их в 1-2 каплях воды. Добавить в каждую пробирку по 2-3 капли
раствора лакмуса и слегка подогреть. В третью пробирку налить 2-3 капли раствора лакмуса
и 1-2 капли воды и сравнить цвет содержимого этой пробирки с окраской полученных
растворов. На какую реакцию среды указывает окраска лакмуса в растворах солей?
Написать в молекулярной и ионной форме уравнения процессов, вызывающих
изменение окраски лакмуса.
Опыт 4. Комплексные соединения цинка и кадмия.
Поместить в пробирку 1 каплю раствора соли цинка и добавить 2 капли 2 н. раствора
аммиака. Осадок, какого вещества образовался? К полученному осадку приливать по каплям
избыток раствора аммиака до растворения осадка. Тот же опыт проделать с раствором соли
кадмия.
Написать уравнения реакций, считая, что характерным координационным числом для
обоих ионов комплексообразователей является 4. Написать уравнения диссоциации
полученных комплексных соединений и комплексных ионов, а также выражения
констант их нестойкости.
Опыт 5. Окислительные свойства солей ртути.
Налить в пробирку 2 капли раствора нитрата ртути (II) и 3 капли 0,5 н. раствора хлорида
олова. Наблюдать после первой капли появление белого осадка каломели Hg2Cl2. Через 3-4
минуты осадок темнеет. Написать уравнения реакций.
Контрольные вопросы:
1..Написать уравнение реакций растворения цинка в кислотах: а) соляной, б) серной
(концентрированной и разбавленной), в) азотной (концентрированной и разбавленной), г)
щелочи.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 127 из 133
2. Какой из гидроксидов Zn(OH)2 или Cd(OH)2 должен проявлять, более основные свойства?
Ответ мотивировать.
3. Написать уравнения реакций, протекающих при добавлении к раствору, содержащему
ионы цинка, кадмия и ртути, а) избытка щелочи, б) избытка раствора аммиака.
4. Написать уравнение реакции растворения ртути в концентрированной азотной кислоте: а)
в избытке, б) в недостатке.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 13
Получение и свойства соединений элементов УІВ подгрупп . Хром и его соединения.
Цель занятия: Ознакомление со свойствами металлов подгруппы хрома.
Оборудование и реактивы. Пробирки, штатив, спиртовка. Азотная, серная, соляная
кислоты, едкий натрий, пероксид водорода. Сульфат хрома, иодид калия, карбонат натрия,
хлорид бария, нитрат свинца.
Выполнение работы.
Опыт 1. Получение и свойства гидроксида хрома (III)
Получить в двух пробирках малорастворимый гидроксид хрома (III) взаимодействием
раствора соли хрома (III) (3-4 капли) с 2н раствором щелочи (1-2 капли). Испытать
отношение гидроксида хрома к кислоте и к избытку щелочи, для чего добавлять в одну
пробирку по каплям 2н. раствор серной кислоты, в другую - 2н. раствор щелочи до
растворения осадка.
Написать уравнения реакций: а) получения гидроксида хрома(III), б) взаимодействия
гидроксида хрома (III) с кислотой и со щелочью. Сделать вывод о химическом (кислотноосновном) характере гидроксида хрома (III). Раствор, содержащий K3[Cr(OH)6]
сохранить для опыта 4.
Опыт 2. Гидролиз сульфата хрома(III)
Испытать действие сульфата хрома(III) на лакмус, для чего в пробирку с 3-5 каплями
раствора нейтрального лакмуса прибавить несколько кристалликов сульфата хрома до
изменения окраски лакмуса.
Написать в молекулярной и ионной форме уравнение реакции гидролиза. Как можно
ослабить гидролиз данной соли? Как усилить его?
Опыт 3. Совместный гидролиз сульфата хрома и карбоната натрия.
К 2-3 каплям раствора сульфата хрома (III) прибавлять по каплям карбонат натрия до
образования осадка Cr(OH)3. Отметить выделение газа.
Почему не получился карбонат хрома (III)? Какой выделялся газ? Написать
молекулярное и ионное уравнения реакции.
Опыт 4. Восстановительные свойства солей хрома(III)
К полученному в опыте 1 раствору K3[Cr(OH)6] добавить 1-2 капли щелочи и 3-5 капель 3%ного раствора пероксида водорода. Нагреть смесь на водяной бане до перехода зеленой
окраски в желтую, что указывает на образование в растворе хромата калия. Написать
уравнение окисления K3[Cr(OH)6] в K2CrO4.
Опыт 5. Переход хромата калия в дихромат.
К раствору хромата калия (3-4 капли) прибавлять по каплям 2н. раствор серной кислоты.
Отметить окраску взятого и полученного растворов и указать, какими ионами эти окраски
обусловливаются. Написать уравнение реакции. Почему полученная соль относится к
солям изополикислот?
Опыт 6. Переход дихромата калия в хромат.
К раствору дихромата калия (3-4 капли ) прибавлять по каплям раствор щелочи до изменения
окраски. Написать уравнения реакции.
Опыт 7. Получение хроматов бария, свинца.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 128 из 133
В три пробирки с раствором хромата калия (2-3 капли) прибавить по 2-3 капли растворов: в
первую – хлорида бария, во вторую – нитрата свинца. Отметить цвета осадков. Написать в
молекулярные и ионные уравнения реакций.
Опыт 8. Окисление иодида калия.
К подкисленному серной кислотой раствору дихромата калия (4-5 капель ) добавить 3-4
капли раствора иодида калия. Отметить изменение окраски. Доказать с помощью раствора
крахмала выделение свободного йода, для чего в пробирку с 5-6 каплями крахмала внести
одну каплю полученного в опыте раствора. Написать уравнение реакции.
Опыт 9. Окисление соляной кислоты.
К раствору дихромата калия (2-3 капли ) прибавить 10-12 капель концентрированной
соляной кислоты. Смесь нагреть до перехода оранжевой окраски в зеленую. Отметить
выделение газа. Как изменилась степень окисления хрома? Какой газ выделяется?
Написать уравнение реакции.
Контрольные вопросы:
1. Объясните, почему при действии растворов сульфида аммония и карбоната натрия на
раствор сульфата хрома (III) выпадают осадки одинакового состава? Напишите уравнения
реакций.
2. Почему аммиакаты хрома (III) получают не в водной среде?
3. Как изменяются окислительно-восстановительные свойства у хрома различной степени
окисления?
Свойства молибдена, вольфрама и их соединений
Оборудование и реактивы. Пробирки, штатив, спиртовка. Азотная, серная, соляная
кислоты, едкий натрий. Молибдат аммония, цинк, вольфрамат натрия, карбонат аммония,
метилоранж.
Выполнение работы.
Опыт 1. Молибденовая кислота и молибдаты.
А) К 2-3мл молибдата аммония прилить2-3мл азотной кислоты. Наблюдать образование
молибденовых кислот. Осадок разделить в две пробирки. В одну прилить избыток
концентрированной соляной кислоты, в другую – избыток 20%-го раствора едкого натра.
Написать уравнения реакции.
Б) Налить в стакан 5-10мл концентрированной соляной кислоты, прилить несколько капель
молибдата аммония и бросить кусочек цинка. Наблюдать бурное выделение водорода,
изменение окраски раствора от бесцветного через изумрудно-зеленый до краснокоричневого. Написать уравнения реакций.
Опыт 2. Вольфрамовая кислота и вольфраматы.
К 5мл5%-го раствора вольфрамата натрия прилить 2-3 капли концентрированной соляной
кислоты и нагреть до слабого кипения. Испытать отношение вольфрамовой кислоты к
растворам кислот и щелочей. Написать уравнения реакций.
Контрольные вопросы:
1. Как объяснить сходство химических и физических свойств молибдена и вольфрама?
2. Что называют молибденовой и вольфрамовой кислотами? Выделены ли они в свободном
состоянии?
3. Как относятся оксиды молибдена и вольфрама (VI) к воде, кислотам, щелочам?
4. Приведите примеры гетерополисоединений молибдена.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 14
Свойства марганца и его соединений
Цель занятия: Ознакомление со свойствами марганца и его соединений.
Оборудование и реактивы. Пробирки, штатив, спиртовка. Азотная, серная, соляная
кислоты, едкий натрий. Сульфат марганца, перманганат калия, пероксид водорода, бромная
вода, хромат калия, карбонат натрия, этиловый спирт.
Выполнение работы.
Опыт 1. Гидроксид марганца (II) и его свойства.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 129 из 133
В две пробирки внести по 3-4 капли раствора соли марганца (II) и по 2-3 капли 2н. раствора
щелочи. Каков цвет полученного осадка гидроксида марганца(II)? Размешать осадок
стеклянной палочкой и отметить его побурение вследствие окисления марганца(II) до
марганца (IV). Во вторую пробирку с осадком гидроксида марганца добавить 2-3 капли 2н.
раствора серной кислоты. Что наблюдается? Какие свойства характерны для гидроксида
Mn(II)?
Написать уравнения реакций.
Опыт 2. Получение некоторых малорастворимых солей марганца (II).
В двух пробирках получить: а) хромат марганца, б) карбонат марганца взаимодействием
хромата калия, карбоната натрия с сульфатом марганца(II). Растворы брать по 3-4 капли.
Отметить цвета осадков. Добавить к каждому осадку 2-4 капли 2н. раствора кислоты.
Сделать вывод о растворимости полученных солей марганца в кислой среде. Написать
уравнения реакций.
Опыт 3. Окисление соли марганца (II) бромом.
Внести в пробирку 2 капли раствора сульфата марганца(II) и 3 капли 2н. раствора едкого
натра. К полученному осадку гидроксида марганца добавить 5-6 капель бромной воды.
Отметить изменение цвета осадка вследствие образования соединения марганца (IV).
Написать уравнение реакции.
Опыт 4. Влияние рН среды на характер восстановления перманганата.
В три пробирки внести по 3-4 капли раствора перманганата калия. В одну пробирку добавить
2 капли 2н. раствора серной кислоты, в другую – столько же воды, в третью – 3-4 капли 2н.
раствора щелочи. Во все пробирки прибавить кристаллического сульфита натрия или калия.
Отметить различное изменение первоначальной окраски раствора перманганата в каждом
случае. Написать уравнения реакций.
Опыт 5. Окисление перманганатом калия сульфата марганца(II).
Внести в пробирку 3-4 капли раствора перманганата калия и столько же раствора сульфата
марганца. Отметить исчезновение фиолетовой окраски и образование бурого осадка.
Опустить в пробирку синюю лакмусовую бумажку. Какая среда в полученном растворе?
Написать уравнение реакции.
Опыт 6. Окисление перманганатом калия пероксида водорода.
В пробирку внести 3-5 капель раствора перманганата калия и 2-3 капли 2н. раствора серной
кислоты. Добавить 3-4 капли 10%-ного раствора пероксида водорода. Какой газ
выделяется? Как изменилась степень окисления марганца? Написать уравнение
реакции.
Опыт 7. Окисление перманганатом калия спирта в кислой и щелочной среде.
В две пробирки внести по 2-3 капли раствора перманганата калия. В одну пробирку добавить
2 капли 2н. раствора серной кислоты, в другую – столько же 2н. раствора щелочи. В
пробирку с подкисленным раствором перманганата калия добавить 3 капли этилового
спирта. Раствор подогреть маленьким пламенем горелки. Отметить изменение окраски. Как
изменилась степень окисления марганца?
В другую пробирку к щелочному раствору перманганата также добавить 3 капли этилового
спирта. Наблюдать постепенное восстановление перманганата сначала до манганата, а затем
до диоксида марганца. Отметить последовательность изменения окраски раствора. Написать
уравнения реакций: восстановления перманганата калия спиртом в кислой среде и
восстановления в щелочной среде сначала до манганата, а затем манганата – до диоксида
марганца, учитывая, что в каждом случае спирт окисляется в альдегид.
Контрольные вопросы:
1. Какое соединение марганца называют манганатом?
2. Как можно получить марганцовый ангидрид?
3. Сравните свойства кислородных соединений марганца.
4. Объясните, почему хлорная и марганцовая кислоты относятся к числу сильных кислот?
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 130 из 133
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 15
Свойства железа и его соединений
Цель занятия: Ознакомление со свойствами железа и его соединений.
Оборудование и реактивы. Пробирки, штатив, спиртовка. Азотная, серная, соляная
кислоты, едкий натрий. Соль Мора, хлорид железа, иодид калия, сульфит натрия, роданид
аммония, гексацианоферрат (III) калия, гексацианоферрат (II) калия.
Выполнение работы.
Опыт 1. Характерные реакции на ионы Fe 2+ и Fe 3+ .
Приготовить в пробирке раствор соли Мора и добавить 1 каплю раствора гексацианоферрата
(III) калия (красной кровяной соли K 3 [Fe(CN) 6]. Отметить цвет образовавшегося осадка.
Написать молекулярное и ионное уравнения реакции.
Опыт 2. Поместить в пробирку 2-3 капли раствора хлорида железа (III) и добавить 1 каплю
раствора гексацианоферрата (II) калия K 4[ Fe(CN) 6].
Отметить цвет образовавшегося осадка. Написать уравнение реакции в молекулярной
и ионной форме.
Опыт 3. Поместить в пробирку 5-6 капель раствора хлорида железа (III) и добавить 1 каплю
0,01 н. раствора роданида аммония (или калия). Такой же опыт проделать с раствором соли
Мора. Перенести 1 каплю полученного в первой пробирке раствора в другую пробирку и
добавить 8-10 капель воды.
Написать уравнение реакции. Чем объясняется ослабление окраски при разбавлении?
Опыт 4. Взаимодействие железа с кислотами.
В три пробирки внести по 5 капель 2н. растворов кислот: в первую – соляной, во вторую –
серной, в третью – азотной. В четвертую пробирку поместить 3 капли концентрированной
серной кислоты. В каждую пробирку поместить немного железных опилок или кусочек
железной стружки, после чего пробирку с концентрированной серной кислотой осторожно
нагреть. Наблюдать происходящие процессы. Затем в каждую пробирку прибавить по 1
капле 0,01 н. раствора роданида калия или аммония, которые с ионами Fe 3+ дают
характерную красную окраску соединения Fe(SCN)3. Убедиться в том, что в соляной и
разбавленной серной кислоте образуются ионы Fe 2+, а в азотной кислоте и
концентрированной серной кислоте ионы Fe 3+ . Написать уравнения проведенных
реакций. Чем объяснить , что при взаимодействии железа с серной кислотой различной
концентрации образуются соли железа в различной степени окисления?
Опыт 5. Гидроксид железа (II).
В пробирку с 3-4 каплями раствора соли Мора приливать 2 н. раствор щелочи до выпадения
зеленого осадка гидроксида железа (II). Перемешать полученный осадок стеклянной
палочкой и наблюдать через 1-2 минуты побурение осадка вследствие окисления гидроксида
железа(II) в гидроксид железа (III). Проверить опытным путем, как взаимодействует
свежеосажденный гидроксид железа (II) с 2н. раствором соляной кислоты. Какие свойства
проявляет в этой реакции гидроксид железа (II)? Написать уравнения реакций.
Опыт 6. Восстановительные свойства соединений железа (II).
Приготовить в двух цилиндрических пробирках раствор соли Мора. В одну из них добавить
1 каплю концентрированной азотной кислоты, подогреть раствор до прекращения выделения
газа и дать ему остыть. Затем в обе пробирки добавить по 1 капле 0,01 н. раствора роданида
аммония. В какой пробирке наблюдается красное окрашивание раствора и почему?
Написать уравнение реакции, считая, что азотная кислота восстанавливается
преимущественно до NO.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 131 из 133
Опыт 7. Гидроксид железа (III).
В две пробирки внести по 5-6 капель раствора хлорида железа(III) и добавить по 3-4 капли
2н. раствора щелочи. Что наблюдается? В одну пробирку добавить разбавленной кислоты
до растворения осадка, во второй пробирке проверить растворимость осадка в щелочи.
Написать уравнения реакций.
Опыт 8. Окисление иодида калия.
В пробирку с 3-4 каплями раствора FeCl3 добавить 1-2 капли раствора иодида калия. В какой
цвет и почему окрашивается раствор? Написать уравнение реакции.
Опыт 9. Окисление сульфита натрия.
В пробирку с 3-4 каплями раствора FeCl3 добавить несколько кристалликов сульфита натрия.
При этом вначале появляется буро-красное окрашивание вследствие образования
малоустойчивого сульфита железа (III), которое исчезает при нагревании. Написать
уравнение реакции окисления сульфита натрия хлоридом железа(III) учитывая, что в
реакции принимает участие вода.
Опыт 10. Гидролиз сульфата железа.
Поместить в пробирку 5-6 капель нейтрального раствора лакмуса и добавить соли Мора.
Размешать стеклянной палочкой. Установить по цвету лакмуса реакцию среды в полученном
растворе. Написать уравнение реакции гидролиза FeSO4.
Контрольные вопросы:
1. Как изменяются кислотно-основные свойства гидроксидов железа с изменением степени
окисления железа?
2. Чем объясняется уменьшение величин характерных степеней окисления при переходе от
железа к никелю?
3. Что такое ферриты? Как их получают, какими свойствами они обладают?
4. Как можно получить соединения железа (VI)? Как они называются и какими свойствами
они обладают?
Свойства кобальта, никеля и их соединений
Цель занятия: Ознакомление со свойствами кобальта, никеля и их соединений.
Оборудование и реактивы. Пробирки, штатив, спиртовка. Азотная, серная, соляная
кислоты, едкий натрий. Нитрат кобальта, нитрит калия, гидроксид аммония, пероксид
водорода, хлорид кальция, этиловый спирт.
Выполнение работы.
Опыт 1. Получение оксида кобальта (III)
Поместить в тигелек несколько кристаллов нитрата кобальта (II), поставить тигелек в
фарфоровый треугольник и осторожно нагревать слабым пламенем горелки до полного
прекращения выделения газообразных продуктов. После охлаждения тигля перенести
порошок в пробирку, добавить 2-3 капли концентрированной хлороводородной кислоты и
определить по запаху, какой газ выделяется.
Разложение нитрата кобальта (II) протекает по уравнению:
4 Cо(NO3)2 = 2Cо2O3 + 8NO2 + O2
Указать окислитель и восстановитель в этой реакции. Написать уравнение реакции
взаимодействия оксида кобальта (III) с концентрированной хлороводородной кислотой.
Какие свойства оксида кобальта (III) проявляются в этой реакции? Какой цвет имеет
полученный раствор?
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 132 из 133
Опыт 2. Получение гидроксида кобальта (II) и его окисление.
В две пробирки поместить по 2-3 капли раствора соли кобальта и добавлять по каплям
раствор едкой щелочи, сначала появляется синий осадок основной соли, который затем
становится розовым, что указывает на образование гидроксида кобальта (II). Осадок в одной
пробирке тщательно размешать стеклянной палочкой, а в другую прибавить 2-3 капли 3%ного раствора пероксида водорода. В какой из пробирок наблюдается окисление гидроксида
кобальта? Написать уравнения реакций.
Опыт 3. Аквакомплекс кобальта (II) и его разрушение.
В две пробирки поместить по 4-5 капель насыщенного раствора соли кобальта (II). В первую
пробирку добавить 2 капли концентрированной соляной кислоты, во вторую пробирку
внести небольшой кусочек предварительно прокаленного на асбестированной сетке хлорида
кальция. Что наблюдается? В третью пробирку поместить 1 микрошпатель соли кобальта и
3-4 капли этилового спирта, отметить цвет полученного раствора. Прибавить к раствору 7-8
капель воды до нового изменения окраски. Написать стеклянной палочкой, смоченной 0,02
н. раствором CоCl2 , какое-либо слово на фильтровальной бумаге. Подсушив бумагу,
поднести ее к пламени горелки и слегка подогреть, пока текст не станет видимым. Обратить
внимание на последующее обесцвечивание надписи при охлаждении. Изменение цвета
раствора во всех случаях объясняется тем, что непрочный комплексный ион [Co(H2O)6] 2+
сообщает раствору розовую окраску, а элементарный ион Co2+ - синюю.
Опыт 4. Получение комплексного роданида кобальта.
Поместить в пробирку 2 капли насыщенного раствора соли кобальта (II) и добавить 5-6
капель насыщенного раствора роданида аммония, учесть, что при этом образуется раствор
комплексной соли (NH4)2[Co(SCN)4] . Написать уравнение реакции.
Опыт 5. Получение амминокомплексов кобальта.
К 3-4 каплям раствора соли кобальта (II) прибавлять по каплям 25%-ный раствор аммиака до
выпадения осадка гидроксида кобальта (II) и его дальнейшего растворения вследствие
образования комплексного соединения, в котором кобальт имеет координационное число,
равное 6. Написать уравнения реакций.
Опыт 6. Получение нитритокомплекса кобальта.
Поместить в пробирку 3-4 капли насыщенного раствора соли кобальта (II) и 1 микрошпатель
кристаллического нитрита калия. Добавить 1-2 капли 2 н. раствора серной кислоты. Какой
газ выделяется ? Через несколько минут наблюдать выпадение осадка, отметить его
цвет.Написать уравнения реакций, учитывая, что нитрит калия в присутствии серной
кислоты окисляет кобальт (II) до кобальта (III), в результате чего образуется
нерастворимое комплексное соединение K3|Co(NO2)6| . Записать название полученного
комплексного соединения.
Опыт 7. Получение оксидов никеля.
Укрепить открытую стеклянную трубку в штативе горизонтально и поместить в нее 2
микрошпателя нитрата никеля (II). Нагревать трубку в том месте, где находится соль, слабым
пламенем горелки. Наблюдать образование черного оксида никеля (III) и убедиться в
выделении кислорода по вспыхиванию внесенной в трубку тлеющей лучинки. Нагревать
дальше полученный непрочный оксид никеля (III) до перехода его в устойчивый серозеленый оксид никеля (II). Дать трубке остыть, вытряхнуть из нее оксид никеля (II) на лист
бумаги и поместить несколько крупинок в пробирку. Добавить 2-3 капли 2н. раствора HCl и
слегка подогреть. Что наблюдается? Написать уравнения реакций:
Опыт 8. Получение гидроксида никеля (II) и его окисление.
УМКД 042-16-13.1.3 /03-2013
Редакция №1 от
.09.2013
стр. 133 из 133
В три пробирки поместить по 2-3 капли раствора соли никеля и добавлять по каплям
раствор едкой щелочи до выпадения осадка гидроксида никеля (II). В первой пробирке
осадок тщательно размешать стеклянной палочкой, во вторую добавить 2-3 капли 3%-ного
раствора пероксида водорода. Наблюдается ли изменение цвета осадка? Происходит ли
окисление гидроксида никеля (II кислородом воздуха и пероксидом водорода? В третью
пробирку прибавить 1 каплю бромной воды. Что наблюдается?
Написать уравнения реакций. Сравнить восстановительные свойства гидроксидов
железа, кобальта и никеля в степени окисления +2 по наблюдениям и при сравнении
стандартных окислительно-восстановительных потенциалов (при переходе в
гидроксиды этих элементов в степени окисления +3
Опыт 9. Получение амминокомплекса никеля.
Один микрошпатель соли никеля (II) растворить в 5 каплях воды. Добавить 5 капель 25%ного раствора аммиака. Как изменяется цвет раствора? Добавить к раствору 2-3 капли
раствора сульфида натрия. Что выпадает в осадок? Написать уравнения реакций:
Опыт 10 Получение гексааммино-никело(II) хлорида.
К раствору NiSO 4 прибавляют по каплям раствор аммиака. Наблюдают образование
зеленого осадка гидроксосульфата никеля. Приливают избыток раствора аммиака. Как
меняется цвет раствора? Напишите уравнения реакций по стадиям. Какой ион
определяет цвет раствора?
Опыт 11. Реактив на ион никеля – диметилглиоксим (реактив Чугаева)
Поместить в пробирку 5-6 капель воды, 2 капли раствора соли никеля и 1 каплю аммиачного
раствора диметилглиоксима. Реакция идет с образованием нерастворимого комплексного
диметилглиоксимата никеля, представляющего собой хелат. Благодаря интенсивной и яркой
окраске осадка (обратить внимание на цвет) эту реакцию используют для обнаружения очень
малой концентрации ионов никеля в растворе.
Контрольные вопросы:
1. Что происходит при взаимодействии гидроксидов кобальта (III) и и никеля (III) с
концентрированной соляной кислотой и с разбавленными серной и азотной кислотами?
Напишите уравнения реакций.
2. Как можно получить оксиды кобальта (III) и никеля (III)?
3. Напишите уравнение реакции: CoCl2 + KNO2 + CH3COOH → .
Почему реакцию
следует проводить в уксуснокислой среде?
4. Почему железо и никель могут образовывать одноядерные карбонилы, а кобальт таких
карбонилов не образует?