Галогены Презентация на тему Выполнила: ученица 9 класса
advertisement

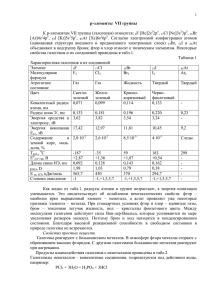
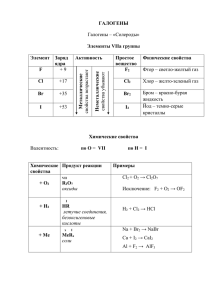
Презентация на тему: Галогены. Выполнила: ученица 9 класса Пашикян Кристина Биологическое значение и применение галогенов и их соединений. Характерные черты 1.Молекулы галогенов состоят из двух атомов . 2. Cтепень окисления -1. 3. Радиус атомов в подгруппе галогенов увеличивается от фтора к астату. 4.Окислительные свойства от фтора к астату уменьшаются. Биологическое значение галогенов. Йод(от греческого – Их применение. цвет фиалки, фиолетовый.) 1.Источником йода служат подземные воды. 2.Йод плохо растворяется в воде, значительно лучше – в спирте . 3.Спиртовой раствор йода широко применяют для дезинфекции небольших ран на коже. 4.Йод в нашем организме играет выдающуюся роль. Он обеспечивает нормальное функционирование щитовидной железы. 5.Йод применяют при глубокой очистке металлов, синтезе лекарств. Для определения его в йодистых металлах требуется предварительно выделить его. Это достигается множеством способов . Самое простое - нагревать йодистые металлы с солями окиси железа. FeCl + 2KJ = FeCl + 2KCl + J. Бром (Бром от греческого – зловоние.) 1.В 1825 г. французский химик А.Ж.Балар выделил бром из золы морских водорослей. 2.Бром – тяжелая темно-красная жидкость . образующая желтобурые пары с резким запахом, способные вызвать поражение дыхательных путей. 3.Бромид лития предотвращает коррозию в холодильных установках, помогает кондиционировать воздух. 4.красно-бурая жидкость. Ядовита. Поражает обонятельный нерв. Очень летуч, поэтому содержится в запаянных ампулах. В лаборатории бром можно получить взаимодействием бромидов с подходящим окислителем, например перманганатом калия или диоксидом марганца, в кислой среде. MnO2 + 2H2SO4 + 2NaBr = Br2 + MnSO4 + Na2SO4 2S + Br2 = S2Br2 2P + 3Br2 = 2PBr3 2Al + 3Br2 = 2AlBr3 Ni + Br2 = NiBr2 В твердом, жидком и газообразном состоянии бром существует в виде двухатомных молекул Br2. Элементный бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами и многими металлами, эти реакции зачастую сопровождаются воспламенением (например, с фосфором ,оловом,сурьмой) Хлор (от греческого – желтозеленый.) 1.Хлор в промышленности получают электролизом водного раствора хлорида натрия. 2.В лаборатории для получения хлора используют окисление концентрированной соляной кислоты сильными окислителями: 14HCl + K2Cr2O7 = 2CrCl3 + 2KCl + 3Cl2 + 7H2O. 3.Растворимость хлора в воде мала. 4.Впервые хлор был использован в медицине. Раствор CaCl(OCl) в воде – хлорная известь – рекомендовался как дезинфицирующее средство врачам и студентам-медикам при работе в моргах. 5.Хлором обеззараживают воду. 6.В цветной металлургии хлорированием руд извлекают из них некоторые металлы (титан, ниобий, тантал). На высоте 15–25 км над землей находится озоновый слой атмосферы, защищающий живые объекты от жесткого ультрафиолетового излучения. При попадании в атмосферу хлорсодержащие соединения диссоциируют под действием УФ-света с образованием атомов хлора, которые реагируют с озоном: • Cl + O3 = • ClO + O2. Cl2 + H2 → 2HCl 5Cl2 + 2P → 2PCl5 C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. 2S + Cl2 → S2Cl2 Хлор вытесняет бром и иод из их соединений с водородом и металлами: Cl2 + 2HBr → Br2 + 2HCl Cl2 + 2NaI → I2 + 2NaCl Фтор (от греческого phthoros – разрушение. ) 1.Он образует соединения со всеми химическими элементами. Фтор единственный реагирует и образует соединения с благородными металлами (золото, платина и др.), а также с инертными газами 2.Фтор – самый сильный окислитель. 3.Фтороводородная кислота слабая. Но это единственная кислота, способная реагировать со стеклом: 4HF + SiO2 = SiF4 + 2H2O. 2F2 + 2H2O → 4HF + O2 XeF8 → XeF6 + F2 MnF4 → MnF3 + 1/2 F2 Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например: Астат(по-гречески означает неустойчивый) 1.Этот элемент был предсказан Д.И.Менделеевым под названием экайода и стал вторым синтезированным элементом. 2.По своим свойствам астат похож и на йод, и на полоний, свинец – имеет выраженные металлические свойства. 3.Атомы всех изотопов самого тяжелого галогена очень неустойчивы. Конец. Спасибо за внимание.