p-элементы VII группы
advertisement
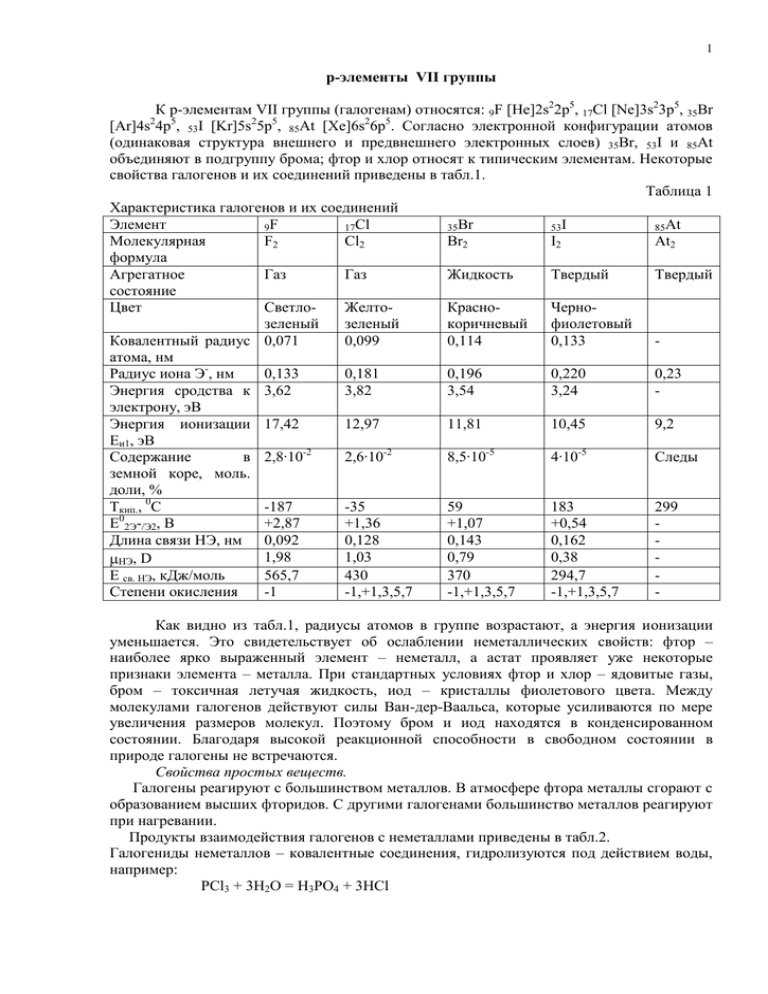
1 p-элементы VII группы К р-элементам VII группы (галогенам) относятся: 9F [He]2s22p5, 17Cl [Ne]3s23p5, 35Br [Ar]4s24p5, 53I [Kr]5s25p5, 85At [Xe]6s26p5. Согласно электронной конфигурации атомов (одинаковая структура внешнего и предвнешнего электронных слоев) 35Br, 53I и 85At объединяют в подгруппу брома; фтор и хлор относят к типическим элементам. Некоторые свойства галогенов и их соединений приведены в табл.1. Таблица 1 Характеристика галогенов и их соединений Элемент 9F 17Cl 35Br 53I 85At Молекулярная F2 Cl2 Br2 I2 At2 формула Агрегатное Газ Газ Жидкость Твердый Твердый состояние Цвет СветлоЖелтоКрасноЧернозеленый зеленый коричневый фиолетовый Ковалентный радиус 0,071 0,099 0,114 0,133 атома, нм Радиус иона Э-, нм 0,133 0,181 0,196 0,220 0,23 Энергия сродства к 3,62 3,82 3,54 3,24 электрону, эВ Энергия ионизации 17,42 12,97 11,81 10,45 9,2 Еи1, эВ Содержание в 2,8·10-2 2,6·10-2 8,5·10-5 4·10-5 Следы земной коре, моль. доли, % Tкип., 0С -187 -35 59 183 299 Е02Э-/Э2, В +2,87 +1,36 +1,07 +0,54 Длина связи НЭ, нм 0,092 0,128 0,143 0,162 1,98 1,03 0,79 0,38 НЭ, D Е св. НЭ, кДж/моль 565,7 430 370 294,7 Степени окисления -1 -1,+1,3,5,7 -1,+1,3,5,7 -1,+1,3,5,7 Как видно из табл.1, радиусы атомов в группе возрастают, а энергия ионизации уменьшается. Это свидетельствует об ослаблении неметаллических свойств: фтор – наиболее ярко выраженный элемент – неметалл, а астат проявляет уже некоторые признаки элемента – металла. При стандартных условиях фтор и хлор – ядовитые газы, бром – токсичная летучая жидкость, иод – кристаллы фиолетового цвета. Между молекулами галогенов действуют силы Ван-дер-Ваальса, которые усиливаются по мере увеличения размеров молекул. Поэтому бром и иод находятся в конденсированном состоянии. Благодаря высокой реакционной способности в свободном состоянии в природе галогены не встречаются. Свойства простых веществ. Галогены реагируют с большинством металлов. В атмосфере фтора металлы сгорают с образованием высших фторидов. С другими галогенами большинство металлов реагируют при нагревании. Продукты взаимодействия галогенов с неметаллами приведены в табл.2. Галогениды неметаллов – ковалентные соединения, гидролизуются под действием воды, например: PCl3 + 3H2O = H3PO4 + 3HCl 2 Таблица 2 Продукты взаимодействия галогенов с неметаллами Реагент Галоген H2 O2 S P C HF OF2 SF6, PF5 CF4 Фтор SF4 HCl Хлор Cl2O, ClO2, Cl2O6, Cl2O7 HBr Бром Иод HI I2O5 S2Cl2, SCl2, SCl4, SOCl2 Si SiF4 F2 - ClO2F3, ClO3F, ClOF3, ClO2F, ClOF5 BrF, BrF5, BrF3 IF7, IF5, PCl5, PCl3 CCl4 SiCl4 PBr3 CBr4 SiBr4 PI3 CI4 SiI4 Cl2 ClF, ClF3, ClF5 BrCl ICl3, ICl Взаимодействие с водой. Благодаря высокому электродному потенциалу фтор разлагает воду 2F2 + 2H2O = 4HF + O2 Другие галогены при взаимодействии с водой диспропорционируют, например: Cl2 + H2O = HCl + HClO Ослабление окислительной активности сказывается на уменьшении склонности брома и йода к реакциям диспропорционирования. Так, константа гидролиза реакции Э2 + Н2О НЭ + НЭО в ряду Cl2 – Br2 – I2 заметно уменьшается: 3·10-4, 4·10-9 и 5·10-23. Следовательно, равновесие реакции взаимодействия галогенов с водой при переходе от хлора к йоду все более смещается влево. Взаимодействие с растворами щелочей. При взаимодействии фтора с разбавленным раствором щелочи образуется дифторид кислорода: 2F2 + 2KOH = OF2 + 2KF + H2O При комнатной температуре хлор при взаимодействии со щелочами диспропорционирует по схеме: Cl2 + 2KOH = KCl + KClO + H2O Если вместо KOH взять Ca(OH)2, то в результате реакции получается двойная соль CaCl(OCl), называемая хлорной или белильной известью. При нагревании образуются хлорид и хлорат калия: 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O Аналогичным образом ведут себя бром и иод. Степень окисления фтора, как самого электроотрицательного элемента принимается равной -1. Максимальная валентность фтора, согласно теории ВС, как и у других элементов 2-го периода, равна 4. Из минералов фтора наибольшее значение имеют CaF2 – плавиковый шпат (флюорит), Na3AlF6 – криолит и Ca5(PO4)3F – фторапатит. Фтор исключительно химически активен. В атмосфере фтора горят такие стойкие вещества, как стекло (в виде ваты), вода: SiO2 + 2F2 = SiF4 + O2 , 2H2O + 2F2 = 4HF + O2 Фтор окисляет некоторые так называемые инертные газы Xe + 2F2 = XeF4; H = -252 кДж/моль. Непосредственно фтор не взаимодействует лишь с гелием, неоном и аргоном. В качестве материала аппаратуры для получения фтора, его хранения и перевозки используется 3 никель (и некоторые его сплавы), который устойчив к воздействию фтора за счет образования защитной пленки NiF2. Фтор получают электролизом его расплавленных соединений. Для этих целей обычно используют эвтектическую смесь HF – KF или фторогидрогенаты калия. Фтор широко применяется для синтеза различных хладагентов и полимерных материалов – фторопластов (тефлон), отличающихся высокой химической стойкостью. Жидкий фтор и ряд его соединений применяются в качестве окислителя ракетного топлива. В соответствие с закономерным изменением характера элементов по периодам и группам периодической системы изменяются и свойства фторидов, например: NaF MgF2 AlF3 SiF4 PF5 SF6 Химическая природа основная амфотерная кислотная 3Анионные комплексы AlF6 SiF62- PF6- SF6 Ионные фториды (проявляют основные свойства) – кристаллические вещества с высокой температурой плавления. Ковалентные фториды (проявляют кислотные свойства) – газы или жидкости. В реакции 2NaF + SiF4 = Na2[SiF6] ионный NaF выступает в качестве донора, а ковалентный SiF4 – в качестве акцептора электронных пар, носителем которых является F- ион. Основные фториды при гидролизе создают щелочную среду, а кислотные фториды – кислотную: NaF + H2O NaOH + HF; SiF4 + 3H2O H2SiO3 + 4HF Соединения с водородом типа HBF4, HPF6, H2SiF6 в свободном состоянии неустойчивы. Их водные растворы – очень сильные кислоты. HF обычно получают действием серной кислоты на флюорит: CaF2 + H2SO4 = CaSO4 + 2HF Характерной особенностью плавиковой кислоты (водного раствора HF) является ее способность взаимодействовать с SiO2: SiO2 + 4HF(раствор) = SiF4 + 2H2O(жидкая) Поэтому ее не хранят в стеклянной посуде, а обычно в сосудах из полиэтилена, каучука или парафина. Плавиковая кислота применяется для травления стекла, удаления песка с металлического литья, получения фторидов, в органическом синтезе и т.д. Хлор – типичный неметаллический элемент. Встречается он главным образом в виде хлоридов. Из них наиболее важными минералами являются NaCl – каменная соль, NaCl·KCl- сильвинит, KCl·MgCl2·6H2O – карналлит. В огромном количестве хлориды содержатся в морской воде, входят составной частью во все живые организмы. Молекула хлора подобно молекулам фтора и других галогенов двухатомна. Энергия ее диссоциации существенно выше, чем у остальных двухатомных молекул галагенов. Полагают, что в молекуле Cl2 существует дополнительное связывание по донорно-акцепторному механизму за счет неподеленной электронной пары одного атома хлора и свободной d-орбитали другого. Считается, что порядок связи в молекуле Cl2 составляет 1,12. Хлор – активный окислитель. Он энергично реагирует с металлами и большинством неметаллов (за исключением O2, N2 и инертных газов), легко окисляет многие сложные соединения. Восстановительные свойства хлор проявляет лишь при взаимодействии с фтором. Получают свободный хлор окислением хлоридов: в лаборатории – химическим окислением концентрированной соляной кислоты, например: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O, в технике – электролизом водного раствора NaCl и как побочный продукт – при получении натрия электролизом расплава NaCl. Хлор применяют для стерилизации питьевой воды, широко используют в качестве окислителя в самых разнообразных отраслях химической промышленности. 4 Основные хлориды, бромиды и иодиды (см. выше основные и кислотные фториды) гидролизу практически не подвергаются, а кислотные гидролизуются полностью и необратимо с образованием кислот: SiCl4 + 3H2О = H2SiO3 + 4HCl BBr3 + 3H2O = H3BrO3 + 3HBr PI3 + 3H2O = H3PO3 + 3HI Различие свойств хлоридов, а также бромидов и иодидов, разного типа (основные и кислотные) проявляется также в реакциях их между собой, например: KCl + AlCl3 =K[AlCl4], 2KI + HgI2 = K2[HgI4]. При этом основные галогениды (за счет ионов Cl-) являются донорами, а кислотные – акцепторами электронных пар. Амфотерные хлориды (например, BeCl2, AlCl3) взаимодействуют как с кислотными, так и с основными соединениями. Бром обычно сопутствует хлору в его калийных минералах. Бром и иод встречаются в морской воде и нефтяных буровых водах, откуда их главным образом и добывают. Ничтожные количества астата обнаружены в продуктах естественного радиоактивного распада урана и тория. Растворимость галогенов в воде сравнительно мала. При охлаждении водных растворов выделяются кристаллогидраты клатратного типа Э2·8Н2О. Галогены лучше растворяются в органических растворителях (спирт, бензол, эфир, сероуглерод и др.). Этим пользуются для извлечения Br2 и I2 из различных смесей. Об уменьшении окислительной активности молекул галогенов с увеличением порядкового номера элемента свидетельствует сопоставлении их стандартных электродных потенциалов (табл. 1). Напротив, восстановительная активность в ряду Br2 – I2 - At2 заметно повышается. Йод, например, окисляется концентрированной азотной кислотой: 3I2 + 10HNO3(кон.) = 6HIO3 + 10NO +2H2O. Окислительная способность брома и йода широко используется в различных синтезах и для анализа веществ. Йод применяется как антисептическое и кровоостанавливающее средство. Бром и йод получают, окисляя бромиды и иодиды, например, по реакции 2NaЭ + MnO2 + 2H2SO4 = Э2 + MnSO4 + Na2SO4 + 2H2O. При получении брома в качестве окислителя часто используют хлор: 2KBr + Cl2 = 2KCl + Br2








