ЭЛЕКТРОЛИЗ А.К. Галиакбарова, учитель химии МОБУ Краснохолмская СОШ №1 МР Калтасинский район РБ
advertisement

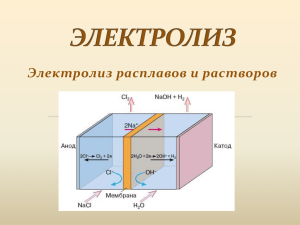
ЭЛЕКТРОЛИЗ А.К. Галиакбарова, учитель химии МОБУ Краснохолмская СОШ №1 МР Калтасинский район РБ Цели урока • изучить сущность процесса электролиза; • сформировать умение определять процессы, происходящие на электродах, составлять суммарное уравнение реакции электролиза; • углубить знания об окислительно-восстановительных процессах, сформировать понимание практического значение электролиза в природе и жизни человека; • продолжить развитие интеллектуальных (умение анализировать, сравнивать, делать выводы) и практических умений учащихся, их познавательного интереса; • воспитывать культуру общения через работу в парах «ученик-ученик», «ученик-учитель», воспитывать личностные качества: наблюдательность, внимательность, доброжелательность и требовательность друг к другу. Ответьте на вопросы 1) Какие процессы называются окислительновосстановительными? 2) Что такое электрический ток? 3) Какие вещества называются электролитами, неэлектролитами? 4) Приведите примеры неэлектролитов, сильных и слабых электролитов. 5) Дайте определение электролитической диссоциации? Какие бывают ионы? 6) Напишите уравнение диссоциации 𝑯𝟐 SO4,𝑯𝟐 S, NaOH, CuCl2. 7) Что собой представляет катод, и какие процессы происходят на катоде? 8) Что собой представляет анод, и какие процессы происходят на аноде? Электролиз - окислительновосстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор СХЕМА ЭЛЕКТРОЛИЗА ЭЛЕКТРОЛИЗ РАСПЛАВА И РАСТВОРА ХЛОРИДА НАТРИЯ Катодные процессы: - не зависит от материала катода - зависит от положения катиона металла в электрохимическом ряду напряжений I группа II группа Li+ Rb+ K+ Cs2+ Ba2+ Sr2+ Na2+ Mg2+ Be2+ Al3+Mn2+ III группа Cr2+ Zn2+ Fe2+ Co2+ Ni2+ Cu2+ Ag+ Hg2+ Pt2+ Sn2+ Au+ Men+ +n e→ Me0 Восстанавливаются катионы металлов: Катионы металлов не восстанавливаются. n+ Me + n e →Me0 Восстанавливаются 2H O+2e→2OH +H 0↑ 2 2 молекулы воды: + + 2e →H 0↑ 2H 2 2H2O + 2e → 2OH +H2 ↑ - 0 параллельные процессы! Молекулы воды не восстанавливаютс я! Анодные процессы: зависят от материала анода: - если анод растворимый, (Fe, Cu, Ag и др.), независимо от природы аниона идет окисление металла анода: Me0 → Me+ - если анод нерастворимый, т.е. инертный (графит, уголь, Pt, Au) то результаты зависят от анионов кислотных остатков I группа - – II группа 3- F MnO4 PO4 CO32 - NO3- SO42 Анионы оксокислот не окисляются. Окисляются молекулы воды. 2H2O - 4 e →O20↑ + 4H+ ОН4 ОН- - 4 е →О20 ↑+ 2Н2О (в щелочной среде) 2H2O - 4 e→O20↑ + 4H+ (в кислой и нейтральной средах ) III группа Cl – Br – J – S 2 – R COO – Окисляются анионы кислотных остатков: 2 Cl – - 2e→ Cl20 ↑ 2 Br – - 2e→ Br20 2 J – - 2e→ J20↓ S2 – - 2e→ S0↓ 2R COO – - 2e →R – R + 2 CO2 ↑ Молекулы воды не СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА СУЛЬФАТА МЕДИ(II) Применение электролиза: • В электрометаллургии. Для получения металлов (Al, Na, Mg, Cd). • В химической промышленности для получения водорода, галогенов, щелочей. • Для очистки металлов, рафинирование (Cu, Ni, Pb). • В гальваностегии – покрытие одних металлов другими для защиты от коррозии (цинкование, алитирование, лужение, хромирование, никелирование, золочение). • В гальванопластике- получении металлических копий. Графический диктант. 1) Электролиз – это окислительновосстановительный процесс; 2) Катод – отрицательно заряженный электрод; 3) На катоде происходит процесс электрохимического окисления; 4) Анион SO42 – будет окисляться на аноде в водном растворе; 5) Анион Cl – будет окисляться на аноде в водном растворе; 6) Катион Na + будет восстанавливаться на катоде в водном растворе; 7) Катион Cu2 + будет восстанавливаться на катоде в водном растворе; 8) При электролизе раствора NaCl можно получить щелочь NaOH и газы H2 и Cl2. Проверьте ответы: 1. Да 2. Да 3. Нет 4. Нет 5. Да 6. Нет 7. Да 8. Да Оцените работу: нет ошибок - «5», 1 ошибка«4», 2 ошибки- «3» Тест 1. Расплав какого вещества подвержен электролизу? а – хлорид кальция б – парафин в - глюкоза г - азот 2. Что следует подвергнуть электролизу для получения хлора? а - хлорную воду б - раствор хлората калия в - расплав хлорида калия г - хлор электролизом не получают 3. Цвет лакмуса в околокатодном пространстве при электролизе раствора бромида натрия а - малиновый б – фиолетовый в - красный г - синий 4. Какое вещество нельзя получить при электролизе раствора поваренной соли? а - Na б - H2 в - Cl2 г - NaOH 5. При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется а - Zn б - O2 в - H2 г - SO2 6. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить а - выделение NO2 б – образование меди в - выделение O2 г растворение анода В) расплав хлорида калия НАЗАД А) хлорид кальция назад Г) синий НАЗАД А) Na НАЗАД Б) О2 НАЗАД Б) образование меди НАЗАД Домашнее задание § 19 1.Подготовить слайд-плакат по теме: «Применение электролиза» 2.Составить схемы электролиза растворов: 1-й ряд - AgNO3, 2-й ряд - CaBr2, 3-й ряд FeSO4 3.Решить задачу*: Вычислить объём выделившегося газа при электролизе раствора нитрата серебра, содержащего 12 г соли. Использованные ресурсы • • • • http://kristallikov.net/page33.html http://dic.academic.ru/dic.nsf/bse/153557/%D0%AD% D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0% BE%D0%BB%D0%B8%D0%B7 http://him.1september.ru/2008/12/43.htm http://school-collection.edu.ru/catalog/rubr/d05469af69bd-11dbbd130800200c9c11/?interface=catalog&class[]=54&s ubject[]=31