Методическая разработка учебного занятия по химии в 11
advertisement
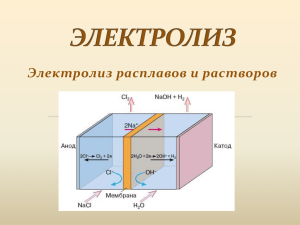
Методическая разработка учебного занятия по химии в 11 классе по теме «Электролиз». Автор Вильдяскина Е С. – учитель химии МОУ Макарьевская СОШ Цель: Освоение понятий «электролиз», «анод», «катод», формирование знаний об основных отличиях процессов электролиза расплавов и растворов солей. Овладение умениями составлять уравнения реакций электролиза расплавов и растворов. Развитие познавательных интересов о применении электролиза на промышленных предприятиях в Красноярском крае. Тип занятия: Изучение нового Форма занятия: Школьная лекция Структура Этап урока Орг момент Актуализация знаний Изучение нового Задача Деятельность учителя учащихся Мотивация на Предлагает ин- Слушают, делапредстоящую формацию о РУ- ют выводы и деятельность САЛе ставят цель на урок Выведение в ак- Предлагает вы- Работают в тивное состояние полнить задание группах опорных знаний: в группах ОВР, степень окисления, окисОрганизует об- Обсуждают релитель, восстасуждение вы- зультаты выполновитель, окисполненного ненного задания ление, восстановление, анионы – анод, катионы – катод. Освоение поня- - в форме крат- Слушают, смоттий «электро- кого выступле- рят видеосюжет, лиз», «анод», ния вводит в те- делают записи в «катод», форми- му и дает уста- тетради, Методы Рассказ, беседа Способы организации Фронтальный Средства Слайд презентации Самостоятельная Групповой работа Карточки с заданиями Беседа или дис- Фронтальный куссия (по ситуации) Доска -Рассказ, демон- Фронтальный страция видео Слайды презентации, видеосюжет, рабочие тетради рование знаний об основных отличиях процессов электролиза расплавов и растворов солей. Закрепление изученного новку на дальнейшую деятельность - организует дея- -работают тельность в группах группах в - работа с разными источниками информации Групповой, парный или индивидуальный (в зависимости от запросов обучающихся) - представитель Фронтальный от каждой группы выступает у доски Рассказ учителя Фронтальный с элементами беседы и постановкой проблемных вопросов - организует об- - представляют суждение результаты работы в группах по заданию -объясняет сущ- Слушают, смотность процесса рят слайды, деэлектролиза рас- лают записи в плавов и раство- рабочей тетради ров солей, обращает внимание на отличие между ними. Осмысление и Проводит корот- Работают с те- Тестирование, Фронтальный запоминание но- кое тестирование стами как первичный вого. Овладение контроль умениями составлять уравнения реакций электролиза расплавов и растворов. Энциклопедия по химии, словари химических терминов, диск «Общая химия», Интернет Рабочие тетради учащихся Слайды, доска, таблица «Электролиз расплава и раствора хлорида натрия», рабочие тетради Тестовые ния зада- Подведение итогов. Рефлексия Осмысление Организует прособственной дея- цесс рефлексии тельности по достижению поставленной цели, соотношение поставленной цели с полученным результатом На основе полу- Самоконтроль ченных результатов планируют ДЗ и определяют дальнейший план работы по изучаемой теме ПРИЛОЖЕНИЕ Задание для постановки учебной задачи на этапе актуализации: Найти лишнее: CuO + H2 SO4 = CuSO4 + H2O CuCl2 = Cu +Cl2 CuCl2 + 2 NaOH = 2NaCl + Cu(OH) 2 CuCl2 + AgNO3 = AgCl +Cu(NO3) 2 Подборка заданий для проведения урока 1. Окислительные свойства серная кислота проявляет в реакции, схема которой: 1) H2SO4 + NH3 → NH4HSO4 2) H2SO4 + KOH → K2SO4 + H2O 3) H2SO4 + P → H3PO4+ SO2 4) H2SO4 + P2O5 → HPO3 + SO3 Индивидуальный 2. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора. ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ А) CuCl2 1) водород Б) AgNO3 2) кислород В) K2S 3) металл Г) NaBr 4) галоген 5) сера 6) азот Ответ: В3 3311 3. Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в ней восстано- вителем. 1) 2) 3) 4) СХЕМА РЕАКЦИИ Si + C SiC NO2 + Mg MgO + N2 SO2 + O2 SO3 NO2 + SO2 SO3 + NO А) Б) В) Г) Д) Е) ВОССТАНОВИТЕЛЬ Si C Mg NO2 SO2 O2 4. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах. 1) 2) 3) 4) ФОРМУЛЫ ВЕЩЕСТВ CaCl2 Fe(NO3)3 K2SO4 FeCl3 А) Б) В) Г) ПРОДУКТЫ ЭЛЕКТРОЛИЗА Ca, O2 , Cl2 Fe, H2, Cl2 K, H2, SO3 Fe, H2, O2 Д) H2, Cl2 Е) H2, O2 5. Восстановительные свойства железо проявляет в реакции: 1) 2) 3) 4) FeO + H2SO4 = FeSO4 + H2O Fe(OH)2 + 2HCl = FeCl2 + 2H2O 2FeCl2 + Cl2 = 2FeCl3 FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl 6. Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его водного раствора. А) Б) В) Г) ФОРМУЛА ВЕЩЕСТВА AlCl3 RbOH Hg(NO3)2 AuCl3 1) 2) 3) 4) 5) 6) ПРОДУКТ ЭЛЕКТРОЛИЗА алюминий рубидий ртуть водород кислород золото 7. Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его водного раствора. ФОРМУЛА ВЕЩЕСТВА ПРОДУКТ ЭЛЕКТРОЛИЗА А) Cu(NO3)2 1) металл Б) AgNO3 2) водород В) СaCl2 3) кислород Г) Na2SO4 4) хлор 5) оксид серы (IV) 6) оксид азота (IV) 8. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора сульфата натрия на инертных электродах. Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: Записаны уравнения реакций, протекающие: 1) на катоде: 2H2O + 2e = H2 + 2OH– 2) на аноде: 2H2O – 4e = O2 + 4H+ 3) Составлено общее уравнение электролиза: 2H2O = 2H2 + O2 Ответ правильный и полный, включает все названные выше элементы Правильно записаны только два из названных выше элементов ответа Правильно записан один из названных выше элементов ответа Все элементы ответа записаны неверно Максимальный балл Баллы 3 2 1 0 3 Задачи по теме «Электролиз» 1. При электролизе водных растворов каких веществ происходит разложение воды на кислород и водород? NaCl, CuSO4 , Na 2SO4 , AgNO3 , KNO3 2. При электролизе водных растворов каких веществ происходит разложение воды на кислород и водород? NaOH, MgSO4 , MgCl2 , CH3 COOH Na, KOH 3. При электролизе какого вещества на катодене происходит выделения водорода? NaCl, СuCl2, NaOH, НCl. 4. Металл, который может быть полученпри электролизе водного раствора его соли – это … а) натрий, б) барий, в) кальций, г) медь 5. Металл, который не может быть полученпри электролизе водного раствора его соли – это … а) цинк, б) калий, в) свинец, г) серебро 6. При электролизе водного растворасульфата меди (II) с инетрным электродом на аноде происходит: а) осаждение меди б) выделение водорода в) выделение кислорода, г) окисление сульфат-ионов 7. Электролиз водного раствора поваренной соли- это способ одновременного получения: а) натрия и кислорода б) натрия, хлора и водорода в) гидроксида натрия, хлора и кислорода г) гидроксида натрия, хлора и водорода 8. Можно ли получить металлический калий при электролизе водного раствора гидроксида калия? Почему? 9. Составьте уравнение электролиза водного раствора иодида калия. Будет ли изменяться окраска раствора крахмала при добавлении его в анодное пространство? 10. Из чего нужно сделать катод и аноддля проведения процесса рафинирования меди? Составьте схему электролиза. 11. Иодид натрия рапрлавили и подвергли элекролизу с инертными электродами. На катоде образовался натрий массой 13,8 г. Вычислите массу вещества, которое выделилось при этом на аноде. 12. Медь получают электолизом водного раствора сульфата меди (II) с инетрными электродами.при этом на аноде выделился кислород объемом 448 л (н.у.). Рассчитайте массу меди, полученной на катоде. 13. При электролизе расплава хлорида кальция на аноде был получен хлор объемом 112 л (н.у.), а на катоде - кальций массой 180 г. Считая, что массовая доля выхода хлора равна 100%, определите массовую долю выхода кальция.