47. Уравнение состояния идеального газа
advertisement

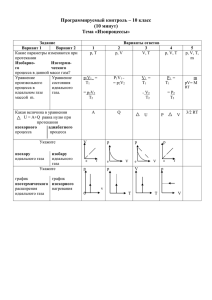
Уравнение состояния идеального газа Уравнение состояния идеального газа 𝑃 = 𝑛𝑘𝑇 𝑁 𝑃 = 𝑘𝑇 𝑉 𝑃𝑉 = 𝜈𝑁𝐴 𝑘𝑇 𝑁 𝑛= 𝑉 𝑁 = 𝜈𝑁𝐴 𝑚 𝜈= 𝑀 𝑚 𝑃𝑉 = 𝑁𝐴 𝑘𝑇 𝑀 𝑃 𝑇 Дж 𝑁𝐴 𝑘 = 𝑅 = 8,31 моль ∙ К 𝑅 — универсальная газовая постоянная. Уравнение состояния идеального газа: 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 𝑉 Уравнение Клапейрона Бенуа Клапейрон 1799 — 1864 Проводил исследования, посвященные теплоте и пластичности тел. В 1834ом году вывел уравнение состояния идеального газа для постоянной массы: 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 при 𝑚 = 𝑐𝑜𝑛𝑠𝑡 Уравнение Менделеева-Клапейрона Дмитрий Менделеев 1834 — 1907 Провёл важнейшие исследования, посвященные теории газов. В 1874ом году доработал уравнение Клапейрона: 𝑃𝑉 = 𝑅, при 𝜈 = 1 𝑇 𝑃𝑉 = 𝜈𝑅𝑇 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 МПа Манометр 𝑇 = 𝑐𝑜𝑛𝑠𝑡 Как изменится температура идеального газа, если его давление увеличилось в три раза, а объём уменьшился в два раза? Дано: 𝑃 =3 𝑃0 𝑉 1 = 𝑉0 2 𝑇 −? 𝑇0 𝑃0 𝑉0 = 𝜈0 𝑅𝑇0 𝑃𝑉 = 𝜈𝑅𝑇 𝑃𝑉 𝜈𝑅𝑇 = 𝑃0 𝑉0 𝜈0 𝑅𝑇0 𝑃𝑉 𝑇 = 𝑃0 𝑉0 𝑇0 3 𝑇 = 2 𝑇0 Кислород находится в баллоне при температуре 25 𝟐𝟓 ℃. ℃ Давление в баллоне составляет 22 атм атм. Найдите плотность кислорода при таких условиях. Дано: СИ 𝑇 = 25 ℃ 298 К 𝑃 = 2 атм 2 × 105 Па 𝑂2 𝜌−? 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 𝑚 𝑅𝑇 𝑃= 𝑉 𝑀 𝑃𝑀 𝜌= 𝑅𝑇 𝑀 𝑂2 𝑚 𝜌= 𝑉 𝑂2 г кг = 32 = 0,032 моль моль Кислород находится в баллоне при температуре 𝟐𝟓 ℃. Давление в баллоне составляет 2 атм. Найдите плотность кислорода при таких условиях. Дано: 𝑇 = 298 К 𝑃 = 2 × 105 Па 𝑂2 𝜌−? 𝑃𝑀 𝜌= 𝑅𝑇 𝑀 𝑂2 г кг = 32 = 0,032 моль моль 2 × 105 × 0,032 𝜌= = 1,3 кг/м3 8,31 × 298 𝑂2 При нормальном давлении и температуре 20 𝟐𝟎 ℃, ℃ плотность воздуха составляет 1,2 𝟏, 𝟐кг/м кг/м𝟑.3Определите молярную массу воздуха. Дано: 105 СИ 𝑃= Па 𝑇 = 20 ℃ 293 К 𝜌 = 1,2 кг/м3 𝑀−? 𝑃𝑀 𝜌𝑅𝑇 𝜌= ⇒𝑀= 𝑅𝑇 𝑃 1,2 × 8,31 × 293 кг 𝑀= = 0,0292 5 10 моль 𝑀 = 0,79𝑀 𝑁2 + 0,21𝑀(𝑂2 ) кг 𝑀 = 0,0288 моль Основные выводы Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона): 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 Универсальная газовая постоянная: Дж 𝑅 = 8,31 моль ∙ К Уравнение состояния идеального газа позволяет рассмотреть различные процессы, происходящие в системе при тех или иных внешних условиях.