Тема: Важнейшие классы неорганических соединений.
advertisement

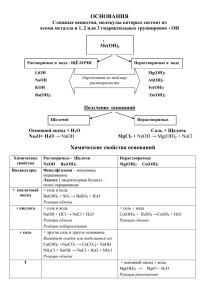
Тема: Важнейшие классы неорганических соединений. Учитель химии: Шохина К.А. Классы неорганических соединений: • • • • оксиды (2 элемента, один из них кислород) основания (есть гидроксо-группа -ОН) кислоты (на первом месте Н) соли (металл + кислотный остаток) Классификация оксидов: • основные (металл ст.ок. +1,+2) • кислотные (все неметаллы + металлы в ст.ок. +5,+6,+7) • амфотерные (металлы ст.ок. +3,+4) Химические свойства основных оксидов с кислотными оксидами, образуя соль (р.с.) CaO + SO2 = CaSO3 + H2O = H2SO3 с кислотами, образуя соль и воду (р.о.) СaO + 2 HCl = CaCl2 + H2O с водой, если образуется растворимое основание (р.с.) CaO + H2O = Ca(OH)2 Химические свойства оснований меняют окраску индикаторов (диссоциируют (распадаются) в водных растворах) NaOH ↔ Na+ + OHс кислотными оксидами, образуя соль и воду (р.о.) 2 NaOH + SO3 = Na2SO4 + H2O c кислотами, образуя соль и воду (р.о., реакция нейтрализации) 2 NaOH + H2SO4 = Na2SO4 + H2O Щелочи (растворимые основания) реагируют с растворами солей, если образуется осадок (р.о.) 2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 Нерастворимые основания при нагревании разлагаются (р.р.) Mg(OH)2 = MgO + H2O Химические свойства кислот меняют окраску индикаторов HCl ↔ H+ + Clс основными оксидами, образуя соль и воду (р.о.) (см. р. в основных оксидах) c основаниями, образуя соль и воду (р.о., реакция нейтрализации) (см. р. в основаниях) с растворами солей, если образуется газ или выпадает осадок (р.о.) H2SO4 + BaCl2 = BaSO4↓ + 2 HCl 2HCl + Na2CO3 = 2 NaCl + H2CO3 H2O + CO2↑ некоторые кислоты разлагаются на свету или под действием нагревания (р.р.) H2SiO3 = SiO2 + H2O c металлами, стоящими в ряду активности до водорода, образуя соль и водород (р.з.) 2HCl + Zn = ZnCl2 + H2↑ Химические свойства солей с щелочами (см. хим. свойства оснований) с кислотами (см. хим. свойства кислот) с металлами, если металл активнее (р.з.), образуя соль и металл СuSO4 + Zn = ZnSO4 + Cu между собой, образуя 2 новые соли (р.о.) AgNO3 + NaCl = NaNO3 + AgCl↓ Условия протекания реакций ионного обмена 1) образование осадка 2) образование газа 3) образование малодиссоциирующего вещества (вода)