Дисперсные системы
advertisement

Лекция №12
Физик-химия дисперсных систем. Методы
получения, свойства дисперсных систем.
Стойкость и коагуляция лиофобных золей.
Свойства растворов ВМC
Подготовили:
К.х.н., доц. Иванец Л.Н.,
Асс. Козачок С.С.
Дисперсная система — это система, в
которой мелкие частицы одной или
нескольких веществ равномерно
распределены между частицами другого
вещества.
• Дисперсной фазой называют
мелкие частицы вещества которое
распределено в системе.
• Дисперсионной средой называют
вещество в котором распределена
дисперсная фаза.
Гомогенная (однородная)
дисперсная система
• это система в которой между
дисперсной фазой и дисперсионной
средой нет поверхности раздела.
• К таким системам принадлежат
истинные растворы. Размеры молекул,
ионов меньшие чем 1·10-9м. Такие
системы термодинамически устойчивые
и понятие дисперсности к ним не
относится.
Гетерогенная (неоднородная)
дисперсная система
• это система в которой частицы
дисперсной фазы имеют размер
больше чем 1·10-9м и составляют
отдельную фазу от дисперсионной
среды.
Степень дисперсности (D)
это величина, обратная размеру
частицы(d)
D = 1/d
Чем меньший размер частицы тем
большая дисперсность системы
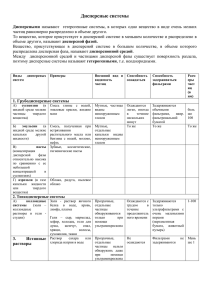
Классификация дисперсных
систем.
Классификация по
степени дисперсности
средней дисперсности
Грубодисперсные
(d= 10-3-10-5 м)
к ним принадлежат
грубые суспензии,
эмульсии, порошки.
(d= 10-5-10-7 м)
высокодисперсные
к ним принадлежат
тонкие суспензии,
дым,
пористые тела.
(d= 10-7-10-9 м)
это коллоидные
системы.
Классификация по агрегатному состоянию.
Классификация по межфазовому взаимодействию
лиофобные
это системы, в которых
слабые силы
Межмолекулярного
взаимодействия.
К ним принадлежат
лиозоли, аэрозоли,
эмульсии, пены.
Лиофобные золи
это коллоидные
растворы.
лиофильные
это системы, в которых
Интенсивное
взаимодействие
между фазой и
средой.
К ним принадлежат
растворы
высокомолекулярных
соединений.
Коллоидные растворы (золи)
Коллоидными растворами называют
микрогетерогенные дисперсные
системы с частицами размером от 10-7
до 10-9м. Их характеризует не только
наличие поверхности раздела между
дисперсной фазой (каждой частицей) и
дисперсионной средой (растворителем),
но и малая устойчивость; коллоидные
растворы не образуются
самопроизвольно.
Условия образования
коллоидных растворов
• малая растворимость веществ дисперсной
фазы в дисперсионной среде
• -соответственная степень дисперсности
вещества (d = 10-7-10-9 м)
• -наличие стабилизатора, который придает
частицам дисперсной фазы одноименного
заряда, что предупреждает их объединение
(агрегацию).
Методы получения коллоидных
растворов (золей)
• Конденсационные методы.
Это методы получения золей путем
укрупнением микрочастиц
Конденсационные методы разделяют на
физические и химические.
• Диспергационные методы.
Это методы дробления больших частиц
до коллоидной степени дисперсности.
Строение коллоидной
частицы
AgNO3 + КI = AgI + KNO3
(mAgI) —агрегат
[(mAgI) nAg+]n+— ядро
{[(mAgI)nAg+]n+(n-x)NO3-}x+ —гранула
{[(mAgI) nAg+]n+(n-x)NO3-}x+х NO3- мицелла
Строение коллоидной
частицы
Молекулярно-кинетические
свойства коллоиднодисперсных систем.
• Молекулярно-кинетические свойства
это свойства, которые обусловлены
тепловым движением частиц.
• Это броуновское движение, диффузия,
осмотическое давление,
седиментационно-диффузионное
равновесие.
Броуновское движение.
• Тепловое хаотическое движение
дисперсных частичек называется
броуновским движением. Это
движение возникает вследствие
ударов молекул дисперсионной
среды и частиц дисперсной фазы.
Диффузия
• это процесс самопроизвольного
выравнивания концентрации
диспергированного вещества под
влиянием теплового хаотического
движения частичек системы.
• Скорость диффузии всегда
увеличивается с повышением
температуры.
Осмотическое давление
• это явление, которое связано с
тепловым движением микрочастиц.
Дисперсные системы имеют
осмотическое давление, но оно очень
мало.
Седиментационно-диффузное
равновесие.
• Седиментация- это процесс оседания
частиц дисперсной фазы под действием
силы земного притяжения.
• Процессы диффузии и седиментации
имеют противоположные направления в
результате чего в дисперсной системе
устанавливается седиментационнодиффузное равновесие.
Светорассеяние.
• Для коллоидных систем в которых размеры
частичек меньше длинны волн видимого
спектра, характерно светорассеяние.
• При боковом освещении коллоидного
раствора можно наблюдать конус Тиндаля –
это образование светящегося конуса.
• Опалесценция – это матовое свечение золей.
Электрокинетические явления.
• Это явления, которые базируются на
взаимодействии между электрическими
и кинетическими свойствами
дисперсных систем.
• Электрокинетические явления это
электрофорез и электроосмос.
Электрофорез
• Движение
заряженных
коллоидных частиц,
а также частиц
грубых взвесей к
противоположно
заряженному
электроду
называется
электрофорезом.
Электроосмос
• Перемещение
дисперсионной среды
относительно
неподвижной
дисперсной фазы к
электроду,
происходящее под
влиянием внешней
разности потенциалов,
называют
электроосмосом.
Коагуляция коллоидных растворов
•
•
•
•
•
•
•
•
•
Коагуляцией называют уменьшение дисперсности системы в
результате слипания частичек дисперсной фазы.
Коагуляция может происходить вследствие старения системы,
изменения температуры, механического действия, действием
электромагнитного поля и в наибольшей мере под действием
электролитов.
Правила коагуляции
Коагуляцию вызывают любые электролиты, но с заметной скоростью
она начинается при достижении определенной концентрации, т.е. при
достижении “порогу коагуляции”. Порог коагуляции выражают в
ммоль/л: = Сэл Vэл/Vзоля;
Коагулирующее действие имеет лишь тот ион электролита, заряд
которого противоположный заряду коллоидной частички.
коагулирующия способность иону тем большая, чем больший его заряд
(правило Шульц-Гарде);
У неорганических ионов с одинаковим зарядом коагулирующее
действие возрастает с уменьшением гидратации;
У органических ионов коагулирующия способность возрастает с
повышением адсорбционной способности
Начала коагуляции отвечает снижение - потенциала к критической
величине (30 мВ); В осадке, образованному
при коагуляции, всегда присутствуют ионы, которые ее вызвали.
•
•
•
Коагуля́ция — процесс обращения крови.
При разрушении стенки сосудов,
тромбоциты собираются у места травмы
и выбирают тромбопластин, который
рядом с кальцием, витамином К и
протромбином, оказывает содействие
превращению фибриногена в фибрине.
Образовываются сетки фибрина, где
задерживаются форменные элементы
крови. Это и является сгустком крови —
тромбом. Процесс коагуляции
продлевается 3-8 мин .
Свертывание крови (гемокоагуляция) —
сложный биологический процесс
образования нитей белка фибрина,
которые образовывают тромбы, в
результате чего кровь теряет текучесть,
приобретая сыроподобной консистенции.
В нормальном состоянии кров —
легкотекучая жидкость, которая имеет
вязкость близкую к вязкости воды. В
крови растворимые фибриноген,
протромбин и ионы кальция.
Понятие о ВМС, их получение и классификация
•
К высокомолекулярным веществам (ВМВ) относят соединения с
молекулярной массой 104-106 и выше.
• Высокомолекулярные вещества имеют важное значение в
разных областях науки и техники. Особенно большая их роль в
процессах жизнедеятельности. К высокомолекулярным
соединениям принадлежат белки (казеин, желатин, крахмал и
др.), которые составляют основу питания, нуклеиновые кислоты
и другие биополимеры.
• В технике и быту находят широкое применение такие ВМР, как
целлюлоза и ее производные, шерсть, натуральный шелк,
хлопок, разнообразные синтетические смолы, пластмассы,
натуральные и синтетические каучуки, пленкообразующих
материалы, синтетические волокна (капрон, нитрон, полиэстер )
и др. определенное использование нашли ВМС в медицине и
фармации. Из полимеров изготовляют инструментарий,
предметы ухода за больными, протезы для замены утраченных
органов. В фармации полимеры используют для изготовления
оболочек капсул, в которые помещают врачебные вещества, как
покрытие и составные части таблеток, как вспомогательные
вещества для создания мазей и пластырей. Из
модифицированной целлюлозы, например, изготовляют бинты и
вату с кровоостанавливающим свойствами. И это далеко не
полный перечень применения ВМС в фармации.
Физические свойства полимеров
• Полимеры большей частью аморфные вещества. Длинные
цепочки и большая молекулярная масса не разрешают
полимерам переходить к жидкому состоянию (быстрее
наступает химический распад). Тем не менее при повышении
температури с полимерами происходят изменения - они
размякают и становятся очень пластическими. Температура
перехода от крохкого состояния к пластическому называется
темературой склувания. Температура склувания не является
четко определенной температурой фазового перехода, а лучше
указывает на температурный диапазон, в котором происходят
изменения. При низких температурах полимеры є довольно
крохкими материалами.
• Большей частью используются механические свойства
полимеров. При темературе высшей за температуру склувания
их нетрудно прессовать в произвольную форму, при застигании
они сохраняют форму и могут служить для инкапсуляции и
других целей. Тем не менее сопряженных полимеры все более
чаще используются как органические полупроводники.
Методы получения ВМР
•
•
•
•
•
•
•
Естественные BMP содержатся в разных растительных и животных организмах и
могут быть выделенные из них с помощью экстракции, фракционного осаждения
и других методов.
Синтетические BMP получают из низкомолекулярных веществ методами
полимеризации и поликонденсации.
Полимеризация — это реакция соединения большого числа молекул
низкомолекулярных веществ (мономеров), которые имеют кратные связи.
Реакция не сопровождается выделением побочных продуктов. Этим методом
получают полиетилен, поливинилхлорид, полиизобутилен и другие BMP.
Поликонденсацией называется процесс соединения молекул одинакового или
разного строения, который сопровождается, как правило, выделением
низкомолекулярных веществ. Исходные мономеры должны содержать в
молекуле не меньше двух функциональных групп ( -ОН, -СООН, -NНз и др.). При
поликонденсации бифункциональных соединений получают линейные или
циклические BMP, а при поликонденсации три- и тетрафункциональных
соединений - BMP пространственного строения. Например, поликонденсацией
двоатомних спиртов получают линейные простые полиэфиры:
n ( HO-R-OH) + n( HO-R'-OH) → (- R-O-R'-)n+ пН2О.
BMP можно получить также методом химических преобразований. Метод
Основывается на химических реакциях, когда в готовые высоко-молекулярные
вещества вводят новые функциональные группы, или старые группы замещают
новыми, или происходит сшивание макромолекул или их деструкция.
В зависимости от характера реакций они разделяются на два вида:
полимераналогичнии преобразование и макромолекулярные реакции. К первому
виду принадлежит, например, реакция взаимодействия целлюлозы с азотной
кислотой, в результате которой образовывается тринитрат целлюлозы.
Примером макромолекулярной реакции есть сшивания макромолекул
полиакриловой кислоты этиленгликолем, при этом образовывается
пространственный полимер с новыми физическими свойствами.
Набухание и растворение ВМР.
• Механизм растворения полимеров отличается от механизма
растворения низкомолекулярных веществ. При растворении
последних частички их диффундируют в объем
растворителя. В случае растворения полимеров полимер
выполняет роль растворителя, а низкомолекулярная
жидкость — растворенного вещества. Т.е. происходит
диффузия молекул растворителя в объем полимера. В
начальный период молекулы растворителя проникают у
«пустоты» между макроцепями полимера. При этом
происходит уменьшение общего объема системы. Это
явление называется контракцией (V). Контракция
сопровождается выделением теплоты сольватации и в
большинстве случаев подчиняется эмпирическому
уравнению:
•
V = am (b + m)
• где m – масса жидкости, поглощенной 1 г полимера, а, b —
постоянные величины.
• Дальше межмолекулярные связи в полимере ослабляются и молекулы
растворителя все больше проникают вглубь полимера. Объем его
увеличивается, а общий объем системы остается постоянным.
Односторонний процесс проникновения молекул растворителя в фазу
полимера называется набуханием.
• В зависимости от строения макроцепи и характера взаимодействия
макромолекул между собой и молекулами растворителя различают
ограниченное и неограниченное набухания.
• Неограниченное набухание - это набухание, которое
самопроизвольно переходит у растворение, при этом образовывается
однофазная гомогенная система.
• Ограниченным набуханием называется процесс взаимодействия
полимера с низкомолекулярной, жидкостью, ограниченный стадией
набухания. Самопроизвольное растворение полимера не происходит,
т.е. цепи полимера полностью не отделяются один от другого. При
этом образовываются две сосуществующих фазы. Одна фаза является
раствором низкомолекулярной жидкости в полимере, а вторая чистой низкомолекулярной жидкостью. Эти фазы разделенные
видимой поверхностью деления и находятся в равновесии.
• Процесс набухания количественно характеризуется степенью и
скоростью набухания. Степень набухания (а) выражается
количеством жидкости, поглощенной единицей массы или
объема полимера.
• Степень набухания может быть определена весовым или
объемным методом. Весовой метод состоит во взвешивании
образцу к и после набухания. Степень набухания
рассчитывается за формулой:
•
α= m-m0 /m0
•
где m0— масса исходного полимера; m – масса набухлого
полимера.
• Скорость набухания полимера определяется скоростью
диффузии растворителя у него, поэтому она характеризуется
теми же закономерностями, которые и химическая реакция 1-го
порядка. Итак, константу скорости набухания полимера
можно рассчитать за уравнением:
•
k = 1/ t*ln αmax/ αmax-a1
• где αmax — предельная или максимальная степень набухания, α
— степень набухания к времени t