Первый закон термодинамики. Применение первого закона
advertisement

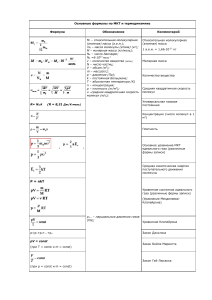
Вопросы фронтальной беседы: - Какой раздел в физике называется термодинамикой? - От каких физических величин зависит внутренняя энергия тела? - Чему равна внутренняя энергия идеального одноатомного газа ? - 1 моль идеального одноатомного газа нагревают на 1К. Чему равно изменение внутренней энергии? Вопросы фронтальной беседы: - Назовите два способа изменения внутренней энергии? - Как рассчитать работу газа? - Что называют количеством теплоты? - От чего зависит удельная теплоемкость вещества? - Удельная теплоёмкость воды С = 4200 Äæ .Что означает эта величина? êã Ê Первый закон термодинамики. Применение первого закона термодинамики к различным процессам. К середине 19 века многочисленные опыты показали, что механическая энергия никогда не пропадает бесследно. Закон сохранения энергии: Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую. Р. Майер Д.Джоуль Закон сохранения и превращения энергии, распространённый на тепловые явления, носит название первого закона термодинамики. Первый закон термодинамики: Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты переданного системе: А ΔU=Q+A Q А – работа над системой Внутренняя энергия изолированной системы остаётся неизменной (сохраняется). Учитывая, что A’ = - А А’ – работа самой системы Q=A’+ΔU ΔU U1 U2 3 m U R T 2 M Q = ∆U + A’ A p V ' изотермический изохорный изобарный процесс процесс процесс T = const V = const ΔТ=0 ∆U=0 ΔV=0 А’=0 Q = A’ Q = ∆U P = const Q = ∆U + A’ Рассмотрим процесс, протекающий в системе, которая не обменивается теплотой с окружающими телами. Процесс в теплоизолированной системе называют адиабатный процесс. Q = const Q = ∆U + A’ - A’= - А ∆U = A 3 m U R T 2 M ∆U = Q + A Q = ∆U + A’ A p V ' Изохорны Изотерми Изобарный Адиабатны й процесс ческий процесс й процесс процесс V = const T = const P = const A=0 ∆U = 0 ∆U = Q Q = A/ A/ > 0 ∆U = Q + A Q = const ∆U = A Уравнение теплового баланса ΔU=Q+A ∆Ui = Qi Q1 + Q2 + Q3 + … = 0 Q1, Q2, Q3 – количества теплоты, полученные или отданные телами Н2 О Проверь себя!!! 1. Как формируется первый закон термодинамики? 2. С какими изопроцессами вы познакомились? 3. Как записывается уравнение теплового баланса? 4. Можно ли считать человека термодинамической системой? 5. За счёт чего поддерживается постоянная температура (внутренняя энергия) человека?