Ковалентная связь и ковалентные кристаллы 1
advertisement
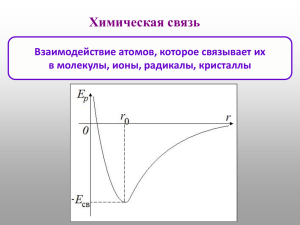
Ковалентная связь и ковалентные кристаллы 1 Атом водорода Почему электрон не падает на ядро? Почему спектры поглощения и излучения атомов и молекул имеют полосчатый характер? 2 Уравнение Шредингера для электрона в атоме водорода 2 2 e2 r (r ) E (r ) r 2m 3 ( r ) dr 1 2 Основное состояние: Er min H Разделение переменных в сферических координатах: 3 Собственные числа = разрешенные уровни энергии 4 Спектральные серии атома водорода 5 6 l=0 Собственные функции nlm n = 1, 2,… ; l = 0, .. , n – 1; m = -l,…, l l=1 l=2 n =1 1s n =2 2s 2p n =3 3s 3p 3d n =4 4s 4p 4d l=3 4f 7 Принцип Паули: на одной орбитали ≤ 2е Атомные орбитали и строение атомов 8 Молекула водорода Н2 Атомы водорода Электроны испытывают притяжение к соседнему атому Образование ковалентной связи 9 Ковалентная связь образуется парой электронов ↑↓ - по одному от соединяемых атомов Ковалентные связи могут образовывать только атомы с незаполненными внешними оболочками 10 Антисимметричность многоэлектронной ВФ: (1,2) (2,1) Разделение пространственных и спиновых переменных: (r , s ) (r ) ( s ) Основное состояние: S = 0 – синглет: (1,2) (1) (2) (2) (1) Метод валентных связей: (1,2) ~ a (1) b (2) a (2) b (1) Метод молекулярных орбиталей: Электронная плотность: (1,2) ~ a (1) b (1) a (2) b (2) (r ) 1 a (r) b (r) ab (r) 2(1 S ) Плотность перекрывания: ab (r ) 2 a (r ) b (r ) Интеграл перекрывания: S a (r ) b (r )dr 3 11 Заряд перекрывания Q S /(1 S ) +Q/2 -Q +Q/2 Кулоновская энергия ковалентной связи: Q(Q / 2) Q / 2 Q2 2 1.75 R/2 R R 2 U Coul 12 Гетерополярные связи Ионно-ковалентные связи Ионные связи 13 Гибридизация – смешение орбиталей с разными l 1 1 2 ( s pz ) 2 1 2 ( s pz ) sp 1 1 3 ( s 2 pz ) 2 1 3 1 2 ( s pz 3 2 py ) 3 1 3 ( s pz 3 2 py ) 1 2 sp2 1 1 4 [ s px py pz ] 2 1 4 [ s px py pz ] 3 1 4 [ s px py pz ] 4 1 4 [ s px py pz ] sp3 14 Примеры молекул с гибридными АО O=C=O 15