Кислоты.
advertisement

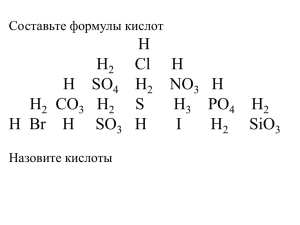
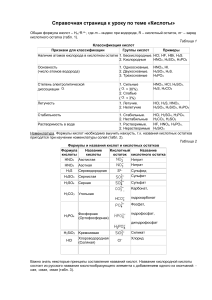
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на атомы металлов, и кислотного остатка. H+n R-n, где R- кислотный остаток ; n- число атомов водорода, равное валентности кислотного остатка. HCl H2SO4 HNO3 H2CO3 H3PO4 Классификация кислот. • По количеству атомов водорода (по основности) • 1. одноосновные HCl • 2. двухосновные H2SO4 • 3. трехосновные H3PO4 Классифицируйте кислоты : По наличию атома кислорода. 1. Кислородсодержащие H2SO4 2. Бескислородные HCl HHF 2SO3 Физические свойства твёрдые H3PO4 HPO3 H3BO3 жидкие H2SO4 HNO3 HCl К И С Л О Т Ы растворимые в воде H2SO4 H3PO4 нерастворимые в воде H2SiO3 Растворы кислот имеют кислый вкус. Например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: яблочная муравьиная лимонная щавелевая Изменение окраски индикатора. название индикатора окраска индикатора в нейтральной среде окраска индикатора в кислой среде лакмус фиолетовая красная метиловый оранжевый оранжевая фенолфталеин бесцветная краснорозовая бесцветная Разрушают кожу, ткани, древесину. ! ОСТОРОЖНО! Нейтрализовать раствором соды, смыть водой. Химические свойства. • 1. Взаимодействие с Металлами. Ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au водород из кислот не вытесняют вытесняют водород из кислот Mg кислота Кроме HNO3 Сu Zn + Ме0 до водорода соль + Н2 Русский химик, академик Петербургской Академии наук. Основоположник физической химии. В 1863 г. составил вытеснительный ряд металлов, который называется по имени ученого. Химические свойства. • 2. Взаимодействие с оксидами Ме МеО (основными: Ме+1, +2, амфотерными: Ме+3,+4) Оксид Ме CuO + кислота соль + H2SO4 вода Химические свойства. • 3. Взаимодействие с основаниями Ме(ОН)n (р. нейтрализации) основание + кислота соль + вода Химические свойства. • 4. Взаимодействие с солями соль + Раствор соли кислота соль + вода осадок Слабая кислота Сухая соль HNO3 H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3 H3PO4 (каждая предыдущая кислота может вытеснить из соли последующую) Слабые кислоты ЗАПОМНИ ! • H2CO3 CO2 H 2O Угольная кислота H2SiO3 Кремниевая кислота H2SO3 SO2 H 2O Сернистая кислота H2S Сероводородная кислота Получение кислот Бескислородные кислоты • H2 + Cl2 = 2HCl • Взаимодействие простых веществ. Кислородсодержащие кислоты • SO3 + H2O = H2SO4 • Взаимодействие кислотного оксида и воды. NaCl(тв.) + H2SO4 (конц.) Na2SO4 + 2HCl Летучие кислоты могут быть вытеснены из солей менее летучими кислотами.