Тематическое планирование 8 класс, 68 часов (2 часа в... № Дидактические единицы Пр/р, л/о, дем., к/р.
advertisement
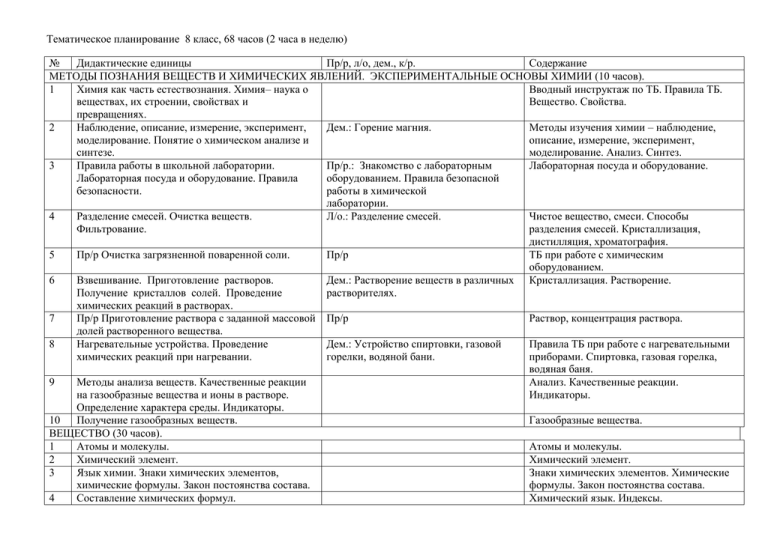
Тематическое планирование 8 класс, 68 часов (2 часа в неделю) № Дидактические единицы Пр/р, л/о, дем., к/р. Содержание МЕТОДЫ ПОЗНАНИЯ ВЕЩЕСТВ И ХИМИЧЕСКИХ ЯВЛЕНИЙ. ЭКСПЕРИМЕНТАЛЬНЫЕ ОСНОВЫ ХИМИИ (10 часов). 1 Химия как часть естествознания. Химия– наука о Вводный инструктаж по ТБ. Правила ТБ. веществах, их строении, свойствах и Вещество. Свойства. превращениях. 2 Наблюдение, описание, измерение, эксперимент, Дем.: Горение магния. Методы изучения химии – наблюдение, моделирование. Понятие о химическом анализе и описание, измерение, эксперимент, синтезе. моделирование. Анализ. Синтез. 3 Правила работы в школьной лаборатории. Пр/р.: Знакомство с лабораторным Лабораторная посуда и оборудование. Лабораторная посуда и оборудование. Правила оборудованием. Правила безопасной безопасности. работы в химической лаборатории. 4 Разделение смесей. Очистка веществ. Л/о.: Разделение смесей. Чистое вещество, смеси. Способы Фильтрование. разделения смесей. Кристаллизация, дистилляция, хроматография. 5 Пр/р Очистка загрязненной поваренной соли. Пр/р ТБ при работе с химическим оборудованием. 6 Взвешивание. Приготовление растворов. Дем.: Растворение веществ в различных Кристаллизация. Растворение. Получение кристаллов солей. Проведение растворителях. химических реакций в растворах. 7 Пр/р Приготовление раствора с заданной массовой Пр/р Раствор, концентрация раствора. долей растворенного вещества. 8 Нагревательные устройства. Проведение Дем.: Устройство спиртовки, газовой Правила ТБ при работе с нагревательными химических реакций при нагревании. горелки, водяной бани. приборами. Спиртовка, газовая горелка, водяная баня. 9 Методы анализа веществ. Качественные реакции Анализ. Качественные реакции. на газообразные вещества и ионы в растворе. Индикаторы. Определение характера среды. Индикаторы. 10 Получение газообразных веществ. Газообразные вещества. ВЕЩЕСТВО (30 часов). 1 Атомы и молекулы. Атомы и молекулы. 2 Химический элемент. Химический элемент. 3 Язык химии. Знаки химических элементов, Знаки химических элементов. Химические химические формулы. Закон постоянства состава. формулы. Закон постоянства состава. 4 Составление химических формул. Химический язык. Индексы. 5 Относительные атомная и молекулярная массы. Атомная единица массы. 6 Вычисление относительной молекулярной массы вещества по формуле. Количество вещества, моль. Молярная масса. Молярный объем. 7 8 9 10 Чистые вещества и смеси веществ. Качественный и количественный состав вещества. Простые вещества (металлы и неметаллы). 11 Сложные вещества (органические и неорганические). Основные классы неорганических веществ. 12 13 14 15 16 17 18 19 20 21 22 23 Периодический закон и периодическая система химических элементов Д.И. Менделеева. Группы и периоды периодической системы. Строение атома. Ядро (протоны, нейтроны) и электроны. Изотопы. Строение электронных оболочек атомов первых20 элементов периодической системы Д.И. Менделеева. Строение молекул. Химическая связь. Типы химических связей: ковалентная (полярная и неполярная). Типы химических связей: ионная, металлическая. Понятие о валентности и степени окисления. Составление формул соединений по валентности (или степени окисления). Составление формул соединений по валентности (или степени окисления). Вычисление массовой доли элемента в Коэффициенты. Атомные единицы массы. Относительные атомная и молекулярная массы. Атомная единица массы. Дем.: Химические соединения количеством вещества в 1 моль. Дем.: Модель молярного объема газов. Дем.: Образцы простых и сложных веществ. Дем.: Образцы типичных металлов и неметаллов. Л/о.: Знакомство с образцами простых и сложных веществ. Моль. Молярная масса. Молярный объём. Чистое вещество, смеси. Анализ состава вещества Металлы. Неметаллы. Классы неорганических веществ: оксиды, кислоты, основания, соли. ПСХЭ Д.И. Менделеева. Периодический закон. Группы, периоды. Атом. Ядро, электрон, протон, нейтрон. Изотоп. Энергетические уровни и подуровни. Химическая связь. Химическая связь. Валентность. Степень окисления. Валентность, индекс Валентность, индекс Массовая доля элемента. 24 25 26 27 химическом соединении. Установление простейшей формулы вещества по массовым долям элементов. Вещества в твердом, жидком и газообразном состоянии. Кристаллические и аморфные вещества. Типы кристаллических решеток (атомная и молекулярная). Типы кристаллических решеток (ионная). Типы кристаллических решеток (металлическая). Методы познания веществ и химических явлений. Вещества. 30 Методы познания веществ и химических явлений. Вещества. ХИМИЧЕСКАЯ РЕАКЦИЯ (10 часов). 1 Химическая реакция. 28 29 2 3 4 5 Уравнение и схема химической реакции. Сохранение массы веществ при химических реакциях. Условия и признаки химических реакций. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ. Классификация химических реакций по различным признакам: изменению степеней окисления химических элементов. Решение задач 3 состояния вещества Дем.: Модели кристаллических решеток ковалентных соединений. Вещества кристаллические и аморфные. Кристаллическая решётка Дем.: Модели кристаллических решеток ионных соединений. Повторение и обобщение Контрольная работа Л/о.: Химические явления (прокаливание медной проволоки; взаимодействие мела с кислотой). Химическая реакция. Уравнения химических реакций. Л/о.: Взаимодействие углекислого газа с известковой водой. Л/о.: Получение осадков нерастворимых гидроксидов и изучение их свойств. Дем.: Реакций, иллюстрирующих основные признаки характерных реакций. Дем.: Нейтрализация щелочи кислотой в присутствии индикатора. Условия возникновения и протекания реакций. Реакции соединения, разложения, замещения и обмена Реакции окислительно-восстановительные. Классификация химических реакций по различным признакам: поглощению или выделению энергии. 7 Понятие о скорости химических реакций. Катализаторы. 8 Пр/р Выполнение опытов, демонстрирующих Пр/р генетическую связь между основными классами неорганических соединений. 9 Химическая реакция Повторение и обобщение 10 Химическая реакция Контрольная работа ЭЛЕМЕНТАРНЫЕ ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ (18 часов) 1 Кислород, получение и применение. 2 Кислород, физические и химические свойства. 3 Пр/р Получение, собирание и распознавание Пр/р кислорода. 4 Оксиды. 5 Водород, получение и применение. 6 Водород, физические и химические свойства. 7 Пр/р Получение, собирание и распознавание Пр/р водорода. 8 Кислоты. 9 Соли. л/о.: Вытеснение одного металла другим из раствора соли. 10 Генетическая связь между классами неорганических соединений. 11 Вода и ее свойства. 12 Растворимость веществ в воде. Дем.: Растворимость некоторых веществ в воде. 6 13 14 15 Круговорот воды в природе. Галогены. Хлороводород. 16 Соляная кислота и ее соли. 17 18 Неметаллы Неметаллы Дем.: Распознавание соединений хлора. Дем.: Получение хлороводорода и его растворение в воде. Л/о.: Растворение железа и цинка в соляной кислоте. Повторение и обобщение Контрольная работа по теме Термохимические уравнения реакций. Экзотермические и эндотермические реакции. Скорость химической реакции. Катализатор. Кислород. Оксиды. Правила ТБ при выполнении химического эксперимента. Оксиды Правила ТБ при выполнении химического эксперимента. Кислоты. Соли. Растворимость. Растворение. Растворы ненасыщенные, насыщенные, перенасыщенные. Испарение. Галогены. Хлор. Фтор. Бром. Йод. Хлороводород. Хлориды.