ктп по химии 10 кл - icrov
advertisement
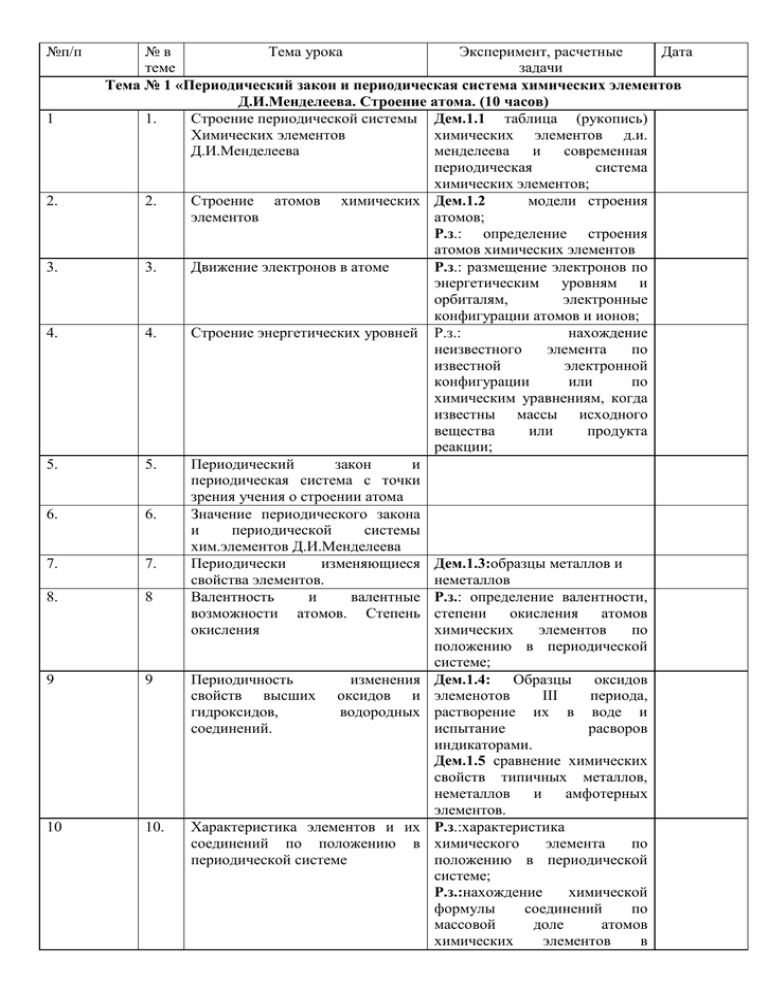
№п/п 1 2. 3. 4. 5. 6. 7. 8. 9 10 №в Тема урока Эксперимент, расчетные Дата теме задачи Тема № 1 «Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. (10 часов) 1. Строение периодической системы Дем.1.1 таблица (рукопись) Химических элементов химических элементов д.и. Д.И.Менделеева менделеева и современная периодическая система химических элементов; 2. Строение атомов химических Дем.1.2 модели строения элементов атомов; Р.з.: определение строения атомов химических элементов 3. Движение электронов в атоме Р.з.: размещение электронов по энергетическим уровням и орбиталям, электронные конфигурации атомов и ионов; 4. Строение энергетических уровней Р.з.: нахождение неизвестного элемента по известной электронной конфигурации или по химическим уравнениям, когда известны массы исходного вещества или продукта реакции; 5. Периодический закон и периодическая система с точки зрения учения о строении атома 6. Значение периодического закона и периодической системы хим.элементов Д.И.Менделеева 7. Периодически изменяющиеся Дем.1.3:образцы металлов и свойства элементов. неметаллов 8 Валентность и валентные Р.з.: определение валентности, возможности атомов. Степень степени окисления атомов окисления химических элементов по положению в периодической системе; 9 Периодичность изменения Дем.1.4: Образцы оксидов свойств высших оксидов и элеменотов III периода, гидроксидов, водородных растворение их в воде и соединений. испытание расворов индикаторами. Дем.1.5 сравнение химических свойств типичных металлов, неметаллов и амфотерных элементов. 10. Характеристика элементов и их Р.з.:характеристика соединений по положению в химического элемента по периодической системе положению в периодической системе; Р.з.:нахождение химической формулы соединений по массовой доле атомов химических элементов в 11 1 12. 2 13 3 14. 4. 15. 5. 16. 6. 17 7. 18. 19 составе; Тема № 2 «Химическая связь и строение вещества» (8 часов) Ковалентная связь. Донорно- Дем.2.2 образцы веществ с акцепторный механизм различной химической связью образования ковалентной связи (оксида кремния (IV) и хлорида натрия); Р.з. определение типа химической связи в различных соединениях; Свойства ковалентной связи. Р.з. определение типа Гибридизация атомных орбиталей гибридизации и и геометрия молекул. пространственного строения молекул; Ионная связь Дем.2.2 образцы веществ с различной химической связью (оксида кремния (IV) и хлорида натрия); Металлическая и водородная Р.з. определение типа связи химической связи в различных соединениях; Типы кристаллических решеток Дем.2.1 модели кристаллических решеток хлорида натрия, графита, алмаза, оксида углерода (IV), меди; Р.з. определение типа кристаллической решетки по известным физическим свойствам, прогноз свойства веществ по типу кристаллической решетки; Зависимость свойств простых и Лабораторный опыт № 1: сложных веществ от вида хим. «Изготовление молекул связи и типа кристлл. решетки. веществ с различными видами связи. Изучение свойства веществ с разными кристаллическими решетками», Систематизация и обобщение Р.з. расчеты по химической знаний по темам № 1 и 2 формуле вещества; . Контрольная работа № 1 по темам 1 и 2 Тема № 3 «Химические реакции и закономерности их протекания» (14 часов) 1. Классификация химических Р.з. вычисление массы, реакций количества вещества, количество атомов, молекул, объем (газа) по химическим формулам и уравнениям; Дем.3.1 примеры опытов, демонстрирующие различные химические реакции; Дем.3.6 опыты, иллюстрирующие химические свойства оксидов, кислот, оснований, амфотерных 8. 20 2. 21 3. 22 23. 24-25 4. 5 6-7 26 8 27. 9 28. 29. 10 11 гидроксидов и солей; Лабораторный опыт № 2: «Получение гидроксидов (щелочей, кислот) и изучение их свойств, Гидролиз солей»; Лабораторный опыт № 3: «Экспериментальное подтверждение качественного состава кислот, оснований и солей»; Окислительно– Р.з. вычисления с восстановительные реакции понятиями: моль, молярная масса, молярный объем, определение степени окисления элементов по формулам веществ и выполнение упражнений на составление окислительновосстановительных реакций; Электролиз расплавов и растворов Р.з. составление схем процесса солей электролиза расплавов и растворов и расчеты масс, объема (газа) продуктов электролиза Дем.3.3 электролиз расплавов и растворов солей (мультимедиа); Гидролиз солей Скорость химических реакций Факторы влияющие на скорость Р.з. вычисление процентной и химических реакций молярной концентрации растворов; Дем.3.2 примеры экзо - и эндотермических реакций; Дем.3.4 изучение зависимости скорости химической реакций от различных факторов; Катализаторы и ингибиторы. Дем.3.5 изучение скорости Катализ: гомо- и гетерогенный различных реакций, происходящих в природе и при применении веществ в быту, на производстве; Вычисление скорости реакции от Р.з. расчеты по концентрации реагирующих в-в и термохимическим уравнениям от температуры и определение теплового эффекта реакции; Р.з.вычисление изменения скорости реакции от концентрации реагирующих веществ и от температуры; Химическое равновесие Смещение химического Р.з. примеры на смещение равновесия, принцип Ле-Шателье химического равновесия от изменения концентрации, температуры и давления; Лабораторный опыт № 4: «Смещение химического равновесия в системе (на примере тиоционата аммония (калия) и хлорида железа (III) путем изменения концентрации)», 30. 31. 32. 33. 34. 35. 36-37 38. 39. 40. 41. Понятие о ядерных реакциях и их роль в энергетическом потенциале Казахстана 13 Систематизация и обобщение знаний по теме 14. Контрольная работа № 2 по теме № 3 Тема № 4 «Общая характеристика металлов и неметаллов» (6 часов) 1. Металлы и неметаллы. Лабораторный опыт № 5: Сравнительная характеристика «Химические свойства строения атомов металлов типичных металлов, главных подгрупп и неметаллов неметаллов и амфотерных элементов». 2. Электрохимический ряд Р.з. решение задач на смеси с напряжения металлов использованием электрохимического ряда напряжения металлов 3. Особенности строения металлов и Дем.4.1 образцы неметаллов (атомов, ионов), неметаллов, металлов и их кристаллических решеток соединений; модели кристаллических решеток металлов; 4- 5 Закономерности изменения свойств металлов и неметаллов и их соединений 6 Нахождение металлов, Р.з. вычисление массы, объема неметаллов и их соединений в (газообразного) продукта природе. Основные реакции по известной массе месторождения металлов и раствора и массовой доле неметаллов в Казахстане растворенного вещества; Тема № 5 «Важнейшие s-элементы и их соединения» (6 часов) 1. Положение s-элементов в периодической системе, особенности строения. 2. Натрий и калий, получение, физ. св-ва. 3. Химические свойства натрия и Р.з. вычисление массы, калия. Важнейшие соединения количества вещества реагента натрия и калия и их применение или продукта по химическим уравнениям указывающих на генетическую связь металлов и их соединениями; Дем.5.1 взаимодействие натрия, калия, кальция с водой; 5.2 качественные реакции на ионы натрия, калия, кальция (окрашивание пламени); 12 42. 4. 43. 5. 44. 6. 45. 1. 46. 2 47 3 48. 4 49 5 50 6 Кальций и магний, получение, физ. св-ва Химические свойства кальция и магния. Важнейшие соединения кальция и магния и их применение. Жесткость воды и способы ее устранения. Р.з. вычисление массы, количества вещества реагента или продукта по химическим уравнениям указывающих на генетическую связь металлов и их соединениями; Дем.5.1 взаимодействие натрия, калия, кальция с водой; 5.2 качественные реакции на ионы натрия, калия, кальция (окрашивание пламени); Лабораторные опыты № 6: «Ознакомление с образцами важнейших солей натрия, калия, магния и кальция, сравнение химической активности металлов. Практическая работа № 1 Пр.р.№.1 «Решение экспериментальных задач по теме «Металлы главных подгрупп» Тема № 6 «Важнейшие d-элементы и их соединения» (8 часов) Положение d-элементов в периодической системе, особенности строения их атомов Медь и ее соединения. Дем.6.1 получение гидроксидов железа (II) и (III), меди (II), цинка, хрома (III), испытание отношения гидроксидов к кислотам и щелочам. Цинк и его соединения Дем.6.1 получение гидроксидов железа (II) и (III), меди (II), цинка, хрома (III), испытание отношения гидроксидов к кислотам и щелочам Хром и его соединения. Дем.6.1 получение гидроксидов железа (II) и (III), меди (II), цинка, хрома (III), испытание отношения гидроксидов к кислотам и щелочам Железо и его соединения Дем.6.1 получение гидроксидов железа (II) и (III), меди (II), цинка, хрома (III), испытание отношения гидроксидов к кислотам и щелочам Лабораторный опыт № 7. «Качественные реакции на распознавание ионов Cu2+, Fe2+, Fе3+, Zn2+»; Практическая работа № 2 Пр.р. № 2 «Решение экспериментальных задач по теме «Металлы побочных подгрупп» 51 52 53. 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. Обобщение и систематизация Р.з. расчеты по уравнениям знаний по темам 4,5,6 химических реакций с участием металлов (с реагентами, имеющими примеси, а также на практический выход продукта от теоретически возможного); 8 Контрольная работа №3 по тема 4,5,6 Тема № 7: «Важнейшие р – элементы и их соединения» (10 часов) 1. Положение р – элементов в . периодической системе. Особенности строения атомов. 2. Алюминий и его соединения Дем.7.1 коллекции: алюминий и его сплавы, силикаты, стекла; 3. Общая характеристика неметаллов и их соединений 4. Углерод и кремний, их Р.з. вычисления связанные с соединения и свойства использованием относительной плотности и молярного объема газов в реакциях с участием неметаллов; Дем.7.1 коллекции: алюминий и его сплавы, силикаты, стекла; Дем.7.2,7.3 поглощение активированным углем растворенных веществ (адсорбция); получение оксида углерода (IV) и взаимодействие его с водой и раствором щелочи; 5. Азот и фосфор,их соединения и свойства 6. Практическая работа №3 Пр.р.№ 3 «Получение аммиака, изучение свойств водного раствора аммиака и солей аммония» 7. Сера, её соединения и их Р.з. расчетные задачи на свойства растворы; 8. Хлор и его соединения, их Лабораторные опыты № 8: свойства. Йод. «Генетическая связь между классами неорганических веществ. Ознакомление со свойствами ортофосфорной кислоты, фосфатов. Действие раствора йода на крахмал»; 9. Практическая работа №4 Пр.р.№ 4 «Решение экспериментальных задач по теме «Качественные реакции на некоторые анионы» 10. Контрольная работа № 4 по теме № 7 Тема № 8 «Производство неорганических соединений и сплавов» (6 часов) 1. Общие научные принципы химического производства, 7 64. 2. 65. 3. 66. 4. 67. 5. 68. 6. металлургическая промышленность, Получение металлов, сплавы. Дем.8.1 модели Производство чугуна, стали и промышленного получения алюминия серной кислоты, аммиака, чугуна, стали и алюминия; Производство серной и азотной Р.з. «Разноуровневые типовые кислот задачи с технологическим и экологическим содержанием»; Дем.8.1 модели промышленного получения серной кислоты, аммиака, чугуна, стали и алюминия Производство аммиака и Р.з. «Разноуровневые типовые силикатная промышленность задачи с технологическим и экологическим содержанием»; Дем.8.1 модели промышленного получения серной кислоты, аммиака, чугуна, стали и алюминия Важнейшие фосфорные, Дем.8.2 коллекция калийные и азотные удобрения и «Образцы удобрений» их производство Химическая грамотность и экологическая культура – необходимые условия НТП.