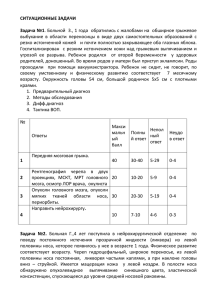
файл (4.0 MiB) - Электронная библиотека открытых
advertisement

Министерство здравоохранения Кыргызской Республики Национальный госпиталь На правах рукописи УДК:[616.831-006-021.3]-07-089(575.2-25) НАЗАРАЛИЕВА ЭЛЕОНОРА ТУУГАНБАЕВНА ПЕРВИЧНЫЕ ОПУХОЛИ ГОЛОВНОГО МОЗГА У ЖИТЕЛЕЙ ЧУЙСКОЙ ОБЛАСТИ И Г. БИШКЕК (клиника, диагностика, результаты лечения) 14.01.18 – нейрохирургия Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук Дюшеев Буранбек Джамгырчиевич Бишкек ̶ 2015 ОГЛАВЛЕНИЕ СПИСОК СОКРАЩЕНИЙ…………………………………………………………4 ВВЕДЕНИЕ …………………………………………………………………............5 ГЛАВА I. ЭПИДЕМИОЛОГИЯ ПЕРВИЧНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА (ОБЗОР ЛИТЕРАТУРЫ)……………………………………....................11 ГЛАВА II. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ…………...............29 2.1. Дизайн исследования и клинический материал .............................. 29 2.2.Статистический анализ результатов исследования.............................34 ГЛАВА III. КЛИНИКО-ЭПИДЕМИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ПЕРВИЧНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА В Г.БИШКЕКЕ И ЧУЙСКОЙ ОБЛАСТИ…………………………………………………….............35 3.1. Демографическая и экологическая ситуация в Чуйской области и г. Бишкеке……………………………………………………………...........35 3.2. Заболеваемость первичными опухолями головного мозга в Чуйской области и г. Бишкеке…………………………………………......42 3.3. Гистотопографическая характеристика ПОГМ в Чуйской области и г. Бишкеке……………………………………………………………...........49 ГЛАВА IV. КЛИНИКО-СТАТИСТИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ С ПЕРВИЧНЫМИ ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА.................................63 4.1. Общая характеристика больных с первичными опухолями головного мозга, поступающих в нейрохирургический стационар………............................63 4.2. Структура и особенности клинических проявлений первичных опухолей головного мозга……………………....................................................... 74 2 ГЛАВА V. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ И АНАЛИЗ КАЧЕСТВА ДИАГНОСТИКИ БОЛЬНЫХ С ПЕРВИЧНЫМИ ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА………………………............................................................................... 100 ВЫВОДЫ……………………………………………………………………...... 133 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ……………………………………...... 135 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ…………………………..... 136 3 СПИСОК СОКРАЩЕНИЙ ГХЦГ ‒ Гексахлорциклогексан ДДТ ‒ 1,1-Ди (4-хлорфенил)-2,2,2-трихлорэтан. ЗЧЯ ‒ задняя черепная ямка КТ ‒ компьютерная томография КР – Кыргызская Республика МРТ ‒ магнитно-резонансная томография ММУ ‒ мостомозжечковый угол НГ – Национальный госпиталь ОГМ ‒ опухоли головного мозга ПДК ‒ предельно допустимая концентрация ПОГМ ‒ первичные опухоли головного мозга РМИЦ – республиканский медико-информационный центр ТЭЦ ‒ Теплоэлектроцентраль ХСО ‒ хиазмально-селлярная область ЧМТ ‒ черепно-мозговая травма ЭЭГ – электроэнцефалография ЭХО ЭГ - эхоэнцефалография 4 ВВЕДЕНИЕ Актуальность темы диссертации В структуре онкологических заболеваний особое место занимают опухоли головного мозга, составляющие лишь около 2% всех онкологических больных, но при этом летальность при них достигает 7% от всех умерших от онкопатологии, также остается высокой послеоперационная летальность по сравнению с результатами хирургического лечения новообразований других локализаций [Зозуля Ю.А. и др., 1998; Олюшин В.Е., 1998; Давыдов М.И., 2006; Сафин Ш.М., 2006; Улитин А.Ю., 1997; Дюсембеков Е.К.,2010; Legler J.M., 1999; Davis F.G., 2001; Wrensch M., 2001; Mueller B.A., 2001; Мarugame T., 2006; Sundeep D., 2006]. Данное заболевание, нанося значительный социально-экономический ущерб обществу, ставит задачу помощи этой категории больных в число наиболее актуальных в нейрохирургии и организации здравоохранения [Абдрахимов Б.Е., 1986; Камалова Г.М., 1995; Захматова Т.В., 2000; Давыдов М.И., 2006; Ишматов Р.Ф., 2007; Kaplan S., 1997; Robertson P.L., 1998; Wrensch M., 2002; Marugame T., 2006]. Большое количество широкомасштабных исследований, посвященных распространенности новообразований головного мозга, свидетельствует о возрастающей заболеваемости первичными опухолями головного мозга (ПОГМ) во всех регионах мира. Выявлены возрастные, гендерные, географические, расово-этнические отличия, а также разнообразные факторы риска развития ОГМ. Несмотря на широкое нейровизуализационных методов (КТ, МРТ), развитие современных на современном этапе по- прежнему остается высокой частота не распознанных при жизни опухолей головного мозга [Улитин А.Ю., 1997; Давыдов М.И., 2006; Дюсембеков Е.К., 2008; Fogelholm R., 1984; Sundeep D., 2006]. Результаты проведенных исследований остаются крайне разноречивыми, кроме вышеуказанных особенностей, они зависят от задач, стоявших перед исследователями, и методик сбора материала в разных регионах мира [Поляков 5 И.В. и др., 1995; Улитин А.Ю., 1997; Ярцев В.В. и др., 1997; Зозуля Ю.А. и др., 1998; Сафонова И.А., 2000; Лосев Ю.А., 2003; Можейко Р.А., 2004; Заридзе Д.Г., 2002; Дюсембеков Е.К., 2010]. В последнее время широкое применение методов нейровизуализации, микрохирургической техники, современных методов лучевой и химиотерапии обозначило перспективы своевременной и адекватной диагностики и лечения опухолей головного мозга. В этих условиях проведение клинико- эпидемиологических исследований в нейроонкологии приобретает особую актуальность для понимания причин развития и распространенности ОГМ в различных социально-географических зонах, а также особенностей их клиникофункционального течения. Их результаты ̶ основа для планирования профилактических и лечебно-диагностических мероприятий с целью снижения заболеваемости и смертности населения от ОГМ [Смулевич В.Б., 2000; Заридзе Д.Г., 2002; Doll R., Peto R., 1981]. Исходя из этих исследований разрабатываются регионарные и общегосударственные онкологические программы с принятием аргументированных управленческих решений [Чаклин А.В., 1982; Поляков И.В., 2002; Улитин А.Ю., 1997; Чиссов В.И., 2002; Davis F., 1996; Pobereskin L.H., 2000]. Однако до настоящего времени клинико-эпидемиологических исследований ОГМ в нашей стране не проводилось. Таким образом, высокая социальноэкономическая значимость данного заболевания, недостаточная изученность факторов риска его развития, трудности ранней диагностики и высокая летальность требуют совершенствования организационных мероприятий по своевременному выявлению и эффективной тактике лечения ОГМ в Кыргызской Республике. Учет заболеваемости в различных географических и административных районах республики позволит решить вопросы рациональной организации специализированной нейрохирургической помощи больным с ОГМ. 6 Цель исследования На основании результатов клинико-эпидемиологических исследований первичных новообразований головного мозга (ПОГМ) среди населения г.Бишкека и Чуйской области разработать научно обоснованные рекомендации по совершенствованию специализированной нейрохирургической помощи больным с ПОГМ. Задачи исследования: 1. Изучить заболеваемость, гисто-топографическую структуру, возрастные и гендерные особенности ПОГМ среди населения г. Бишкека и Чуйской области. 2. Определить клинические проявления ПОГМ и причины их позднего выявления. 3. Провести анализ качества диагностики и лечения больных с ПОГМ. 4. Разработать клинико-диагностические рекомендации по совершенствованию специализированной нейрохирургической помощи при ПОГМ. Научная новизна Впервые в Кыргызской Республике на основе эпидемиологического метода исследования изучены частота, гистологическая структура ПОГМ среди городского и сельского населения Чуйской области КР, дан прогноз заболеваемости ОГМ на ближайшее время. Выявлены основные клинические проявления ПОГМ, причины поздней диагностики в различных группах больных в зависимости от гистологической структуры, возраста и пола. Установлено запоздалое выявление ПОГМ у 88,5% больных, что обусловлено латентностью течения заболевания, сопутствующей полиморбидностью на догоспитальном этапе и особенно ̶ низкой онкологической настороженностью врачей первичного звена. Практическая значимость полученных результатов Полученные сведения о заболеваемости и смертности от ПОГМ имеют практическое значение для научно обоснованного планирования, организации 7 нейроонкологической помощи и разработки медико-экономических стандартов лечения. Выявленные тенденции динамики и географии новообразований головного мозга позволят эффективно использовать кадровый потенциал и материальные ресурсы медицинских учреждений страны, занимающихся оказанием лечебнопрофилактической помощи нейроонкологическим больным. Результаты клинико-статистического анализа, проведенного в ходе исследования, обнаружили основные клинические проявления опухолей головного мозга, определили варианты их течения, что может способствовать повышению эффективности их выявления на догоспитальном этапе. Основные положения диссертации, выносимые на защиту: 1. Среднегодовая заболеваемость ПОГМ среди жителей Чуйской области составила 2,9 на 100 тыс. населения, среди жителей г. Бишкека – 3,1 на 100 тыс. населения. Отмечается линейный рост данного показателя: для Чуйской области ‒ на 6,9% в год, для г. Бишкека – на 12,9% в год. Пик заболеваемости ОГМ приходится на возраст пациентов 55‒64 года, что составляет 8,9 случая на 100 тыс. населения в данном возрастном диапазоне. 2. Среди первичных опухолей головного мозга наибольший удельный вес занимают оболочечно-сосудистые опухоли, составляя 44,8%, и глиомы‒ 38,2%. Существенно редки опухоли гипофиза (9,3%), опухоли черепно-мозговых нервов (4,9%) и регистрировались турецкого глиомы седла (2,1%). (71,0%), реже ̶ У детей наиболее менингиомы часто (12,9%) и медуллобластомы (19,0%). У лиц среднего возраста ‒ глиомы (41,6%), менингиомы (31,4%) и аденомы гипофиза (12,4%); доля медуллобластом уменьшается. Для старших возрастных групп (>55 лет) среди ПОГМ преобладают менингиомы, доля которых составляет 57,1%, глиомы (25,6%), аденомы гипофиза (9,1%) и опухоли черепно-мозговых нервов (4,5%). 3. Более 40% больных поступают в стационар с опухолями больших и гигантских размеров, причем опухоли больших размеров чаще характерны для супратенториальной локализации и менингиом. 8 В стадии начальных клинических проявлений поступают только 0,7% больных, с умеренными клиническими проявлениями проявлениями – 58,7 и – 31,1%, с выраженными клиническими 9,4% больных госпитализируются в состоянии декомпенсации. Установлена высокая частота поступлений в стационар больных в тяжелом состоянии, имеющих инвалидность, с нарушениями сознания, чаще характерными для детей (в 90% случаев), пожилых пациентов (в 70 ̶ 80% случаев) и пациентов с большими размерами ОГМ (более 3 см). 4. Течение послеоперационного периода у каждого четвертого пациента носит осложненный характер (общая среднегодовая частота осложнений достигает 27,6%). Послеоперационная летальность составила 8,3% случаев. Главной причиной запоздалого выявления ПОГМ остается низкая онкологическая настороженность врачей первого контакта. Так, лишь у 11,5% нейроонкологических больных отсутствовали недостатки диагностического процесса на догоспитальном этапе. 5. Заболеваемость ПОГМ, имеющая тенденцию к росту, в 2017 г. составит по ̶ Чуйской области 4,8 на 100 тыс. населения, по г. Бишкеку 6,6 на 100 тыс.населения. Внедрение в практику Результаты клинической исследования, картины, касающиеся диагностики и клинической лечения эпидемиологии, ПОГМ, внедрены в практическую деятельность врачей нейрохирургических и неврологических отделений Национального госпиталя, в учебный процесс кафедры. Личный вклад соискателя Автором лично осуществлялся анализ литературных данных, документов Национального статистического (Демографический ежегодник комитета Кыргызской Республики за 2006 ̶ 2010 гг. г. Бишкека), набор клинического материала, изучались данные историй болезни пациентов нейрохирургических отделений, операционных журналов, медицинских карт радиологического отделения, протоколов патолого-анатомических исследований, а также результатов хирургического лечения. 9 Апробация результатов исследования Основные положения и выводы диссертационной работы представлены на конференции нейрохирургов (г. Ош, 2012), на совместном заседании сотрудников кафедры нейрохирургии до и последипломного образования КГМА им. И.К. Ахунбаева и нейрохирургов Национального госпиталя МЗ КР (г. Бишкек, 2014), на XX Азиатском конгрессе нейрохирургов (г. Астана, 2014) Публикации По материалам диссертации опубликованы 8 научных работ. Утверждены два рационализаторских предложения: свидетельство №787 от 31.12.14 г., №788 от 31.12.14 г., выданных Кыргызпатентом. Структура и объем диссертации Диссертационная работа изложена на 152 страницах. Состоит из введения, пяти глав, выводов, практических рекомендаций, списка использованной литературы (159 источника авторов ближнего и дальнего зарубежья), содержит 28 рисунка, включая диаграммы и графики, и 46 таблиц. 10 ГЛАВА 1 ЭПИДЕМИОЛОГИЯ ПЕРВИЧНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА (ОБЗОР ЛИТЕРАТУРЫ) В настоящее время эпидемиология, первоначально изучавшая распространение инфекционных заболеваний, трансформировалась в науку об изучении причин и условий возникновения, распространения неинфекционных заболеваний: сердечно-сосудистых, онкологических, травматологических поражений и других состояний в различных популяциях. Результаты клиникоэпидемиологических исследований позволяют получить наиболее достоверные характеристики здоровья населения и определить приоритеты охраны здоровья населения, основных направлений реформирования здравоохранения с целью эффективного распределения крайне ограниченных ресурсов, выделяемых на его развитие [Берснев В.П. и др., 1999; Лосев Ю.А., 2003; Власов В.В., 2004; Кондратьева Е.В., 2011]. В структуре онкологических заболеваний особое место занимают опухоли головного мозга (ОГМ), которые составляют лишь около 2% всех онкологических больных, между тем летальность при них достигает 7% от всех умерших от онкопатологии. Высокий социальный и экономический ущерб, который данная патология наносит обществу, ставит задачу помощи этой категории больных в число наиболее актуальных в нейрохирургии и организации здравоохранения [Улитин А.Ю., 1997; Ярцев В.В. и др., 1997; Зозуля Ю.А. и др., 1998; Алексеев А.Г., 2005; Давыдов М.И., 2006; Davis F.et al., 1996; Wrensh M. et al., 2000; Mueller B.A. et al., 2001]. По данным научной литературы, заболеваемость первичными опухолями головного мозга (ПОГМ) колеблется в очень широких пределах ̶ от 3,1 до 16,5 случая на 100 000 населения [Шебзухова Л.М., 1995; Улитин А.Ю., 1997; Бурнин С.М. и др., 2005; Дюсембеков Е.К.,2010; Ahlbom A., 1990; PrestonMartin S., 1996; Kuratsu J., Ushio Y., 1997; Robertson P.L., 1998; Davis F.et al., 1996; Wrensh M. et al., 2000; Mueller B.A. et al., 2001]. 11 Согласно результатам многолетних эпидемиологических исследований, проведенных в экономически развитых странах, рост заболеваемости ОГМ отмечается повсеместно. Так, по данным De Ross A.J., (2003), в США в 1990 г. заболеваемость ПОГМ на 100 тыс. населения составляла 8,2, в 1995-м – 10,9, в 2000-м ‒ 12,8, в 2003 г. – 14,4, такие же данные, почти двукратный прирост ОГМ за предыдущие 20 лет наблюдений, констатировали Farwill G.R. et al. (1984) и Preston-Martin (1996). S. Аналогичные данные приводятся исследователями Скандинавских стран [Johannessen T.B. et al., 1999], Японии [Marugame T., Kamo K.I., 2006], Австралии [Werner M.H. et al., 1999]. Основной причиной данной ситуации большинство авторов признают ухудшение экологической обстановки на планете, свидетельство чему ‒ более частая выявляемость ОГМ в индустриально развитых странах. Важная роль внешней среды в онкогенезе распространенности подтверждается ОГМ неблагоприятных районах в почти экологически двукратной чистых и разницей экологически одного города, в частности в Санкт-Петербурге [Олюшин В.Е. и соавт., 2002; Улитин А.Ю., 1997]. Повышение уровня развития онкологических заболеваний, в том числе опухолей головного мозга, преимущественно в экономически развитых странах ассоциируется с уровнем загрязнения атмосферного воздуха [Можейко Р.А.,2004]. К другим источникам загрязнения внешнего воздуха относятся промышленные выбросы, например, электростанций, работающих на угле, металлургических и целлюлозно-бумажных предприятий, являющихся основным источником выделения двуокиси серы. Как известно, химические реакции между полициклическими ароматическими углеводородами и диоксидом азота при участии солнечного света приводят к образованию тропосферного азота, одного из самых распространенных и опасных веществ, загрязняющих воздух [Ostro et al., 2005]. Соответственно клинико-эпидемиологические исследования ОГМ имеют особую актуальность в нейрохирургии и организации здравоохранения во 12 многих регионах мира [Шебзухова Л.М., 1995; Улитин А.Ю., 1997; Ярцев В.В. и др., 1997; Зозуля Ю.А. и др., 1998; Сафонова И.А., 2000; Лосев Ю.А., 2003; Можейко Р.А., 2004; Дюсембеков Е.К.,2010; Parkin D.M, 1988; Kellio M. et all., 1991; Riggs J.E., 1995; Preston-Martin S., 1996; Kuratsu J., Ushio Y., 1997; Davis F.et al., 1996; Wrensh M. et al., 2000; Marugame T., Kamo K.I., 2006; Arora R.S. et al., 2009]. Важную роль экологических факторов в нейроонкогенезе подчеркивают многие исследователи [Лосев Ю.А.,2003; Можейко Р.А., 2004; Дюсембеков Е.К.,2010; Boyle P. et al., 1990; Riggs J.E., 1995; Helseth A., 1995; Polednak A.P., 1996]. Между тем наиболее низкая заболеваемость первичными ОГМ в Японии установлена в городе Хиросима, который, как известно, в 1945 г. подвергся атомной бомбардировке армии США, что противоречит установившемуся мнению о роли радиоактивного загрязнения как фактора риска развития ОГМ [Yonehara S., 2004]. Выявляемые различия в заболеваемости ПОГМ в разных регионах мира, помимо социально-экономических особенностей проживания населения, обусловлены такими факторами, как урбанизация, загрязнение окружающей среды, характер питания, а также разными задачами, стоявшими перед исследователями, и методикой сбора материала [Улитин А.Ю., 1997; Ярцев В.В. и др., 1997; Зозуля Ю.А. и др., 1998; Сафонова И.А., 2000; Вахитов Ш.М. и др., 2003; Лосев Ю.А., 2003; Можейко Р.А., 2004; Кондаков Е.Н., 2008; Дюсембеков Е.К., 2010; Заридзе Д.Г., 2002]. Так, например, по данным Ibrahim A.W. (1992), заболеваемость ПОГМ в Саудовской Аравии составляет лишь 3,1 на 100 тыс. населения в год. Очевидно, что автор анализировал только данные отчетов нейрохирургических отделений и это обстоятельство связано с особенностями менталитета большинства мусульманских стран, фактически исключающих патологоанатомическое исследование умерших. Без учета данных аутопсии истинная распространенность ОГМ в странах Ближнего Востока искажена, тем более известно, что от 30 до 43% ОГМ выявляются только на аутопсии [Улитин А.Ю., 13 1997]. Односторонний характер носят и данные по заболеваемости ОГМ в Республике Казахстан (3,1 на 100 тыс. населения), которые приводит Е.К. Дюсембеков (2010), изучивший распространенность только злокачественных ОГМ глиального характера. Несомненно, общая заболеваемость ОГМ в Казахстане является более высокой. Таковы и данные по Беларуси [Терехов В.С., Короткевич Е.А., 2006]. Ещё более низкие показатели приводят Ansari N.A., Al-Hilli F. (2005): в Бахрейне заболеваемость ПОГМ с 1952 по 2004 год составляла лишь 0,29 случая на 100 тыс. населения в год, что свидетельствует о неудовлетворительном уровне выявляемости данного заболевания в этой стране. Как отмечено выше, к регионам с высокой распространенностью ОГМ относятся страны Северной Америки и Япония. Так, по данным De Ross A.J. (2003), в США за период с 1998 по 2002 год заболеваемость ПОГМ составляла 14,4 на 100 тыс. населения в год. В Канаде ̶ 11,1 [Pirouzmand F., Sadanand V., 2007]. По данным японского регистра заболеваемости ОГМ регистрировалось 10,2 случая ПОГМ на 100 тыс. населения в год [Kuratsu J., Ushio Y., 1997; Marugame Т., 2006]. По данным Европейского национального онкологического регистра (ENCR), за 1998 г. заболеваемость ПОГМ составляла в среднем 7,7 на 100 тыс. населения. При этом самая высокая цифра по Европе отмечалась в Швеции – 14,5 на 100 тыс. населения в год и в Греции – 14,3. Наиболее низкая заболеваемость регистрировалась в Нидерландах – 5,93, во Франции – 6,51, в Австрии – 6,18 и Ирландии – 6,84 на 100 тыс. населения в год. Другие страны Западной Европы относят к регионам с умеренной распространенностью ОГМ, где частота данной патологии варьировала от 9,21 на 100 тыс. населения в год в Великобритании [McNally R.J., 2004], до 11,1 в странах Балканского полуострова [Tuskan-Mohar L., Materljian E., 2004]. Несомненный интерес представляют исследования по распространенности ОГМ, проведенные в различных регионах Российской Федерации и странах бывшего СССР. По данным Улитина А.Ю. (1997), в Санкт-Петербурге 14 распространенность впервые выявленных ОГМ составила 13,9 на 100 тыс. населения в год, а в сельской местности Ленинградской области ‒ 7,42 [Лосев Ю.А., 2003]. Аналогичная ситуация складывается и в других регионах России: в Кабардино-Балкарии ̶ 7,04 [Шезбухова Л.М., 1995]; в Ростове-на-Дону ‒ 6,7 [Балязин В.А. и соавт., 2000]; в Ставропольском крае – 9,2 [Можейко Р.А., 2004]; в Калининградской области – 7,9 [Горенштейн А.Е.,2009]; заметно меньше в Татарстане ̶ 4,16 случая на 100 тыс. населения [Алексеев А.Г., 2005]. Согласно результатам вышеуказанных эпидемиологических исследований в Санкт-Петербурге [Олюшин В.Е. и соавт.,1998; Улитин А.Ю., 1997], на наш взгляд, наиболее масштабным и методичным, крайне важным является то, что 49% обнаруженных на аутопсии ОГМ были доброкачественным и при своевременной диагностике могли быть успешно удалены. Преобладание среди выявленных новообразований головного мозга опухолей больших (40%) и гигантских (42%) размеров свидетельствует о низком уровне диагностики в современном мегаполисе, каким является Санкт-Петербург, не говоря уже о провинции. Таким образом, следует констатировать, что в целом по России выявляемость ОГМ гораздо ниже истинной цифры заболеваемости. На высокую выявляемость ОГМ в высокоразвитых странах благоприятно влияет наличие множества благотворительных организаций, обществ пациентов, страдающих новообразованиями различных локализаций, а также форумов, гостевых страниц сайтов лечебных учреждений, позволяющих пациентам получить ответы на интересующие вопросы по электронной почте или в режиме on-line. Таким образом, в настоящее время охват населения современными информационными технологиями является одним из важных факторов, влияющих на выявляемость ОГМ и приобретающих всё большее значение в будущем [Терехов В.С., Короткевич Е.А.,2006; Tuskan-Mohar L., Materljian E., 2004]. Определенное влияние на статистические показатели частоты выявления ОГМ оказывает повышение общей культуры просвещения населения. Следует учесть и 15 и уровня санитарного психологический фактор онконастороженности населения, активизирующий обращаемость в медицинские учреждения [Терехов В.С., Короткевич Е.А., 2006; Tuskan-Mohar L., Materljian E.,2004]. Достоверность немногочисленных эпидемиологических данных в других странах СНГ также далека от реальности, поскольку учет показателей заболеваемости и ее распространённости проводится двумя независимыми друг от друга организациями. Опухоли злокачественного ряда (код МКБ С70-С72) учитываются службами онкологического диспансера [Мартынов Б.В. и соавт., 2002; Терехов В.С., Короткевич Е.А., 2006]. А новообразования ЦНС доброкачественного ряда (код МКБ D32-D33) ‒ обычно невропатологами и нейрохирургами. Таким образом, проблема двойного учёта церебральной опухоли не может не отражаться на статистических показателях. На постсоветском пространстве за пределами России эпидемиологические исследования малочисленны, отсутствует комплексность, не отражены региональные особенности распространения ОГМ в пределах одной страны. В Украине, Беларуси, Молдове эпидемиологические ограничивались только учетом ОГМ у больных исследования нейрохирургических учреждений. Так, следующие авторы приводят не эпидемиологические, а по сути клинико-статистические данные по заболеваемости ПОГМ [Зозуля Ю.А. и др., 1998; Терехов В.С., Короткевич Е.А., 2006; Dumitrescu G. и соавт.,1995]. Исследования других авторов справедливо подчеркивают необходимость широкомасштабных эпидемиологических исследований для разработки и осуществления регионарных и общегосударственных программ по решению вопросов оказания своевременной и квалифицированной медицинской помощи больным с ОГМ с принятием аргументированных управленческих рекомендаций [Зозуля Ю.А. и соавт., 1998; Розуменко В.Д., 2006; Терехов В.С., Короткевич Е.А.,2006]. При изучении заболеваемости ОГМ в различных материковых зонах проживания установлено, что, например, на Тайване она достоверно ниже, чем в материковом Китае, Америке, Германии, Японии. В целом ОГМ в Азии 16 встречаются реже, чем в Америке [Hwang S.L. et al., 1992; Tuskan-Mohar L. et al., 2004]. Интересные сведения получены при изучении расовых, этнических различий в распространенности инцидентность определяется первичных среди ОГМ, европеоидного и максимальная населения США и индустриально развитых стран Европы, в то время как представители негроидной и особенно монголоидной расы заболевают реже [Preston-Martin S. et al., 1996; David N.L.,2004]. Большинство авторов данные факты связывают с генетической предрасположенностью. Несомненно, важное место занимают уровень материального благополучия, доступность медицинской помощи и контроль пациента над собственным здоровьем в указанной части населения [Greenwald P., 1981; Cella D., 1998]. Для нашей высокогорной республики важные данные получены в Дагестане, где заболеваемость ОГМ в горной и высокогорной местности (15,2% населения) составила 25,8 на 100 тыс. человек, тогда как в предгорьях и низинах (58,9% населения) ̶ 5,6 наблюдения на 100 тыс. населения [Умаханов Р.У.и соавт.,1990]. Таким образом, среди жителей высокогорных районов в отличие от жителей низменностей и предгорий заболеваемость ОГМ почти в 5 раз чаще. Любопытные сведения приводит Кондратьева В.А. (2011) о связи между ритмом солнечного излучения, геомагнитных бурь и возникновением первичных ОГМ [Бреус Т.К., 2005; Кондратьева В.А.,2011]. Согласно клинико-статистическим данным второй половины ХХ в. касательно возрастных особенностей ОГМ, опухолям головного мозга подвержены лица любого возраста, между тем среди детей наиболее часты медуллобластомы, краниофарингиомы, астроцитомы, которые редки в возрасте старше 60 лет, а менингиомы, невриномы слухового нерва являются казуистикой. Среди пожилых наиболее часты менингиомы, глиобластомы, невриномы и МТС. Возрастной пик заболеваемости ОГМ приходится на период 40 ̶ 60 лет [Раздольский И.Я., 1957; Бабчин И.С., Бабчина И.П.,1973; Ромоданов А.П.,1993]. Долгое время эти данные были неизменными и кочевали из одной монографии в другую. Лишь проведенные 17 позже широкомасштабные эпидемиологические исследования по-иному выстроили возрастные критерии при ОГМ. Так, по данным белорусских нейроонкологов, наибольшая частота встречаемости первичных ОГМ ̶ в возрастных группах от 45 ̶ 49 до 65 ̶ 69 лет, а резкое снижение показателя в возрастной группе старше 70 лет связано с увеличением абсолютного числа населения ввиду увеличения возрастного интервала [Терехов В.С., Короткевич Е.А., 2006]. Эти же авторы пришли к выводу: на возрастной показатель частоты встречаемости влияет лишь количество выявленных ОГМ и численность населения данной возрастной группы. В Норвегии пик заболеваемости охватывает возраст от 55 до 64 лет с последующим снижением уровня заболеваемости, в Финляндии самая высокая заболеваемость ОГМ приходится на 6-е и 7-е десятилетия жизни ̶ 10,5 и 8,9 на 100 тыс. населения [Kallio М., 1991]. Весьма неожиданны данные бразильских авторов: в Южной Бразилии ПОГМ чаще всего выявляются в возрасте от 20 до 29 лет и от 50 до 59 лет с пиком заболеваемости в 35- летнем возрасте [Torres L.F., Almeida R., Avila S., 1990]. У детей ОГМ занимают второе место среди всех онкопоражений после опухолей кроветворной и лимфатической систем [Kустов В.И. и соавт.,1990; Зозуля Ю.А. и др., 1998; Орлов Ю.А., 2000; Можейко P.A., 2004; Давыдов М.И.,2006]. В Канаде уровень заболеваемости у детей равен 4,03‰, аналогичны показатели по США, Англии, Германии, Финляндии и другим странам Западной Европы [Battistella P.A. et al., 1990; Smith M.A., Freidlin B., 1998]. В Японии распространенность ОГМ среди детей составила 2,5 больного на 100 тыс. населения в год. Сходные данные представлены для Китая – 1,99 случая на 100 тыс. детей. Значительно меньшая заболеваемость новообразованиями головного мозга регистрируется в африканских странах – 0,42 ‒ 0,49 на 100 тыс. детей, и, напротив, более высокие значения данного показателя характерны для западноевропейских стран ‒ 3,1 ‒ 3,4 случая на 100 тыс. детей в год [Parkin D.M., 1988]. При этом 70% всех ОГМ составляют нейроэктодермальные внутримозговые опухоли при явном превалировании глиом, медуллобластом и 18 эпендимом, и, как правило, медуллобластомы в 2 раза чаще встречаются у мальчиков. Согласно данным литературы прежних лет, у детей 2/3 ОГМ локализуются субтенториально, у взрослых, наоборот, супратенториально. По новым сведениям, у детей субтенториально ОГМ располагаются всего в 40% случаев, и наоборот. Старые тезисы верны в следующем: у детей большая часть новообразований располагается срединно и чаще они внутримозговые, глиального характера [Орлов Ю.А., 2000; Хилько В.А. и соавт., 2003; Коновалов А.Н., 2004; Можейко P.A., 2004]. У лиц пожилого и старческого возрастов, согласно широкомасштабным эпидемиологическим исследованиям конца ХХ в., значительное место среди причин, приводящих к смерти, занимают ОГМ [Улитин А.Ю., 1997; Ярцев В.В. и др., 1997; Kallio M. et all., 1991; Kuratsu J., Ushio Y., 1997; Riggs J.E., 1995; Preston-Martin S., 1996; Helseth A., 1997]. Увеличение средней продолжительности жизни закономерно увеличило частоту возникновения ОГМ у лиц пожилого и старческого возрастов, причем в возрасте старше 60 лет с каждыми последующими 10 годами жизни вероятность развития опухоли повышается на несколько порядков, что обусловлено общебиологическими принципами развития и старения человеческого организма. Нынешняя демографическая ситуация является беспрецедентной, человечество стоит на пороге «глобального постарения» населения планеты, причем пожилой контингент становится старше, доживая до 80 лет и более [Мелентьев А.С. и др., 1995; Котельников Г.П. и др., 1997; Шабашова Н.Я. и др., 2001; Hazzard W.R., 1993; Riggs J.E., 1995; Ebrahim S. аnd Kalache A., 1996]. Соответственно в высокоразвитых в социально-экономическом отношении странах со средней продолжительностью жизни 75 ‒ 85 лет регистрируют более высокие показатели заболеваемости ОГМ. В Швейцарии, например, наиболее высокие уровни заболеваемости ПОГМ в возрастных группах до 75 лет [Levi F. et al.,1990]. Но наиболее показательны они в США: в 1968 ‒ 1988 гг. показатели смертности от ОГМ среди населения в возрасте 65 ̶ 74 возросли до 50%, в 19 возрасте 75 ‒ 84 ‒ до 200% и до 800% в более старшей возрастной группе [Modan B. et al., 1992; Riggs J.E., 1995]. По мнению большинства авторов, такое драматическое увеличение определяющими факторами: смертности обусловлено несколькими более высокая выявляемость новообразований головного мозга благодаря внедрению КТ и МРТ в 80-х годах; увеличение доли старших возрастных групп среди пожилых; распространенность метастатических ОГМ, так как возрастной пик онкологических заболеваний приходится на рассматриваемую группу больных; наличие специальных медицинских программ, направленных на улучшение качества медицинской помощи пожилым людям. В тех странах, где в структуре населения преобладают лица пожилого и старческого возрастов, высок уровень заболеваемости населения ОГМ. Поэтому сопоставление данных о заболеваемости по странам должно проводиться с учетом возрастной структуры населения [Василевский М.Г.,1999; Дюсембеков Е.К., 2008; Greig N.H. et al., 1990; Boyle P. et al., 1990; Riggs J.E., 1995; Helseth A., 1995; Polednak A.P., 1996; Fathallah-Shaykh H.M. et al., 1998; Bernard W.S., 2003]. Безусловно, гисто-топографические особенности ПОГМ в значительной степени определяют проводимой терапии, особенности а также течения заболевания, продолжительность эффективность жизни пациентов. Общеизвестно, что супратенториальное расположение процесса регистрируется у взрослых в 2 ‒ 3 раза чаще, чем субтенториальное, а у детей наблюдается обратное соотношение [Арендт А.А., 1961; Артанян А.А., 1979; Chrisrensen H., 2003]. При этом распределение опухолей относительно намета мозжечка зависит от гистологической структуры. Характерным для астроцитом и глиом является их преимущественное расположение в лобных и височных долях головного мозга, на долю которых приходится 44 ‒ 67% всех глиом. Теменная доля поражается в 3 ‒ 14% случаев, затылочная ‒ в 2 ‒ 6% [Артанян А.А., 1979; Chrisrensen H., 2003]. Мозжечковая локализация глиом у взрослых встречается в 6 ‒ 9% случаев, в то время как у детей достигает 38 ‒ 44%. Локализация ПОГМ в других отделах мозга (боковые 20 желудочки, III и IV желудочки, ствол мозга) достаточно редка и не превышает 17 ‒ 20% от всех интракраниальных новообразований. Сходные данные приводит Савченко А.Ю. (1997), который в 75% случаев выявил супратенториальное расположение первичных ОГМ. При этом глиомы чаще локализовались в височной, лобной и теменной долях. Среди новообразований задней черепной ямки (ЗЧЯ) опухоли мозжечка диагностировались в 15,1% наблюдений, первичное поражение ствола мозга – в 1,8% случаев, желудочков мозга – в 7,1%. Мультицентрическое расположение опухолей отмечалось в 24%, причем существенно чаще у детей. Излюбленной локализацией медуллобластом оказались мозжечок и IV желудочек (97,1% случаев). Дюсембеков супратенториальных Е.К. (2010) опухолей над также сообщает о преобладании субтенториальными, при этом внутримозговые глиомы чаще локализовались в теменной и лобной долях головного мозга. Судя по данным диссертации Дюшеева Б.Д. (2000), посвященной опухолям ЗЧЯ у лиц пожилого и старческого возраста по данным материала НИИ им. Бурденко, новообразования такой локализации составляют 15,2% от всех ПОГМ. Доброкачественные менингиомы и невриномы составляли 34,2 и 40,3% соответственно. При этом для больных пожилого и старческого возрастов характерными внутримозговые оказались опухоли метастатические мозжечка опухоли ЗЧЯ, (гемангиобластомы, а первичные астроцитомы, эпендимомы) представлены единичными наблюдениями. Отметим, среди различных гистологических подтипов ОГМ наиболее распространены глиальные опухоли. В США это более 50% всех случаев ОГМ, а в Российской Федерации ‒ 48 ‒ 56% [Wrensch М. et al., 2002; Smith M.A., 2006; Шебзухова Л.М., 1995; Улитин А.Ю.,1997; Балязин В.А. и соавт., 2000; Можейко Р.А., 2003; Ковалев Г.И., 2006; Горенштейн А.Е.,2009]. В Китае и Германии их частота была несколько ниже, составляя до 43%. В Мексике и Японии глиомы регистрировались соответственно в 33 и 27% случаев. Доля менингиом и неврином слухового нерва в указанных странах оказалась 21 приблизительно сопоставимой, составив 17 ‒ 22% и 6 ‒ 9% случаев ОГМ. Аденомы гипофиза в Мексике и Японии регистрировались в 24 и 13% от всех ОГМ, а в США, Германии и Китае – 5% и 7% соответственно [Hwang S.L. et al., 1992; Tuskan-Mohar L. et al., 2004]. Любопытны данные о распространенности опухолей шишковидной железы, так, например, в Японии они составляют 5 ‒ 15% всех ОГМ, выявляемых у детей, в то время как в других странах мира их частота не превышает 0,1 – 0,5%. Объяснений этому феномену до настоящего времени нет. Лимфомы, вторая по частоте среди гистологических групп ОГМ в США, связывается со СПИДом, колоректальным раком, раком мочевого пузыря [Ahsan H. et al., 1995]. Schlehover B. et al. (1992) установили, что у женщин в состоянии менопаузы, обусловленной хирургической овариэктомией и отсутствием продукции эстрогенов, риск возникновения менингиом головного мозга в 8 раз меньше, чем в контрольной группе. Наиболее часто клинические проявления менингиом наблюдаются во второй половине беременности, т.е. когда уровень прогестерона наивысший, а эстрогена ̶ наименьший, в период наибольшей секреции женских половых гормонов. Установлено, что у больных раком молочной железы риск появления менингиомы в 2,4 раза выше, чем у остальных женщин. Анализ данных литературы по изучению гендерных различий в распространенности первичных ОГМ раскрывает неоднозначность результатов исследований. В частности, Gitty A.C. et al. (1998) сообщают о большей распространенности ПОГМ среди мужчин по сравнению с женщинами в Нидерландах (6,5 и 4,4 случая на 100 тыс. населения соответственно). По данным Klaeboe L. et Hall P. (2004), проводивших исследования в Скандинавских странах, заболеваемость ПОГМ была также выше у мужчин и варьировала в пределах 8,4 ‒ 11,8 на 100 тыс. населения в год, в то время как у женщин аналогичный показатель не превышал 5,8 ‒ 9,4 случая. 22 Однако в ряде других исследований сообщается о преобладании женщин в структуре ПОГМ. Так, согласно результатам итальянских исследователей [Ferrari G. et al., 1985], заболеваемость ПОГМ на Аппенинском полуострове составила 9,1 случая на 100 тыс. населения у женщин и 8,5 ‒ у мужчин. Аналогичные результаты приводит Johannessen T.B. (1999), который, опираясь на данные Норвежского онкологического регистра, выявил большую заболеваемость ОГМ у женщин в сравнении с мужчинами (16,2 и 14,7 случая на 100 тыс. населения в год соответственно). О большей частоте ПОГМ среди женщин сообщают многие российские исследователи. Так, Улитин А.Ю. (1997) отмечал в 1,5 раза более высокую заболеваемость ПОГМ среди женской популяции г. Санкт-Петербурга. Причем данная тенденция была характерна для всех возрастных категорий обследованных. По данным Горенштейна А.Е. (2009), заболеваемость ПОГМ по Калининградской области среди женщин в 1,3 раза превысила аналогичный показатель среди мужчин. Тем не менее ряд исследователей свидетельствуют о несущественных гендерных различиях в заболеваемости ПОГМ в разных регионах мира [Раздольский И.Я.,1957; Бабчин И.П.,1973; Смулевич В.Б., 1983; Алексеев А.П.,2005; Горенштейн А.Е., 2009; Berens, M.E., 1990; Torres L.F. et al., 1990; Warner M.H. et al., 1999; Smith М. et al., 2006]. Таким образом, распространенность опухолевых заболеваний головного мозга зависит от пола, а также от региональной принадлежности: в одних регионах преимущественно болеют лица мужского пола, в других ̶ женского. Распространенность ПОГМ, как и других онкозаболеваний, напрямую связана с факторами риска (ФР), впервые о которых стали говорить в связи с результатами Фремингемского исследования в США [Sytkowsky P.A. et al., 1990; Posner B.M. et al., 1995]. Известный американский эпидемиолог Kannel W. (1984), осуществлявший данное исследование, дал следующую формулировку ФР: «Фактор риска является характеристикой лица (демографической, анатомической, физиологической), которая увеличивает вероятность (риск) того, что у этого лица разовьются некоторые проявления определенного 23 заболевания». Он рассматривает факторы риска не только как корреляции с инцидентом заболевания, но и как причину, выделяя при этом как изменяемые (модифицированные), так и неизменяемые (немодифицированные) ФР (возраст, пол, семейный анамнез). В 1976 г. была сделана попытка дать определение ФР исходя из потребностей профилактической медицины [Метелица В.И., Мазур Н.А., 1976]. Согласно их определению, ФР – это ряд факторов внешней и внутренней среды, которые: во-первых, ассоциируются с большим распространением заболевания по данным одномоментных популяционных исследований; во-вторых, связаны с большей частотой возникновения новых случаев болезни по данным проспективных эпидемиологических исследований; в-третьих, воздействие на эти факторы или, как говорят, их контролирование может привести к уменьшению риска возникновения болезни. Как известно, изучение факторов риска развития того или иного заболевания имеет целью проведение соответствующих профилактических мероприятий. В результате многочисленных эпидемиологических исследований были выделены основные факторы риска онкологических заболеваний головного мозга ‒ возраст, урбанизация, высокое распространение канцерогенных веществ, повышенный радиационный фон, черепно-мозговые травмы, вирусная инфекция, наследственная предрасположенность и генетические аномалии. Влияние возраста, а также пола на риск развития ПОГМ было подробно рассмотрено нами выше. В общей онкологии к изученным и доказанным факторам риска, относятся: курение ‒ рак лёгкого; урогенитальная инфекция (хламидиоз, герпес) – урогенитальные онкологические заболевания; избыточная инсоляция ‒ меланома кожи; ионизирующее излучение ‒ озлокачествление клеток кроветворной системы [Gregor A. et al.,1996]. К сожалению, в нейроонкологии подобные факторы не имеют столь убедительных доказательств, поэтому до настоящего времени не существует регламентированных мер профилактики 24 опухолевых поражений ЦНС [Розуменко В.Д., 2006]. Ввиду этого важность поиска и изучения предполагаемых факторов риска развития ОГМ очевидна. Рассмотрев экологические, географические, расово-этнические, возрастные и половые особенности эпидемиологии ОГМ, остановимся на профессиональнобытовых, наследственно-генетических, вирусных и других факторах риска. В настоящее время проводится множество исследований по изучению влияния различных профессиональных и бытовых факторов на возникновение опухолей. В частности, в Уэльсе установили отчётливую зависимость возникновения глиобластом от воздействия на организм N-нитрозоаминов у работников пищевой промышленности. Безусловно, N-нитрозоамины способны поступать в организм с пищей, водой и сигаретным дымом [Berleur M.P., Cordier S., 1995; Bondy M. et al., 1994]. Высок риск глиом и менингиом у работников железных дорог, электротехнических и телефонных компаний, что связывают с онкогенным воздействием электрических [Gurney J.et al., 2001] и магнитных полей [Preston-Martin et al., 1996], у женщин, работающих на производстве катодных лучевых трубок [Ryan P. et al., 1992]. Глиомы чаще встречаются у лиц, связанных с добычей и переработкой нефти, контактирующих с органическими растворителями, промышленными отходами [Thomas T. et al., 1987; Demers P. et al., 1991; Alexander V., 1991]. Следует отметить, что, несмотря на многочисленность проведенных исследований, прямых корреляций с вышеуказанными профессиональными вредностями и развитием ОГМ не установлено. В последнее время в популярной литературе появилось множество сообщений об онкогенном воздействии современных средств мобильной связи, в частности сотовых телефонов, на головной мозг [Lonn S. et al., 2004]. В исследованиях Wrensch М. и соавт. (1997) показано влияние семейного анамнеза на возможность развития глиом, при этом установлено, что заболеваемость повышается в случае, если семейный анамнез отягощен глиомами и вирусной инфекцией. О существенной роли наследственности в 25 развитии ПОГМ сообщают Лосев Ю.А. (2003), Дюсембеков Е.К. (2008), Hemminki K. и соавт. (2000). Интересные данные приводят Batra S. и соавт. (1994), которые выявили делеции в хромосомах 9 (9р), 13 (13q) и 19 (19q) у больных со злокачественными астроцитомами. При этом отмечено, что мутации в хромосоме 10q встречаются в основном при глиобластомах, что подтверждает роль генетического фактора в развитии наиболее злокачественных новообразований головного мозга. Lai H. (1996), Hoffman K.A. (2007) считают, что при всех злокачественных опухолях имеют место не единичные, а множественные генетические аномалии. В настоящее время возникновение медуллобластом, нейробластом и злокачественной лимфомы связывают с онкогенными полиомавирусами ВК (BKV), simian virus 40 (SV40) JC (JCV) [Gavin P., Yogev R., 1999]. Так, Geissler E. и Staneczek W. (1998), исследуя детское население в течение 20 лет, выявили, что у детей, привитых вакциной, поливакциной, контаминированной SV40, более часто развиваются глиобластомы и медуллобластомы в отличие от непривитых. Последняя четверть революционными века в изменениями, нейрохирургии обусловленными отмечена рядом поистине важнейших предпосылок: ‒ широкое внедрение в диагностический комплекс высокоинформативных неинвазивных методов нейровизуализации (КТ, МРТ, МРТ-ангиографии, ОФЭКТ, ПЭТ); ‒ обязательное применение при оперативных вмешательствах микрохирургической техники, усовершенствование технических средств, таких, как ультразвуковой аспиратор, высокоскоростные дрели, лазерная «вапоризация» опухоли; применение «нейронавигации» в современных нейрохирургических операционных, позволяющей использовать возможности КТ и МРТ с целью коррекции пространственной ориентации хирурга непосредственно во время оперативного вмешательства; 26 ‒ расширение и развитие арсенала новых хирургических доступов в нейрохирургии, с целью снижения частоты ретракционных осложнений, улучшения визуального контроля с использованием интраоперационной КТ и МРТ, повышения радикальности оперативных вмешательств; ‒ значительное совершенствование нейроанестезиологии с возможностью интра- и периоперационного мониторинга не только жизненно важных функций и их регуляции, включая внутричерепное давление, но и интраоперационного нейромониторинга; ‒ наряду с традиционными хирургическими методами лечения новообразований головного мозга применение радиохирургических методов лечения (Gamma-knife, Cyber-knife, линейные ускорители); обязательное комплексное лечение глиальных опухолей с использованием современных химиотерапевтических средств и иммунных методов лечения. Следует подчеркнуть, комплексном лечении произошедшие опухолей коренные головного мозга преобразования открывают в новые перспективы в эффективности лечения данной категории больных [Гуляева С.Е., 1998; Мартынов Б.В. и др., 2002; Голанов А.В., 2002; Гайдар Б.В.,2004; Коновалов А.Н., 2004; Семин П.А. и др., 2004; Пронин И.Н. , 2006; Ырысов К.Б. и др., 2011; Мамытов М.М., и др., 2012; Chidel M.A. et al., 2000]. Представленный сравнительный нейроэпидемиологических анализ результатов современных исследований свидетельствует о повсеместном повышении уровня заболеваемости первичными ОГМ, причем наиболее значима эта тенденция в пожилом и старческом возрастах. Несмотря на широкое развитие современных нейровизуализационных методов исследования, задачи раннего выявления данных заболеваний остаются первостепенными. Обнаруженные климато-географические, расово-этнические, гендерные, социально-экологические особенности распространенности ПОГМ диктуют необходимость нейроэпидемиологических исследований в каждом регионе с целью научного планирования и совершенствования нейрохирургической помощи населению. Установление роли и значимости 27 провоцирующих производственных и бытовых факторов риска развития ПОГМ в перспективе позволит разработать мероприятия. 28 адекватные профилактические ГЛАВА 2 МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ В данной главе нами представлены материалы и методы исследования больных с ПОГМ, проживающих на территории г. Бишкека и Чуйской области. На основании полученных нами данных приведены демографические и экологические показатели изучаемых регионов. 2.1. Дизайн исследования и клинический материал Исследования проведены в трех направлениях: 1. Эпидемиологическое ‒ изучение распространенности заболеваемости и смертности от ПОГМ среди жителей г. Бишкек и Чуйской области, изучение структуры гистологических типов и локализации ПОГМ, специфики возрастнополового распределения. 2. Клиническое ‒ изучение особенностей дебюта ПОГМ, течения болезни, длительности анамнеза, ближайших и отдаленных результатов лечения, структуры мультидисциплинарного лечения больных. 3. Медико-организационное ‒ изучение медицинской помощи данной категории больных, особенности организации определение вопросов по совершенствованию оказания медицинской помощи больным с ПОГМ. Объектом исследования явились жители г. Бишкека и Чуйской области, находившиеся на лечении по поводу ПОГМ в стационарах, оказывающих специализированную нейроонкологическую помощь (Национальный госпиталь, Национальный центр охраны материнства и детства, городская детская больница скорой медицинской помощи) за период с 2001 по 2010 год. Для оценки заболеваемости ПОГМ, а также качества проводимых лечебнодиагностических мероприятий были изучены данные историй болезни пациентов нейрохирургических медицинские карты отделений (форма радиологического 003/У), операционные отделения патологоанатомических исследований (форма 014-У), 29 (форма), журналы, протоколы данные департамента регистрации актов гражданского состояния при правительстве КР (форма 8-У), отчетные документы Национального статистического комитета КР. Всего за период с 2001 по 2010 год в указанных стационарах прошли обследование и лечение 474 больных с ПОГМ. Распределение по полу и возрасту обследованных больных представлено в табл. 2.1.1. Как следует из полученных данных, большинство пациентов находились в возрастном диапазоне от 35 до 65 лет, причем чаще опухолями страдали женщины по сравнению с мужчинами (58,6 против 41,3%). Таблица 2.1.1 ‒ Распределение больных по полу и возрасту Возрастная группа 0 ̶ 18 19 ̶ 34 35 ̶ 44 45 ̶ 54 55 ̶ 64 65 ̶ 74 75 и старше Всего Мужчины абс. число 17 37 29 61 31 21 196 Женщины абс. число 17 43 68 88 49 12 1 278 % 3,6 7,8 6,1 12,9 6,5 4,4 41,3 % 3,6 9,07 14,3 18,6 10,3 2,5 0,2 58,6 Всего абс. число 34 80 97 149 80 33 1 474 % 7,2 16,9 20,4 31,4 16,9 7,0 0,2 100 У всех больных были изучены анамнестические данные, ретроспективно проанализирован дебют заболевания, характер появления и формирования неврологических симптомов и симптомокомплексов, длительность от момента появления симптомов до установления диагноза. В отношении всех больных проводился комплекс клинических обследований, включавший неврологическое, нейроофтальмологическое и отоневрологическое исследования, а также компьютерно-томографическое (КТ), магнитно-резонансное краниографическое томографическое исследование, исследование электроэнцефалография (МРТ), (ЭЭГ), эхоэнцефалография (ЭХО ЭГ). Гистологическая верификация опухоли была проведена у 424 пациентов. У 50 больных по ряду причин анализ гистологического типа опухоли не 30 произведен. При распределении ОГМ по гистологической структуре была использована международная классификация опухолей нервной системы, разработанная экспертами ВОЗ в 2007 г. Оценка тяжести состоянии больного до поступления в отделение и после лечения производилась по шкале Карновского в баллах [Karnоfsky D.A. и соавт., 1948] (табл. 2.1.2). Таблица 2.1.2 ‒ Оценка тяжести состояния больного по шкале Карновского (в баллах) Шкала Оценка тяжести 100 практически здоров, нет жалоб 90 нормальная активность, минимальные симптомы 80 нормальная активность с усилием, четкие симптомы 70 ухаживает за собой, не может работать 60 непостоянно требует помощи 50 нуждается в посторонней помощи 40 инвалид, нуждается в специализированной помощи и уходе 30 глубокая инвалидность, госпитальный больной 20 требует поддерживающих жизнь мероприятий 10 умирающий больной Кроме того, при поступлении в стационар общее состояние больных оценивалось с учетом фазы опухолевого поражения головного мозга (Лихтерман Л.Б., 1979), при котором выделяют 5 фаз клинического течения опухолевого процесса: I фаза ‒ клиническая компенсация. Нет общемозговой и очаговой симптоматики. II фаза ‒ клиническая субкомпенсация. На фоне общемозговой симптоматики выявляются очаговые признаки раздражения и выпадения. 31 III фаза – умеренная клиническая декомпенсация. Выраженная гипертензионная симптоматика. Симптомы выпадения преобладают над симптомами раздражения. IV фаза ‒ грубая клиническая декомпенсация. Выраженная очаговая симптоматика. Нарушение сознания. V фаза ‒ терминальная. Нарушение жизненно важных функций. Пациенты с ПОГМ, поступившие в нейрохирургические отделения, по шкале Карновского распределились следующим образом (рис.2.1.1.). Подавляющее их большинство (342 больных, т.е. 72,1%) на момент поступления имели 70 баллов и более по шкале Карновского, т.е. ухаживали за собой, из них 103 больных (21,7%) сохраняли нормальную физическую активность. Нуждались в посторонней помощи 26,7% пациентов, из них большинство ‒ непостоянно (23,6%). В стационар в тяжелом состоянии при необходимости постоянного ухода поступили 1,0% больных. Рис. 2.1.1. Распределение больных по шкале Карновского. По шкале Л.Б. Лихтермана больные с ПОГМ при поступлении в стационар распределились следующим образом. С начальными клиническими проявлениями поступили трое больных (0,6%), с умеренными клиническими 32 проявлениями ̶ 148 (31,2%), с выраженной клинической симптоматикой ̶ 278 (58,6%), и еще 45 пациентов (9,5%) поступили в лечебные учреждения в стадии декомпенсации. Хирургическое удаление опухоли проведено 424 пациентам с использованием микрохирургической техники. Наша шкала оценки радикальности удаления создана на основе предложенных ранее критериев [Gay E.,1995, Al-Mefty 1997, Colli 2001]: тотально: вся опухоль удалена (100%), что было видно на операции и подтверждено данными КТ или МРТ; субтотально: объем удаления опухоли ‒ 90% и более; частично: удалено менее 90%, но более 50% опухоли. Тотальное удаление проведено 129 пациентам, субтотальное – 272 больным и еще 23 пациентам выполнено частичное удаление опухоли. Химиотерапия проведена у 82 пациентов на базе Национального центра онкологии. Лучевая терапия по стандартным протоколам проведена у 110 больных на аппарате для дистанционной лучевой терапии в режиме тормозного излучения и у 50 пациентов ‒ на γ-терапевтическом аппарате в статическом режиме с двух боковых противолежащих полей. В работе были использованы официальные документы Национального статистического комитета Кыргызской Республики [демографический ежегодник за 2006 ̶ 2010 гг., Бишкек]. Состояние окружающей среды и влияние вредных веществ на организм были изучены по данным экологического обзора Кыргызской Республики, составленным Государственным агентством по охране окружающей среды и лесного хозяйства при правительстве Кыргызской Республики и Госагентством гидрометеорологии Кыргызской Республики (2009 г., Бишкек). При исследовании применены нормативно-правовые акты: Закон КР «Об охране атмосферного воздуха» от 12 июня 1999 года № 51 (в редакции законов КР от 24 июня 2003 года №109, 9 августа 2005 года №145), Закон КР «Об охране окружающей среды» от 16 июня 1999 года №53 (в редакции 33 законов КР от 4 февраля 2002 года №22, 11 июня 2003 года №101, 11 августа 2004 года №13, 6 августа 2005 года № 124). 2.2. Статистический анализ результатов исследования Статистическая обработка полученных нами данных проводилась при помощи программы Statistica и пакета стандартных статистических показателей (SPSS 11.0). Для оценки заболеваемости, особенностей распространения ПОГМ применяли метод сбора абсолютных и вычисления относительных величин (интенсивные и экстенсивные). Достоверность различий между группами определяли по критерию Стьюдента (t) и по уровню вероятности безошибочного прогноза (p). Для анализа заболеваемости использовали показатели динамического ряда ‒ абсолютный прирост (убыль), темпы прироста (%). Полученные показатели послужили статистической основой для разработки прогнозов заболеваемости ПОГМ до 2015 г. при помощи методов математического прогнозирования и моделирования. Для выравнивания уровня динамического ряда вычисляли скользящую среднюю величину с целью выявления закономерности в изменении распространенности заболеваемости первичными опухолями головного мозга [Акынбеков К.У. и др., 2006]. 34 ГЛАВА 3 КЛИНИКО-ЭПИДЕМИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ПЕРВИЧНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА В Г. БИШКЕКЕ И ЧУЙСКОЙ ОБЛАСТИ 3.1. Демографическая и экологическая ситуация в Чуйской области и г. Бишкеке По природно-климатическим условиям не более 30% из общей площади республики пригодны для постоянного проживания и только примерно 20% относятся к зонам с благоприятными условиями, где проживает большая часть населения страны. При этом вся антропогенная нагрузка приходится на эти территории. Именно к таким зонам относится Чуйская область Кыргызской Республики. Чуйская область, один из наиболее развитых промышленных и сельскохозяйственных регионов Кыргызстана, занимает Чуйскую, ЧонКеминскую и Кичи-Кеминскую долины, при этом ее площадь составляет 20200 км². В состав Чуйской области входят Панфиловский, Жайыльский, Московский, Сокулукский, Аламудунский, Чуйский, Иссык-Атинский, Кеминский административные районы. Численность постоянного населения в Чуйской области к 2010 г. составляла 808 245 человек, из них городского населения ‒ 144 429, сельского – 663 816. В г. Бишкеке к 2010 г. проживали 846 467 человек. На начало 2011 г. 32,3% от общей численности населения составляли дети и подростки, 61,1% ‒ лица трудоспособного возраста и 6,6% ‒ лица пожилого и старческого возрастов. При распределении женщин и мужчин по возрасту было отмечено, что после 35 лет число женщин начинает преобладать над количеством мужчин, а в возрасте старше 80 лет ‒ превосходит более чем в 2 раза. Причем подобное преобладание женщин характерно для большинства стран, в том числе и СНГ. Основными причинами подобной возрастной асимметрии является так называемая «типичная мужская сверхсмертность», обусловленная особенностями мужской профессиональной 35 деятельности, большей подверженностью вредным привычкам, особенностями гормонального фона, высокой сердечно-сосудистой заболеваемостью. Начиная с 2005 г. отмечается возрастание численности населения Чуйской области (рис. 3.1.1). Так, если численность населения данного региона страны в 2005 г. составляла 752,6 тыс. человек, то в 2009-м превысила 800 тыс., а в 2010 г. достигла 811,6 тыс. человек. При этом отмечалось преимущественное возрастание численности сельского населения, и если в 2001 г. она по Чуйской области составляла 599,9 тыс. человек, то в 2010-м уровень данного показателя достиг 667,0 тыс. человек. В то же время доля и численность городского населения Чуйской области имела тенденцию к снижению: если в 2001 г. она составляла 162,0 тыс. человек, то в 2010-м снизилось до 144,6. Рис. 3.1.1. Динамика численности населения Чуйской области за 2001–2010 гг. Аналогичная ситуация по динамике численности населения прослеживается в г. Бишкеке. Как следует из данных, представленных на рис. 3.1.2, начиная с 2002 г. в г. Бишкеке отмечается рост численности населения. Так, число жителей г. Бишкека в 2002 г. составляло 770,6 тыс. населения, а в 2010-м ‒ уже 853,1. При этом отметим, что рост численности населения, прежде 36 всего в Бишкеке, происходит не за счет увеличения рождаемости, а обусловлен процессами внутренней миграции ‒ ввиду переезда жителей из сельских районов разных областей страны в г. Бишкек. Рис. 3.1.2. Динамика численности населения г. Бишкека за 2001–2010 гг. Об этом же свидетельствует и снижение рождаемости, отмечаемое в 90-е годы и начале 2000-х годов. В частности, в начале 2000-х годов отмечалось уменьшение численности населения в возрасте 0 ‒ 18 лет, и только в последние годы численность населения в данной возрастной группе возросла и на начало 2011 г. составляла 32,3% от общей численности населения. В последнее десятилетие возрастает численность трудоспособного населения, доля которого составляет 61,1%. В то же время доля пожилых лиц несколько сократилась (до 4,4%), причем этот показатель несколько выше в Чуйской области и г. Бишкеке (6,6%), где проживает значительная часть лиц славянской национальности с высокой долей пожилых лиц и низким уровнем рождаемости. Отмечая миграцию значительного контингента сельского населения в крупные города республики, особенно Бишкек и Ош, подчеркнем: фактическое население г. Бишкека превысило 1 млн. человек, хотя генеральными планами развития, разработанными в 70 ‒ 80-е годы, рост численности его населения 37 лимитировался 600,0 ‒ 700,0 тыс.человек. Дефицит жилищного фонда, ограниченность источников водоснабжения, мощностей тепло-, энергоснабжения, канализационной сети и очистных сооружений и других коммунальных служб на фоне резко увеличившейся антропогенной и техногенной (автотранспорт) нагрузки на городскую окружающую среду оказывают выраженное негативное влияние на биосферу и здоровье людей. По природно-климатическим условиям в развитие получили горнодобывающая, нашей стране приоритетное перерабатывающая и легкая промышленность, а также энергетика и сельское хозяйство. И здесь необходимо отметить, что почти все предприятия данных отраслей оснащены устаревшими технологиями и оборудованием. Это в свою очередь влечет загрязнение окружающей и производственной среды, что, с одной стороны, неблагоприятно влияет на здоровье населения, а с другой ‒ сопряжено с высоким риском острых интоксикаций, развитием профессиональной и онкологической патологии. К тому же содержание пыли, химических веществ в воздухе производственных помещений превышает нормы ПДК, уровни шума и вибрации выше допустимых. Основными источниками загрязнения атмосферного воздуха остаются предприятия энергетики, горнодобывающей и перерабатывающей отраслей, стройматериалов, коммунального хозяйства, частный сектор населения, а также передвижные источники загрязнения. Так, по сведениям Государственного агентства по охране окружающей среды и лесного хозяйства при правительстве КР, за 2009 г. количество выбросов вредных веществ от промышленных объектов, расположенных по районам Чуйской области, составляет: по Иссык-Атинскому району – 4262,89 тонны в год, Аламудунскому ‒ 2151,172, Чуйскому – 432,888, Кеминскому ̶ 243,151, Сокулукскому – 1215,07, Московскому – 1701,104, по Жайыльскому – 415,461 тонны в год. По данным Нацстаткома, выбросы вредных веществ от стационарных источников загрязнения по Бишкеку за 2009 г. составили 25,6 тыс.тонн в год, в 38 том числе твердых ‒ 6,4 тыс.тонн в год; газообразных и жидких ‒ 9,2 тыс. тонн в год. Физико-географические и климатические условия г. Бишкека и относительная замкнутость Чуйской долины способствуют возникновению интенсивных приземных и приподнятых инверсий, что в совокупности с выбросами источников загрязнения ведет к формированию высокого потенциала загрязнения атмосферы. В результате среднегодовое содержание почти всех примесей в целом по городу превышает допустимые нормы. Так, по данным главного управления по гидрометеорологии при МЧС, состояние атмосферного воздуха определялось следующими загрязняющими веществами: сернистый ангидрид, диоксид серы, диоксид азота, оксид азота, формальдегид, аммиак. Среди специфических веществ, загрязняющих атмосферный воздух, необходимо отметить соли тяжелых металлов, в частности твердые частицы и свинец. Загрязнение воздуха диоксидом и оксидом азота в 2007 г. превышало ПДК соответственно в 1,2 и 1,3 раза, при этом наиболее загрязненным районом является центральная часть города, где отмечается превышение допустимых норм по всем определяемым веществам. Также выявлены случаи превышения предельно допустимых концентраций формальдегида (в 4 раза) в отдельных районах города Бишкека. Как показал анализ уровня загрязнения атмосферного воздуха за пятилетний период по Чуйской области, в том числе столице, есть тенденция к увеличению концентраций диоксида азота, оксида азота в воздухе Бишкека, Кара-Балты, Токмака. Основными стационарными источниками промышленного загрязнения атмосферного воздуха по г. Бишкеку являются ТЭЦ, выбросы от которой составили в 2009г. 15,9 тыс.тонн, 46 котельных «Бишкектеплокоммунэнерго» ‒ ещё 0,744 тыс.тонн. Кроме того, отсутствие в Кыргызстане собственных запасов природного газа привело большинство ТЭЦ, котельных и владельцев 39 частных домов к использованию твердого топлива местного происхождения, имеющего относительно низкую калорийность и высокую зольность. В настоящее время автомобильный транспорт остается одним из наиболее интенсивных и стабильно растущих источников загрязнения воздушной среды, поскольку более четверти автомобилей из-за изношенности эксплуатируются с превышением норм токсичности и дымности. Большинство машин импортного производства не оборудованы нейтрализаторами вредных и канцерогенных веществ, влияющих на здоровье человека, что в свою очередь повлекло рост болезней органов дыхания, онкологических и аллергических заболеваний. Так, за 2009 г. выброс вредных веществ в атмосферный воздух от автотранспорта составил 87 694 т/год, в том числе 72810 тонн окиси углерода (СО); углеводородов – 8220 т/год. Высокая плотность транспортного потока оказывает отрицательное воздействие на состояние атмосферного воздуха в городах. Ежегодный расход топлива на работу автотранспорта, включая индивидуальный, составляет 400 ‒ 600 тыс. тонн условного топлива. Практически 99% используемого топлива приходится на автомобильный бензин и дизельное топливо. Так, под воздействием повышенных концентраций вредных веществ находятся приблизительно более половины населения Чуйской области, включая г. Бишкек. Важным фактором, оказывающим негативное влияние на здоровье населения, является показатель качества питьевой воды. Наиболее подвержены загрязнению водостоки бассейна р. Чу. Загрязненные сточные воды промышленных и сельскохозяйственных объектов, сброс воды с полей, насыщенных продуктами распада минеральных удобрений и ядохимикатов, а также хозяйственная деятельность населения качественно изменяют органолептические и химические свойства воды рек республики. В реках Чу, Аламедин, Чон-Кемин, Иссык-Ата, Кичи-Кемин систематически отмечается повышенное содержание азота аммонийного и нитритного, соединений меди, цинка, нефти и нефтепродуктов, органических и других вредных веществ, а также остаточного количества ядохимикатов группы ДДТ, ГХЦГ. Имеются 40 данные о загрязнении подземных вод нитратами и марганцем на юго-западном участке г. Кара-Балта ввиду утечек в прошлом загрязненных промышленных стоков из хвостохранилища гидрометаллургического завода Кара-Балтинского горнорудного комбината. По поверхностным водам рек Аламедин и Ала-Арча, протекающих на территории г.Бишкека, отмечается превышение ПДК. По реке Аламедин превышение ПДК по меди ‒ в 2 раза, по азоту нитритному ‒ в 1,25 ‒ 1,65 раза. По реке Ала-Арча превышение ПДК на 1 км ниже города по азоту нитритном ‒ в 2 ‒ 3,35 раза, по меди ‒ в 2 раза. В Кыргызской Республике накопилось значительное количество радиоактивных отходов, причиной чему явились активная деятельность горнодобывающих и перерабатывающих предприятий урановой промышленности в 40 ‒ 50-х годах прошлого столетия, ядерные испытания на полигонах и аварии на предприятиях. К тому же на территории Кыргызской Республики расположено 35 хвостохранилищ (30 хвостохранилищ из них содержат отходы уранового производства, 5 ̶ отходы производства цветных металлов) и 25 горных отвалов. В Чуйской области имеются хвостохранилища радиоактивных отходов, четыре из которых расположены близ пгт. Ак-Тюз; хвостохранилище Кара-Балтинского горнорудного комбината, расположенное в 1,5 км от г. Кара-Балты и на 600 м западнее от промплощадки гидрометаллургического завода; хвостохранилище в пгт. Орловка (Буурдинское хвостохранилище). По данным Государственного агентства по охране окружающей среды и лесному хозяйству при правительстве КР, в 2000 г. АО «Ак-Тюз» было переработано 17934 тонн руды месторождений «Долпран», «Кызыл-Байрак» и «Куран-Джайлоо», в процессе чего в 2000 г. в атмосферный воздух было выброшено 0,03 тонны загрязняющих веществ, заскладировано 17 370 т, сброшено в р. Кичи-Кемин 141002 м3 сточных вод. В 2001г. переработано 26135 тонн руды, при этом выбросы вредных веществ в атмосферный воздух составили 0,05 тонн/год, заскладировано 25314,36 тонны отходов, сброшено 41 204002 м3 сточных вод. Средний гамма-фон по границам хвостохранилища составляет 70 ‒ 300 мкР/час, на аномальных участках в районах складирования концентрата ‒ 800 ‒ 1000 мкР/час. На территории хвостохранилища КараБалтинского горнорудного комбината радиоактивное излучение наблюдается в основном на поверхности хвостохранилища и достигает максимального уровня в некоторых точках ‒ до 1500 мкР/час. Доза излучения в местах обследования свалки, прилегающей к Буурдинскому хвостохранилищу, составляет 150 ‒ 200 мкР/ч, при фоновых излучениях ‒ 25 мкР/час. Таким обстановку образом, в социально-гигиеническую Чуйской удовлетворительной. При области этом и и эпидемиологическую г.Бишкеке ухудшение нельзя состояния признать экологии носит прогрессирующий характер, негативно влияя на частоту заболеваемости, в том числе и нейроонкологическую. 3.2. Заболеваемость первичными опухолями головного мозга в Чуйской области и г. Бишкеке За анализируемый период ‒ с 2001 по 2010 год ‒ всего по Чуйской области и г. Бишкеку было зарегистрировано 474 случая ПОГМ. Из них 224 случая отмечено по Чуйской области (табл. 3.2.1). Таблица 3.2.1 ‒ Уровень заболеваемости ПОГМ на 100 тыс. населения по Чуйской области за период 2001‒2010 гг. Скользящая Среднегодова Абсолютное Заболеваемос я численность число ть на 100 тыс. населения больных населения 2001 761800 23 3,0 - 2002 754800 16 2,1 2,7 2003 751700 23 3,1 2,8 2004 752500 24 3,2 2,8 2005 752600 15 2,0 2,5 2006 783800 17 2,2 2,4 Год 42 средняя заболеваемос ти Продолжение табл. 3.2.1 Среднегодов ая Год численность населения Абсолютное Заболеваемо сть на 100 число средняя тыс. больных Скользящая заболеваемости населения 2007 791500 24 3,0 2,8 2008 798300 26 3,2 3,1 2009 804900 26 3,2 3,4 2010 811600 30 3,7 - Всего 224 14,4 22,4 2,9±0,2 За анализируемый период с 2001 по 2010 год по Чуйской области среднее количество выявленных ПОГМ составило 22,4 случая ежегодно. Таким образом, средняя заболеваемость ПОГМ среди жителей Чуйской области равна 2,9±0,2 на 100 тыс. населения. При этом обнаружена видимая тенденция к росту заболеваемости. В среднем заболеваемость ПОГМ за 10 лет на 100 тыс. населения увеличилась на 52%, а абсолютный прирост за данный период Показатель Заболеваемость на 100 тыс. населения Абсолютны й прирост Темп прироста (%) 3,0 2,1 3,1 3,2 2,0 2,2 3,0 3,2 3,3 2010 2009 2008 2007 2006 2005 2004 2003 2002 2001 Таблица 3.2.2 ‒ Анализ показателей динамического ряда по заболеваемости ПОГМ на 100 тыс. населения по Чуйской области за 2001 ̶ 2010 гг. Год 3,7 Итого составил 0,7 случая (табл. 3.2.2). 2,9 -0,9 +1,0 +0,1 -1,2 +0,2 +0,8 +0,2 0 +0,5 +0,7 -30 0 +15, +52, 6 0 +47, +3,2 +10, +36, +6,7 6 37,5 0 4 43 Для выявления закономерности изменений заболеваемости мы провели выравнивание уровней динамического ряда путем вычисления скользящей средней. При этом заслуживает внимания тот факт, что повышение заболеваемости ПОГМ в Чуйской области регистрируется с 2007 г., что, вероятнее всего, связано с улучшением качества диагностики и широким использованием современных методов нейровизуализации (КТ и МРТ). Например, в г. Бишкеке начали работу диагностические центры с магнитнорезонансными и компьютерными томографами: в 2006 г. ‒ «Неомед» в 2007-м ‒ «Медипол», в 2008-м ̶ «Юрфа». Рис. 3.2.1. Удельный вес (%) ПОГМ в различных районах Чуйской области. Анализ территориального распределения заболеваемости ПОГМ по районам Чуйской области (рис. 3.2.1) свидетельствует о ее повсеместном распространении, однако удельный вес новообразований значительно варьируется в различных районах данного региона. Наибольшее число опухолей выявлялось в Иссык-Атинском (21,9%), Аламудунском (21,8%) и Сокулукском (21%) районах. В то же время наименьшее их количество регистрировалось в Жайылском (7,1%), Кеминском (6,2%) и Панфиловском (6,3%) районах. При изучении заболеваемости ПОГМ в различных регионах Чуйской 44 области были выделены ранговые места по удельному весу ПОГМ. Наиболее неблагоприятными в нейроонкологическом плане являются Иссык-Атинский (3,8 на 100 тыс. населения), Аламудунский (3,7), Сокулукский (3,2) и Панфиловский (2,6) районы. Наименьшая заболеваемость ПОГМ отмечалась в Жайылском (1,7 на 100 тыс.), Чуйском (2,5) и Московском (1,6) районах (табл. 3.2.3). Таблица 3.2.3 ‒ Заболеваемость и удельный вес ПОГМ в районах Чуйской области Среднегодов ая численность населения 133770 Район Аламудунск ий Жайылский 93800 Кеминский 55970 Московский 82800 Панфиловск ий Сокулукский 42660 145120 Чуйский 100950 ИссыкАтинский Итого 127390 Абсолютн ое число больных за 10лет 49 М=4,9 16 М=1,6 14 М=1,4 13 М=1,3 11 М=1,1 47 М=4,7 25 М=2,5 49 М=4,9 224 Заболеваемо сть на 100 тыс. Удельны Ранговы й вес, % е места 3,7 21,8 II 1,7 7,1 V 2,5 6,2 VI 1,6 5,8 VII 2,6 4,9 VIII 3,2 21,0 III 2,5 11,2 IV 3,8 21,9 I 100,0 Анализируя полученные данные, мы выявили: чем ближе районы располагаются к г. Бишкеку, тем выше уровень заболеваемости ПОГМ в них. Важно отметить, что в районах с высоким показателем заболеваемости (ИссыкАтинский, Аламудунский, Сокулукский) сосредоточено большинство предприятий, а именно по производству теплоэнергетики, стройматериалов, пищевой и химической промышленностей. Они загрязняют атмосферный 45 воздух Чуйской области выбросами химических веществ, (диоксид и оксид азота), показатели которых превышают ПДК в 1,2 и 1,3 раза соответственно (Экологический обзор Кыргызской Республики, 2009). При этом в районах, где расположены хвостохранилища с определенной радиационной обстановкой, показатель заболеваемости вопреки ожидаемому был невысоким, о чем говорится в работах авторов, изучавших причины развития ОГМ (Berleur M.P., 1995; Yonehara S. et al., 2004). Научные работы, посвященные теме Чернобыльской катастрофы, не подтвердили влияния радиации на частоту ОГМ у взрослой части населения (Розуменко В.Д., 2006, Apshkalne D., 1993). Так, у жителей Хиросимы, находившихся в 1,5 ‒ 2 км от эпицентра взрыва, заболеваемость ОГМ увеличилась в 2,1 раза – такой же рост заболеваемости дают ежегодные рентгеновские снимки зубов (Rodvall Y. et al., 1998). Рассмотрим уровень заболеваемости ПОГМ в г. Бишкеке (табл. 3.2.4). Таблица 3.2.4 ‒ Уровень заболеваемости ПОГМ на 100 тыс. населения по г. Бишкеку за период 2001 ̶ 2010 гг. Год 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 Всего М+m Среднегодовая Абсолютное численность число населения больных 768600 20 770600 23 775300 27 784600 25 794800 16 809100 17 817700 32 827300 21 839500 27 853100 42 250 22,4 46 Заболеваемость на 100 тыс. населения 2,5 3,0 3,5 3,2 2,0 2,2 4,0 2,6 3,3 5,2 3,1±0,3 Скользящая средняя заболеваемости 3,0 3,2 2,9 2,5 2,7 2,9 3,3 3,7 Большая часть ПОГМ зарегистрирована в г. Бишкеке (250 случаев) ‒ в среднем 25 случаев ежегодно. Средняя заболеваемость ПОГМ за 10 лет среди жителей г. Бишкека составила 3,1±0,3 на 100 тыс. населения, а по Чуйской области ‒ 2,9±0,2 на 100 тыс. населения. При, казалось бы, отсутствии различий между средними величинами уровня заболеваемости ПОГМ за 10 лет как по г. Бишкеку, так и по Чуйской области (t=0,8; p>0,05) темп прироста по столице в среднем составил 131,9%, а по Чуйской области ‒ 52,0% (табл. 3.2.5), т.е. разность превысила 2,5 раза. Это обусловлено повышением заболеваемости ПОГМ в 2007-м и 2010 г. в Бишкеке, что, вероятнее всего, связано с улучшением качества диагностики. При этом темп прироста в эти годы, являясь высоким, составил +81,8 и +57,6 соответственно. Таблица 3.2.5 ‒ Анализ показателей динамического ряда по заболеваемости 2003 2004 2005 2006 2007 2008 2009 2010 Заболеваемость на 100 тыс. населения Абсолютный прирост Темп прироста (%) 2002 Показатель 2001 Год Среднее за 10 лет ПОГМ на 100 тыс. населения по г. Бишкеку за 2001 – 2010 гг. 2,5 3,0 3,5 3,2 2,0 2,2 4,0 2,6 3,3 5,2 3,2 +0,5 +0,5 -0,3 -1,2 +0,2 +1,8 -1,4 +0,7 +1,9 +2, 7 +20 +16,7 -8,6 -37,5 +10 +81,8 -35 +26,9 57,6 +13 1,9 При изучении половозрастных особенностей заболеваемости ПОГМ среди населения Чуйской области и г. Бишкека были получены следующие результаты (табл.3.2.6). Таблица 3.2.6 ‒ Заболеваемость ПОГМ среди мужчин и женщин по г. Бишкеку и Чуйской области Пол г.Бишкек Чуйская область Все обследованные Мужчины М±m 2,6±0,6 2,4±0,2 2,5±0,1 Женщины М±m 3,6±0,4 3,5±0,2 3,5±0,3 Разность м-ж >0,05 <0,001 <0,01 В среднем за 10 лет (с 2001 по 2010 год) заболеваемость среди мужчин 47 составила 2,6 на 100 тыс. населения и была сопоставима по г. Бишкеку и Чуйской области (2,6±0,6 и 2,4±0,1 на 100 тыс. населения соответственно). У женщин заболеваемость в целом оказалась выше (3,5±0,3), чем у мужчин, причем по общим результатам как по Чуйской области, так и по Бишкеку достоверных различий не обнаружено. Изучение возрастной динамики распространенности ПОГМ среди населения г. Бишкека и Чуйской области дало следующие результаты (табл. 3.2.7). Таблица 3.2.7 ‒ Возрастная динамика заболеваемости ПОГМ по г. Бишкеку и Чуйской области на 100 тыс. населения за период 2001 ̶ 2010 гг. Возрастная группа 0 ̶ 18 19 ̶ 34 35 ̶ 44 45 ̶ 54 55̶ 64 65 ̶ 74 75 ̶ 100 Бишкек 0,6 1,6 3,8 9,1 10,3 7,3 0,1 Чуйская область 0,8 1,9 4,4 7,5 7,8 3,7 - Общая заболеваемость 0,7 1,7 4,2 8,3 8,9 5,5 0,25 Регион Пик заболеваемости пришелся на возраст 55 ‒ 64 года, составив 8,9 случая на 100 тыс. населения. Следует отметить, что высокая заболеваемость ПОГМ регистрировалась и в более молодом возрасте. Так, среди лиц в возрастной группе 35 ‒ 44 года заболеваемость составляла 4,2 наблюдения на 100 тыс. населения, а в возрасте 45 ‒ 54 года ‒ 8,3 случая. Среди детей и лиц молодого возраста, как и следовало ожидать, заболеваемость ПОГМ была существенно ниже – 0,7 и 1,7 случая на 100 тыс. населения. Показатели заболеваемости ПОГМ среди различных половозрастных групп населения г. Бишкека и Чуйской области представлены в табл. 3.2.8. Так, заболеваемость у женщин в возрастной группе старше 35 лет превышает значения данного показателя среди мужчин. Особенно велики различия в возрастной группе 35 ̶ 44 года, в которой заболеваемость ПОГМ 48 среди женщин более чем вдвое выше аналогичного показателя среди мужчин (5,7 и 2,5 случая на 100 тыс. населения). Таблица 3.2.8 ‒ Заболеваемость ПОГМ по возрастным группам среди мужчин и женщин на 100 тыс. населения по г. Бишкеку и Чуйской области за период 2001 ‒ 2010 гг. Возраст 0‒18 19‒34 35‒44 45‒54 55‒64 65‒74 Старше Пол 75 лет Мужчина 0,7 1,4 2,5 7,6 7,8 4,0 - Женщина 0,7 1,8 5,7 9,8 9,8 5,3 0,3 3.3. Гистотопографическая характеристика ПОГМ в г. Бишкеке и Чуйской области Гистологическая верификация опухоли была проведена у 424 пациентов (табл. 3.3.1). Таблица 3.3.1 ‒ Распределение ПОГМ по гистологической структуре Абсолютный показатель 162 21 190 39 9 3 424 Подгруппы опухолей Нейроэпителиальные Опухоли черепно-мозговых нервов Оболочечно-сосудистые опухоли Опухоли гипофиза Краниофарингиомы Прочие Итого: Удельный вес (%) 38,2 4,9 44,8 9,3 2,1 0,7 100,0 У 50 больных по ряду причин (отказ больного от операции, паллиативное вмешательство, недостаточное количество гистологического материала) анализ гистологического типа опухоли не производился. Диагноз опухоли головного мозга этим больным был выставлен на основании комплексного клиникоинструментального обследования с использованием современных методов нейровизуализации. Данная группа больных с неуточненным гистологическим диагнозом ПОГМ не была подвержена анализу в данной главе. 49 Среди обследованных нами больных преобладали пациенты с оболочечно-сосудистыми опухолями, доля которых составила 44,8%, и пациенты с нейроэпителиальными опухолями ‒ 38,2%. Существенно реже встречались опухоли гипофиза (9,3%), опухоли черепно-мозговых нервов (4,9%) и краниофарингиомы (2,1%). На долю прочих гистологических вариантов ПОГМ приходилось 0,7%. Таблица 3.3.2 отражает заметное преобладание нейроэпителиальных опухолей, аденом гипофиза и краниофарингиом у городских жителей. Вероятнее всего, настороженностью это связано жителей с города, более высокой доступностью онкологической квалифицированных специалистов и нейровизуализационных методов диагностики. Таблица 3.3.2 ‒ Распределение ПОГМ по гистологической структуре по Чуйской области и г. Бишкеку Регион Подгруппы опухолей г. Бишкек Чуйская область Нейроэпите Опухо ОболоАдено Кранио- Про- Итого -лиальные ли чечнома фаринчие опухоли ЧМН сосудис- гипогиома тые физа опухоли 87 (39,4%) 11 93 23 6 1 221 (5,0%) (42,1%) (10,4%) (2,7%) (0,5%) (100% ) 75 (36,9%) 10 97 16 3 2 203 (4,5%) (47,8%) (7,9%) (1,5%) (1,0%) (100% ) При изучении частоты выявляемости отдельных гистологических вариантов ПОГМ отмечено доминирование менингиомы, которая была диагностирована у 170 пациентов ( 40,1% случаев от всех ПОГМ). Далее следуют глиобластомы (13,9%), астроцитомы (13,0%) и аденомы гипофиза (9,2%). Существенно реже встречаются невриномы VIII пары черепномозговых нервов (4,9%), медуллобластомы (3,5%) и краниофарингиомы (2,1%). По остальным гистологическим вариантам ПОГМ этот показатель не превышает 1,5% (табл. 3.3.3). 50 Таблица 3.3.3 ‒ Распределение ПОГМ по гистологической структуре в зависимости от пола Гистологическая форма Все Женщины Мужчины пациенты Менингиома 170 (40,1%) 113 (43,8%) 57 (34,3%) Менингосаркома 5 (1,2%) 2 (0,8%) 3 (1,8%) Аденома гипофиза 39 (9,2%) 22 (8,5%) 17 (10,2%) Невринома VIII пары 21 (4,9%) 14 (5,4%) 7 (4,2%) Глиобластома 59 (13,9%) 31 (12,0%) 28 (16,7%) Астроцитома 55 (13,0%) 34 (13,2%) 21 (12,7%) Олигодендроглиома 8 (1,9%) 4 (1,5%) 4 (2,4%0 Олигоастроцитома 2 (0,5%) 2 (0,8%) Медуллобластома 15 (3,5%) 7 (2,7%) 8 (4,8%) Эпендимома 6 (1,5%) 4 (1,5%) 2 (1,2%) Эпендиомобластома 4 (1,0%) 1 (0,4%) 3 (1,8%) Хориодпапиллома 6 (1,5%) 2 (0,8%) 4 (2,4%) Хориодкарцинома 1 (0,25%) 1 (0,4%) Нейробластома 3 (0,7%) 2 (0,8%) 1 (0,6%) Краниофарингиома 9 (2,1%) 4 (1,5%) 5 (3,0%) Гемангиобластома 6 (1,5%) 5 (1,9%) 1 (0,6%) Герминома 1 (0,25%) 1 (0,4%) Дермоидная киста 1 (0,25%) 1 (0,4%) Ангиоретикулосаркома 1 (0,25%) 1 (0,4%) Хондросаркома 1 (0,25%) 1 (0,6%) Гемангиома 8 (2,0%) 6 (2,3%) 2 (1,2%) Ганглиоглиома 3 (0,7%) 1 (0,4%) 2 (1,2%) Всего 424 (100,0) 258 (100,0) 166 (100,0) У мужчин так же, как и в общей группе, наиболее часто встречаются оболочечно-сосудистые опухоли ‒ менингиомы, которые регистрируются у 57 пациентов (34,3% случаев от всех первичных ОГМ). Реже были диагностированы глиобластомы (16,7%), астроцитомы (12,7%) и аденомы гипофиза (10,2%). Значительно более редко выявлялись медуллобластомы 51 (4,8%), невриномы VIII пары ЧМН (4,2%), краниофарингиомы (3,0%) и олигодендроглиомы (2,4%). Частота встречаемости остальных гистологических вариантов ПОГМ у мужчин не превышает 2% (табл. 3.3.3). У женщин в структуре ПОГМ также лидировали менингиомы, которые наблюдались у 113 больных (в 43,8% случаев от всех первичных ОГМ). Следующими по частоте являлись астроцитомы (13,2%), далее следовали глиобластомы (12,0%) и аденомы гипофиза (8,5%). Существенно реже регистрировались невриномы VIII пары ЧМН (5,4%), медуллобластомы (2,7% случаев) и гемангиомы (2,3%). Остальные гистологические варианты ПОГМ у женщин представлены лишь единичными наблюдениями (табл. 3.3.3) Анализируя гендерные различия в частоте встречаемости гистологических вариантов ПОГМ, следует отметить, что у женщин достоверно чаще выявлялись менингиомы (43,8% против 34,3% у мужчин). Из оболочечнососудистых опухолей у мужчин преобладали злокачественные виды ‒ менингосаркома (1,8% против 0,8%). Выявлена частая регистрация у мужчин таких вариантов ПОГМ, как глиобластомы (16,7% против 12,0% у женщин), медуллобластомы (4,8% против 2,7% у женщин) и аденомы гипофиза (10,2% против 8,5% у женщин). Гистологические варианты ПОГМ относительно возрастной принадлежности представлены в табл. 3.3.4. Таблица 3.3.4 ‒ Распределение ПОГМ по гистологической структуре в зависимости от возраста Гистологическая форма Возраст по группам 0‒18 1.Оболочечнососудистые опухоли, в том числе - менингиома 2. Аденома гипофиза 19‒34 35‒44 45‒54 55‒64 65‒74 75‒100 4 20 37 79 35 14 (12,9%) (29,8%) (41,6%) (59,4%) (47,9%) (46,7%) 1 4 14 28 76 33 14 (12,9%) (20,9%) (31,4%) (57,1%) (45,2%) (46,7%) 1 - 6 (9,0%) 11 (12,4%) 52 12 (9,1%) 9 (12,3%) 1 (3,3%) - 3. Опухоли ЧМН ̶ - невринома VIII пары 1 (3,2%) 6 (9%) 4 (4,5%) 6 (4,5%) 1 (1,4%) 3 (10%) - Продолжение табл.3.3.4 Гистологическая Возраст по группам форма 4.Нейроэпителиальные опухоли, в том числе - глиобластома - астроцитома - медуллобластома 5.Краниофарингиома 6. Прочие Итого 0‒18 19‒34 35‒44 45‒54 55‒64 65‒74 75‒100 22 (71%) 32 (47,8%) 37 (41,6%) 34 (25,6%) 25 (34,2%) 12 (40,0%) - 4 (12,9%) 7 (22,6%) 6 (19,4%) 4 (12,9%) - 11 (16,4%) 10 (14,9%) 5 (7,5%) 2 (3,0%) 1 (1,5%) 67 (100,0) 14 (15,7%) 14 (15,7%) 1 (1,1%) - 12 (16,4%) 8 (11%) 5 (16,7%) 5 (16,7%) - - - - - 13 (9,8%) 11 (8,3%) 3 (2,3%) 2 (1,5%) - - - 89 (100,0) 133 (100,0) 30 (100,0) 1 (100,0) 31 (100,0) 1 (1,4%) 2 (2,8%) 73 (100,0) - В детском и юношеском возрастах доминирующим гистологическим типом ПОГМ являлись нейроэпителиальные опухоли, частота которых в возрастном диапазоне 0‒18 лет достигала 71%. Из них астроцитомы регистрировались у 22,6% пациентов, медуллобластомы – у 19,4%, у 12,9% встречались глиобластомы. С одинаковой частотой у детей и юношей выявлялись менингиомы и краниофарингиомы (по 12,9%). И, наконец, наиболее редко встречались невриномы (у одного пациента – 3,2%). Аденом гипофиза в данной возрастной группе не выявлено. В возрастной группе 19 ‒ 34 года также лидирующую позицию в гистологической структуре ПОГМ занимают нейроэпителиальные опухоли, однако их доля существенно ниже по сравнению с детским возрастом (47,8% против 71% у детей). При этом доля глиобластом выше (16,4% против 12,9%) и несколько ниже доля астроцитом (14,9% против 22,6%) и медуллобластом 53 (7,5% против 19,4%). В то же время отмечено увеличение выявляемости оболочечно-сосудистых опухолей (29,8% против 12,8% у детей), в частности менингиом (до 20,9%), аденом гипофиза (9,0%) и неврином (9,0%). Частота краниофарингиом существенно ниже (до 3,0% против 12,9% у детей). В возрастной группе 35‒44 года частота встречаемости нейроэпителиальных и оболочечных опухолей одинакова (по 41,6%). При этом доминирующей по распространенности становится менингиома, которая диагностируется более чем в 30% случаев. Доля глиобластом и астроцитом существенно не изменяется (по 15,7%), однако значительно уменьшается доля медуллобластом (до 1,1%). Плавно возрастает доля аденом гипофиза (до 12,4%). У пациентов в возрасте 45 ‒ 54 года лидируют оболочечно-сосудистые опухоли, на долю которых приходится до 60% всех ПОГМ, причем в основном за счет высокой распространенности менингиомы, которая диагностируется у 57,1% больных. Доля нейроэпителиальных новообразований (астроцитом, глиобластом) значительно снижается (до 25,6% против 41,6% в предыдущей возрастной подгруппе). Частота встречаемости аденом гипофиза и неврином существенно не изменяется (9,1 и 4,5% соответственно). В возрастном диапазоне 55 ‒ 64 года по-прежнему преобладают менингиомы, доля которых составляет 45,2%. Затем следуют нейроэпителиальные опухоли, частота которых достигает 34,2%, из них глиобластомы диагностированы у 16,4% больных и у 11% пациентов выявлены астроцитомы. Остается существенной доля аденом гипофиза (12,3%). С этого возраста отмечается отсутствие медуллобластом. У пожилых пациентов на первом месте по распространенности менингиомы (46,7%). Второе место по частоте встречаемости занимают нейроэпителиальные опухоли (40%), из них глиобластомы и астроцитомы диагностированы у 33,4% больных. Отмечен рост неврином до 10% и некоторое снижение доли аденом гипофиза (3,3%). 54 Более наглядно возрастная динамика основных гистологических вариантов ПОГМ представлена на рис. 3.3.1. Рис. 3.3.1. Возрастная динамика основных гистологических вариантов ПОГМ. Наиболее значительны как по частоте, так и приросту заболеваемости ПОГМ менингиомы и глиобластомы, динамика заболеваемости которыми по Чуйской области и г. Бишкеку отражена в табл. 3.3.5. Таблица 3.3.5 ‒ Динамика заболеваемости менингиомами и глиобластомами на 100 тыс. населения за период 2001 ̶ 2010 гг. по г. Бишкеку Чуйской области Год Менингиомы Глиобластомы г. Бишкек Чуйская обл. г. Бишкек Чуйская обл. Заболеваемость 2001 0,8 1,2 0,0 0,3 2002 0,6 0,5 0,1 0,1 2003 1,4 1,3 0,3 0,5 2004 1,3 1,2 0,8 0,5 2005 0,8 0,7 0,1 0,1 2006 0,6 1,1 0,5 0,4 2007 1,0 0,9 0,5 0,3 2008 0,7 1,1 0,2 0,4 2009 0,8 1,2 0,6 0,5 2010 2,3 1,7 0,6 0,6 55 Анализ динамики основных гистологических типов ПОГМ за последние 10 лет (с 2001 по 2010 год) показал: как по г. Бишкеку, так и по Чуйской области отмечен рост заболеваемости в основном двумя типами опухолей: менингиомой и глиобластомой. Так, заболеваемость менингиомой по Чуйской области возросла с 1,2 на 100 тыс. населения в 2001 г. до 1,7 на 100 тыс. населения в 2010-м, т.е. увеличилась на 41%. Рост заболеваемости данным типом ОГМ в Бишкеке более внушителен: с 0,8 на 100 тыс. населения в 2001 г. до 2,3 на 100 тыс. населения в 2010-м. Аналогично отмечался рост заболеваемости глиобластомой по Чуйской области ̶ 0,3 до 0,6 на 100 тыс. населения и по г. Бишкеку с 0 до 0,6 на 100 тыс. населения. Заболеваемость другими гистологическими вариантами ОГМ за анализируемый период не претерпела существенной динамики. Таким образом, лидирующее место в гистологической структуре опухолей занимают оболочечно-сосудистые опухоли, на долю которых приходится до 45% от всех ПОГМ, причем в основном за счет высокой распространенности менингиом, которые диагностируются в 40% случаев, и нейроэпителиальных опухолей, доля которых достигла 38,2%. Существенно реже встречались опухоли гипофиза (9,3%), опухоли черепно-мозговых нервов (4,9%) и краниофарингиомы (2,1%). В детском возрасте в гистологической структуре ПОГМ занимают нейроэктодермальные опухоли (глиобластомы, астроцитомы и медуллобластомы), во взрослом – менингиомы, доля которых в возрастной группе 45 ̶ 54 года достигает 57,1%. Одной из важных характеристик ПОГМ наряду с гистологической верификацией являются топографо-анатомические особенности опухоли по отношению к структурам головного мозга, которые определяют как клинические особенности, так и тактику хирургического лечения таких опухолей, а в конечном итоге ‒ эффективность лечения. Согласно результатам нашего исследования, среди всех ПОГМ превалировала супратенториальная локализация, которая выявлялась у 82,1% обследованных пациентов. У 17,3% 56 больных опухоли располагались субтенториально и еще в 0,6% случаев отмечалась суб- и супратенториальная локализация опухоли. Рис. 3.3.2. Локализация менингиом по отношению к структурам мозга. Проанализированы оболочечно-сосудистых топографо-анатомические характеристики и нейроэпителиальных опухолей, составляющих основную часть всех диагностированных гистологических форм ОГМ – 190 (44,8%) и 162 (38,2%) соответственно. Как следует из данных, представленных на рис. 3.3.2, среди менингиом наиболее часто встречались конвекситальные (31,8%) и парасагиттальные (30,0%) образования. Несколько реже диагностировались менингиомы базальной локализации (17,1%) и ЗЧЯ (12,9%). Редкими локализациями менингиом отмечены желудочковая система (1,8%), блюменбахов скат, кавернозный и поперечный синусы, клиновидные отростки (6,5%). Наиболее частой локализацией нейроэпителиальных опухолей являлись полушария головного мозга (71,6% случаев) (рис.3.3.3). В 27,85% глиомы распространялись на две и более доли. В лобной доле глиомы локализовались в 19,1% случаев, в теменной – в 11,1%, височной – в 10,5% и в затылочной доле – в 3,1% случаев. Реже глиомы поражали ствол мозга (7,4%), ЗЧЯ (6,8%) и желудочковую систему мозга (10,5%). Самыми редкими локализациями глиом 57 являлись ХСО (1,2%) и мозолистое тело (2,5%). Зависимость локализации глиом от пола и возраста нами не выявлена. Рисунок 3.3.3. Локализация нейроэпителиальных опухолей по отношению к структурам мозга. Таким образом, среди всех ПОГМ превалировала супратенториальная локализация, выявленная более чем у 80% обследованных пациентов. При этом среди менингиом преобладали конвекситальные и парасагиттальные образования, а для нейроэпителиальных опухолей была характерна полушарная локализация, часто с распространением глиом на две и более доли. Заключение В третьей главе на первом этапе исследования нами была дана клиникоэпидемиологическая характеристика первичных опухолей головного мозга, диагностированных у жителей Бишкека и Чуйской области. Согласно результатам проведенного исследования, средняя заболеваемость ПОГМ среди жителей г. Бишкека составила 3,1 на 100 тыс. населения. При этом за период с 2001 по 2010 год заболеваемость первичными ОГМ по Бишкеку выросла с 2,5 на 100 тыс. населения до 5,2, увеличившись более чем в 2,1 раза. Средняя заболеваемость ПОГМ среди жителей Чуйской области составила 2,9 на 100 тыс. населения. При этом за последнее десятилетие она имеет тенденцию к росту: если в 2001 г. средний уровень 58 заболеваемости по области составлял 3,0 на 100 тыс. населения, то к 2010-му он достиг 4,2, т.е. увеличился на 40%, что существенно меньше по сравнению с аналогичным показателем в г.Бишкек. Изучение территориального распределения заболеваемости ПОГМ по Чуйской области выявило существенные различия ее локализации в разных районах данного региона. Так, наиболее неблагоприятные в нейроонкологическом плане ‒Иссык-Атинский (3,8 на 100 тыс. населения), Аламудунский (3,7), Сокулукский (3,2) и Панфиловский (2,6) районы. Наименьшее число заболеваемости ПОГМ отмечено в Жайылском (1,7 на 100 тыс.), Чуйском (2,5) и Московском (2,9) районах. Анализируя полученные данные, мы выявили зависимость уровня заболеваемости в этих районах от расположения относительно г. Бишкека. Так, близость к столице предопределяет рост заболеваемости. Отметим также, что в районах с высоким показателем заболеваемости (Иссык-Атинский, Аламудунский, Сокулукский) сосредоточено большинство предприятий по производству стройматериалов, теплоэнергетики, пищевой и химической промышленностей, загрязняющих атмосферу Чуйской области выбросами химических веществ (диоксид и оксид азота), показатели которых превышали ПДК в 1,2 и 1,3 раза соответственно. Между тем районы, отмеченные расположением хвостохранилищ с определенной радиационной обстановкой, характеризуются невысоким показателем заболеваемости вопреки ожидаемому. Данный факт отмечен и в работах других авторов, изучавших причины развития ОГМ (научные работы, посвященные теме Чернобыльской катастрофы и Хиросимы). Изучение гендерных особенностей заболеваемости ПОГМ подтвердило, что среди мужчин в среднем за 10 лет (с 2001 по 2010 год) заболеваемость составила 2,6 на 100 тыс. населения и была сопоставима по г. Бишкеку и Чуйской области (2,6 и 2,4 на 100 тыс. населения соответственно). Таким образом, у женщин заболеваемость в целом оказалась существенно выше, чем у мужчин (3,5 против 2,5), без существенных различий между г. Бишкеком и 59 Чуйской областью. Исследование возрастной динамики распространенности ПОГМ среди населения г. Бишкека и Чуйской области показало, что пик заболеваемости ПОГМ приходился на возраст 55 ̶ 64 года, составив 8,9 случая на 100 тыс. населения. Однако высокая заболеваемость ПОГМ регистрировалась и в более молодом возрасте. Так, среди лиц в возрастной группе 35 ̶ 44 года она составляла 4,2 наблюдения на 100 тыс. населения, а среди лиц в возрасте 45 ̶ 54 года ̶ 8,3 случая на 100 тыс. населения. Среди детей и лиц молодого возраста заболеваемость ПОГМ была существенно ниже – 0,7 и 1,7 случая на 100 тыс. населения. Следует отметить, что у женщин в возрастных группах старше 35 лет заболеваемость превышает значения данного показателя среди мужчин. Особенно велики различия в возрастной группе 35 ‒ 44 года, в которой заболеваемость среди женщин более чем вдвое выше аналогичного показателя среди мужчин (5,7 и 2,5 случая). Изучение частоты встречаемости отдельных гистологических вариантов выявило: доминирование оболочечно-сосудистой опухоли ‒ менингиомы, которая была диагностирована у 170 пациентов (40,1% случаев от всех первичных ОГМ). Далее следуют нейро-эпителиальные опухоли (глиобластомы ‒ 13,9%, астроцитомы ‒ 13,0%, медуллобластомы ̶ 3,5%) и опухоли ХСО (аденомы гипофиза ‒ 9,2%, краниофарингиомы ‒ 2,1%). Реже встречаются невриномы VIII пары черепно-мозговых нервов (4,9%). Частота встречаемости остальных гистологических вариантов ПОГМ не превышает 1,5%. Анализируя гендерные различия в частоте встречаемости гистологических вариантов ПОГМ, следует отметить, что у женщин достоверно чаще выявлялись менингиомы. По частоте встречаемости других гистологических видов опухолей существенных различий между мужчинами и женщинами не отмечено (p>0,05), однако замечена тенденция к более частой регистрации у мужчин таких вариантов медуллобластомы и опухоли гипофиза. 60 ПОГМ, как глиобластомы, При изучении гистологической картины ПОГМ в зависимости от возраста оказалось, что в детском возрасте доминирующим гистологическим типом являлись нейроэпителиальные опухоли, частота которых в возрастном диапазоне 0 ‒ 18 лет достигала 71%. Из них астроцитомы регистрировались у 22,6% пациентов, медуллобластомы – у 19,4%, у 12,9% встречались глиобластомы. С одинаковой частотой у детей выявлялись менингиомы и краниофарингиомы. И, наконец, наиболее редко встречались невриномы. Аденом гипофиза в данной возрастной группе не выявлено. В возрастной группе 19 ‒ 34 года по-прежнему лидирующую позицию в гистологической структуре ОГМ занимали нейроэпителиальные опухоли, однако их доля в данной группе существенно уменьшилась по сравнению с детским возрастом. При этом увеличилась доля глиобластом и несколько снизилась доля астроцитом и медуллобластом. В то же время отмечалось увеличение частоты встречаемости оболочечных опухолей, в частности менингиом, аденом гипофиза и неврином. Частота краниофарингиом существенно снизилась. В возрастной группе 35 ‒ 44 года частота встречаемости нейроэпителиальных и оболочечно-сосудистых опухолей одинакова. При этом доминирующей по распространенности становится менингиома, которая диагностируется более чем в 30% случаев. Доля глиобластом и астроцитом существенно не изменяется, однако значительно уменьшается встречаемость медуллобластом. У пациентов в возрасте 45 ‒ 54 года лидирующее место занимают оболочечные опухоли, на долю которых приходится до 60% от всех ПОГМ, причем в основном за счет высокой распространенности менингиомы. Доля нейроэпителиальных новообразований (астроцитом, глиобластом) значительно снижается. Частота встречаемости аденом гипофиза и неврином существенно не изменяется. В возрастном диапазоне 55 ‒ 64 года по-прежнему наиболее высокая распространенность менингиом и нейроэпителиальных опухолей. Остается существенной доля аденом гипофиза. С этого возраста отмечается отсутствие медуллобластом. У пожилых пациентов доминирует 61 менингиома, далее следуют нейроэпителиальные опухоли. Увеличивалось количество неврином и несколько снижалась доля аденом гипофиза. Одной из важных характеристик ПОГМ наряду с гистологической верификацией является локализация опухоли по отношению к структурам головного мозга, которая определяет тактику оперативного вмешательства и возможность радикального удаления опухоли, а в конечном итоге ̶ эффективность лечения. Согласно результатам нашего исследования, среди всех ПОГМ превалировала супратенториальная локализация, которая выявлялась у 82,1% обследованных пациентов. У 17,3% больных опухоли располагались субтенториально, и еще в 0,6% случаев отмечалась суб- и супратенториальная локализация. При этом среди менингиом преобладали конвекситальные и парасагиттальные образования, для нейроэпителиальных же опухолей была характерна полушарная локализация, часто с распространением глиом на две и более доли. 62 ГЛАВА 4 КЛИНИКО-СТАТИСТИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ С ПЕРВИЧНЫМИ ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА 4.1. Общая характеристика больных с первичными опухолями головного мозга, поступающих в нейрохирургический стационар Проведенный нами статистический анализ показал, что из 424 больных лишь трое (0,7%) поступили в стационар с начальными и 132 (31,1%) ‒ с умеренными клиническими проявлениями болезни. Основная масса пациентов (249 больных ‒ 58,7%) направлялась в нейрохирургический стационар на стадии выраженных клинических проявлений заболевания и еще 40 пациентов (9,4%) были доставлены в клинику в декомпенсированном состоянии (рис. 4.1.1), что свидетельствует о поздней диагностике ОГМ и соответственно определяет тяжесть состояния основной массы больных при поступлении в нейрохирургическую клинику (рис. 4.1.1). Рис. 4.1.1. Распределение больных с ПОГМ при поступлении в нейрохирургический стационар по степени выраженности клинических проявлений (%). Мы проследили результаты по критерию тяжести состояния больных, поступивших в нейрохирургический стационар, в разных возрастных группах (табл. 4.1.1). 63 Таблица 4.1.1 ‒ Состояние больных при поступлении в нейрохирургический стационар в разных возрастных группах (абс.число и %) Возраст Начальные Умеренные Выраженные Декомпенсация Всего проявления проявления проявления 0 3 (8,8%) 24 (70,6%)* 7 (20,6%)* 34 0 ̶ 18 лет (100%) 0 28 (35%) 49 (61,3%) 3 (3,7%) 80 19 ̶ 34 (100%) года 1 (1,0%) 36(37,1%) 55 (56,7%) 5 (5,2%) 97 35 ̶ 44 (100%) года 1 (0,7%) 54 (36,2%) 80 (53,7%) 14 (9,4%) 149 45 ̶ 54 (100%) года 1 (1,3%) 16 (20%) 52 (65%) 11 (13,7%) 80 55 ̶ 64 (100%) года 0 11 (33,3%) 17 (51,5%) 5 (15,2%) 33 65 ̶ 74 (100%) года Больше 0 0 1 0 1 75 лет Всего 3 (100,0) 148 (100,0) 278 (100,0) 45 (100,0) 474 (100,0) Согласно полученным данным, 70,6% детей и юношей поступили в клинику с выраженными клиническими проявлениями заболевания, а 20,6% пациентов данного возраста госпитализированы в декомпенсированном состоянии, т.е. менее 10% пациентов детского и юношеского возрастов поступили в клинику в стадии умеренных проявлений. Известные из литературы анатомо-физиологические особенности детского возраста, такие, как пластичность черепа, незаращенность костных швов, незрелость нервных структур и функций большинства анализаторов, являются основными причинами достаточно длительно латентного течения внутримозговых новообразований (Никифоров А.С., 2004). Однако наши данные свидетельствуют о низкой степени онконастороженности родителей и врачей первичного звена. В большинстве случаев наблюдаются дети с разными диагнозами. Из 34 больных возрастной категории (0 ‒ 18 лет) 12 наблюдались по поводу последствий родовой травмы с судорожным синдромом, 8 ‒ с 64 энтеровирусной и менингококковой инфекцией, 4 ‒ с церебральным параличом, 3 ‒ по поводу заболевания глаз и 7 ‒ больные с астеновегетативным и невротическим синдромами. В следующей возрастной группе (19 ‒ 34 года), число больных с умеренными клиническими проявлениями увеличивается в 3 раза в сравнении с предыдущей группой и почти в 5 раз меньше больных в декомпенсированном состоянии. В возрастных группах 35 ‒ 44 и 45 ‒ 54 года вышеуказанная тенденция сохраняется. В группе больных 55 ‒ 64 года и старше пациентов клинических в декомпенсированном проявлений. состоянии Основной увеличивается количество и причиной стадии позднего выраженных выявления новообразований головного мозга у больных в указанных возрастных группах было наличие сопутствующей патологии, нередко конкурирующей патологии, что служило причиной более позднего выявления первичных опухолей головного мозга. Характерная особенность в группе больных пожилого возраста ‒ увеличение случаев в стадии декомпенсации. Анатомо-физиологические особенности организма пожилых, склонность их к множественности сопутствующих заболеваний определяют крайнюю сложность распознавания новообразований в начале их клинических проявлений. Именно на этом этапе развития заболевания клиницистами совершается наибольшее число диагностических просчетов. В качестве иллюстрации приведем наблюдение: больной А., 66 лет, история болезни №27924, поступил в отделение нейрохирургии с жалобами: на резкое снижение слуха в левом ухе, шум в нем, шаткость, головокружения, поперхивания, онемение и периодические боли левой половины лица с периодическим спазмом жевательной мускулатуры. Начало заболевания острое: год назад появились сильные головные боли в теменно-затылочной области с тошнотой, рвотой, головокружением, выраженной шаткостью на фоне высоких цифр артериального давления. 65 Больной неоднократно безуспешно лечился в неврологическом отделении с диагнозом: острое нарушение мозгового кровообращения в вертебро- базиллярном бассейне. Позже заметил ухудшение слуха на левое ухо, присоединились боли в левой половине лица, затем поперхивания при приеме пищи. Сопутствующие заболевания: КБС. Стенокардия напряжения. Атеросклероз коронарных и мозговых сосудов. Гипертоническая болезнь III степени высокого риска. При поступлении в больницу общее состояние больного средней тяжести, несколько вялый, адинамичный. Сходящееся косоглазие, больше слева, из-за пареза VI пары. Легкий парез мимической мускулатуры левой половины лица, понижение вкусовой чувствительности на всей половине языка. Левосторонняя глухота. Глоточный рефлекс слева выпал, выявлена девиация языка влево. Сухожильные рефлексы с конечностей оживлены. Координаторные пробы не выполняет. Проба на диадохокинез положительная. Офтальмоскопически: vd=1,0 vs=0,8. На глазном дне: выраженные застойные диски зрительных нервов, больше слева, с кровоизлияниями по ходу сосудов и на дисках зрительных нервов. При МРТ- исследовании головного мозга (рис. 4.1.2): в левом мостомозжечковом углу очаг повышенной плотности с перифокальной зоной отека, распространяющийся супратенториально. а б Рис. 4.1.2. МР-томограмма больного А. до (а) и после операции (б). 66 Операция: Парамедианным доступом удалена большая невринома слухового нерва слева. В послеоперационном периоде несколько нарос парез лицевой мускулатуры слева, который в последующем на фоне комплексной терапии значительно регрессировал. А Б А: 1-слуховой проход; 2- невринома Б: 1 – тройничный нерв; 2 – сохраненный лицевой нерв Рис . 4.1.3. Интраоперационные фотографии до операции до (А) и после (Б). Данное клиническое наблюдение заслуживает внимания тем, что сопутствующая патология в виде недостаточности кровообращения на фоне гипертонической болезни маскировала основную симптоматику образования левого мосто-мозжечкого угла, течение которого было латентным, и тем самым явилось причиной запоздалой диагностики невриномы слухового нерва. Согласно анамнестическим сведениям, нами установлено, что 113 больных на начальной стадии клинических проявлений первичных опухолей головного мозга первоначально наблюдались и лечились у невропатологов, отоларингологов и терапевтов с различными диагнозами. Наиболее часто диагноз трактовался как цереброваскулярная патология (65 наблюдений), как возрастные изменения или воспалительные поражения глаз и органов слуха (20) либо как последствия черепно-мозговой травмы (10). В 18 случаях вторичная психопатологическая симптоматика при первичных опухолях 67 головного мозга у лиц пожилого и старческого возрастов (ЛПСВ) была первоначально расценена как сосудистая деменция. Степень выраженности клинических проявлений в зависимости от гистологической формы дана в табл. 4.1.2. Таблица 4.1.2 ‒ Распределение степени выраженности клинических проявлений при различных гистологических типах ПОГМ Клинические проявления Начальные Умеренные Менингиомы Глиобластомы Астроцитомы Аденомы гипофиза 0 12 (30,8%) 25 (64,1%) Невриномы VIII пары 1 (4,8%) 5 (23,8%) 1 (0,6%) 66 (38,8%) 1 (1,7%) 14 (23,7%) 0 12 (21,8%)* Выраженные 89 (52,4%) 35 (59,3%) 37 (67,3%)* Декомпенсация Всего 14 (8,2%) 9 (15,3%)° 6 (10,9%) 2 (5,1%) 1 (4,8%) 170 (100,0) 59 (100,0) 55 (100,0) 39 (100,0) 21 (100,0) 14 (66,7%) Примечание * ̶ р<0,05 в сравнении с группой менингиом; ° р<0,05 в сравнении с группами аденом гипофиза и неврином Анализ клинического состояния больных с ПОГМ, поступивших в нейрохирургический стационар, в зависимости от их гистологического варианта определяет более тяжелое состояние больных при нейроэпителиальных опухолях (глиобластома, астроцитома), что связано с темпом роста данных опухолей, сопутствующим им интоксикационным синдромом. Именно в этих группах, естественно больше при глиобластоме, превалировало число больных в стадии декомпенсации, почти каждый шестой пациент (р<0,05). Умеренные клинические проявления, как и следовало ожидать, чаще обнаруживались у больных с оболочечно-сосудистыми опухолями. Больные с аденомами гипофиза и невриномами VIII пары ЧМН поступали в стадии выраженных клинических проявлений ‒ 64,1 и 66,7% соответственно, что ниже, чем среди пациентов с глиальными опухолями. К сожалению, эта нейрохирургический категория стационар больных была неоправданно госпитализирована поздно, учитывая, в что клиническая манифестация опухолей данной локализации довольно яркая и 68 ранняя и эти больные длительное время наблюдались у окулистов, лор-врачей и сурдологов. В современной литературе, а на практике ‒ в странах бывшего Советского Союза стала широко использоваться унифицированная шкала Карновского [Karnоfsky D.А. и соавт., 1948), которая представлена в табл. 4.1.3. Таблица 4.1.3 ‒ Распределение нейроонкологических больных по шкале Карновского в разных возрастных группах Функциональный статус Возраст по группам 30 40 50 60 70 80 90 Всего 0 ‒ 18 0 0 2 (6,5%) 12 (38,7%)* 14 (45,2%) 3 (9,7%) 0 31 19 ‒ 34 0 0 0 9 (13,2%) 39 (57,4%) 35 ̶ 44 1 (1,1%) 2 (2,2%) 0 12 (13,5%) 49 (55,1%) 45 ̶ 54 0 0 4 (3,0%) 27 (20,3%) 68 (51,1%) 55 ̶ 64 0 1 (1,4%) 6 (8,3%) 25 (34,7%)* 29 (40,3%) 65 ̶ 74 0 0 0 13 (43,3%)* 10 (33,3%) 75 ̶ 100 0 0 0 0 1 0 0 1 Всего 1 3 12 98 210 93 7 424 19 1 (27,9% (1,5% )* ) 22 3 (24,7% (3,4% )* ) 31 3 (23,3% (2,3% )* ) 11 (15,3% 0 ) 7 (23,4% 0 ) 68 89 133 72 30 Примечание ‒ * р<0,05 Данные сопоставления состояния больных при поступлении по фазам клинического течения и тяжестью состояния больных по шкале Карновского во 69 многом совпадают. Однако эта шкала на наш взгляд, является более конкретизирующей и удобной для оценки тяжести состояния больных и более четко отражает качество жизни больного как на момент поступления в клинику, так и после лечения в отдаленном периоде. Таблица 4.1.4 ‒ Распределение больных с различными гистологическими типами ПОГМ по шкале Карновского Тип Менингиомы Глиомы Аденомы Невриномы ПОГМ гипофиза VIII пары Баллы 30 1 (0,6%) 0 0 0 40 1 (0,6%) 2 (1,2%) 0 0 50 2 (1,2%) 9 (5,6%) 0 1 (4,8%) 60 29 (17,1%) 51 (31,5%)* 6 (15,4%) 7 (33,3%) 70 84 (49,4%) 76 (46,9%) 26 (66,7%)* 9 (42,5%) 80 50 (29,4%) 21 (13,0%)* 7 (17,9%) 3 (14,3%) 90 3 (1,8%) 3 (1,9%) 0 1 (4,8%) Всего 170 (100,0) 162 (100,0) 39 (100,0) 21 (100,0) Примечания ‒ *p<0,05. Больные с менингиомами в состоянии инвалидности поступали в 19,5% случаев, причем в 17,1% это были пациенты, не постоянно нуждающиеся в посторонней помощи, т.е. имеющие 60 баллов по шкале Карновского. В 49,4% случаев пациенты имели 70 баллов, еще в 29,4% – 80 баллов по шкале Карновского (табл. 4.1.4). У больных с глиомами отмечались более низкие значения функционального статуса. Так, 38,3% пациентов с глиомами имели на момент постановки диагноза и поступления в нейрохирургический стационар ту или иную степень инвалидности, что было в 2 раза больше по сравнению с группой больных, страдающих менингиомами (p<0,05). Высокая степень инвалидизации отмечалась и в группе пациентов с невриномами VIII пары ЧМН, которая среди 70 данной категории больных достигала 38,1%. Наиболее редко в инвалидизирующем состоянии госпитализировались пациенты с аденомой гипофиза (15,4% случаев). Итак, как и следовало ожидать, наиболее низкий функциональный статус при поступлении имели дети и пожилые пациенты, а также больные, страдающие глиальными опухолями. Весьма важным показателем у пациентов с ПОГМ является уровень состояния сознания. Зачастую грубые нарушения сознания определяют тяжесть адекватной оценки неврологического статуса. По нашим данным, 356 пациентов (84%) поступили в стационар в ясном сознании, 20 больных (4,7%) – в состоянии умеренного оглушения, 39 ‒ глубокого оглушения, 5 больных (1,2%) ‒ в состоянии сопора и ещё 4 пациента (0,9%) были доставлены в коматозном состоянии (рис 4.1.4). Рис. 4.1.4. Основные виды нарушения сознания у больных с первичными опухолями головного мозга при поступлении в нейрохирургический стационар. Дальнейший анализ уровня нарушения сознания проводился с учетом возраста больных и гистологического типа ОГМ. Как следует из данных, представленных в табл.4.1.5, возраст не оказывал существенного влияния на уровень сознания нейроонкологических стационарное лечение. 71 больных, поступающих на Таблица 4.1.5 ‒ Распределение нейроонкологических больных по уровню сознания в зависимости от возраста Сознание Возраст Ясное по группам Оглуше- Затормо- ние женное Кома Сопор Всего I, II, III 0 ̶ 18 26 (83,9%) 1 (3,2%) 4 (12,9%) 0 0 31 19 ̶ 34 61 (89,7%) 1 (1,5%) 6 (8,8%) 0 0 68 35 ̶ 44 74 (83,1%) 7 (7,9%) 4 (4,5%) 2 (2,2%) 2 (2,2 %) 89 6 (4,5%) 11 (8,3%) 2 (1,5%) 2 (1,5%) 133 9 (12,5%) 1 (1,4%) 0 72 0 0 30 45 ̶ 54 112 (84,2%) 55 ̶ 64 59 (81,4%) 3 (4,2%) 65 ̶ 74 23 (76,7%) 2 (6,7%) 75 и старше 1 0 0 0 0 1 Всего 356 20 39 5 4 424 5 (16,7%)* Примечание ‒ * p<0,05 В частности, у пациентов в возрасте до 18 лет умеренное и глубокое оглушение отмечалось в 16,1% случаев, среди больных 19 ‒ 34 года – в 10,3%, 35 ‒ 44 года – в 12,4%, 45 ‒ 54 года – в 12,8%. При этом отметим, что в двух последних возрастных диапазонах отмечались случаи, когда пациенты поступали в стационар в состоянии сопора или комы. В возрасте 55 ‒ 64 года нарушения сознания при поступлении регистрировались у 18,1% пациентов, а в возрасте 65 ‒ 74 года – у 16,7%. Итак, результаты нашего исследования свидетельствуют об отсутствии четкой зависимости уровня сознания больных, поступающих в стационар, от их возраста. 72 Далее нами был проведен анализ нарушения сознания в зависимости от гистологической структуры ПОГМ (табл.4.1.5). Наиболее выраженные нарушения сознания нейроонкологических больных при поступлении в стационар отмечались в группе лиц с нейроэпителиальными опухолями. В ясном сознании в стационар госпитализировались только 73,4% больных, 8,6% пациентов поступали в состоянии умеренного оглушения, 13,6% ‒ в состоянии глубокого оглушения, 2,5% ‒ в сопорозном состоянии и еще 1,9% ‒ в состоянии комы. При этом отметим, что у троих из четверых больных, госпитализированных в стационар в состоянии комы, при гистологическом исследовании диагностированы нейроэпителиальные опухоли. Таблица 4.1.6 ‒ Уровень нарушения сознания у больных, поступивших в нейрохирургический стационар, в зависимости от гистологического типа опухоли Сознание Гистологическая ЗатормоКома I, Всего группа Ясное Оглушение Сопор женное II, III 119 (73,4%)* 14 (8,6%) 22 (13,6%)* 4 (2,5%) 3 (1,9%) 162 18 (85,7%) 2 (9,5%) 1 (4,8%) 0 0 21 Менингиомы 151 (88,8%) 4 (2,4%) 13 (7,6%) 1 (0,6%) 1 (0,6%) 170 Аденомы гипофиза 39 (100%) 0 0 0 0 39 Всего 327 20 36 5 4 392 Глиомы Невриномы VIII пары Примечание ‒ * р<0,05 Менее выраженные нарушения сознания выявлялись у нейроонкологических больных с другими гистологическими вариантами ОГМ (табл. 4.1.6). При менингиомах ясное сознание при поступлении в стационар определялось у 88,8% больных, умеренное оглушение – у 2,4% и глубокое 73 оглушение – у 7,6% пациентов. Сходные данные были получены в отношении пациентов с невриномами VIII пары ЧМН. Ясное сознание при поступлении имели 85,7% больных с данным гистологическим типом ОГМ, у 9,5% больных отмечено состояние умеренного оглушения, у 4,8% ̶ глубокого оглушения. В группе с аденомами гипофиза зафиксировано поступление больных в ясном сознании. 4.2. Структура и особенности клинических проявлений первичных опухолей головного мозга Многообразие и неспецифичность клинических проявлений ОГМ требуют особого внимания и ответственности всех специалистов первичного звена, к которым обращается пациент за медицинской помощью. Неврологические очаговые симптомы, как правило, являются следствием поражения объемным процессом определенных зон головного мозга, присоединение гипертензионно-гидроцефальных и дислокационных симптомов может значительно затруднить первичную диагностику. Широкое внедрение в клиническую практику современных методов нейровизуализации (КТ и МРТ) в настоящее время привело к значительному снижению интереса к анализу неврологических проявлений внутричерепных новообразований. Между тем отбор больных на КТ и МРТ-исследования производится на основании неврологической симптоматики как в дебюте, так и на стадии выраженных клинических проявлений. Поэтому залогом ранней и правильной диагностики ПОГМ является своевременная и адекватная интерпретация первоначальных клинических симптомов ‒ одно из важных условий успешного лечения заболевания. По результатам нашего исследования в 27,3% случаев ПОГМ дебютировали с появления головной боли и судорожного синдрома (22,6%). В 18,0% наблюдений заболевание проявлялось 4,7% ̶ снижением слуха. 74 снижением остроты зрения, в Согласно анамнестическим сведениям, большинство больных на начальной стадии клинических проявлений опухолей головного мозга первоначально наблюдались и лечились у невропатологов, отоларингологов и терапевтов с различными диагнозами. Наиболее часто встречающиеся первоначальные диагнозы, под маской которых скрывался основной диагноз опухоли головного мозга, при различных типах представлены ниже. Менингиомы первоначально интерпретировались как синдром вертебробазилярной недостаточности (17,6% случаев), эпилепсия (14,1%), заболевания глаз (10,0%), дисциркуляторная энцефалопатия (12,4 %), проявления шейного остеохондроза (7,1%) и острых нарушений мозгового кровообращения (7,1%). Несколько реже данный гистологический тип опухоли имитировал гипертоническую болезнь (4,7%), заболевания лор-органов (в 4,7%) , следствие ЧМТ (в 4,1%) (табл. 4.2.1). Таблица 4.2.1 ‒ Клинические маски менингиом n=170 Частота симптомов Клинические маски абс. число % Синдром ВБН 30 17,6 ОНМК 12 7,1 Дисциркуляторная энцефалопатия 21 12,4 Невралгия Vпары 2 1,2 Гипертоническая болезнь 8 4,7 Шейный остеохондроз 12 7,1 Воспаление лор-органов 8 4,7 ЧМТ 7 4,1 Заболевания глаз 17 10,0 Эпилепсия 24 14,1 Эндокринные заболевания 2 1,2 75 При нейроэпителиальных опухолях, в частности при глиобластоме и астроцитоме, также часто первоначальные симптомы интерпретированы как иные заболевания ЦНС, лор-органов, однако сравнительно с менингиомами более часто зафиксирован диагноз: дисциркуляторная энцефалопатия (табл. 4.2.2). Таблица 4.2.2 ‒ Клинические маски глиобластом (n-59), астроцитом (n-55) Глиобластомы Клинические маски Астроцитомы Частота симптома абс. число % абс. число % Синдром ВБН 7 11,9 11 20,0 ОНМК 3 5,1 2 3,6 Дисциркуляторная 15 25,9 17 30,9 3 5,1 1 1,8 4 6,8 1 1,8 2 3,4 2 3,6 ЧМТ 2 3,4 2 3,6 Заболевания глаз 2 3,4 3 5,5 Эпилепсия 7 12,1 6 10,9 Невралгия 1 1,7 1 1,8 энцефалопатия Гипертоническая болезнь Шейный остеохондроз Воспаление лорорганов 76 Больные с астроцитомами дисциркуляторной энцефалопатии ошибочно наблюдались случаев), (30,9% по поводу вертебро-базилярной недостаточности (20,0% случаев), эпилепсии (10,9% случаев). Аденомы гипофиза ввиду их локализации ХСО имеют специфическую клиническую эндокринными симптоматику, сопряженную расстройствами. В связи с с нарушением этим и зрения и интерпретация первоначальных симптомов при ОГМ данной локализации была несколько иная: 69,2% пациентов лечились у окулистов с разными заболеваниями и у эндокринологов (20,5%) и гинекологов (12,8%). В 7,7% наблюдений ‒ у неврологов с синдромом ВБН (табл. 4.2.3), который возможен почти у каждого третьего больного как сопутствующая патология. Таблица 4.2.3 ‒ Клинические маски аденом гипофиза n-39 Частота симптомов абс. число % Клинические маски Синдром ВБН ОНМК ХНМК Церебральный атеросклероз 3 1 1 1 7,7 2,6 2,6 2,6 ЧМТ Заболевания глаз Гинекологические заболевания Эндокринные заболевания 2 27 5 8 5,1 69,2 12,8 20,5 Невриномы слухового нерва также находятся в достаточно ограниченном анатомическом пространстве с характерной симптоматикой поражения черепных нервов мосто-мозжечкового угла. В зависимости от превалирования того или иного черепного нерва манифестация симптомов имеет свои особенности (табл.4.2.4). Таблица 4.2.4 ‒ Клинические маски неврином VIII пары ЧМН (n-21) Клинические маски Частота симптомов абс. число % от общего числа больных 77 Синдром ВБН Заболевания ЖКТ Кохлеоневрит Шейный остеохондроз Дисциркуляторная энцефалопатия Воспаление лор-органов ЧМТ Заболевания глаз Невралгия 6 1 8 3 1 28,6 4,8 38,1 14,3 4,8 5 1 1 1 23,8 4,8 4,8 4,8 Наиболее часто такие больные первоначально лечатся у сурдологов (38,1% случаев), лор-врачей (23,8%). Нередко у больного в анамнезе был гнойный отит и другие воспалительные заболевания среднего уха, что, безусловно, вуалирует симптоматику опухоли. В качестве иллюстрации ошибочных диагнозов, установленных больным на этапе первичного звена, приводим выписку из истории болезни больной М.У. Больная М.У. 1962 г.р., история болезни №21706, ольфакторной ямки. Двусторонний амавроз. диагноз: опухоль Умеренный выраженный гипертензионный синдром. Эписиндром. При поступлении отмечены жалобы на незначительные головные боли, без четкой локализации, головокружения, слепоту. Наличие однократного генерализованного эпиприступа. Из анамнеза установлено, что головные боли беспокоят пациентку в течение девяти лет. С 2007 г. лечилась у окулиста по месту жительства по поводу начальной катаракты и глаукомы. В июне 2008 г. симптоматика прогрессировала – был эпизод генерализованного эпиприступа, что послужило поводом для направления больной в нейрохирургическое отделение и проведения МРТ- исследования головного мозга. При поступлении состояние больной средней тяжести, неврологически ‒ двусторонний амавроз, гипосмия, выраженный гипертензионный синдром. 78 Офтальмологически: OU-1/∞ ps.inc. На глазном дне: диски зрительных нервов белого цвета, интенсивнее слева, границы четкие, артерии узкие, вены сужены, сетчатка резко диспигментирована. Заключение: Нисходящая атрофия зрительного нерва обоих глаз. МРТ головного мозга: супраселлярно определяется образование округлой формы, с четкими, бугристыми контурами, до 40 мм в наибольшем измерении. Желудочки мозга расширены, боковые симметричны, водопровод мозга проходим. Умеренно расширены субарахноидальные пространства. МР-томограмма представлена на рис. 4.2.1 (а) а б Рис. 4.2.1. МР-томограмма больной М.У. до операции (а) и после (б). 06.08.08 г. произведена операция по удалению менингиомы бугорка турецкого седла биаурикулярным доступом. Пластика стенки лобной пазухи надкостницей. Опухоль была интимно спаяна с обеими ВСА (передней мозговой и передней соединительной). Обонятельные нервы были атрофичными. Стебель гипофиза оттеснен вправо. После удаления опухоли 79 визуализировались базилярная артерия и обе задние мозговые артерии, ствол мозга. Гистологическое течение гладкое. исследование Регресс – менингиома. общемозговой Послеоперационное симптоматики. Зрение на дооперационном уровне. Выписана в удовлетворительном состоянии. Контрольная МРТ головного мозга после операции: данные за послеоперационные изменения без признаков наличия новообразования (рис. 4.2.1,б). Данный пример является следствием грубой врачебной ошибки, которая привела к слепоте больной. Опухоль выявлена в стадии декомпенсации. В данном случае наличие у больной сопутствующих заболеваний глаз ‒ катаракты и глаукомы ‒ послужило основной причиной запоздалого выявления новообразования. Гигантские размеры опухоли значительно усугубляли риск оперативного вмешательства. Использование микрохирургической техники позволило тотально удалить новообразование. Однако операция не имела перспективы в плане восстановления утраченных зрительных функций. Нами представлены данные о сроках с момента появления первых симптомов до установления диагноза в зависимости от возраста и гистологических типов ОГМ (табл. 4.2.5). Таблица 4.2.5 ‒ Средняя продолжительность клинических проявлений ПОГМ в зависимости от возраста больных Возраст До 6 мес. До 12 Более Итого 1 ̶ 3 года 3 ̶ 5 лет мес. пяти лет 0 ‒ 18 19 9 3 2 1 34 лет (55,9%)* (26,5%) (8,8%)* (5,9%)* (2,9%)* (100,0) 19 ‒ 34 26 22 12 8 12 80 года (32,5%) (27,5%) (15,0%) (10%) (15,0%) (100,0) 35 ‒ 44 35 25 11 13 12 96 года (25,8%) (36,1%) (11,3%) (13,4%) (12,4%) (100,0) 80 45 ‒ 54 41 45 20 24 18 148 года (20,9%) (37,2%) (13,5%) (16,2%) (12,2%) (100,0) 55 ‒ 64 30 20 8 14 8 80 года (18,7%) (37,5%) (10,0%) (17,5%) (10,0%) (100,0) 65 ‒ 74 10 11 6 2 33 года (30,3%) (33,3%) (18,2%) (6,1%) (100,0) 1 0 0 0 0 1 162 132 60 65 53 474 (26,8%) (34,2%) (12,6%) (13,7%) (11,2%) (100,0) Старше 75 лет Итого 4(12,1%) В период до шести месяцев с момента начала заболевания в нейрохирургический стационар было госпитализировано всего 26,8% больных, в период до 12 месяцев – 34,2% больных, а в сроки 1 ̶ 3 года диагноз был установлен у 12,6% пациентов. В сроки от 3 до 5лет госпитализировано в нейрохирургические отделения 65 больных (13,7%) и в сроки, превышающие пятилетний период, – 53 пациента (11,3%). Оценивая влияние возраста на длительность анамнеза ОГМ, следует отметить следующее. Наиболее короткий нейроонкологический анамнез регистрировался у детей и юношей. Так, в возрасте до 18 лет в течение первого года с момента появления клинических симптомов заболевание было диагностировано у 82,4% больных, что существенно выше, чем в более старших возрастных группах (p<0,05), причем у 55,6% нейроонкологическая патология была верифицирована в течение первых шести месяцев от начала заболевания. Следует отметить, что в старших возрастных группах сроки с момента появления первых симптомов до установления диагноза увеличивались. В сроки до одного года опухоли мозга диагностировались только у 55 ̶ 58% больных, а в сроки до шести месяцев – менее чем у 40% (p<0,05) в сравнении с возрастной группой 0 ‒ 18 лет. 81 При изучении влияния гистологического типа ПОГМ на сроки до установления диагноза выяснилось, что наиболее короткий анамнез до установления диагноза был характерен для злокачественных новообразований (табл.4.2.6). Таблица 4.2.6 ‒ Продолжительность клинических проявлений в зависимости от гистологического варианта ОГМ Длительность Менингианамнеза омы Глиоблас- Астроцито- Аденомы Неври- томы мы гипофиза номы VIII пары до 6 мес. 44 30 20 7 3 (25,9%) (51,7%) (36,4%) (17,9%) (14,3%) Продолжение табл. 4.2.6. Длительность Менинги- Глиоблас- Астроцито- Аденомы Неври- анамнеза омы томы мы гипофиза номы VIII пары До 12 мес. 1 ̶ 3 года 3 ̶ 5 лет Свыше пяти 57 (33,5%) 10 9 4 3 (17,2%) (16,4%) (10,2%) (14,3%) 15 8 14 3 4 (8,8%) (13,8%) (25,4%) (7,7%) (19,0%) 35 (20,6%) 6 10 14 (35,9%) 6 (10,3%) (18,2%) 4 2 (6,9%) (3,6%) 58 55 39 21 (100,0) (100,0) (100,0) (100,0) 19 (11,2%) лет Итого 170 (100,0) (28,6%) 11 (28,2%) 5 (23,8%) В частности, более чем 50% больным с глиобластомами диагноз устанавливается в течение первых шести месяцев, еще у 29% пациентов верификация диагноза происходит в сроки до 12 месяцев. И лишь менее чем у 82 20% больных анамнез симптоматики до установления диагноза превышает год. При астроцитомах, как и следовало ожидать, проявлений была несколько дольше. длительность клинических В первые шесть месяцев с момента появления симптомов диагноз ОГМ установлен у 36,4% больных, в сроки до 12 месяцев ‒ 16,4% и еще у 25,4 % больных заболевание диагностировано в сроки от одного до 3 лет. При менингиомах только у 25,9% больных заболевание было диагностировано в течение шести месяцев с момента появления клинических симптомов. Наиболее часто заболевание диагностировано в сроки до 12 месяцев с момента появления симптоматики (33,5%). Обращает на себя внимание тот факт, что у более чем 40% больных менингиомы диагностированы спустя 1 год и более с момента появления клинических симптомов, причем у 11,2% больных длительность анамнеза составляла 5 и более лет. Еще в более поздние сроки диагностированы больные с аденомами гипофиза. В сроки до шести месяцев заболевание было выявлено у семерых пациентов (17,9%). При этом у 14 больных (35,9%) длительность анамнеза с момента появления симптомов составила 1 год и более, а у 28,2% ‒ более 5 лет. У больных с невриномами VIII пары ЧМН до одного года заболевание было диагностировано у 14,3% больных. Наиболее часто длительность анамнеза невриномы VIII пары составляла от 1до 3 лет (19,0%) и у 23,8% заболевание было диагностировано спустя 5 и более лет с момента появления первых симптомов. К моменту поступления в нейрохирургическое отделение, т.е. на стадии выраженных клинических проявлений, у всех наших больных имелось сложное переплетение общемозговых, очаговых дислокационных симптомов, разграничение которых достаточно условно, поэтому они объединены в одну таблицу. Анализ соотношений общемозговых и очаговых симптомов при ПОГМ представлен в табл. 4.2.7. 83 Таблица 4.2.7 ‒ Основные клинические симптомы ПОГМ у больных при госпитализации в нейрохирургическое отделение Симптомы Частота симптомов абс.число число в % 410 96,7 Судорожные припадки: 126 29,7 генерализованные 95 22,4 парциальные 31 7,3 Афатические 36 8,5 Головная боль, тошнота, рвота расстройства продолжение табл. 4.2.7 Симптомы Частота симптомов абс.число число в % 71 16,7 Зрительные расстройства 129 30,4 Изменения на глазном 127 29,9 Снижение слуха 38 9,0 Парезы конечностей 149 35,1 Нарушение 64 15,1 Атаксия 112 26,4 Интеллектуально- 84 19,8 Менингиальные знаки 7 1,7 Психические нарушения 19 4,5 Поражение ЧМН (лицевой, тройничный, обонятельный) дне чувствительности мнестические 84 Эндокринные 36 8,5 Головокружение 281 66,3 Изменение массы тела 16 3,8 расстройства В клинической симптоматике ПОГМ доминировали головная боль, тошнота, рвота (в 96,7%) на фоне общей слабости (в 80,4%) и головокружения (в 66,3%). Параличи и парезы конечностей отмечались у 35,1% больных, судорожный синдром ‒ 29,7%. Из них у 22,4% судороги были генерализованными, у 7,3% пациентов выявлялись парциальные судороги, атаксия отмечалась у 26,4%, поражение ЧМН ‒ у 16,7%, нарушение чувствительности ‒ у 15,1% пациентов. При офтальмологическом исследовании у 29,9% пациентов диагностированы изменения на глазном дне (застойные соски зрительных нервов, атрофия зрительного нерва), у 30,4% больных отмечались зрительные расстройства. Интеллектуально-мнестические нарушения наблюдались у 19,8% пациентов, реже отмечалось снижение слуха (9,0%) и диагностированы эндокринные расстройства (8,5%). Таблица 4.2.8 ‒ Клиническая симптоматика менингиом головного мозга (n-170) Симптомы Частота симптомов абс. число число в % Головная боль, тошнота 166 97,6 Судороги, в т.ч. 57 33,5 генерализованные 39 22,9 Зрительные расстройства 39 23,0 Изменения на глазном дне 38 22,4 Нарушение функции черепно- 21 12,4 Парезы конечностей 66 38,8 Нарушения чувствительности 30 17,6 Атаксия 61 35,9 мозговых нервов 85 Интеллектуально-мнестические 29 17,1 Менингиальные знаки 4 2, Повышение АД 12 7,1 Эндокринные нарушения 4 2.4 Головокружение 105 61,8 нарушения Нами представлены клинические симптомы заболевания в зависимости от гистологического варианта наиболее распространенных ПОГМ (табл. 4.2.8 и 4.2.9). Таблица 4.2.9 ‒ Клиническая симптоматика нейроэпителиальных опухолей головного мозга (глиобластома, астроцитома) n-114 Симптомы Частота симптомов абс. число % Головная боль, тошнота 109 95,6 Судороги, в т.ч. генерализованные 61 53,5 Афатические расстройства 16 14,0 Снижение остроты зрения 12 10,5 Атрофия зрительных нервов 3 2,6 Застойные соски зрительных нервов 34 29,8 Нарушение функции ЧМН 10 8,8 Парезы конечностей 56 49,1 Нарушения чувствительности 21 18,4 Атаксия 52 45,7 Интеллектуально-мнестические 33 28,9 79 69,3 нарушения Головокружение 86 Особую группу ПОГМ составляют опухоли ХСО ввиду их особой локализации, гистологической природы, что предопределяет особенности клинической симптоматики. Рассмотрим наиболее часто встречающуюся разновидность опухоли этой локализации ‒ аденому гипофиза ‒ и размеры опухоли в зависимости от роста. К сожалению, основную массу составили больные с аденомами гипофиза с обширным экстраселлярным ростом. Как и следовало ожидать, у большинства больных отмечались нарушения зрения, почти у половины больных ̶ эндокринные расстройства (табл. 4.2.10). При аденомах гипофиза головная боль и тошнота выявлялись у 97,4% поступивших больных. При этом существенно выше оказалась частота таких симптомов, как зрительные расстройства (87,2%), изменения на глазном дне ̶ в 41,0%. Обращает на себя внимание тот факт, что почти половина пациентов с аденомами гипофиза (48,7%) страдают различными эндокринными нарушениями. Таблица 4.2.10 ‒ Клиническая симптоматика аденом гипофиза Симптомы Частота симптомов абс. число % Головная боль, тошнота 38 97,4 Судороги, в т.ч. 1 2,6 Зрительные расстройства 34 87,2 Изменения на глазном дне 16 41,0 Нарушение функции черепно-мозговых 3 7,7 Парезы конечностей 2 5,1 Атаксия 8 20,5 Интеллектуально-мнестические 2 5,1 4 10,2 генерализованные нервов ‒ глазодвигательные расстройства нарушения Менингеальные знаки 87 Головокружение 24 61,5 Общая слабость 12 30,8 Эндокринные нарушения 19 48,7 В 17,9% случаях были выявлены симптомы гипофизарной апоплексии. В настоящее время данный термин представляет собой симптомокомплекс, обусловленный кровоизлияния острым или увеличением ишемического аденомы некроза. гипофиза Клинически вследствие гипофизарная апоплексия характеризуется внезапным появлением головной боли с рвотой, нарушением зрения, менингиальным синдромом, глазодвигательными расстройствами, иногда и нарушением сознания. Это острое состояние, при котором необходимо экстренное оперативное вмешательство. В качестве иллюстрации приводим выписку из истории болезни больной К. Больная К., 38 лет, история болезни №3267, госпитализирована с жалобами на прогрессирующее снижение остроты зрения, ограничение наружных полей зрения, выраженную головную боль, общую слабость. Из анамнеза установлено, что около трех недель назад внезапно возникла головная боль, отмечено резкое снижение остроты зрения и сужение наружных полей зрения, быстрая утомляемость и общая слабость. При поступлении общее состояние больной удовлетворительное. Двустороняя амблиопия больше слева, выпадение височной половины зрения. Умеренная ригидность затылочных мышц. Офтальмологически: острота зрения правого глаза ‒ 0,6, левого ‒ 0,02, битемпоральная гемианопсия. На глазном дне: частичная атрофия зрительных нервов. МРТ головного мозга: в проекции турецкого седла определяется дополнительное объёмное образование солидного характера, с четкими, неровными контурами, размерами до заполняющее полость турецкого седла. 88 23,2*26,6*36,1мм. полностью а б Рис 4.2.3. МР-томограмма больной К. до операции (а) и после (б). Произведена операция: КПТЧ в правой лобно-височной области с удалением гигантской аденомы гипофиза. Гистологический диагноз: хромофобная аденома гипофиза. На рис 4.2.4 А-В представлены этапы удаления аденомы гипофиза На рис. 4.2.4 А. обнажена ХСО, где 1 ̶ правый зрительный нерв; 2 – опухоль с участками кровоизлияния. После удаления аденомы гипофиза визуализируется 1 – правый зрительный нерв; 2 – левый зрительный нерв; 3- ВСА (рис. 4.2.4 В). 89 Рис 4.2.4. А ̶ В. Этапы удаления аденомы гипофиза. 90 В послеоперационном периоде отмечено улучшение остроты зрения слева, к 14-му дню нормализовались поля зрения. Больная выписана в удовлетворительном состоянии. В данном случае представлена клиника гипофизарной апоплексии с резким падением менингиальных зрения на фоне выраженных общемозговых и симптомов. Такое состояние требует незамедлительного хирургического вмешательства, позволяющего надеяться на более лучшие функциональные результаты. К сожалению, в настоящее время не только невропатологи, но и нейрохирурги недостаточно осведомлены о синдроме гипофизарной апоплексии, что зачастую влечет неправильную интерпретацию симптомов и нередко приводит к госпитализации в непрофильные учреждения, в частности в инфекционную больницу с подозрением на менингит, в инсультное отделение с диагнозом: субарахноидальное кровоизлияние, в офтальмологическое отделение с подозрением на глаукоматозный приступ. При невриномах VIII пары ЧМН (табл.4.2.11) наиболее часто регистрировались общемозговые нарушения в виде головной боли и тошноты (95,2%), а также застойные соски зрительных нервов (23,8%). В значительном числе случаев выявлялись атаксические расстройства (81,0%), головокружение (71,4%) и нарушение функции слухового нерва (52,4%). Реже отмечались развитие бульбарного синдрома (28,6% случаев), парезы конечностей (19,0% ) и нарушения чувствительности (9,5%). Таблица 4.2.11 ‒ Клиническая симптоматика невриномы VIII пары Симптомы Частота симптомов абс. число % Головная боль, тошнота 20 95,2 Судороги, в т.ч. 2 9,5 1 4,8 генерализованные Афатические расстройства 91 продолжение табл.4.2.11 Симптомы Частота симптомов абс. число % Снижение остроты зрения 1 4,8 Изменения на глазном дне 5 23,8 Нарушение функции слухового 11 52,4 Атаксия 17 81,0 Головокружение 15 71,4 Нарушения чувствительности 2 9,5 Парезы конечностей 4 19,0 Интеллектуально-мнестические 2 9,5 6 28,6 нерва нарушения Бульбарный синдром При изучении частоты встречаемости очаговых симптомов оказалось, что пирамидная симптоматика встречается при менингиомах и нейроэпителиальных опухолях приблизительно с одинаковой частотой, достигающей 57,6% при глиобластомах, 40% ̶ при астроцитомах и 38,8% ‒ при менингиомах. В то же время встречаемость паретических нарушений оказалась существенно ниже при аденомах гипофиза (5,1%, p<0,01) в сравнении с другими гистологическими вариантами ОГМ. Атаксические расстройства у больных с астроцитомами оказались существенно выше и достигали 60%. Нарушения чувствительности у больных с менингиомами и нейроэпителиальными опухолями регистрировались в 16,4 ‒ 0,3% случаев без значимых различий между указанными группами пациентов. Следует отметить, что у больных с аденомами гипофиза данный симптом практически не выявлялся. Афатические расстройства регистрировались у 6,5% больных с менингиомами, у 12,3% ‒ с астроцитомами, у 15,3% ‒ с глиобластомами и не встречались у больных с аденомами гипофиза. 92 Для пациентов с аденомами гипофиза наиболее характерными оказались следующие симптомы: снижение остроты зрения (89,7%), атрофия зрительных нервов (38,5%) и эндокринные нарушения (48,7%), которые регистрировались у данных пациентов достоверно чаще, чем при других гистологических вариантах ОГМ (p<0,01). Интеллектуально-мнестические расстройства, напротив, не были характерны для аденом гипофиза (табл. 4.2.10). У больных с невриномой VIII пары ЧМН наиболее часто встречаемыми очаговыми симптомами явились головокружение (71,4%), атаксия (81,0%) и нарушение функции слухового нерва (52,4%). В то же время сравнительно редко в сравнении с другими гистологическими вариантами ПОГМ встречались судорожный синдром (9,5%), парезы (19,0%) и снижение остроты зрения (4,8%) (табл. 4.2.11). Таким образом, для больных с менингиомами и нейроэпителиальными опухолями характерно сочетание общемозговых нарушений с судорожным синдромом, чувствительными, паретическими нарушениями и атаксией, причем для глиобластом наиболее характерно наличие парезов, а для астроцитом – атаксических нарушений. Клиническая симптоматика больных с аденомами гипофиза была представлена общемозговой симптоматикой в сочетании со снижением остроты зрения, атрофией зрительных нервов и эндокринными нарушениями. Для невриномы VIII пары ЧМН наиболее характерны атаксия, головокружение и нарушение функции слухового нерва. В нашей работе магнитно-резонансная томография и компьютерная томография проводились у 285 и 189 больных с первичными опухолями головного мозга соответственно. На основании методов нейровизуализации (протоколы КТ и МРТ ‒ исследований) определялась локализация и размеры опухолей, которые в дальнейшем были уточнены интраоперационными данными (табл. 4.2.12). 93 Таблица 4.2.12 ‒ Распределение больных с ПОГМ в зависимости от размера новообразований Размер опухоли Количество случаев % от общего числа до 1 см 29 6,8 до 3 см 163 38,4 до 5 см 128 30,2 больше 5 см 104 24,5 Всего 424 100,0 Как мы уже отмечали, наиболее часто больные поступают в нейрохирургический стационар с большими размерами опухолей (табл. 4.2.13). Таблица 4.2.13 ‒ Распределение гистологических типов опухолей головного мозга в зависимости от их размера Гистологический тип опухоли Размер Менин- Глиоблас- Астроци- Аденомы Невриномы опухоли гиомы томы томы гипофиза VIII пары 21 15 14 22 2 (12,4%) (25,4%)* (25,5%)* (56,4%)*^° (9,5%) 54 24 24 12 4 (31,8%) (40,7%) (43,6%) (30,8%) (19,0%) 43 13 4 4 10 (25,3%) (22%) (7,2%)*^ (10,3%)* (47,6%) 52 7 13 1 5 (30,5%) (11,9%)* (23,6%) (2,6%)*^° (23,8%) 170 59 55 39 21 до 1 см до 3 см до 5 см > 5 см Всего Примечание ‒ * p<0,05 в сравнении с группой менингиом; ^ p<0,05 в сравнении с группой глиобластом; °p<0,05 в сравнении с группой астроцитом. Так, с опухолями малых размеров (до 1 см) в стационар госпитализировано всего 6,8% больных. Опухоли средних размеров (до 3 см) 94 выявлены у 38,4% больных, а большие и гигантские ПОГМ диагностированы соответственно у 30,2 и 24,5% пациентов, что говорит о низком уровне диагностики ПОГМ среди жителей Чуйской области и г.Бишкека. Среди менингиом большие и гигантские размеры определялись в 55,8 %, среди глиобластом ‒ 33,9%, среди астроцитом ‒ 30,8%, среди аденом гипофиза ‒ 12,9%. Необходимо отметить, что опухоли малых размеров выявлены среди аденом гипофиза, что, по-видимому, объясняется спецификой клинических проявлений данной опухоли и анатомо-физиологическими особенностями ее локализации. Невриномы VIII пары ЧМН зачастую имели большие и гигантские размеры (47,6 и 23,8% соответственно). Таким образом, более 40% больных поступают в стационар с опухолями больших и гигантских размеров, причем чаще опухоли больших размеров характерны для супратенториальной локализации и менингиом. Приводим клиническое наблюдение: Больная А.Ш. 38 лет, история болезни №30293/552; находилась на стационарном лечении в отделении нейрохирургии с диагнозом: опухоль височно-базальной локализации слева с выраженным гипертензионным синдромом. Эписиндром. Поступила в бессознательном состоянии, после двух эпизодов генерализованного приступа с клонико-тоническими судорогами в конечностях, пеной изо рта и прикусом языка. Из анамнеза установлено, что головные боли беспокоили ее в течение многих лет. Больная неоднократно получала консервативное лечение по месту жительства по поводу дисциркуляторной энцефалопатии, от которого отмечался положительный эффект. Утром на фоне относительного благополучия у больной развился генерализованный эпиприступ с потерей сознания, на неопределенное время, с тонико-клоническими судорогами в конечностях, пеной изо рта, прикусом языка. После приступа — выраженная 95 общая слабость и умеренные головные боли. Больная была доставлена в территориальную больницу, где на фоне консервативного лечения ее состояние несколько улучшилось. По настоянию родственников проведено МРТ- исследование головного мозга и получены МРТ- данные за геморрагический инсульт в височной доле слева на фоне дисциркуляторной энцефалопатии с наружной заместительной гидроцефалией (рис.4.2.5). Рис 4.2.5. МР-томограмма головного мозга больной А.Ш. без контрастного усиления. После консультации нейрохирурга проведено МРТ ‒ исследование головного мозга с внутривенным контрастированием (рис. 4.2.6). Рис. 4.2.6. МР-томограмма головного мозга больной А.Ш. контрастным усилением. 96 с На МР – томограмме получены данные за объемное образование височной доли слева с реактивными изменениями ТМО лобно-височнотеменной долей слева, неравномерное расширение субарахноидального пространства правого полушария головного мозга. При поступлении в стационар состояние пациентки средней тяжести, сознание заторможенное. Неврологический статус представлен легкой правосторонней пирамидной недостаточностью, умеренной ригидностью затылочных мышц. Произведена операция: птериональная КПТЧ в левой лобно-височной области с удалением менингиомы крыла основной кости. Гистологическое исследование: менингиома. Рис. 4.2.7. МР- томограмма головного мозга больной А.Ш. после операции. Послеоперационное течение без осложнений. Больная была активизирована. Отмечался полный регресс неврологической симптоматики. Во время пребывания в клинике эпиприступов не было. Контрольная МРТ головного мозга после операции: данные за послеоперационные изменения без признаков наличия новообразования (рис. 4.2.7). В данном клиническом наблюдении была неверной трактовка первоначальных симптомов в течение многих лет без МРТ-контроля с диагнозом: дисциркуляторная энцефалопатия без должной консультации нейрохирурга, что исключило установление основной причины заболевания. 97 Произведенное МРТ-исследование головного мозга без контрастного усиления интерпретировало данные как следствие инсульта в бассейне СМА. Только МРТ головного мозга с контрастным усилением позволило дифференцировать основную патологию — опухоль головного мозга. Удаление опухоли было тотальным. Острое развитие клинической симптоматики было связано с вторичными сосудистыми нарушениями. Заключение Согласно нашим данным, в клинической симптоматике ПОГМ доминировали головная боль, тошнота, рвота (96,7%), общая слабость (80,4%) и головокружение (66,3%). Параличи и парез конечностей отмечались в 35,1% случаев, судорожный синдром – в 29,7%. Из них у 20% больных судороги были генерализованные, еще у 2,4% ‒ вторичногенерализованные и у 7,3% пациентов выявлялись парциальные судороги. Атаксия отмечалась у 26,4% больных, поражение ЧМН ‒ у 16,7%, нарушение чувствительности ‒ у 15,1% пациентов. При офтальмологическом исследовании у 22,4% поступивших диагностированы застойные соски зрительных нервов, у 22,6% отмечалось снижение остроты зрения, у 7,5% диагностирована атрофия зрительных нервов и у 7,8% пациентов выявлялись изменения полей зрения. Интеллектуально-мнестические нарушения наблюдались у 19,8% больных, реже отмечалось снижение слуха (9,0%) и диагностированы эндокринные расстройства (8,5%). Наиболее часто встречающимися ошибочными диагнозами, под маской которых скрывался основной диагноз ОГМ, отмечены: для менингиом и нейроэпителиальных опухолей ‒ синдром вертебро-базилярной недостаточности, эпилепсия, дисциркуляторная энцефалопатия и шейный остеохондроз; для аденом гипофиза ‒ различные заболевания глаз, эндокринологические и гинекологические заболевания; для неврином VIII пары ‒ кохлеоневрит, заболевания лор-органов, базилярной недостаточности и шейный остеохондроз. 98 синдром вертебро- Согласно полученным данным, в период до 1 месяца с момента начала заболевания в нейрохирургический стационар было госпитализировано всего 5,5% больных, в период с 1 до 6 месяцев ‒ 28,7%, а в сроки с 6 до 12 месяцев диагноз был установлен еще у 27,9%. В сроки от 1 до 5 лет госпитализировано в нейрохирургические отделения 125 больных (26,4%) и в сроки, превышающие пятилетний период ‒ 53 (11,3%). Наиболее короткий нейроонкологический анамнез регистрировался у детей и юношей. В возрасте до 18 лет в течение первого года с момента появления клинических симптомов заболевание было диагностировано у 82,4% больных, причем у 55,6% нейроонкологическая патология была верифицирована в течение первых 6 месяцев от начала заболевания. В старших возрастных группах сроки с момента появления первых симптомов до установления диагноза увеличивались. Так, в сроки до 1 года опухоли мозга диагностированы только у 55 ‒ 58% больных, а в сроки до 6 месяцев ‒ менее чем у 40%. Наиболее короткий анамнез до установления диагноза был характерен для злокачественных новообразований. В частности, более чем у 50% больных с глиомами диагноз устанавливается в течение первых 6 месяцев, еще у 29% верификация диагноза происходит в сроки от 6 до 12 месяцев. И лишь менее чем у 20% анамнез симптоматики до установления диагноза превышает один год. Напротив, длительные сроки заболевания, по данным анамнеза, чаще встречались у больных доброкачественного характера. Так, больные с опухолями мозга с ОГМ, особенно с менингиомой, невриномой VIII пары ЧМН и аденомой гипофиза, длительное время наблюдались и лечились амбулаторно по поводу различных заболеваний, симулирующих опухоль головного мозга. При поступлении в нейрохирургическое отделение функциональный статус по шкале Карновского в 30 баллов отмечался у одного пациента (0,2%), 40 баллов ‒ у 4 больных (0,8%), в 50 баллов ‒ у 15 (3,2%), 60 баллов ‒ у 112 (23,6%), 70 баллов ‒ у 232 (48,3%), 80 баллов ‒ у 103 больных (21,7%) 99 и в 90 баллов ‒ у 7 пациентов (1,5%). Иными словами, ту или иную степень инвалидности (функциональный класс 60 баллов и менее) имели 132 пациента (27,8%). Отметим, что наиболее низкий функциональный статус при поступлении имели дети и пожилые пациенты, а также больные, страдающие глиальными опухолями. Размер ОГМ существенного влияния на показатель функционального статуса пациентов не оказывал. Проведенный анализ уровня нарушения сознания у нейроонкологических пациентов при первичном поступлении в стационар выявил, что 356 пациентов (84%) поступили в стационар в ясном сознании, 20 (4,7%) – в состоянии оглушения, 39 пациентов были госпитализированы в заторможенном состоянии, 5 (1,2%) ‒ в состоянии сопора и ещё 4 пациента (0,9%) были доставлены в коматозном состоянии. При этом наиболее часто с различными нарушениями сознания в нейрохирургический стационар госпитализируются дети, пожилые пациенты, лица с большими размерами ОГМ, а также больные с нейроэпителиальными опухолями. 100 ГЛАВА 5 РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ И АНАЛИЗ КАЧЕСТВА ДИАГНОСТИКИ БОЛЬНЫХ С ПЕРВИЧНЫМИ ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА Оперативное лечение было выполнено 424 пациентам, что составило 89,5% от общего числа больных, 50 (10,5%) больных были выписаны без хирургического вмешательства по различным причинам, у данной группы больных не было заключения патоморфологического исследования. Диагноз ПОГМ, помимо клинической картины, подтвержден данными КТ, МРТ исследования. В эту же группу включены больные, которым были проведены паллиативные вмешательства (шунтирующие операции) ‒ 8 человек, 32 пациента (6,8%) не оперированы в связи с отказом от оперативного лечения; у 4 (0,8%) противопоказанием к операции служил тяжелый соматический статус; 6 больных (1,3%) признаны неоперабельными, в связи с распространением опухолевого процесса, с поражением функционально важных зон мозга и декомпенсированным состоянием. Тактика хирургического вмешательства при ПОГМ с применением того или иного операционного доступа была определена топографоанатомическими особенностями опухолей, их размерами, соотношением с окружающими структурами, степенью выраженности неврологической симптоматики, общесоматическим состоянием и индивидуальными особенностями каждого больного. Техника пластическую удаления и опухоли резекционную включала трепанации стандартные черепа с костно- применением традиционных доступов, которые достаточно освещены в различных литературных источниках. Оперативные вмешательства проводились под комбинированным эндотрахеальным наркозом и с использованием микроскопа, бинокулярной лупы с волоконным оптическим световодом (ЛБВО) с увеличением 3,3 раза и микрохирургического инструментария. Предоперационная подготовка больного включала: назначение адекватных доз кортикостероидных препаратов, коррекцию дыхательных и 101 сердечно-сосудистых расстройств и нормализацию показателей водноэлектролитного обмена. Для оценки степени радикальности удаления опухоли мы использовали наиболее широко распространенные в литературе понятия – «тотальное», «субтотальное» и «частичное удаление» опухоли. Под тотальным удалением предполагалось абсолютно полное удаление опухоли при адекватном вмешательства. При оптическом субтотальном контроле оставались зоны оперативного неудаленными лишь небольшие фрагменты опухоли на сосудах, черепных нервах и/или на стволе мозга. Все остальные вмешательства подразумевали частичное удаление опухоли. Тотальное удаление опухоли было выполнено 136 больным, что составило 32,0%. Субтотальное (99 ‒ 80% объема удаленной опухолевой ткани) произведено у 265 пациентов (62,5%). Частичное (менее 80% опухолевой ткани) осуществлено у 23 больных (5,4%). Удельный вес дан в табл. 5.1. Таблица 5.1 ‒ Распределение больных в зависимости от степени радикальности проведенной операции Степень радикальности Количество больных Число больных операции (абс.число) (%) Тотальное удаление 136 32,0 Субтотальное удаление 265 62,5 Частичное удаление 23 5,4 Всего 424 100,0 Наиболее высокая частота тотальных удалений опухоли отмечалась среди менингиом. В частности, 97 пациентам (57,1%) с менингиомами выполнено тотальное удаление новообразования, 64 больным с менингиомами (37,6%) произведено субтотальное и еще 9 (5,3%) – частичное удаление опухолевого образования (рис. 5.1). 102 Рис. 5.1. Объем оперативного вмешательстава у больных с менингиомами. Анализ радикальности хирургического вмешательства в зависимости от гистологической структуры ПОГМ представлен в табл. 5.2. Таблица 5.2 ‒ Объем оперативного вмешательства у больных с ПОГМ в зависимости от гистологической структуры Объем операции Вид опухоли тотальное субтотальное частичное всего удаление удаление удаление (абс.числ о) Нейроэпителиальные 12 96 6 114 Менингиома 97 64 9 170 Аденома гипофиза 27 9 3 39 Невринома VIII пары 8 10 3 21 Прочие 24 44 12 80 (глиобластома, астроцитома) Как следует из анализа материала исследования, тотальное удаление было у больных с конвекситальными менингиомами ‒ 54 случая, с менингиомами парасагиттальной локализации ‒ 43. Субтотальное и частичное удаление менингиом чаще были связаны не с их размерами, а с 103 топографо-анатомической особенностью. Так, почти все менингиомы базальной локализации ‒ 29 ‒были удалены субтотально и частично. При ряде опухолей (4 случая) было произведено двухэтапное удаление. Это опухоли супра-, субтенториальной множественные менингиомы. При локализации, удалении опухоли первично- мы склонялись к удалению первоначально той части, которая вызывает наиболее выраженную клинику. При отсутствии таковой удалялись наибольшие в размере узлы опухоли. В двух случаях нам удалось одновременно удалить два узла опухоли из двух разных доступов. На радикальность удаления опухоли повлияли локализация, характер роста опухоли, в частности ее инвазивность. Менингиомы, прорастающие в кавернозный, верхний поперечный синус, магистральные сосуды, область центральных извилин, вен Лабе, Тролляра и сильвиевой щели, также удалялись частично либо субтотально. Частичное удаление опухоли произведено девяти больным. С аденомами гипофиза прооперировано 39 больных. Предоперационная подготовка заключалась в обязательном назначении кортикостероидов, чаще в суточной дозе 12 мг, в день операции. Почти в 90% использовался односторонний субфронтальный доступ. В остальных случаях ‒ бифронтальный ввиду гигантских размеров опухоли. Адекватный доступ с аспирацией СМЖ из базальных цистерн позволял исключить массивную дегидратацию во время доступа для осуществления свободного доступа к образованиям ХСО. Лишь в одном случае было применено дренирование бокового желудочка и еще в одном ‒ разгрузочная люмбальная пункция. В последние годы нами шире стал использоваться птериональный подход при аденомах гипофиза, позволяющий сохранить обонятельные нервы на начальных этапах операции, визуализировать и контролировать ветви внутренней сонной артерии, отходящие от нее верхнюю и нижнюю гипофизарные артерии и хиазмальную артериальную дугу. Данный доступ 104 незаменим при опухолях с преимущественным параселлярным ростом под височную долю мозга. Как известно, важнейшим показательным критерием эффективности оперативного вмешательства является динамика зрительных расстройств. Хорошим результатом операции являлось полное восстановление остроты зрения или увеличение остроты зрения не менее чем в 2 раза, но не ниже чем до 0,1 при соответствующем расширении полей зрения ‒ 32 случая, отсутствие изменений зрительных нарушений после операции наблюдалось у четверых больных, у троих отмечалось ухудшение зрения. Таблица 5.3 ‒ Динамика зрительных нарушений при различных анатомотопографических подгруппах аденом гипофиза Анатомотопографические подгруппы Кол-во больных Динамика зрительных расстройств Хорошая Удовлетворительная Ухудшение АГ с обширным экстраселлярным ростом 17 5 9 2 Без изменени й 1 АГ с умеренным экстраселлярным ростом 22 4 14 1 3 Как мы и полагали, хорошее, удовлетворительное восстановление функций зрительных нервов отмечено у больных с аденомами гипофиза с умеренным экстраселлярным ростом, неудовлетворительное — у больных с большими аденомами гипофиза. Соответственно худшие результаты также наблюдались в последней группе больных (табл. 5.3). Таким напрямую образом, связана с травматичность размерами оперативного опухолей. вмешательства Большое значение в восстановлении зрительных функций имел темп развития зрительных нарушений. Важным для больных с АГ имели дооперационные глазодвигательные расстройства (7,7%), которые в послеоперационном периоде имеют тенденцию к более медленному регрессу. 105 Тем не менее эндокринно-обменные расстройства являются еще более стойкими. Отмечавшиеся в послеоперационном периоде в 5,5% случаев гипоталамические расстройства в виде повышенной сонливости, психоэмоциональной лабильности, нестабильности артериального давления, проявлений несахарного диабета, гипопитуитарного синдрома привели к использованию заместительной терапии. В одном случае была произведена повторная операция в связи с образованием субдуральной гематомы. Во всех случаях субтотального и частичного удаления АГ больным была рекомендована послеоперационная лучевая терапия. Как известно, основными принципами хирургии нейроэпителиальных опухолей являются точный топографо-анатомический диагноз (данные КТ и МРТ до операции), рациональный доступ к опухоли вне проекции функционально важных микрохирургической зон техники, мозга, использование позволяющей современной максимально сохранить смежные структуры, артерии, венозные коллекторы, а также безопасность операции, обеспечивающаяся адекватным анестезиологическим пособием. (Коновалов А.Н., 2004). При внутримозговых опухолях нейроэпителиального ряда, особенно располагающихся в области функционально важных зон мозга, имеет значение выбор внепроекционных доступов к опухолевому узлу с целью минимизировать послеоперационные неврологические выпадения. При опухолях рассматриваемой гистологической структуры оценка радикальности удаления опухоли основана на заключениях оперирующего хирурга. Между тем послеоперационные КТ и МРТ-исследования проводились достаточно редко из-за финансовых возможностей пациента. Однако послеоперационные изменения в остром и подостром периодах не всегда позволяют однозначно оценить радикальность удаления опухоли. 106 Рис.5.2. Радикальность удаления опухолей у больных с глиобластомами. В рамках нашего исследования тотальное удаление глиальных опухолей, в частности глиобластом и астроцитом (в 12 случаях), проводилось при опухолях больших размеров, локализующихся поверхностно, в нефункционально важных зонах мозга, вызывающих значительный массэффект и неврологическую симптоматику. Субтотальное и частичное удаление опухоли применялось в 112 случаях ‒ при расположении опухоли в функционально значимых зонах, глубинной ее локализации, а также у пожилых и соматически ослабленных больных. Как известно, несмотря на комбинированное (комплексное) лечение, включающее удаление опухоли, лучевую и химиотерапию в различных модификациях, средняя продолжительность жизни больных с глиобластомами составляет около одного года. В связи с этим клинического случая представляется важным привести описание больной с опухолью «глиобластома» трижды оперированной в нейрохирургическом отделении НГ МЗ КР и получившей комплексное лечение. Больная Н. 28 лет, история болезни №19319, поступила 16.06.10 г. в нейрохирургическое отделение Национального госпиталя МЗ КР с жалобами на выраженные головные боли диффузного характера, на высоте которых 107 были тошнота и рвота, нарушения речи, ухудшение зрения, судорожные подергивания в правых конечностях, без потери сознания, отмечены общая слабость, снижение веса. Из анамнеза установлено, что первые симптомы заболевания появились в марте 2010 г., когда начали беспокоить упорные головные боли. В течение трех месяцев пациентка наблюдалась у невропатолога по месту жительства с диагнозом: вегетососудистая дистония, но от консервативной терапии эффекта не было. Проведено МРТ-исследование головного мозга и получены данные за объемное образование в теменной доле слева (см. рис. 5.3). Рис. 5.3. МРТ больной Н. (снимки до первой операции). Неврологически: больная заторможенная, простые инструкции выполняет. Отмечены умеренный правосторонний гемипарез, простые парциальные сенсорные эпиприступы. Умеренная ригидность затылочных мышц. Офтальмологически: VOU ‒ 0,4. Глазное дно: начальные признаки застоя сосков зрительных нервов. После обследования и подготовки 20.06.10 г. произведена операция: КПТЧ в левой височно-затылочно-теменной области с удалением внутримозговой опухоли. Гистологический результат – глиобластома. Послеоперационный период протекал без осложнений. Больная была выписана в удовлетворительном состоянии для дальнейшего курса химиотерапии (с применением цитостатического алкилирующего препарата второго поколения темозоломида – темодала) и лучевой терапии. 108 На контрольных снимках через 6 месяцев отмечалась положительная динамика без продолженного роста опухоли (рис.5.4). Рис. 5.4. МРТ больной Н. после первой операции. В 2012 г. появились выраженные головные боли, общая слабость, вновь наросла правосторонняя пирамидная недостаточность. На МР- томограммах данные за продолженный рост опухоли. 04.07.12 г. произведена повторная операция с последующим курсом ХТ и ЛТ. Позже, через четыре месяца, в связи с продолженным ростом опухоли и нарастанием общемозговой симптоматики, с правосторонней пирамидной недостаточностью и учащением частоты эпилептических приступов 13.11.12 г. произведено повторное оперативное вмешательство (рис.5.5). Рис.5.5. МРТ больной Н. до третьей операции. Послеоперационный период протекал гладко, значительно регрессировала неврологическая симптоматика. Больная была выписана в удовлетворительном состоянии для дальнейшего курса ХТ и ЛЧ в онкологическом центре. На последних, контрольных, МРТ- снимках от 2014 г. (рис.5.6) отмечается положительная динамика без продолженного роста опухоли 109 Рис.5.6. МРТ больной Н. после третьей операции на фоне комбинированной терапии. Этапы операции даны на рис. 5.7 (А,Б,С). А На рис. 5.7 А – визуализирован 1 — прилежащий участок мозга с крупными сосудами; 2 – опухоль (глиобластома). В: 2 – выделение и удаление опухоли 110 С: 3 — ложе удаленной опухоли; 4 — прилежащий участок мозга Рис. 5.7. Этапы операции по удалению глиобластомы ( А, В, С). Приведенное клиническое наблюдение иллюстрирует, во-первых, низкую нейроонкологическую настороженность врачей первичного звена: больная в течение трех месяцев получала лечение по поводу вегетососудистой дистонии без МРТ-исследования головного мозга, вовторых, успешность проведенного комбинированного лечения: хирургическое вмешательство + химиотерапия + лучевая терапия в раннем послеоперационном периоде. Что касается группы опухолей ЧМН, наиболее частыми оказались невриномы слухового нерва (у 21 больного). Операции проведены с применением традиционного субокципитального парамедианного доступа. У шестерых больных невриномы слухового нерва были средних размеров (диаметром до 3 см), в 15 случаях имели большие и гигантские размеры (диаметром более от 3 см до более 5 см). Тотальное удаление неврином удалось достигнуть у восьмерых больных, (38,1% случая), имевших небольшие Субтотальное удаление произведено 10 (47,6%) и больным (14,3%) (рис. 5.9). 111 размеры опухоли. частичное ‒ троим Рис. 5.8. Радикальность удаления опухолей у больных с невриномой VIII пары ЧМН. Как известно, зона оперативного вмешательства при локализации опухоли в стволе мозга сопряжена с высоким риском гемодинамических нарушений (острые сердечно-сосудистые нарушения в виде нарушений ритма, нестабильности систолического артериального давления), дыхательных и грубых неврологических выпадений. Так, интраоперационное повреждение целостности лицевого нерва, ввиду его разволокнения в строме или капсуле опухоли отмечалось у девяти больных. К слову, необходимость максимального сохранения мозжечковых артерий, особенно васкуляризующих ствол мозга, лицевой нерв (лабиринтная артерия), а также всех черепных нервов этой области сегодня не требует дополнительной аргументации. Так же, как применение интраоперационного мониторинга функций черепных нервов рассматриваемой области, минимальное применение коагуляции с целью гемостаза. По-прежнему послеоперационная летальность, частота послеоперационных осложнений и общая оценка состояния больных остаются важными показателями, определяющими эффективность операций нейроонкологических больных. Как свидетельствуют наши данные, из 424 пациентов в послеоперационном периоде умерли 35, т.е. послеоперационная летальность составила 8,3%. 112 Нами рассмотрены причины летальных случаев (табл. 5.4). Таблица 5.4 ‒ Причины летальных исходов при ПОГМ Причина смерти Количество больных Число больных (%) больных (абс.число) Нарушение мозгового 10 2,3 3 0,7 8 1,9 3 0,7 5 1,2 Пневмония, отек легких 6 1,4 Всего 35 8,3 кровообращения в стволе Кровоизлияние в ложе или остатки опухоли Менингит, менингоэнцефалит, вентрикулит Желудочно-кишечное кровотечение Сердечно-сосудистая недостаточность В десяти случаях (2,3%) осложнением послужило нарушение мозгового кровообращения в стволе головного мозга в виде ишемических расстройств, которые отмечались у больных с опухолями ЗЧЯ, невринома ММУ ‒ 4 случая, 3 ‒ менингиома базальной локализации, 3 ‒ астроцитома полушарной локализации; воспалительные заболевания мозга и оболочек в 1,9% отмечались у троих больных с менингиомой полушарной локализации, у двоих с глиобластомой мозжечка и троих ‒ с внутрижелудочковыми опухолями. Осложнения, послужившие причиной смерти, были связаны с грубым нарушением функций различных внутренних органов (пневмония и отек легких, желудочно-кишечные кровотечения) и занимают от 0,7 до 1,4%. В 113 эту группу были отнесены больные, у большинства которых в анамнезе были сопутствующие хронические заболевания (ХОБЛ, гастриты и язвенная болезнь желудка и двенадцатиперстной кишки). У двоих больных усилилась дыхательная недостаточность в виде отека легких как осложнение имевшейся хронической сердечной недостаточности. При изучении взаимосвязи послеоперационной летальности больных с ПОГМ с гистологическим типом опухоли нами были получены следующие результаты (табл.5.5). Таблица 5.5 ‒ Летальность при различных видах ПОГМ Гистологический тип Общее число опухоли больных Число умерших (абс.) Летальность Общая для данного летальность вида ОГМ к общему (%) числу ОГМ (%) Нейроэпителиальные 162 23 14,2 5,4 Опухоли черепных 21 3 14,3 0,7 190 6 3,2 1,4 51 3 5,9 0,7 нервов Оболочечнососудистые опухоли Прочие Оказалось, что наиболее высокая летальность после оперативного вмешательства была в отношении нейроэпителиальных опухолей и опухолей черепно-мозговых нервов (14,2 и 14,3% соответственно). Послеоперационной летальности при аденомах гипофиза не было. При оболочечно-сосудистых опухолях мозга в послеоперационном периоде умерли шестеро пациентов (3,2% случаев), что было достоверно ниже в сравнении с аналогичным показателем среди других гистологических групп ОГМ (p<0,05). Данные по послеоперационной летальности в зависимости от радикальности оперативного вмешательства представлены в табл. 5.6. 114 Таблица 5.6 – Летальность больных ПОГМ в зависимости от радикальности оперативного вмешательства Объем оперативного Общее число Число умерших Число умерших вмешательства больных (абс.) (%) Тотальное удаление 136 9 6,6 Субтотальное 265 26 9,8 23 0 0 удаление Частичное удаление После тотального удаления опухоли в послеоперационном периоде умерли девять пациентов, что составило 6,6% от общего числа прооперированных больных. После субтотального удаления опухоли умерли 26 пациентов (9,8% случаев). После частичного удаления опухоли послеоперационный период протекал наиболее благоприятно, летальности не было. Сравнительный анализ частоты послеоперационных осложнений (табл. 5.7) у больных с различными гистологическими вариантами ОГМ показал, что наиболее редко послеоперационные осложнения (воспалительные, нарастание неврологической симптоматики, интракраниальные гематомы, эндокринные расстройства и др.) регистрировались у больных с аденомами гипофиза (15,4%), что было достоверно ниже в сравнении с другими гистологическими типами новообразований головного мозга (p<0,05). Таблица 5.7 ‒ Осложнения у больных в послеоперационном периоде при различных гистологических вариантах ПОГМ Осложнения Воспалительные (менингит) 4 (2,4%) Аденомы гипофиза 0 Ликворея 5 (2,9%) 0 0 1 (0,9%) 25 (14,7%)* 0 1 (4,8%) 5 (4,4%) Нарастание неврологической симптоматики (парезы и параличи конечностей) Менингиомы 115 Невриномы VIII пары 1 (4,8%) Нейроэпителиальные опухоли 4 (3,5%) Продолжение табл. 5.7 Осложнения Повреждения ЧМН Интракраниальные гематомы Пневмония ОНМК Эндокринные нарушения Менингиомы 2 (1,2%) Аденомы гипофиза 1 (2,6%) Невриномы VIII пары 11 (52,4%)** Нейроэпителиальные опухоли 4 (3,5%) 1 (0,6%) 1 (2,6%) 0 3 (2,6%) 0 6 (3,5%) 0 0 2 (5,1%) 2 (5,1%) 0 1 (4,8%) 0 2 (1,8%) 15 (13,3%)* 0 Напротив, наиболее часто осложнения регистрировались после оперативного вмешательства по поводу неврином VIII пары: только в 33,3% операционный период у таких пациентов протекал без осложнений (p<0,01). Наиболее характерные послеоперационные осложнения у больных с менингиомами ‒ развитие парезов и параличей конечностей, у пациентов с невриномами VIII пары ‒ повреждения черепно-мозговых нервов, а у больных с нейроэпителиальными опухолями (глиобластомы и астроцитомы) ‒ острые нарушения мозгового кровообращения (табл.5.7). Нами были отмечены существенные различия между группами по структуре развившихся послеоперационных осложнений. Так, у больных с низким функциональным статусом (60 баллов и меньше по шкале Карновского) выявлялись наиболее тяжелые послеоперационные осложнения: кома (1,8%), отек мозга (2,7%), нарастание пирамидной недостаточности (3,6%). Другие осложнения встречались несколько реже (табл. 5.8). У больных с функциональным статусом в 70 баллов наиболее часто встречалось нарастание пирамидной недостаточности (6,1%), ликворея (1,5% случаев), менингоэнцефалит (1,0%), бульбарный синдром (1,0%), У больных с сохраненным функциональным статусом (80 баллов по шкале Карновского и более) отмечались менее серьезные осложнения: нарастание пирамидной 116 недостаточности (4,0%), реже ‒ ликворея (1,0%) и бульбарный синдром (1,0%). Таблица 5.8 ‒ Послеоперационные осложнения в зависимости от функционального статуса больных с ПОГМ Функциональный 60 баллов и менее 70 баллов 80 баллов и статус по (n=114) (n=210) более (n=100) Ликворея 0 3 (1,5%) 1 (1,0%) Эпилептические 1 (0,9%) 1 (0,5%) 1 (1,0%) Менингоэнцефалит 1 (0,9%) 2 (1,0%) 0 Нарастание 7 (6,1%) 6 (2,9%) 4 (4,0%) Отек мозга 3 (2,7%) 1 (0,5%) 0 Бульбарный 0 2 (1,0%) 1 (1,0%) Кома 2 (1,8%) 0 0 Гематома 1 (0,9%) 2 (1,0%) 0 Итого 15 (13,2%) 17 (8,1%) 7 (7,0%) Карновскому приступы пирамидной недостаточности синдром В нашем исследовании среди больных с ПОГМ молодого и среднего возрастов частота развития послеоперационных осложнений существенно не различалась. Так, среди больных до 18 лет частота осложнений составила 12,9%, среди лиц 19 ‒ 34 лет ‒ 17,6%, 35 ‒ 44 года ‒ 15,7%, 45 ‒ 54 года ‒ 16,5% и в возрастной группе 55 ‒ 64 года распространенность послеоперационных осложнений составила 13,9%. Иная ситуация отмечалась среди больных старшей возрастной группы (65 лет и старше). Частота послеоперационных нарушений среди данной категории пациентов составила 33,3% ‒ существенно выше, чем среди больных более младших возрастных 117 групп (p<0,05). Мы связали это с наличием сопутствующих соматических заболеваний, в первую очередь сердечно-сосудистых, которые и могут определять частое развитие осложнений (табл. 5.9) Таблица 5.9 ‒ Частота осложнений у больных с ПОГМ в послеоперационном периоде в зависимости от возраста пациентов Возраст 0 ‒18 19 ‒ 34 35 ‒ 44 45 ‒ 54 55 ‒ 64 65 ‒74 лет Число 4 12 14 22 10 10 больных (12,9%) (17,6%) (15,7%) (16,5%) (13,9%) (33,3%)* % Примечание ‒ * p<0,05 в сравнении группы лиц 65 —74 года со всеми возрастными подгруппами. При оценке результатов лечения в раннем послеоперационном периоде (2‒3 недели) мы главным образом основывались на изменениях общего состояния и неврологического статуса. Анализ состояния больных на момент выписки из стационара мы провели по следующим критериям: улучшение, ухудшение, без перемен. Из 389 больных с улучшением были выписаны 314 человек, что составляет 80,7% случаев, с ухудшением ‒ 45 больных (11,6%) и без перемен ‒ 30 больных (7,7%). Наибольший удельный вес среди больных, выписанных с ухудшением, приходится на пациентов с невриномой слухового нерва и с глиальными опухолями (табл. 5.10). Таблица 5.10 ‒ Состояние больных с ПОГМ на момент выписки из стационара Вид опухоли Состояние больного улучшение ухудшение без перемен Всего Менингиомы 140(86,9%) 8 (5,0%) 13 (8,1%) 161 Нейроэпителиальные 80(78,4%) 12 (11,8%) 10(9,8%) 102 (астроцитомы, глиобластомы) 118 Продолжение табл. 5.10 Вид опухоли Состояние больного улучшение ухудшение без перемен Всего 33 (84,6%) 2 (5,1%) 4 (10,3%) 39 10(55,5%) 6(33,3%) 2(11,1%) 18 Прочие 51 (73,9%) 17 (24,6%) 1 (1,4%) 69 Всего 314 (80,7%) 45 (11,6%) 30 (7,7%) 389 Аденомы гипофиза Невриномы VIII пары Таким образом, общая послеоперационная летальность при ПОГМ составила 8,3%. При этом нами была обнаружена зависимость летальности больных в послеоперационном периоде от гистологического типа опухоли и объема оперативного вмешательства. Сравнительный анализ динамики заболеваемости ПОГМ по г. Бишкеку и Чуйской области, проведенный в рамках нашего исследования, свидетельствует о росте первичной и госпитализированной заболеваемости. В данной работе использовался комплекс математико-статистических методов, который подробно представлен во второй и третьей главах. Полученные показатели послужили статистической основой для разработки прогнозов заболеваемости до 2020 г. при помощи методов математического прогнозирования и моделирования. Мы определили, что за основу прогноза целесообразнее использовать линейный тренд, согласно которому каждому временному периоду придается одинаковая значимость и не делается акцент на периоды роста (Гланц С., 1998). Тренды могут быть построены на основании динамики показателей заболеваемости в 2001 ‒ 2010 гг., подверженных сильным колебаниям. Для прогноза использовано эволюционное развитие событий, не учитывающее последствий очередных реформ, банкротства и различных социально119 экономических перемен, способных влиять на динамику заболеваемости жителей г. Бишкека и Чуйской области Как показывает линейный тренд прогноза, представленный на рис.6.1, заболеваемость будет расти и к 2020 г. составит по Чуйской области ‒ 5,3, а по Бишкеку 7,3 на 100 тыс.населения. Показатель на 100000 населения 6,0 5,3 5,0 4,0 3,1 3,0 3,2 3,0 3,0 2,1 2,0 3,2 3,3 2008 2009 3,7 2,2 2,0 1,0 0,0 годы 2001 2002 2003 2004 2005 2006 2007 2010 2011 2012 2013 2014 2015 2016 2017 2018 Показатель на 100000 населения 8,0 2019 2020 7,3 7,0 6,0 5,2 5,0 4,0 3,0 2,5 3,0 3,5 4,0 3,2 2,0 2,2 2,6 3,3 2,0 1,0 0,0 годы 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 2016 2017 2018 2019 2020 Рис. 5.9. Заболеваемость ПОГМ в Чуйской области и г. Бишкек в 2001‒2010 гг. с прогнозом до 2020 г. Допускаем, что данная прогностическая модель является условной: не взят в расчет факт расширения диагностических комплексов нейровизуализационных методов для раннего выявления ОГМ у населения, особенно в детском возрасте и у ЛПСВ; последние возрастные группы, как следует из нашего исследования, составляют исключительно ограниченный контингент больных, так как нейровизуализационные методы в этих группах используются необоснованно редко. Следует отметить, что имеющийся в настоящее время диагностический комплекс исследований в г. Бишкеке и в Чуйской области недостаточен, и данная ситуация еще более неблагоприятна в отношении других регионов нашей страны. 120 Согласно литературным данным и аналитическим обзорам, оптимального количества КТ и МР-томографов на душу населения в настоящее время нет. Известно, что наиболее оснащенными в этом плане являются Япония, где на 1 млн.населения приходится 46,9 МР-томографов и 101,3 сканеров для компьютерной томографии, и США—31,5 и 34,5 соответственно. По странам ОЭСР эти цифры значительно ниже от 15,3 до 23,5 соответственно. [Щербакова Е.]. Стремительное развитие нейрорадиологии в России, благодаря национальным проектам значительно улучшило ситуацию с оснащенностью учреждений здравоохранения современным оборудованием. Однако и в России этот показатель существенно низок. В Бишкеке и Чуйской области на 100 тыс.населения к 2013 г. приходится 0,3 МР-томографов и 0,5 сканеров для компьютерной томографии, а по республике этот показатель составляет 0,1 и 0,2 соответственно. В нашем исследовании мы отразили динамику заболеваемости ПОГМ в соответствии с расширением диагностических комплексов по Чуйской области и Бишкеку, дополнительно представив ситуацию к 2020 г. (рис. 6.2). 0,6 7 6,0 6 0,5 5,2 5 4,4 0,4 4,0 3,7 4 3,3 0,3 3,3 3,2 2,2 0,5 3 3,0 2,6 0,2 2,2 0,3 0,2 0,1 0,1 0,3 0,3 0,2 0,3 0,3 0,2 0,2 2 1 0,1 0 0 2006 2007 2008 Число МРТ 2009 2010 Число КТ г.Бишке к 2011 2012 2015 Чуйская область Рис. 5.10. Заболеваемость ПОГМ по г. Бишкеку и Чуйской области с 2006 по 2010 год с прогнозом заболеваемости до 2015 г. в соотношении с обеспеченностью МРТ и КТ (на 100 000 населения). 121 Заметим, в Бишкеке динамика первичной заболеваемости неоднозначна, показатель подвержен существенным колебаниям и характеризуется резким снижением в 2008 г. и подъемом в 2006, 2008,2009 и 2010 годах. Вероятнее всего, такая картина была обусловлена недостаточностью работы диагностических комплексов, так как большинство аппаратов с 2007 по 2008 год, работая в аварийном режиме, не могли оказать необходимый комплекс диагностических услуг. Предположим, установленный рост первичной заболеваемости в определенной мере объясняется повышением выявляемости заболевания в результате появления дополнительных диагностических центров с использованием нейровизуализационных методов. В то же время показатели заболеваемости ПОГМ могли быть несколько выше, если бы эти центры были расположены на территории лечебнопрофилактических учреждений, крупных городских и республиканских центров. Безусловно, специализированная медицинская помощь больным с ПОГМ и рациональное использование медицинских ресурсов должны осуществляться в системе четкой и обоснованной нейроонкологической программы. Контроль и установление данной категории пациентов должны проводиться единым государственным нейроонкологическим регистром, куда будет направляться информация со всех регионов республики с учетом особенностей экологии, развития промышленности и состава населения. При внедрении возможность данного регистра реализации в систему международных здравоохранения медицинских появится стандартов диагностики и лечения больных с ПОГМ. Диагностический догоспитальный этап. Особую тревогу вызывает тот факт, что при поступлении в стационар ту или иную степень инвалидности (индекс Карновского ≤ 60 баллов) имел каждый четвертый пациент (27,8%). При этом наиболее часто функциональный статус ≤ 60 баллов отмечался в детском возрасте (у 45,2% обследованных). Существенно 122 реже низкий функциональный статус пациентов имел место в возрастных группах 19 ‒ 34 года (13.2%) и 35 ‒ 44 года (16,8%). По мере увеличения возраста доля больных, имеющих инвалидность на момент госпитализации, увеличивалась, достигая к возрасту 65 ‒ 74 годам 43,3%. Кроме того, отметим, наиболее низкий функциональный статус на момент поступления в стационар имели пациенты, страдающие глиальными опухолями. С увеличением размера опухоли повышалась доля больных, поступающих в стационар с выраженными клиническими проявлениями заболевания или в состоянии декомпенсации. Только 31,8% пациентов госпитализированы в нейрохирургическую клинику с начальными и умеренными проявлениями болезни. Основная масса пациентов (58,7%) направлялась в нейрохирургический стационар при наличии выраженных клинических проявлений заболевания и еще 9,4% пациентов доставлены в клинику в декомпенсированном состоянии. Наиболее часто в тяжелом состоянии госпитализируются пациенты старших возрастных групп (55 лет и старше), что обусловлено наличием сопутствующей патологии, чаще сердечнососудистой. Особую тревогу вызывает тот факт, что более 90% детей при поступлении в стационар имеют выраженные клинические проявления заболевания, из них 20,6% находятся в состоянии декомпенсации. Нами была выявлена еще одна закономерность: чем больше размер ОГМ, тем чаще выявлялись нарушения сознания нейроонкологических больных при поступлении в стационар. Так, если при небольших опухолях нарушения сознания регистрировались у 8,5% больных, то при гигантских опухолях значения данного показателя достигали 21,7%. При этом наиболее часто с нарушениями сознания, причем наиболее тяжелыми ‒ в виде сопора и комы, поступали лица старших возрастных групп, а также дети и подростки (47% случаев). В результате ошибочно диагностируемых патологий и их безуспешного лечения увеличивались сроки с момента появления первых симптомов до установления диагноза. При изучении временного интервала от момента 123 появления первых симптомов до окончательного гистологического заключения, полученного в послеоперационном периоде, нами были получены следующие результаты: при глиобластомах средний временной интервал до постановки диагноза варьировал от 6 месяцев до 2 лет, при астроцитомах ‒ от 6 месяцев до одного года. Еще более длительный догоспитальный этап отмечался при менингиомах. Только у 0,6% больных диагноз устанавливали в течение одного месяца, а у большинства (74,1%) на это уходит более одного года, причем у 11,2% пациентов ‒ более 5 лет. При аденомах гипофиза 5,1% больных госпитализируются в стационар в течение первого месяца с момента появления симптомов, 71,8% ‒ в сроки более одного года, из них 28,2% ‒ спустя 5 лет и более с момента появления клинической симптоматики. При невриномах VIII пары правильный диагноз в течение одного месяца с момента появления симптомов не был установлен ни в одном случае. В среднем для постановки диагноза данного гистологического типа ОГМ требовалось от 6 месяцев до 5 лет. Согласно особенностям опухолевого роста, что особенно важно при злокачественных новообразованиях, только раннее начало комплексного лечения ассоциируется с благоприятным прогнозом. Поэтому удлинение временного интервала до начала лечения, выявленное в нашем исследовании, негативно отражалось на состоянии больных при поступлении в стационар и на последующих результатах терапии. Так, больные, поступающие в нейрохирургический стационар, имели опухоли головного мозга крупных (от 3 до 5 см ‒ 55,4%) или гигантских (свыше 5 см ‒ 19,6%) размеров. Только у четверти пациентов (25,0%) размеры опухоли не превышали 3 см. При этом крупные и гигантские опухоли чаще локализовались супратенториально, а по своей гистологической структуре являлись менингиомами, астроцитомами и глиобластомами. 124 С учетом вышеизложенного нами были проанализированы недостатки диагностической и лечебной составляющих нейроонкологической помощи населению за период с 2001 по 2010 год. С целью характеристики догоспитального этапа была проведена ретроспективная оценка первичной медицинской документации с выделением основных недостатков диагностического поиска: «несвоевременно поставлен диагноз» ‒ временной интервал с момента появления первых симптомов по гистологической верификации опухоли более 6 месяцев, «неправильный диагноз», «больной не обследован в адекватном объеме» до поступления в нейрохирургический стационар, сочетание указанных недостатков, а также отсутствие таковых. У одного пациента допускалось наличие более одного дефекта диагностики. В ходе анализа было установлено, что лишь у 11,5% нейроонкологических больных отсутствовали недостатки догоспитальном этапе, у 55,5% диагностического процесса на диагноз «опухоль головного мозга» был установлен несвоевременно, т.е. в сроки свыше 6 месяцев с момента появления клинической симптоматики, у 14,8% пациентов до обращения к нейрохирургу был поставлен неправильный диагноз и ещё 18,2% больных на догоспитальном этапе были обследованы не в полном объеме (рис.6.3). Рис. 5.11. Структура недостатков диагностического этапа в общей группе больных. 125 У 30,4% обследованных детей с ПОГМ поступают в нейрохирургический стационар с несвоевременно поставленным диагнозом, 10,8% на догоспитальном этапе признаны недостаточно обследованными, у 14,7% больных рассматриваемой возрастной группы был установлен неправильный диагноз, и только у 15 больных (44,1%) не было выявлено дефектов диагностического этапа. Анализ недостатков диагностического этапа ведения нейроонкологических больных в старших возрастных группах показал следующее (табл.5.11). Оказалось, что в старших возрастных группах увеличивается количество пациентов, которым несвоевременно поставлен диагноз. В то же время число больных с неправильным диагнозом и недообследованных существенно не отличается среди больных разных возрастных групп. Так, в возрастной группе 19 ‒ 34 года поздняя диагностика регистрировалась у 57,5% больных, недообследованными признаны 17,5%, с неправильным диагнозом в клинику поступили 12,5%, и только у 12,5% не было выявлено недостатков на этапе диагностического поиска. Таблица 5.11 ‒ Структура недостатков диагностического этапа среди больных старших возрастных групп, страдающих ПОГМ Возраст Дефекты диагностического этапа лет нет недостатков поздняя неправильный недообследованы диагностика диагноз 19 ‒ 34 12,5% 57,5% 12,5% 17,5% 35 ‒ 44 15,5% 53,6% 14,4% 16,5% 45 ‒ 54 14.2% 62,3% 9,9% 13,6% 55 ‒ 64 17,5% 52,4% 11,3% 18,8% Более 65 10,6% 57,6% 11,3% 20,5% 126 Среди больных в возрасте 35 ‒ 44 года несвоевременно поступили в стационар 53,9% пациентов, недообследованы ‒ 16,5%, с неправильным диагнозом госпитализированы 14,4% у 15,5% пациентов дефектов в обследовании не выявлено. Среди пациентов возрастной группы 45 ‒ 54 года недостатки обследования отсутствовали у 14,2% больных, поздняя диагностика зарегистрирована у 62,3%, неправильный диагноз ‒ у 9,9% и не обследованы в полном объеме еще 13,6% пациентов. У больных в возрасте 55 ‒ 64 года несвоевременно поставлен диагноз ОГМ в 52,4% случаев, неверный диагноз на догоспитальном этапе ‒ в 11,3%, недообследованы ‒ в 18,8% и только 17,5% пациентов не имеют недостатков на этапе диагностического поиска. В старшей возрастной группе (> 65 лет) лишь у 10,6% больных не выявлено недостатков обследования, у 57,6% нейроонкологический диагноз поставлен несвоевременно, у 11,3% выставлен неверный диагноз и еще 20,5% больных недообследованы. Данные, отражающие недостатки диагностического догоспитального этапа в зависимости от гистологического типа ПОГМ, представлены в табл. 5.12. Таблица 5.12 ‒ Структура недостатков диагностического этапа среди больных с различными гистологическими типами ПОГМ Дефекты диагностического этапа Вид опухоли нет недостатков поздняя диагностика неправильный диагноз недообследованы Аденомы гипофиза 12,8% 66,1% 12,8% 8,3% Невриномы VIII пары 14,3% 58,4% 9,5% 17,8% Менингиомы 15,3% 54,1% 8,8% 21,8% Глиобластомы 27,1% 39,1% 16,9% 16,9% Астроцитомы 26,4% 43,5% 18,2% 11,9% Наибольшие диагностические трудности для врачей догоспитального звена представляют аденомы гипофиза. Так, лишь у 12,8% больных с данным 127 гистологическим типом ОГМ не выявлено дефектов обследования, 8,3% поступают в нейрохирургический стационар без выполненного в должном объеме диагностического комплекса в 12,8% диагноз был выставлен неверно и 66,1% пациентов поступали в стационар спустя 6 месяцев после появления первых симптомов заболевания. Аналогичная ситуация отмечается и у больных с невриномой VIII пары: у 14,3% пациентов не выявлено недостатков обследования, у 9,5% больных диагноз был поставлен неверно, в 17,8% случаев пациенты поступают в стационар недообследованными и у 58,4% диагноз выставляется несвоевременно. У пациентов с менингиомами несвоевременно поставлен диагноз ОГМ в 54,1% случаев, неверный диагноз на догоспитальном этапе – 8,8%, недообследованы – 21,8% и только 15,3% поступивших не имели недостатков на этапе диагностического поиска. Ввиду гистологической особенности и клинического течения нейроэпителиальных опухолей, в частности астроцитом и глиобластом, поздняя диагностика опухоли отмечена только в 39,1% случаев, неправильный диагноз ‒ в 16,9% случаев, невыполнение в должном объеме диагностических мероприятий ‒ в 16,9% случаев. При этом отсутствие недостатков в обследовании на догоспитальном этапе регистрировалось у 27,1% больных (p<0,05). Для больных с астроцитомами значения указанных показателей составили соответственно 43,5%, 18,2%, 11,9% и 26,4%. Таким образом, качество диагностики нейроонкологических заболеваний у населения г. Бишкека и Чуйской области нельзя признать удовлетворительным главным образом в силу низкой онкологической настороженности врачей первичного контакта (терапевты, офтальмологи, лор-врачи, неврологи), неадекватного и длительного обследования больных, недостаточной обеспеченности больниц современными средствами диагностики ПОГМ в анализируемый период (2001 ‒ 2010 гг.) (главным образом методами нейровизуализации). Резервом улучшения результатов хирургического лечения ОГМ являются меры по переоснащению операционной: 128 обеспечение современными наркозными аппаратами, обязательное использование микрохирургической техники и микроскопа, применение интраоперационной навигации, в том числе метаболической флуоресцентной диагностики и мониторинга основных функций головного мозга. В настоящее время актуален вопрос о необходимости КТ и МРТконтроля радикальности удаления ОГМ в ходе оперативного вмешательства. К сожалению, реальность сегодняшнего дня резко ограничена экономическими возможностями нашего здравоохранения и населения. Для республики с населением не многим более 5 млн. назрела необходимость создания нейрохирургического центра с концентрацией в нем современного оборудования, передовых методов исследования и лучших специалистов. По сути нейроонкологическая помощь пациентам со всей республики ограничена нейрохирургическими отделениями. И, на наш взгляд, децентрализация нейроонкологической службы на современном этапе экономически и технически не осуществима и, возможно, нецелесообразна. Неотъемлемое звено госпитального этапа лечения нейроонкологических больных ‒ нейрореанимационная служба, которая также нуждается в радикальном переоснащении. Важным этапом лечения больных с ПОГМ является химиолучевая и нейрореабилитационная терапия, концентрация которых в одном месте была бы желательной. Разрозненность и отсутствие должной преемственности ‒ основные составляющие, определяющие эффективность лечения указанных больных. Здесь же следует упомянуть, что нейроонкологические больные нашей страны лишены возможности получения стереотаксической радиохирургии (Gamma-knife, Cyber-knife). Таким образом, госпитальный этап лечения больных нуждается в радикальных изменениях, требующих значительных финансовых вливаний. За пределами нашего исследования остались вопросы, связанные с нейрореабилитационным лечением больных с ПОГМ. 129 Заключение Оперативное лечение было выполнено в отношении 424 пациентов, что составило 89,6% от общего числа поступивших больных. Объем удаления опухоли и хирургическая гистологической тактика структуры, определялись локализации в ОГМ, зависимости состояния от пациента, технической оснащенности стационара. Послеоперационные осложнения отмечены у 27,6% пациентов, наиболее частые из которых ‒ послеоперационные парезы и параличи конечностей (8,5%), повреждения черепно-мозговых нервов (5,2%) и острые нарушения мозгового кровообращения (6,6%). У 10 больных (2,4%) развивался послеоперационный менингит, у 7 (1,7%) ‒ ликворея, у 5 (1,2%) ‒ интракраниальные гематомы. Более редкие осложнения ‒ пневмония (0,5%), эндокринные нарушения (0,7% ) и афатические расстройства (0,5%). Наиболее редко послеоперационные осложнения регистрировались у больных с аденомами гипофиза (15,4%), что было достоверно ниже в сравнении с другими гистологическими типами новообразований головного мозга (p<0,05). Напротив, наиболее часто осложнения регистрировались после оперативного вмешательства по поводу неврином VIII пары: только в 33,3% случаев послеоперационный период протекал без осложнений (p<0,01). Обнаружена зависимость структуры осложнений от функционального статуса и возраста пациента. Послеоперационная летальность составила 8,3%. Из 389 больных 314 было выписано с улучшением (80,7%), с ухудшением – 45 (11,6%), без динамики – 30 пациентов (7,7%). Наибольший удельный вес среди выписанных с ухудшением приходится на больных с невриномой слухового нерва и с глиальными опухолями. На основе математического моделирования нами была спрогнозирована заболеваемость ПОГМ по данным регионам до 2015 г. Согласно полученным данным, заболеваемость ПОГМ будет расти и в 2020 г. составит по г. Бишкеку 7,3 на 100 тыс. населения, а по Чуйской 130 области ‒ 5,3 на 100 тыс. населения. Предположительно установленный рост первичной заболеваемости в определенной мере объясняется повышением ее выявляемости в результате появления дополнительных диагностических центров и использования нейровизуализационных методов. Нами изучена организация медицинской помощи нейроонкологическим больным на догоспитальном этапе и в нейрохирургическом стационаре, и при этом выявленные клинические особенности ПОГМ (большие размеры опухоли, уровень нарушения сознания, декомпенсация общего состояния при поступлении больных, инвалидизация большей части пациентов) свидетельствуют о несвоевременной диагностике заболевания и целом ряде недостатков на догоспитальном этапе. Этому способствует ряд факторов как социального, так и медицинского характера. К социальным факторам следует отнести несовершенство системы обязательного медицинского страхования, недофинансирование системы здравоохранения, высокую стоимость платных медицинских услуг, их ограниченную доступность недостаточную обеспеченность для значительной медицинских части населения, учреждений республики современными средствами нейровизуализации, а также их недоступность для жителей отдаленных районов. К факторам медицинского характера следует отнести низкую нейроонкологическую настороженность врачей первичного контакта (терапевтов, врачей общей практики, неврологов, офтальмологов), отсутствие у них навыков активного выявления признаков ПОГМ. Так, в ходе анализа нами установлено, что лишь у 11,5% нейроонкологических пациентов отсутствовали недостатки диагностического процесса на догоспитальном этапе, у 55,5% же больных диагноз «опухоль головного мозга» был установлен несвоевременно, т.е. в сроки свыше шести месяцев с момента появления клинической симптоматики, у 14,8% пациентов до обращения к нейрохирургу был поставлен неправильный диагноз, а ещё 18,2% больных на догоспитальном этапе были обследованы не в полном объеме. 131 Немногим менее половины детей и юношей (44,4% обследованных), больных ПОГМ, поступают в нейрохирургический стационар с несвоевременно поставленным диагнозом, 20,6% на догоспитальном этапе признаны недостаточно обследованными, у 10,8% больных рассматриваемой возрастной группы был установлен неправильный диагноз и только у 15 больных (44,1%) не было выявлено дефектов диагностического этапа. В возрастной группе 19 ‒ 34 года значения указанных показателей составляли 57,5%, 17,5%, 12,5% и 12,5% соответственно. Для пациентов 35 ‒ 44 лет аналогичные показатели составляли 53,9%, 16,5%, 14,4% и 15,5% соответственно. Среди пациентов возрастной группы 45 ‒ 54 года поздняя диагностика зарегистрирована у 62,3% больных, не обследованы в полном объеме еще 13,6% пациентов, неправильный диагноз ‒ у 9,9% и только у 14,2% больных недостатки обследования отсутствовали. У лиц в возрасте 55 ‒ 64 года значения аналогичных показателей составили 52,4%, 18,8%, 11,3% и 17,5% соответственно. В старшей возрастной группе (> 65 лет) лишь у 17,6% больных не выявлено недостатков обследования, у 57,6% больных нейроонкологический диагноз поставлен несвоевременно, у 11,3% больных выставлен неверный диагноз и еще 20,5% больных недообследованы. Данные, отражающие недостатки диагностического догоспитального этапа в зависимости от гистологического типа ПОГМ, свидетельствуют, что наибольшие диагностические трудности для врачей догоспитального звена представляют аденомы гипофиза. Лишь у 12,8% больных с данным гистологическим типом ПОГМ не выявлено дефектов обследования, 8,3% поступают в нейрохирургический стационар без выполненного в должном объеме диагностического комплекса, в 12,8% диагноз был выставлен неверно и 66,1% пациентов поступали в стационар спустя 6 месяцев после появления первых симптомов заболевания. Аналогичная ситуация отмечается у больных с невриномами VIII пары: значения данных показателей составили 14,3%, 17,8%, 9,5% и 58,4% соответственно. У пациентов с менингиомами несвоевременно поставлен диагноз ОГМ в 54,1% 132 случаев, неверный диагноз на догоспитальном этапе ‒ в 8,8%, недообследованы ‒ в 21,8% и только 15,3% пациентов не имеют недостатков на этапе диагностического поиска. Значительно реже догоспитальные недостатки в обследовании отмечены у больных с астроцитомами и глиобластомами. В частности, у больных с глиобластомами поздняя диагностика опухоли отмечена только в 39,1% случаев, неправильный диагноз ‒ в 16,9%, невыполнение в должном объеме диагностических мероприятий ‒ в 16,9%. При этом отсутствие недостатков в обследовании на догоспитальном этапе регистрировалось у 27,1% больных. Для лиц с астроцитомами значения указанных показателей составили соответственно 43,5%, 18,2%, 11,9% и 26,4%. К основным недостаткам госпитального этапа можно отнести следующие: отсутствие интраоперационной нейросонографии для навигации и определения объема удаленной опухоли; ограничение возможностей нейрохирурга по проведению комбинированной терапии первичных злокачественных опухолей головного мозга; отсутствие возможности проведения лучевой терапии в послеоперационном периоде в течение первых 20 дней; невозможность проведения химиотерапевтического лечения на 7 ‒ 20 сутки на фоне лучевой терапии согласно стандартам лечения больных с ПОГМ из-за нерегулярного и неполноценного обеспечения больных соответствующими препаратами; отсутствие возможности больных продолжать лечение в реабилитационно-восстановительных центрах. На основании данных исследования по эпидемиологии, клиникофункциональных проявлений и лечебной тактики ПОГМ в г. Бишкеке и Чуйской области и выявленных недостатков в организации оказания медицинской помощи нейроонкологическим больным предложены меры по их устранения. 133 ВЫВОДЫ 1. Среднегодовая заболеваемость ПОГМ за период 2001 ‒ 2010 гг. среди жителей Чуйской области составила 2,9 случаев на 100 тыс. населения, среди жителей г. Бишкека ‒ 3,1 на 100 тыс. населения. наиболее высокая неблагоприятных заболеваемость районах В Чуйской области наблюдается (Иссык-Атинском, в экологически Аламудунском и Сокулукском). Среди женщин заболеваемость существенно выше: 3,5 против 2,5 у мужчин на 100 тыс. населения. Пик заболеваемости ПОГМ приходится на возраст 55 ‒ 64 года ‒ 8,9 случая на 100 тыс. населения. Среднегодовая заболеваемость ПОГМ среди детей составляет 0,7 случая на 100 тыс. населения, среди лиц молодого возраста ‒ 1,7. 2. В общей структуре ПОГМ наибольший удельный вес занимают оболочечно-сосудистые опухоли (44,8%) и глиомы (38,2%), далее следуют опухоли гипофиза (9,3%), черепно-мозговых нервов (4,9%) и турецкого седла (2,1%). У детей наиболее часто регистрировались глиомы (71,0%), в среднем возрасте ‒ глиомы (41,6%), менингиомы (31,4%) и аденомы гипофиза (12,4%). Для старших возрастных групп (>60 лет) среди ПОГМ характерно увеличение частоты менингиом до 57,1%. 3. ПОГМ в 82,1% случаев имели супратенториальную локализацию, в 17,3% ‒ субтенториальную; остальные 0,6% опухолей располагались суб- и супратенториально. Более 40% больных пребывают в стационар с опухолями больших и гигантских размеров. При поступлении в стационар выраженные клинические проявления имели 58,7% больных, а 9,4% находились в состоянии декомпенсации, причем чаще ‒ дети и пожилые пациенты преимущественно с глиальными опухолями. 4. Оперативное лечение выполнено 424 пациентам ‒ 89,6% от общего числа поступивших больных. 8,3%. Тотальное удаление Послеоперационная летальность составила опухоли 134 выполнено у 30,4% больных, субтотальное ‒ 64,2% и частичное ‒ 5,4% больных. Наиболее частыми послеоперационными осложнениями у больных с ПОГМ были острые нарушения мозгового кровообращения (6,6%), повреждения черепномозговых нервов (5,2%), послеоперационный менингит (2,4%), ликворея (1,7%), интракраниальные гематомы (1,2%), пневмония (0,5%). 5. Важными причинами поздней недостаточное и несвоевременное нейроонкологическая диагностики ПОГМ являются дообследование больных, низкая настороженность в первичном звене лечебно- диагностической помощи, кадровый дефицит неврологов и нейрохирургов, разобщенность неврологической и нейрохирургической служб на этапе диагностики. У 55,5% больных диагноз «опухоль головного мозга» был установлен поздно, 33% пациентов длительное время лечились с неверно поставленным диагнозом в связи с поздним применением к ним современных нейровизуализационных методов исследования. 135 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. Многообразие клинического неврологической симптоматики и вариантов развития ПОГМ и характерная полиморбидность у данной категории больных при наличии манифестных симптомов требуют максимально раннего использования нейровизуализационных методов исследования, предпочтительно МРТ с контрастированием. 2. Активизировать лечебно-профилактическую направленность в работе медицинских учреждений страны ‒ от фельдшерско-акушерских пунктов до специализированных онкологической лечебных учреждений настороженности всех ‒ с целью специалистов. повышения Следует вести постоянную работу по повышению квалификации врачей амбулаторной практики по нейроонкологии с этапной программой обучения в форме лекционных курсов и практических занятий на базе специализированных учреждений. 3. Улучшить качество оказания нейрохирургической помощи путем издания клинических протоколов, методических рекомендаций по тактике диагностики и ведения больных с опухолями головного мозга для всех звеньев здравоохранения с целью обеспечения должной преемственности между ними. 4. С учетом ожидаемого прироста заболеваемости ПОГМ с целью улучшения результатов их лечения объединить разрозненные нейрохирургические отделения г. Бишкека в единый республиканский нейрохирургический оборудованием, центр предусмотрев с необходимым дополнительные модернизированным штаты нейрохирургов, радиологов, химиотерапевтов и других специалистов. 5. Приоритетная задача нейрохирургической службы ‒ создание нейроонкологического регистра опухолей головного мозга, позволяющего определить перспективы развития данного раздела медицины, улучшить качество диагностики и лечения нейроонкологических больных, а также 136 активизировать работу социальных работников, экологов, организаторов здравоохранения. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 1. Алексеев, А.Г. Первичные опухоли центральной нервной системы в республике Татарстан (клиническая эпидемиология и организация медицинской помощи [Текст]: автореф. дис. … канд. мед. наук : 14.00.28, 14.00.33 / А.Г. Алексеев. – СПб, 2005. – 21 с. 2. Анализ результатов диагностики и хирургического лечения аденом гипофиза [Текст]: [М.М. Мамытов, К.Б. Ырысов, К.Т. Мендибаев и др.] // Наука и новые технологии. – Бишкек, 2012. ‒ №5. ‒ С.44 ‒ 47. 3. Арендт, А.А. Клинические особенности симптоматологии и течение опухолей головного мозга у детей [Текст]: многотомное руководство по неврологии в 6 томах / А.А. Арендт. – М. : Медгиз, 1961. – Т. 5. – С. 444–465. 4. Артарян, А.А. Опухоли мозжечка у детей [Текст] / А.А. Артарян. – М. : Медицина, 1979. – 175 с. 5. Бабчин, И.С. Клиника и диагностика опухолей головного и спинного мозга [Текст] / И.С. Бабчин, И.П. Бабчина. – Л. : Медицина, 1973. – 984 с. 6. Балязин, В.А. Структура заболеваемости первичными опухолями головного мозга среди населения г. Ростов-на-Дону и Ростовской области [Текст] / В.А. Балязин, И.А. Сафонова, А.А. Шелеско // Актуальные вопросы неврологии и нейрохирургии : сб. науч. тр. – Ростов-на-Дону, 1999. – С. 37– 39. 7. Безрамочная навигация в хирургии объемных образований головного мозга [Текст] / [П.А. Семин, A.Л. Кривошапкин, Е.Г. Мелиди и др.] // Нейрохирургия. – 2004. – № 2. – С. 20–24. 137 8. Бреус, Т.К. Медицинские эффекты магнитных бурь [Текст] / Т.К. Бреус, Ф.И. Комаров, С.И. Рапопорт // Клиническая медицина. – 2005. – № 3. – С. 4–12. 9. Бурнин, С.М. Характеристика заболеваемости опухолями головного мозга в Челябинской области [Текст] / С.М. Бурнин, С.Л. Пашнин, Д.А. Романюго // Материалы I науч.-практ. конф. нейрохир. и неврол. Сев.-Зап. Рос. – Калининград; Светлогорск, 2005. – С. 56 ‒58. 10. Василевский, М.Г. Эпидемиология злокачественных новообразований в Кыргызстане (демографические и медицинские аспекты) [Текст]: автореф. дис. д-ра мед. наук : 14.00.14 / М.Г. Василевский. – Бишкек, 1999. – 32 с. 11. Вахитов, Ш.М. Социально-гигиенические аспекты заболеваемости и результаты лечения больных с первичными опухолями центральной нервной системы в республике Татарстан [Текст] / Ш.М. Вахитов, В.И. Данилов, А.Г. Алексеев // Неврологический вестник. – 2003. – № 3. – С. 34–39. 12. Власов, В.В. Эпидемиология [Текст]: учеб. пособие для вузов / В.В. Власов. – М. : ГЭОТАР-МЕД, 2004. – 464 с. 13. Гериатрические аспекты внутренних болезней [Текст]: монография / [А.С. Мелентьев, В.С. Гасилин, Е.И. Гусев и др.] – Москва : [б. и.], 1995. – 259 с. 14. Гланц, С. Медико-биологическая статистика [Текст]: научное издание / С. Гланц; Пер. с англ. Ю.А. Данилова; Под ред. Н.Е. Бузикашвили, Д.В. Самойлова. – М.: Практика, 1998. – 459 с. 15. Глиомы у взрослых: подходы к стандартизации лечебной тактики [Текст] / [И.Н. Пронин, В.В. Ярцев, А.Г. Коршунов и др.] // IV съезд нейрохирургов России. – М., 2006. – С. 181‒183. 16. Голанов, A.B. Результаты комбинированного лечения глиобластом больших полушарий головного мозга [Текст] / A.B. Голанов, А.Г. Коршунов // III съезд нейрохирургов России. – СПб., 2002. – С. 88–89. 17. Горенштейн, А.Е. Эпидемиологические аспекты первичных опухолей головного мозга и вопросы организации нейроонкологической помощи в 138 Калининградской области [Текст]: дис. … канд. мед. наук : 14.00.28 / А.Е. Горенштейн. – СПб, 2009. – 135 с. 18. Гуляева, С.Е. Структура и результаты лечения опухолей головного мозга [Текст] / С.Е. Гуляева, В.Э. Банашкевич, A.B. Лантух // II съезд нейрохир. Рос. – Н. Новгород, 1998. – С. 140 ‒141. 19. Давыдов, М.И. Статистика злокачественных новообразований в России и странах СНГ в 2004 г. [Текст] / М.И. Давыдов, Е.М. Аксель // Вестник РОНЦ им. H.H. Блохина. – 2006. – Т. 17, № 3. – прил. 1. – С. 132‒133. 20. Демографические, социальные и медицинские проблемы старения населения [Текст] / [Н.Я. Шабашова, О.Т. Дятченко, Р.Ш. Бахтияров и др.] // Вопросы онкологии. – 2001. – Т. 47, № 5. – С. 523–535. 21. Демографический ежегодник Кыргызской Республики 2006 - 2010 гг. [Текст] : Годовая публикация Нацстаткома КР, Бишкек, 2011. – 346 с. 22. Дюсембеков, Е.К. Клинико-эпидемиологическая характеристика злокачественных опухолей головного мозга в Казахстане и оптимизация нейрохирургической помощи [Текст] : автореф. дис. … д-ра мед. наук : 14.00.28, 14.00.33 / Е.К. Дюсембеков. – Алматы, 2010. – 49 с. 23. Дюсембеков, Е.К. Эпидемилогические аспекты злокачественных опухолей головного мозга в Казахстане [Текст] / Е.К. Дюсембеков // Поленовские чтения: Всерос. науч.-практ. конф. – СПб., 2008. – С. 257‒259. 24. Дюшеев, Б.Д. Опухоли задней черепной ямки у лиц пожилого и старческого возраста [Текст] : автореф. дисс… д-ра мед. наук : 14.00.28 / Б.Д. Дюшеев. – М., 2000. – 42 с. 25. Закон Кыргызской Республики «Об охране атмосферного воздуха» от 12 июня 1999 года №51 (В редакции законов КР от 24 июня 2003 года №109, 9 августа 2005 года №145) 26. Закон Кыргызской Республики «Об охране окружающей среды» от 16 июня 1999 года №53 (В редакции Законов КР от 4 февраля 2002 года №22, 11 июня 2003 года №101, 11 августа 2004 года №13, 6 августа 2005 года №124) 139 27. Заридзе, Д.Г. Эпидемиология, механизмы канцерогенеза и профилактика рака [Текст] / Д.Г. Заридзе // Архив патологии. – 2002. – Т. 64, № 2. – С. 53‒58. 28. Захматова, Т.В. Смертность населения Санкт-Петербурга от заболеваний, требующих нейрохирургической помощи [Текст] : дис. … канд. мед. наук : 14.00.28 / Т.В. Захматова. – СПб., 2000. – 196 с. 29. Зозуля, Ю.А. Молекулярная генетика глиом и перспективы молекулярной нейрохирургии [Текст] / Ю.А. Зозуля, Н.Я. Градина // Вопросы нейрохирургии. – 1998. – № 1. – С. 45–51. 30. Зозуля, Ю.А. Эпидемиологические исследования в нейроонкологии : современное состояние в Украине и за рубежом [Текст] / Ю.А. Зозуля, Я.В. Пацко, А.Н. Никифорова // Вопросы нейрохирургии. – 1998. – № 3. – С. 50– 54. 31. Камалова, Г.М. Диагностика менингиом больших полушарий мозга на догоспитальном этапе [Текст] / Г.М. Камалова // Вопросы онкологии. – 1994. – Т. 40, №4-5-6. – С. 221–225. 32. Клиническая эпидемиология первичных опухолей головного мозга взрослого населения Ульяновской области за период 1996-2005 гг. [Текст] / [Р.Ф. Ишматов, А.И. Медленко, М.А. Мидленкои др.] // Поленовские чтения : матер. науч.-практич. конф. [под ред. проф. В.П. Берснева] ; ФГУ «Российский науч.-исслед. нейрохирургический ин-т им. проф. А.Л. Поленова Росздрава». – СПб. : Изд-во Человек и здоровье, 2007. – С. 203‒205. 33. Ковалев, Г.И. Эпидемиология первичных опухолей головного мозга на территории Краснодарского края [Текст] / Г.И. Ковалев, Г.Г. Музлаев // IV съезд нейрохир. Рос. – М., 2006. – С. 178–179. 34. Кондаков, E.H. О работе нейрохирургической службы Российской федерации в 2000-2006 гг. [Текст] / E.H. Кондаков, В.П. Берснев // Поленовские чтения: Всерос. науч.-практ. конф. – СПб., 2008. – С. 21–22. 140 35. Кондратьева, Е.В. Клинические варианты течения, подходы к прогнозированию первичных опухолей головного мозга [Текст] : автореф. дис. … канд. мед. наук : 14.01.11 / Е.В. Кондратьева. – Киров, 2011. – 22 с. 36. Коновалов, А.Н. Современное состояние проблемы лечения опухолей мозга [Текст] / А.Н. Коновалов // Комбинированное лечение опухолей головного мозга : материалы конференции. – Екатеринбург, 2004. – С. 56–58. 37. Котельников, Г.П. Геронтология и гериатрия [Текст] : учеб. для вузов / Г.П. Котельников; М-во здравоохранения Рос. Федерации, Самар. гос. мед. ун-т, НИИ "Междунар. центр по проблемам пожилых". - М. : Б. и. ; Самара: Самар. дом печати, 1997. – 800 с. 38. Лихтерман, Л.Б. Клиническая диагностика опухолей больших полушарий головного мозга [Текст] / Л. Б. Лихтерман. ‒ М.: Медицина, 1979. – 280 с. 39. Лосев, Ю.А. Эпидемиология первичных опухолей головного мозга в сельской местности (на модели Ленинградской области) [Текст] : дис. … канд. мед. наук : 14.00.28, 14.00.33 / Ю.А. Лосев. – СПб., 2003. – 188 с. 40. Медицинская статистика [Текст] : учебно-методическое пособие / Под ред. К.У. Акынбекова. – Бишкек, КРСУ. – 2006. – 184 с. 41. Международная статистическая классификация болезней и проблем, связанных со здоровьем [Текст] : десятый пересмотр (МКБ-10). – Т. 1, ч.1. – Женева : Всемир. орг. здравоохранения, 2003. – 697 с. 42. Международная статистическая классификация болезней и проблем, связанных со здоровьем [Текст] : десятый пересмотр (МКБ-10). –Т. 1, ч. 2. – Женева : Всемир. орг. здравоохранения, 2003. – 633 с. 43. Метелица, В.И. Эпидемиология и профилактика ишемической болезни сердца [Текст] : научное издание / В.И. Метелица, Н.А. Мазур. – M. : Медицина, 1976. – 168 с. 44. Можейко, P.A. Клиническая эпидемиология первичных опухолей головного мозга в Ставропольском крае [Текст] : автореф. дис. … канд. мед. наук : 14.00.28, 14.00.33 / Р.А. Можейко. – СПБ, 2004. – 23 с. 141 45. Никифоров, A.C. Клиническая неврология [Текст] : в 3 т. : учеб. пособие для слушателей системы последиплом. образования. Т. 3, ч. 1. Основы нейрохирургии / A.C. Никифоров, А.Н. Коновалов, Е.И. Гусев ; Ред. А.Н. Коновалов. – М. : Медицина, 2004. - Т. 3, ч. 1. – 600 с. 46. Олюшин, В.Е. Глиальные опухоли. Распространенность в Санкт- Петербурге, результаты лечения [Текст] / В.Е. Олюшин, А.Ю. Улитин // II съезд нейрохир. Рос. – Н. Новгород, 1998. – С. 148–149. 47. Олюшин, В.Е. Комплексная терапия злокачественных глиом больших полушарий головного мозга [Текст] / В.Е. Олюшин, Г.С. Тиглиев // II съезд нейрохир. Рос. – Н. Новгород, 1998. – С. 109‒111. 48. Опухоли ствола головного мозга [Текст] / В.А. Хилько, Н.В. Шулешова, В.А. Хачатрян [и др.]. – СПб. : Гиппократ, 2005. – 504 с. 49. Орлов, Ю.А. Эпидемиология и результаты лечения опухолей головного мозга у детей (обзор литературы) [Текст] / Ю.А. Орлов // Украинский нейрохирургический журнал. – 2000. – № 2. – С. 5–14. 50. Поляков, И.В. Смертность населения Санкт-Петербурга от нейрохирургической патологии [Текст] / И.В. Поляков, О.В. Могучая, Т.В. Захматова // III съезд нейрохирургов России. – СПб., 2002. – С. 693-695. 51. Практическая нейрохирургия [Текст] : рук. для врачей [Е.Д. Алексеев, Н.А. Аносов, М.А. Асатурян и др.] ; Под общ. ред. Б.В. Гайдара. – СПб. : Гиппократ, 2002. – 648 с. 52. Раздольский, И.Я. Опухоли головного мозга [Текст] / И.Я. Раздольский. – М. : Медгиз, 1957. – 185 с. 53. Распространение опухолей ЦНС у детей на Дальнем Востоке [Текст] / В.И. Кустов, И.Э. Косых, С.М. Киселева [и др.] // Вопросы. нейрохирургии. им. H. H. Бурденко. – 1990. – Вып. 5. – С. 36–38. 54. Розуменко, В.Д. Нейроонкология : современное состояние проблемы [Текст] / В.Д. Розуменко // Онкология. – 2006. – Т. 8, № 2. – С. 188–191. 142 55. Ромоданов, С.А. Организация помощи больным со злокачественными глиомами головного мозга [Текст] / С.А. Ромоданов // I съезд нейрохир. Укр. – Киев, 1993. – С. 5–8. 56. Савченко, А. Ю. Глиомы головного мозга (эпидемиология, диагностика, дифференцированное лечение и реабилитация) [Текст] : монография / А. Ю. Савченко ; Омская гос. мед. акад. – Омск : Изд-во ОмГПУ, 1997. – 311 с. 57. Сафин, Ш.М. Структурный анализ опухолей центральной нервной системы в Республике Башкортостан [Текст] / Ш.М. Сафин // IV съезд нейрохир. Рос. – М., 2006. – С. 214‒216. 58. Сафонова, И.А. Нозогеография как этап эпидемиологического исследования в нейроонкологии [Текст] / И.А. Сафонова // Проблемы лечения и реабилитации в медицине : материалы конгресса хирургических обществ Ростовской области. – Ростов на Дону, 2000. – С. 201–212. 59. Смертность населения Санкт-Петербурга от нейрохирургической патологии [Текст] / [В.П. Берснев, И.В. Поляков, О.В. Могучая и др.] // Нейрохирургия. – 1999. – Т. 3, № 1. – С. 53–56. 60. Смулевич, В.Б. Демографические аспекты эпидемиологии злокачественных новообразований [Текст] / В.Б. Смулевич, Л.И. Ременник. – М., 1983. – 92 c. 61. Смулевич, В.Б. Профессия и рак [Текст] / В.Б. Смулевич. – М. : Медицина, 2000. – 384 с. 62. Станиславский, В.Г. Менингиомы задней черепной ямы [Текст] / В.Г. Станиславский. - Киев : Вища школа, 1976. – 208 с. 63. Стереотаксическая локальная криотомия в комбинированном лечении опухолей головного мозга [Текст] / [Б.В. Мартынов, Б.В. Гайдар, Ю.С. Щиголев и др.] // Материалы III съезда нейрохирургов России. – СПб., 2002. – С. 125–126. 64. Терехов, В.С. Эпидемиология оперированных опухолей головного мозга в Республике Беларусь [Текст] / В. С. Терехов, Е. А. Короткевич // 143 Военная медицина : научно-практический рецензируемый журнал. – 2010. – № 3. – С. 64–71. 65. Улитин, А.Ю. Эпидемиология опухолей головного мозга в Санкт- Петербурге [Текст] : дис. … канд. мед. наук / А.Ю. Улитин. – СПб., 1997. – 211 с. 66. Чаклин, А.В. Профилактика злокачественных опухолей на основе эпидемиологических исследований [Текст] / А. В. Чаклин // Вопросы онкологии. – 1982. – Т. 28, № 5. – С. 133-141. 67. Частота распространения первичных опухолей головного мозга среди населения г. Ростова-на-Дону [Текст] / [В.А. Балязин, И.А. Сафонова, М.С. Ялтырев и др.] // Проблемы нейрохирургии / Под ред. В.П. Берснева, Н.П. Рябуха. – СПб., 2000. – С. 70–73. 68. Чиссов, В.И. Злокачественные новообразования в России в 2000 году (заболеваемость и смертность) [Текст] / В.И. Чиссов, В.В. Старинский. – М. : МНИОИ им. П. А.Герцена, 2002. – 264 с. 69. Шебзухова, Л.M. Эпидемиология и диагностика опухолей головного мозга в Кабардино-Балкарии [Текст]: дис. … канд. мед. наук / Л.М. Шезбухова. – СПб., 1995. – 218 с. 70. Щербакова, Е. Оснащенность томографами выше всего в Японии, обследований больше проводят в США [Электронный ресурс] / http://demoscope.ru 71. Ырысов, К.Б. Способ тотального удаления неврином VIII нерва [Текст] / К.Б. Ырысов, Н.А. Арстанбеков, Б.Ж. Турганбаев // Наука и новые технологии. – Бишкек, 2011. ‒ №6. ‒ С.51 ‒ 53. 72. Экологический обзор [Текст]: отчет Госагентства охраны окружающей среды и лесного хозяйства при правительстве Кыргызской Республики. – Бишкек, 2009. – 82 с. 73. Эпидемиологические исследования в нейрохирургии [Текст] / [И.В. Поляков, Н.С. Соколова, А.Ю. Улитин и др.] // Поленовские чтения : науч. тр. – СПб., 1995. – Вып. 1. – С. 12–16. 144 74. Эпидемиология глиальных опухолей в Санкт-Петербурге [Текст] / В.Е. Олюшин, А.Ю. Улитин, Д.А. Гуляев [и др.] // III съезд нейрохир. Рос. – CПб., 2002. – C. 137‒139. 75. Эпидемиология опухолей головного мозга в Дагестане [Текст] / [Р.У. Умаханов, И.А. Хаметов, Т.А. Айдиев и др.] // Тр. межобл. науч.-практ. конф. нейрохир. Сев. Кавказа. – Владикавказ, 1990. – С. 127–129. 76. Ярцев, В.В. Некоторые аспекты эпидемиологии и классификации опухолей нервной системы [Текст] / В.В. Ярцев, А.Г. Коршунов, В.П. Непомнящий // Вопросы нейрохирургии. – 1997. – № 3. – С. 9–13. 77. A population-based study on the incidence and survival rates of 3857 glioma patients diagnosed from 1953 to 1984 [Техt] / [M. Kallio, R. Sankila, J. Jaaskelainen et al.] // Cancer. – 1991. – Vol. 68, № 6. – P. 1394–1400. 78. Acute effects of summer air pollution on respiratory health of asthmatic children [Text] / [M.H. Gielen, S.C. van der Zee, J.H. van Wijnen et al.] // Am. J. Respir. Crit. Care Med. – 1997. – Vol. 155, № 6. – P. 2105–2108. 79. Ahlbom, A. Some notes on brain tumor epidemiology [Техt] / A. Ahlbom // Ann. NY Acad. Sci. – 1990. – Vol. 609. – P. 179–185. 80. Ahsan, H. Trends in incidence of primary malignant brain tumors in USA, 1981-1990 [Text] / H. Ahsan, A.I. Neugut, J.N. Bruce // Int. J. Epidemiol. – 1995. – Vol.24, № 6. – P. 1078–1085. 81. Alexander, V. Brain tumors risk among United States nuclear workers / V. Alexander [Техt] // Occup. Med. – 1991. – Vol. 6, № 4. – P. 695–714. 82. Al-Hilli, F. Some notes on brain tumor epidemiology / F. Al-hilli, N.A. Ansari [Техt] // Surg. Neurol. – 2005. – Vol. 29. – P. 189 – 196. 83. Al-Mefty, О. Skull base chordomas: a management challenge / О. Al-Mefty, L.A.B. Borba [Техt] // J. Neurosurg. ‒ 1997. ‒ Vol. 86, №2. ‒ P. 182 ‒ 189. 84. An international case-control study of adult glioma and meningioma: the role of head trauma [Техt] / [S. Preston-Martin, J.M. Pogoda, B. Shlehofer et al.] // Int. J. Epidemiol. – 1998. – Vol.27, № 4. – P. 579–586. 145 85. Application of recursive partitioning analysis and evaluation of the use of whole brain radiation among patients treated with stereotactic radiosurgery for newly diagnosed brain metastases [Text] / [M.A. Chidel, J.H. Suhl, C.A. Reddy et al.] // Int. J. Radiat. Oncol. Biol. Phys. – 2000. – Vol. 47, № 4. – P. 993–999. 86. Apshkalne, D. Epidemiological investigation of children brain tumours, compared with acute leukaemia in Latvia before and after Chernobyi accident [Техt] / D. Apshkalne, E. Vitols // 6th Congr. Baltic Neurosurg. – Riga, 1993. – P. 42–43. 87. Berens, M.E. Brain tumour epidemiology growth and invasion [Техt] / M.E. Berens, J.I. Rutka, M.L. Rosenblum // Neurosurg. Clin. – 1990. – Vol. 1, № 1. – P. 1–18. 88. Berleur, M.P. The role of chemical, physical, or viral exposures and health factors in neurocarcinogenesis: implications for epidemiologic studies of brain tumors [Техt] / М.Р. Berleur, S. Cordier // Cancer Causes Control. – 1995. – Vol. 6, № 3. – P. 240–256. 89. Bernard, W. Steward. World Cancer Report [Техt] / W. Steward. Bernard, Paul Kleihues. – LARS Press, Lyon 2003. – 351 p. 90. Brain and other central nervous system cancers: recent trends in incidence and mortality [Техt] / [J.M. Legler, L.A. Gloeckler, M.A. Smith et al.] // J. Natl. Cancer Inst. – 1999. – Vol. 91, № 16. – P. 1382–1390. 91. Brain tumors: classification and clinical aspects [Text] / P.A. Battistella, R. Ruffilli, F. Viero [et al.] // Pediatr. Med. Chir. – 1990. – Vol. 12, № 1. – P. 33–39. 92. Brain tumours in South Brasil: a retrospective study of 438 cases [Техt] / [L.F. Torres, R. Almeida, S. Avilaet al.] // Arq. Neuropsiquiatr. – 1990. – Vol. 48, № 3. – P. 279–285. 93. Cancer incidence and incidence rates in Japan in 2000 [Техt] / [T. Marugame, K. Kamo, K. Katanoda et al.] // Japanese Journal of Clinical Oncology. – 2006. – Vol. 36, № 10. – P. 668–675. 146 94. Cancers in the first-degree relatives of children with brain tumours [Text] / K. Hemminki, X. Li, P. Vaittinen, C. Dong // Br. J. Cancer. – 2000. – Vol. 83, № 3. – P. 407–411. 95. Chordomas and chondrosarcomas of the cranial base: results and follow-up of 60 patients [Техt] / [E. Gay, L.N. Sekhar, E. Rubinstein et al.] // Neurosurgery. 1995. – Vol. 36, № 5. – P. 887–897. 96. Christensen, H.C. Incidences of gliomas and meningiomas in Denmark, 1943 to 1997 [Text] / H. C. Christensen, M. Kosteljanetz, C. Johansen // Neurosurgery. – 2003. – Vol. 52, № 6. – P. 1327–1333. 97. Clinical and epidemiologic characteristics of first primary tumors of the central nervous system and related organs among atomic bomb survivors in Hiroshima and Nagasaki, 1958-1995 [Text] / [S. Yonehara, A.V. Brenner, M. Kishikawa et al.] // Cancer. – 2004. – Vol. 101, № 7. – P. 1644–1654. 98. Colli, B.O. Chordomas of the craniocervical junction: follow-up review and prognostic factors [Техt] / B.O. Colli, O. Al-Mefty // J. Neuroserg. 2001. – Vol. 95, № 6. – P. 933–943. 99. David, N. Louis N.D. Report of the Brain Tumor Progress Review Group /2004 100. Demers, P.A. Occupation, socioeconomic status, and brain tumor mortality: a death certificate-based case-control study [Text] / P.A. Demers, T.L. Vaughan, R.R. Schommer // J. Occup. Med. – 1991. – Vol. 33, № 9. – P. 1001–1006. 101. Dental radiography after age 25 years, amalgam fillings and tumours of the central nervous system [Text] / [Y. Rodvall, A. Ahlbom, G. Pershagen et al.] // Oral Oncol. – 1998. – Vol. 34, № 4. – P. 265–269. 102. Diagnostic sensitiviti bias an epidemiologic exploration of apparent brain tumor exess [Техt] / [Р. Greenwald, B.R. Friendlander, C.E. Lawrence et al.] // Occup..Med. – 1981. – Vol. 23, № 10. – P. 690–694. 103. Doll, R. The causes of cancer [Техt] / R. Doll, R. Peto. – Oxford; New York: Oxford Univ.Press, 1981. – P. 1197–1312. 147 104. Ebrahim, S. Epidemiology in old age [Text] / S. Ebrahim, A.K. Kalache. – London: BMJ Publ. Group, 1996. – 436 p. 105. Epidemiology of primary brain tumors: current concepts and review of the literature [Техt] / [M. Wrensch, Y. Minn, T. Chew et al.] // Neurooncol. – 2002. – Vol. 4, № 4. – P. 278–279. 106. Epidemiology of primary central nervous system tumors in the Coast and Gorski Kotar county Croatia, 1977-2000 [Техt] / [L. Tuskan-Mohar, E. Materljan, A. Jurjevic et al.] // Timori. – 2004. – Vol. 90, № 6. – P. 550–555. 107. Familial and personal medical history of cancer and nervous system conditions among adults with glioma and controls [Text] / [M. Wrensch, M. Lee, R. Miike et al.] // Am. J. Epidemiol. – 1997. – Vol. 145, № 7. – P. 581–593. 108. Farwell, J.R. Tumours of central nervous system in adolescent [Text] / J.R. Farwell, G.J. Dohrman, J.T. Flannery // Am. Fam. Phys. – 1984. – Vol. 29, № 4. – P. 133–139. 109. Fathallah-Shaykh, H.M. Brain tumors in the elderly: undefeated and gaining ground [Text] / H.M. Fathallah-Shaykh, D.D. McIntire // Arch. Neurol. – 1998. – Vol. 55, № 7. – P. 905–906. 110. Fogelholm, R. Epidemiology of central nervous system neoplasms. A regional survey in Central Finland [Техt] / R. Fogelholm, T. Uutela, K. Murros // Acta Neural Scand. – 1984. – Vol. 69, № 3. – P. 129–136. 111. Further clues concerning the aetiology of childhood central nervous system tumours [Text] / [R.J. McNally, R.D. Alston, T.O. Eden et al.] // Eur. J. Cancer. – 2004. – Vol. 40, № 18. – P. 2766-2772. 112. Gavin, P. Central nervous system abnormalities in pediatric human immunodeficiency virus infection [Text] / P. Gavin, R. Yogev // Pediatr. Neurosurg. – 1999. – Vol. 31, № 3. – P. 115–123. 113. Genetics of primary brain tumors: a review / М. Bondy, J. Wiencke, М. Wrensch, А.Р. Kyritsis [Техt] // J. Neurooncol. – 1994. – Vol. 18, № 1. – P. 69– 81. 148 114. Gurney, J.G. Brain and other central nervous system tumors: rates, trends, and epidemiology [Техt] / J.G. Gurney, N. Kadan-Lottick // Curr. Opin. Oncol. – 2001. – Vol. 13, № 3. – P. 160–166. 115. Hazzard, W.R. Irony upon irony. Internal medicine at the crossroads of the crisis in medicine and health care (and what we are trying to do about it at Bowman Gray) [Text] / W.R. Hazzard, R. Velez, R. Merenbloom // N C Med. J. – 1993. – Vol. 54, № 4. – P. 161–164. 116. Helseth, A. Incidence and survival of intracranial meningioma patients in Norway 1963-1992 [Text] / A. Helseth // Neuroepidemiology. – 1997. – Vol. 16, № 2. – P. 53–59. 117. Helseth, A. The incidence of primary central nervous system neoplasms before and after computerized tomography availability [Text] / A. Helseth // J. Neurosurg. – 1995. – Vol. 83, № 6. – P. 999–1003. 118. Hwang, S.L. An analysis of brain tumors in south Taiwan [Text] / S.L. Hwang, S.L. Howng // Gaoxiong Yi Xue Ke Xue Za Zhi. – 1992. – Vol. 8, № 12. – P. 656–664. 119. Ibrahim, A.W. CNS tumors in Eastern Saudi Arabia [Техt] / A.W. Ibrahim // Neurosurg. Rev. – 1992. – Vol. 15, № 4. – P. 489–494. 120. Incidence trends of adult primary intracerebral tumors in four Nordic countries [Техt] / [L. Klaeboe, P. Hall, T. Mathiesen et al.] // Int. J. Cancer. – 2004. – Vol. 108, № 3. – P. 450–455. 121. Increased mortality from brain tumors: a combined outcome of diagnostic technology and change of attitude toward the elderly [Техt] / [B. Modan, D.K. Wagener, J.J. Feldman et al.] // Am. J. Epidemiol. – 1992. – Vol. 135, № 12. – P. 1349–1357. 122. Increasing annual incidence of primary malignant brain tumors in the elderly [Техt] / N.H. Greig, L.G. Ries, R. Yancik, S.I. Rapoport // Journal of the National Cancer Institute. – 1990. – Vol. 82, № 20. – P. 1621–1624. 149 123. Is the increased incidence of primary malignant brain tumours in the elderly real [Техt] / [P. Boyle, P. Maisonneuve, R. Saracci et al.] // J. Natl. Cancer Inst. – 1990. – Vol. 82, № 20. – P. 1594–1596. 124. Kannel, W.B. Risk factor analysis [Text] / W. Kannel, A. Schatzkin // Prog. Cardiovasc. Dis. – 1984. – Vol. 26, № 4. – P. 309–332. 125. Kuratsu, J. Epidemiological study of primary intracranial tumors in elderly people [Техt] / J. Kuratsu, Y. Ushio // J. Neurol. Neurosurg. Psychiatry. – 1997. – Vol. 63, № 1. – P. 116–118. 126. Lai, H. Single - and double -strand DNA breaks in rat brain cells after acute expouse to radiofrequency electromagnetic radiation [Text] / H. Lai, N.P. Singh // // Int. J. Radiat. Biol. – 1996. – Vol. 69, № 4. – P. 513–521. 127. Levi, F. Descriptive epidemiology of malignant brain tumours in the Swiss Canton of Vaud [Техt] / F. Levi, La C. Vecchia, V.C. Te // Neuroepidemiology. – 1990. – Vol. 9, № 3. – P. 135–142. 128. Mobile phone use and the risk of acoustic neuromas [Техt] / S. Lonn, А. Ahlbom, Р. Hall, М. Feychting // Epidemiology. – 2004. – Vol. 15, № 6. – P. 653– 659. 129. Mueller, B.A. Epidemiology of pediatric brain tumors [Text] / B.A. Mueller, J.G. Gurney // Neurosurg. Clin. N. Am. – 1992. – Vol. 3, № 4. – P. 715 – 721. 130. Neuropsychometric evaluation of long-term survivors of adult brain tumours: relationship with tumour and treatment parameters [Техt] / А. Gregor, А. Cull, Е. Traynor, М. Stewart, S. Love // Radiother. Oncol. – 1996. – Vol. 41, № 1. – P. 55–59. 131. Occupation and risk of adult glioma in the United States [Техt] / [A.J. De Roos, P.A. Stewart, M.S. Linet et al.] // Cancer Causes Control. – 2003. – Vol. 14, № 2. – P. 139–150. 132. Occupational risks for the development of brain tumors [Text] / S. Kaplan, S. Etlin, I. Novikov, B. Modan // Am. J. Ind. Med. – 1997. – Vol. 31, № 1. – P. 1520. 150 133. On behalf of specialists in neurooncology in South and East Netherlands, incidence of primary central nervous system cancers in South and East Netherlands in 1989-1994 [Техt] / [A.C. Gitty, van der Sanden, J. Leo et al.] // Neuroepidemiology. – 1998. – Vol. 17, № 5. – P. 247–257. 134. Oncogenes and anti-oncogenes in human central nervous system tumors [Text] / S.K. Batra, B.K. Rasheed, S.H. Bigner, D.D. Bigner // Lab. Invest. – 1994. – Vol. 71, № 5. – P. 621–637. 135. Ostro, B.D. The health benefits of reduced tropo-spheric ozone in California / B.D. Ostro, H. Tran, J.V. Levy // J. Air Waste Manag. Assoc. – 2006. – Vol. 56, № 7. – P. 1007–1021. 136. Parkin, D.M. Intennational incidence of childhood cancer [Техt] / D.M. Parkin. – Ed. D. M. Lyon. – 1988. – 163 p. 137. Pirouzmand, F. The incidence trends of primary brain tumors in Saskatchewan from 1970 to 2001 [Техt] / F. Pirouzmand, V. Sadanand // Can. J. Neurol. Sci. – 2007. – Vol. 34, № 2. – P. 181–186. 138. Pobereskin, L.H. Incidence of brain tumors in two English counties: a population based study [Техt] / L.H. Pobereskin, J.B. Chadduck // J. Neurol. Neurosurg. Psychiatry. – 2000. – Vol. 69, № 4. – P. 464–471. 139. Polednak, A.P. Interpretation of secular increases in incidence rates for primary brain cancer in Connecticut adults, 1965-1988 [Text] / A.P. Polednak // Neuroepidemiology. – 1996. – Vol. 15, № 1. – P. 51–56. 140. Preston-Martin, S. Epidemiology of primary CNS neoplasm [Техt] / S. Preston-Martin // Neuroepidemiology. – 1996. – Vol. 14, № 2. – P. 273–290. 141. Prevalence estimates for primary brain tumors in the United States by behavior and Major histology groups [Техt] / [F.G. Davis, V. Kupelian, S. Freels et al.] // Neuro. Oncology. – 2001. – Vol. 3, № 3. – P. 152–158. 142. Primary brain tumor incidence rates in four United States regions, 1985- 1989 [Техt] / [G. Davis, N. Malinski, W. Haenszel et al.] // Neuroepidemiol. – 1996. – Vol. 15, № 2. – P. 103–112. 151 143. Primary brain tumors in the United States statistical report 1998-2002 [Техt] / [М.А. Smith, J.G. Gurney, М. Linet et al.]. – CBTRUS, (2005-2006). – 62 p. 144. Primary intracranial tumors. Survey of incidence in the province of Trento in the years 1977-1981 [Техt] / G. Ferrari, M.G. Lovaste, M. Moresco, G. Rossi // Ital. J. Neural. Sci. – 1985. – Vol. 6, № 2. – P. 191–196. 145. Progress toward guidelines for the management of fatigue [Review] [Text] / [D. Cella, А. Peterman, S. Passik et al.] // Oncology (Huntingt). – 1998. – Vol. 12, № 11A. – P. 369–377. 146. Residential water source and the risk of childhood brain tumors [Техt] / B.A. Mueller, K. Newton, E.A. Holly, S. Preston-Martin // Environ Health Perspect. – 2001. – Vol. 109, № 6. – P. 551–556. 147. Riggs, J.E. Rising primary malignant brain tumor mortality in the elderly. A manifestation of differential survival [Text] / J.E. Riggs // Arch. Neurol. – 1995. – Vol. 52, № 6. – P. 571–575. 148. Risk factors for tumors of the brain and meninges: results from the Adelaide Adult Brain Tumor Study [Техt] / P. Ryan, M.W. Lee, B. North, A.J. McMichael // Int. J. Cancer. – 1992. – Vol. 51, № 1. – P. 20–27. 149. Risk of astrocytic brain tumors associated with occupational chemical exposures. A case-referent study [Техt] / [T.L. Thomas, P.A. Stewart, A. Stemhagen et al.] // Scant. J. Work Environ Health. – 1987. – Vol. 13, № 5. – P. 417–423. 150. Robertson, P.L. Pediatric brain tumors [Техt] / P.L. Robertson // Prim. Care. – 1998. – Vol. 25, № 2. – P. 323–339. 151. Schlehofer, B. Association between brain tumors and menopausal status [Text] / B. Schlehofer, M. Blettner, J. Wahrendorf // J. Natl. Cancer Inst. – 1992. – Vol. 84, № 17. – P. 1346–1349. 152. Secular trends in diet and risk factors for cardiovascular disease: the Framingham Study [Text] / [B.M. Posner, M.M. Franz, P.A. Quatromoni et al.] // J. Am. Diet. Assoc. – 1995. – Vol. 95, № 3. – P. 171–179. 152 153. Seasonal variation in incidence of pediatric medulloblastoma in the United States, 1995-2001 [Text] / [S. Hoffman, K.A. Schellinger, J.M. Propp et al.] // Neuroepidemiology. – 2007. – Vol. 29, № 1-2. – P. 89-95. 154. Sundeep, D. Trends in brain cancer incidence and survival in the United States: surveillance, epidemiology, and end results program, 1973 to 2001 [Техt] / D. Sundeep, C. Lynch // Neurosurgical focus. – 2006. – Vol. 20, N 4. – E1. 155. Sytkowski, P. A. Changes in risk factors and the decline in mortality from cardiovascular disease. The Framingham Heart Study [Text] / P. A. Sytkowski, W. B. Kannel, R. B. D'Agostino // N. Engl. J. Med. – 1990. – Vol. 322, № 23. – P. 1635–1641. 156. The evolution of the incidence of glial brain tumors in Moldova in 1981- 1991: the effect of excessive accidental hyper-radioactivity [Text] / [G. Dumitrescu, S. Logofatu, M. Balan et al.] // Rev. Med. Chir. Soc. Med. Nat. Iasi. – 1995. – Vol. 99, № 3-4. – P. 211–214. 157. Trends in incidence of brain and central nervous system tumors in Norway, 1970-1999 [Text] // [T.B. Johannesen E. Angell-Andersen, S. Tretli et al.] // Neuroepidemiology. – 2004. – Vol. 23, № 3. – P. 101–109. 158. Trends in reported incidence of primary malignant brain tumors in children in the United States [Техt] / M.A. Smith, B. Freidlin, L.A. Ries, R. Simon // J. Nat. Cancer. Inst. – 1998. – Vol. 90, № 17. – P. 1269–1277. 159. Werner, M.H. Increasing incidence of primary brain tumors in the elderly in Florida / M.H. Werner, S. Phuphanich, G.H. Lyman [Техt] // Cancer Control. – 1995. – Vol. 2, № 4. – Р.309–314. 153