ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №5 Лабораторная работа №3
advertisement

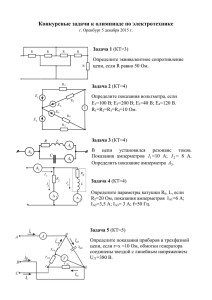
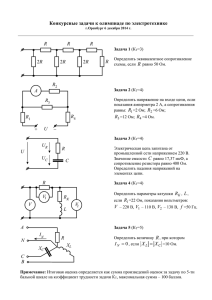
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №5 Лабораторная работа №3. Основные понятия о физико-химическом анализе Общая цель: Вам необходимо овладеть учебной программой данного занятия и научиться применять учебный материал в своей будущей профессии. Сделайте записи в рабочей тетради по плану: дата; номер занятия; тема занятия; цель занятия; основные вопросы темы. Учебные вопросы занятия: 1. Лабораторная работа №4. Основные понятия о физико-химическом анализе. Опыт 1. Построение градуировочной кривой по реперным веществам Опыт 2. Построение диаграммы плавкости солевой системы на примере K2Cr2O7–KNO3 визуально-политермическим методом Ваши действия при подготовке к занятию и отработке программы занятия При подготовке к данному занятию Повторите тему 3 «Равновесия кристаллы – жидкость в двухкомпонентных системах» (Модуль 3 – Фазовые равновесия и термодинамическое учение о растворах) рабочей учебной программы дисциплины «Физическая химия». Это очень важно, так как этот материал является базовой основой для получения новых знаний и на нем строится программа занятия. При отработке 1-го учебного вопроса обратите внимание на: методику выполнения лабораторной работы. Лабораторная работа №4. ОСНОВНЫЕ ПОНЯТИЯ О ФИЗИКО-ХИМИЧЕСКОМ АНАЛИЗЕ. ПОСТРОЕНИЕ ДИАГРАММЫ СОСТОЯНИЯ СОЛЕВОЙ СИСТЕМЫ МЕТОДОМ ВИЗУАЛЬНО-ПОЛИТЕРМИЧЕСКОГО АНАЛИЗА Цель и содержание. Ознакомиться с методом физико-химического анализа, провести анализ диаграмм состояния на основе экспериментальных данных. Теоретическое обоснование В отличие от препаративного метода исследования систем, при котором химические соединения (индивиды) выделяют в чистом виде и затем исследуют, физико-химический анализ изучает не отдельные химические индивиды, а комплексы равновесных фаз, не прибегая к их выделению. Физико-химический анализ позволяет установить состав и природу образующихся фаз и области их существования в зависимости от температуры, давления, концентраций и целого ряда других физических свойств взаимодействующих компонентов. Изучают самые разнообразные физические свойства: температуру фазовых превращений, микротвердость, электропроводность, электродвижущую силу, плотность, вязкость, показатель преломления, магнитную восприимчивость и т. д. Состав многокомпонентной системы может быть выражен различными способами. Обычно состав выражают в массовых или мольных процентах, в массовых или мольных долях, в некоторых случаях в атомах на см3. Термический анализ заключается в определении температур фазовых переходов на основании записи кривых нагревания или охлаждения исследуемых сплавов. Для проведения термического анализа применяют простые (1886, ЛеШателье), дифференциальные (1891, Р. Остен) и комбинированные термопары. В основе действия термопары лежит явление Зеебека, которое заключается в том, что, если нагреть спай разнородных металлов, температуру другого (холодного) оставить при фиксированной температуре, то в замкнутой цепи из этих проволок возникнет электродвижущая сила, которая называется термо-э.д.с. В настоящее время наиболее часто используется комбинированная термопара. Простая термопара помещается в исследуемое вещество (образец), а ветвь дифференциальной – в эталон. Эталон следует выбирать с учетом того, чтобы в исследуемом интервале температур в нем отсутствовали тепловые эффекты и по теплоемкости и теплопроводности он был близок к исследуемому веществу. В термическом анализе используют точно отградуированные установки, показания температуры которых соответствуют значениям международной температурной шкалы. Реперные вещества – это те вещества, которые легко могут быть получены в чистом виде и для которых известны и определены с высокой точностью температуры фазовых переходов. Визуально-политермический анализ – это одна из разновидностей термического анализа. Особенность этого метода заключается в том, что одновременно с построением кривых охлаждения ведется постоянное визуальное наблюдение за прозрачным расплавом системы в сосуде для термографирования. Эффекты фазовых превращений на кривых температура – время корректируют, наблюдая за изменениями, происходящими в системе, например, появлением кристаллов в расплаве или их исчезновением, изменением цвета и т.д. Недостатком визуально-политермического анализа является то, что он применим только к тем системам, которые дают прозрачные расплавы, а достоинство – простота исполнения и доступность оборудования. Аппаратура и материалы Сосуды Степанова, хромель-алюмелевая термопара, ЛАТР, печь, набор термометров (100– 5000С), реперные вещества по указанию преподавателя, K2Cr2O7, KNO3. Указания по технике безопасности При выполнении работы запрещается включать лабораторные установки в отсутствие преподавателя. Все приборы, входящие в состав лабораторной установки, должны быть заземлены, все электрические соединения надежно изолированы. Избегать соприкосновения с разогретыми до высоких температур частями установки. Соблюдать меры предосторожности при работе со стеклом. Методика и порядок выполнения работы Работа состоит из двух опытов. Студенты работают парами и выполняют один опыт по указанию преподавателя в рамках данной темы. Опыт 1. Построение градуировочной кривой по реперным веществам. Проведите градуировку установки по реперным веществам. Используйте в качестве реперных веществ Н2О, Sn, Pb, Zn. H2O ….. tкип. ….. 100 0С Sn ….. tпл. ….. 232 0С Pb ….. tпл. ….. 327 0С Zn ….. tпл. ….. 419 0С Термопару поместите в сосуд Степанова так, чтобы спаренный конец термопары в защитном чехле находился в расплаве при плавлении. При необходимости сосуд Степанова вакуумируется и отпаивается. Через 10–15 секунд записывайте показания милливольтметра в процессе нагревания или охлаждения. По полученным данным постройте кривую нагревания или охлаждения в координатах: показания милливольтметра – время. Горизонтальная площадка на кривой (когда показания милливольтметра со временем не изменяются) соответствует известной температуре фазового превращения (например, температуре плавления металла). Зная температуры фазовых переходов для реперных веществ и соответствующие им показания милливольтметра, постройте реперную или градуировучную кривую для Вашей установки. На оси абсцисс отметьте показания милливольтметра, а на оси ординат соответствующие температуры фазовых превращений. Пользуясь калибровочной кривой и данной термопарой с милливольтметром, можно измерить любую температуру в изучаемом интервале температур. Для измерения ЭДС термопары в лабораторной практике используют прибор ПП-63. При его применении необходимо проводить контроль нуля и соблюдать полярность термопар при подключении к прибору. Контрольные вопросы и защита опыта 1 1. Что такое физико-химический анализ? 2. В чем заключается особенность термического анализа? 3. Что такое реперные вещества? 4. Как с использованием реперных веществ можно построить градуировочную кривую? Опыт 2. Построение диаграммы плавкости солевой системы на примере K2Cr2O7–KNO3 визуально-политермическим методом. Опыт по построению диаграммы плавкости системы K2Cr2O7–KNO3 визуальнополитермическим методом выполните по парам, каждая пара изучит 3–4 состава. Используйте навески массой 2 – 2,5 г, отвечающие заданному составу изучаемой системы. Рассчитанное количество K2Cr2O7 и KNO3 тщательно разотрите в ступке и поместите в сосуд Степанова. Подготовленный сосуд Степанова поместите в установку, состоящую из печи сопротивления со сквозным отверстием для визуального наблюдения и подсветкой. Напряжение на печь сопротивления подается через ЛАТР и равно 50–70 В. Термопару вставьте через трубку 2 таким образом, чтобы королек горячего спая доходил до конца чехла для термопары. Подключив через ЛАТР печь, наблюдайте за плавлением соли через смотровое окошечко. Когда смесь расплавится, выключите печь и записывайте показания милливольтметра (ПП-63) от времени, параллельно строя на миллиметровке кривую охлаждения. Одновременно зафиксируйте показания милливольтметра, когда из расплава появятся первые кристаллы. Через некоторое время вновь включите печь и, записывая показания ПП-63 от времени, постройте кривую нагревания, следя за тем, когда исчезнут последние кристаллики, зафиксируйте соответствующие показания милливольтметра. Эти опыты повторяйте до тех пор, пока температуры исчезновения последних кристаллов при нагревании и появления первых при охлаждении будут близки (допустимая разница 1–2 °С). Полученные данные каждой пары, а также результаты других пар студентов занесите в таблицу и постройте по совокупности данных диаграмму плавкости системы K2Cr2O7 – KNO3. Таблица 1 – Экспериментальные результаты № п/п Экв. % Экв. % Температура, 0С Фазовый состав KNO3 K2Cr2O7 Начало/конец Плавление кристаллизации эвтектики 1 100 0 333 2 3 4 5 6 7 8 9 10 0 100 398 Контрольные вопросы и защита опыта 2 1. Что такое физико-химический анализ? 2. В чем заключается особенность термического анализа? 3. На чем основан визуально-политермический анализ? 4. Как методом визуально-политермического анализа построить диаграмму плавкости бинарной системы? Рекомендуемая литература: Список основной литературы: 1. Беляев, А. П. Физическая и коллоидная химия [Текст] : учеб.для студ. вузов / А. П. Беляев, В. И. Кучук ; под ред. А. П. Беляева. - 2-е изд., перераб. и доп. - М. : ГЭОТАР-Медиа, 2012. - 752 с. 2. Разделы физической химии. лабораторные работы и тесты: уч.по. – Ставрополь:СтГМА, 2008.-120с. 3. Кудряшева, Н. С. Физическая химия : [базовый курс] : учебник для бакалавров / Н.С. Кудряшева, Л.Г. Бондарева ; Сиб. федер. ун-т. – Москва :Юрайт, 2012. – 340 с. 4. Горшков, В. И. Основы физической химии : учебник / В. И. Горшков, И. А. Кузнецов. – 3-е изд. – Москва : БИНОМ. Лаборатория знаний, 2009. – 407 с. Дополнительная литература: 1. Задачи по физической химии : учеб.пособие для студентов вузов / В.В. Еремин, С.И. Каргов, И.А. Успенская [и др.]. – Москва : Экзамен, 2005. 2. Основы физической химии : теория и задачи : учеб. пособие для вузов / [Еремин В. В. и др.] ; Мос.гос. ун-т им. М. В. Ломоносова. – М. : Издательство "Экзамен", 2005. – 478 с. 3. Стромберг, А. Г. Физическая химия : учебник для вузов / А. Г. Стромберг, Д. П. Семченко ; под ред. А. Г. Стромберга. – Изд. 4-е испр. – М. : Высшая школа, 2001. – 527 с. 4. Бокштейн, Б. С. Краткий курс физической химии : учеб.пособие для вузов / Б. С. Бокштейн, М. И. Менделеев. – Изд. 2-е., испр. – М. :ЧеРо, 2001. – 232 с.