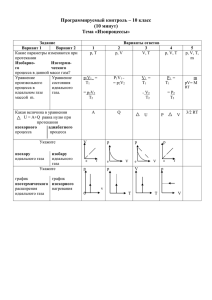
Проект урока Физика 10 класс Тема: Уравнения состояния
advertisement

Проект урока Физика 10 класс Тема: Уравнения состояния идеального газа 1. Тип урока. Изучение нового материала и первичного закрепления знаний 2. Цели урока. Создать условия для вывода, осознания и осмысления уравнения состояния идеального газа 3. Личностные результаты обучающихся: •формирование познавательных интересов, интеллектуальных и творческих способностей учащихся; •самостоятельность в приобретении новых знаний и практических умений; •формирование умений воспринимать, перерабатывать и предъявлять информацию в словесной, образной, символической формах, анализировать и перерабатывать полученную информацию в соответствии с поставленными задачами, выделять основное содержание прочитанного текста, находить в нем ответы на поставленные вопросы и излагать его; •формирование умений работать в группе, представлять и отстаивать свои взгляды и убеждения, вести дискуссию Метапредметные результаты: •овладение навыками самостоятельного приобретения новых знаний; •организации учебной деятельности, постановки целей, планирования, самоконтроля и оценки результатов своей деятельности, умениями предвидеть возможные результаты своих действий; •формирование убеждения в закономерной связи и познаваемости явлений природы, в объективности научного знания, в высокой ценности науки в развитии материальной и духовной культуры людей; •развитие теоретического мышления на основе формирования умений устанавливать факты, различать причины и следствия Предметные результаты: Обучающиеся должны знать: •уравнение, связывающее три макропараметра: P, V, T, - описывающих состояние данной массы идеального газа, называемое уравнением состояния идеального газа. Уравнение состояния записывается в двух формах: уравнение Клапейрона-Менделеева PV = mRT/M (для произвольной массы газа), уравнение Клапейрона PV/T = const (для постоянной массы газа) •Величина R в первом уравнении называется универсальной газовой постоянной R = kNA = 8,31 Дж/ моль* K. Физический смысл R - объем одного моля любого газа при нормальных условиях. •Количественные зависимости между двумя параметрами при постоянном третьем называются газовыми законами Обучающиеся должны уметь: •выводить уравнение состояния идеального газа; •распознавать уравнения состояния идеального газа; уравнения состояния произвольной массы газа; уравнения состояния идеального газа постоянной массы; •распознавать записи соответствующие понятию газовый закон • применять теоретические знания по физике на практике, решать физические задачи по теме «Уравнения состояния идеального газа и газовые законы» Ход урока. № Этапы урока и их содержание Цели этапа Деятельность учителя I Организационный этап. Цели: I. Приветствие обучающихся. II. Три пути ведут к знанию: III. Путь размышления – это путь самый благородный, IV. Путь подражания – это путь самый легкий, -создание позитивного эмоционально го настроя учеников на урок V. И путь опыта – это путь самый горький. VI. обучаюащи хся Организацио Сообщают об нная отсутствую щих. Конфуций (древний мыслитель и философ Китая) Сегодня на уроке нам предстоит пройти эти три пути. У каждого из Вас на столе есть рабочий лист. Прошу Вас заполнять данный лист по мере продвижения по этапам. Предлагаю Вас оценить Ваше настроение в начале пути, отметив смайлик, близкий Вашему состоянию. Итак, нас ждет первый путь – путь размышления. II Целеполагание и мотивация. Цели: -создание условий через проблемную ситуацию для возникновени я у учеников внутренней Ученик: Самый простой способ использовать потребности барометр – прибор для измерения атмосферного включения в давления. учебную Педагог: А если нет барометра, если у нас под рукой деятельность; только линейка и термометр. -наметить Проблемная ситуация. Важную роль в нормальной жизнедеятельности многих людей играет атмосферное давление. Какие способы измерения или вычисления атмосферного давления, например, в нашем кабинете вы можете предложить? Предложите способ определения атмосферного давления в нашем кабинете с помощью линейки и термометра (Время на обдумывание – 3 мин) (В ходе беседы подвести школьников к необходимости установить зависимость между давлением, объемом и температурой) Ученик: Термометром можно измерить температуру, шаги учебной деятельности. Эвристическ ая беседа с учениками. Совместный с учениками анализ предложени й учеников, подвести учеников к необходимо сти установить зависимость между давлением, объемом и температуро й. Обсуждение в малых группах. Высказыван ие предложени й учениками по вычислению давления в кабинете. линейкой измерить размеры комнаты и вычислить объем. А как установить зависимость между давлением, объемом и температурой? Педагог. Для вычисления атмосферного давления в нашем кабинете мы пришли к необходимости установить зависимость между давлением, объемом и температурой. Какова основная учебная (познавательная) задача урока? Ученики: Вывести физический закон, устанавливающий зависимость между тремя макроскопическими параметрами — p, V, T. Педагог. Уравнение, определяющее связь температуры, объема и давления тел, называется уравнением состояния. В некоторых случаях вместо объема в уравнение состояния входит плотность. Для чего нужно уравнение состояния? Знать уравнение состояния необходимо при исследовании тепловых явлений. Оно позволяет полностью или частично ответить на три группы различных вопросов: 1) Уравнение состояния позволяет определить одну величин, характеризующих состояние, например, температуру, если известны две другие величины. Это используется в термометрах. 2) Зная уравнение состояния можно сказать, как протекают процессы при определенных внешних условиях: например, как будет меняться давление газа, если увеличить его объем при неизменной температуре. 3) Зная уравнение состояние, можно определить, как меняется состояние системы, если она совершает работу, или получает теплоту от окружающих тел. Для идеального газа уравнение состояния было установлено французским физиком Клапейроном , а для произвольной массы газа уравнение Клапейрона было обобщено Менделеевым; уравнение состояния называют еще уравнением Менделеева-Клапейрона. Любая реальная система – газ, жидкость, твердое тело - характеризуется своим уравнением состояния. Но только эти уравнения намного сложнее, чем уравнение Менделеева-Клапейрона Учитель дает определение уравнения состояния тел. Рассказывае т, для чего нужно уравнение состояния тел. В ходе беседы высказываю т необходимо сть установить зависимость между давлением, объемом и температуро й. Заполнение рабочих листов для идеального (достаточно разреженного) газа. Подводит школьников к формулиров ке темы урока, задачи урока Педагог: Итак, какова тема сегодняшнего урока: Ученики: Уравнение состояния идеального газа. Педагог: Какова основная познавательная задача? Ученики: Вывести физический закон, устанавливающий зависимость между тремя макроскопическими параметрами — p, V, T идеального газа. Педагог: Составим план наших действий. Урок мы начали с определения очень важного макропараметра – давления. Формулиру ют тему урока, основную задачу урока. Записывают в рабочие тетради. III Актуализация. Цели: -организовать актуализацию знаний 2. Сформулируйте зависимость давления идеального учеников для вывода газа от концентрации и температуры? (p=nkT, уравнения давление прямо пропорционально температуре). состояния 3. Что называется концентрацией? ( Концентрация – идеального газа это число молекул в единице объема n = N/V). 1. От чего зависит давление газа? (давление зависит от концентрации молекул газа и температуры) Фронтальна я беседа с учениками, в ходе которой учитель с учениками определяют план действий. Ученики актуализиру ют знания по теме, совершают мыслительн ую деятельност ь по составлению плана вывода 4 Выразите число молекул N через микропараметры (N = mNA /M) 3. Какую физическую величину называют постоянной Авогадро? - уточнить следующий шаг учебной деятельности. уравнения состояния идеального газа. (NА = 6, 02 * 1023 моль-1 число атомов в 1 моле любого вещества) 4. Каков физический смысл постоянной Больцмана? Чему она равна? (Постянная Больцмана связывает температуру Θ в энергетических единицах с температурой Т в Кельвинах. k = 1,38 * 10-23Дж/K) Педагог: Подумайте, каким образом можно связать три последних выражения, которые содержат интересующие нас макропараметры P, V, T? IV Ученики: Подставить выражение для концентрации и числа молекул в уравнение P = nkT. Следующий путь - путь подражания – это путь самый легкий. Учитель консультиру ет, помогает, тем, кто испытывает затруднения Первичное усвоение материала. Итак, мы вспомнили все необходимое, наметили план решения нашей учебной задачи. Учебная задача. Вывести физический закон, устанавливающий зависимость между тремя макроскопическими параметрами — p, V, T. Индивидуал ьная работа с учебником: 1)изучают самостоятел ьно новый материал. 2) Фиксируют выполнение плана работы в рабочей тетради. Предлагаю вам самостоятельно вывести уравнение состояния идеального газа. Работа с учебником §68. План работы: 1.Вывести уравнение состояния идеального газа Менделеева-Клапейрона Заполнение рабочих листов 2.Ввести универсальную газовую постоянную R. Выяснить физический смысл универсальной газовой постоянной R. 3. Вывести связь между давлением, объемом и температурой идеального газа в двух любых состояниях – уравнение Клапейрона. Осознание и осмысление учебной информации. Цели: Задание для обучающихся: -создать условия для Учитель Работа в консультиру парах: ет, помогает, обсуждение 1.Выделите уравнения, соответствующие понятию «Уравнение состояние идеального газа» 1) P1V1/T1 = P2V2/T2 = P3V3/T3; mRT1/M; 3) p = m0nv2/3; 2) P1V1 = 4) Е = 3kT/2; 6) V1/T1 = V2/T2 при 5) p = nkT; осознания и осмысления учебной информации. По выполнению заданий можно судить о степени понимания и сознания учебной информации P = const m = const 7) ) P1/T1 = P2/T2 при V= const mRT/M тем, кто испытывает затруднения заданий Самопровер ка по ключу. Обсуждение ответов учеников. Заполнение рабочих листов 8) P = m = const 2.Среди уравнений, которые вы отнесли к уравнению состояния идеального газа, укажите уравнения, записанные для: а) произвольной массы газа; б) постоянной (данной) массы газа. Уравнения состояния для произвольной массы газа Уравнение состояния для данной массы газа Беседа с обучающимися по вопросам: 1. Какие величины характеризуют состояние газа? (Макропараметры p, V, T) 2. Чем отличается уравнение состояния газа от уравнения Менделеева - Клапейрона? Какое из них полнее по содержанию? Почему? (Уравнение состояния идеального газа для постоянной массы газа. Уравнение Менделеева – Клапейрона для переменной массы газа) 3. Чему равна универсальная газовая постоянная в СИ? (R=NAk= 8,31Дж/ моль·К – универсальная газовая постоянная) 4. Дополнительная задача. Для постоянной массы идеального газа отношение произведения давления на объем к данной температуре есть величина постоянная. Вычислите отношение произведения давления на объем к данной температуре, если газ находиться при нормальных условиях, полагая что моль газа находиться при нормальных условиях: атмосферное давление p0=1,013·105 Па, температура t= 0°С, или Т0=273,15К, молярный объем V0= 22,41·10-3м3/моль) Решение: p0V0/T0=8,31 Дж/(моль·К) R=8,31 Дж/(моль·К) – универсальная газовая постоянная – объем одного моля любого газа при нормальных условиях. В этом состоит физический смысл универсальной газовой постоянной И путь опыта – это путь самый горький. Первичное закрепление учебного материала. 2. Работа с ЭОР. Уравнение состояния идеального газа (П) Уравнение состояния идеального газа Тест включает 10 интерактивных тестовых заданий с возможностью автоматизированной проверки для аттестации по теме "Уравнение состояния идеального газа" для старшей школы. ООО «Физикон» Физикон http://www.physicon.ru Перед проведением теста познакомить обучающихся с системой оценивания. Максимальное количество очков за задание зависит от его типа и сложности. Количество очков, которое получит обучающийся, также зависит от числа от количества числа попыток ввести ответ; так, если вы правильно ответили только со второго раза, то количество очков уменьшится в 1,5 – 2 раза (в зависимости от типа задания). Оценку по пятибалльной системе можно выставить по следующему принципу: «5» ставится, если тестовый балл превышает 80 %; «4» ставится, если тестовый балл находится в промежутке от 60 % до 80 %; «3» ставится, если тестовый балл находится в промежутке от 40 % до 60 %; Цель: проверить уровень усвоения учебного материала. Учитель консультиру ет, помогает, тем, кто испытывает затруднения Индивидуал ьная работа за ПК с ЭОР. Запись решения задач в рабочей тетради Заполнение рабочих листов «2» ставится, если тестовый балл находится в промежутке менее 40 %. Самооценка по журналу успеваемости ОМС V Информация о домашнем задании. § 68 Стр.189 Пример 1, 2 решения задач (конспект) Упр. 13 (4, 5, 6) Доп.задание: 1.Изложите в форме эссе своё мнение взаимосвязи между величинами уравнения состояния идеального газа и его практического применения. Учитель комментиру ет домашнее задание, отвечает на вопросы Записывают домашнее задание в дневник, задают вопросы Контролиру ет грамотность рассуждений Работа в малых группах, представлен ие результатов обсуждения, записывают ключевые моменты в тетрадь 2. Подготовьте сообщение о великом русском ученом Д.И. Менделееве и его вкладе в развитие МКТ. VI 3. Подготовьте сообщение о Клапейроне. Анализ деятельности 1. Раскройте особенности зависимостей между величинами, входящими в уравнение состояния идеального газа 2. Составьте перечень основных свойств физических величин, характеризующих состояние идеального газа с точки зрения молекулярно-кинетической теории Оценка деятельности 3.Обоснуйте важность понимания уравнения состояния идеального газа как ключевого понятия молекулярно-кинетической теории газов 4. Оцените практическую значимость уравнения состояния идеального газа. Заполнение листов самоконтрол я. Вернемся к проблемной ситуации. Сейчас вы можете предложить способ вычисления давления в нашем кабинете? Предложите!!! VI I Рефлексия (подведение итогов урока) 3. Какие понятия вы сегодня повторили? 4. С какими новыми понятиями вы познакомились? Возвращение к эпиграфу урока. Согласны ли с Вы с высказыванием Конфуция? Какой путь для Вас был самым легким, самым трудным? Оцените Ваше настроение в начале и в конце Заполнение листов самоконтрол я урока с помощью смайликов.