Диссертация Зейналова П. А. - Российский онкологический
advertisement

Федеральное Государственное бюджетное научное учреждение «Российский Онкологический научный центр имени Н.Н. Блохина» На правах рукописи Зейналова Первин Айдын кызы ДИАГНОСТИЧЕСКАЯ И ПРОГНОСТИЧЕСКАЯ РОЛЬ АКТИВАЦИОННЫХ АНТИГЕНОВ ОПУХОЛЕВЫХ КЛЕТОК ПРИ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЕ Диссертация на соискание ученой степени доктора медицинских наук 14.01.12 - онкология Научный консультант: Академик РАН М.И.Давыдов Москва 2015 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ……………………………………………………………………………....4 ГЛАВА I. ОБЗОР ЛИТЕРАТУРЫ. БИОЛОГИЧЕСКАЯ И КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ.......10 ГЛАВА II. ХАРАКТЕРИСТИКА БОЛЬНЫХ И МЕТОДЫ ИССЛЕДОВАНИЯ.….40 ГЛАВА III. РОЛЬ КЛИНИЧЕСКИХ И ЛАБОРАТОРНЫХ ПРИЗНАКОВ В ПРОГНОЗЕ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ........………...48 ГЛАВА IV. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ПОКАЗАТЕЛЕЙ ГЕМОПОЭЗА В У БОЛЬНЫХ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМОЙ.....………….67 ГЛАВА V. ИММУНОФЕНОТИП ДИФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ……………………………………………………………………….….. 87 ГЛАВА VI. ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ……..……..……..167 ВЫВОДЫ………….……………………………………………………………..……194 СПИСОК ЛИТЕРАТУРЫ………………….…………………………………………198 ВВЕДЕНИЕ Актуальность темы исследования. В структуре лимфом у взрослых первое место занимает диффузная Вкрупноклеточная лимфома (ДВКЛ). Это высокоагрессивная лимфома, частота которой составляет до 40% среди неходжкинских злокачественных лимфом. Несмотря на то, что ДВКЛ относится к лимфомам высокой степени злокачественности, она считается потенциально излечимой использованием полихимиотерапии. Внедрение в клиничекую практику лечения ДВКЛ моноклональных антител (препарат ритуксимаб) к антигену CD20 существенно улучшило выживаемость (Coiffier B., 2007). Несмотря на успехи, достигнутые в лечении ДВКЛ за счет внедрения ритуксимаба, стандартом лечения на сегодняшний день является программа CHOP (с ритуксимабом – R-CHOP). Главными факторами прогноза остаются клинические признаки (международный прогностический индекс, IPI), разработанные ещё 20 лет назад, и результаты лечения в целом нельзя назвать удовлетворительными. Важно то, что интенсификация программ терапии не привела к улучшению результатов лечения. На рубеже 2000-х годов в диагностике ДВКЛ наметился существенный прорыв. Он связан с внедрением в диагностическую практику высокотехнологичного метода оценки профилей генной экспрессии (GEP). Внедрение этого метода позволило установить, что ДВКЛ в действительности представляет собой 2 заболевания. Вариант, при котором опухолевые клетки биологически близки В-клеткам зародышевых центров фолликулов лимфатических узлов, носит название GCB-тип. При другом варианте болезни злокачественные клетки ДВКЛ по профилям генной экспрессии соответствуют активированным Влимфоцитам крови, то есть В-лимфоцитам пост-фолликулярных этапов дифференцировки (АВС-тип). Уже в первой работе Alizadeh A.A. et al. (2000) была показана различная чувствительность данных вариантов к проводимому лечению и различный прогноз заболевания. Это было неоднократно подтверждено в последующих работах (Dunleavy K. et al., 2009; Hernandez-Ilizaliturri F.J. et al., 2011). Маркеры CD10, BCL6, IRF4, LMO2, GCET1 и FOXP1 экспрессированы на клетках ДВКЛ вариабельно, их комбинации представляют собой основу алгоритмов иммуногистохимического воспроизведения GEP (Meyer P.N. et al., 2011; Choi W.W. et al., 2009; Hans C.P. et al., 2003). Вместе с тем, единства относительно возможности использования GEP и иммуногистохимических суррогатных маркеров GEP в научной медицинской среде не существует, и на сегодняшний день они не рекомендованы к клиническому использованию для диагностики вариантов ДВКЛ и принятия лечебных решений (Ghelmini M. et al., 2013). Диффузная В-крупноклеточная лимфома любого подтипа (GCB, ABC) происходит из периферических активированных В-клеток. Однако маркеры активации, присутствующие постгерминальных этапов на клетках активации светлых центров и периферических на клетках В-лимфоцитов, систематизировано не изучались. Являясь геопоэтической опухолью, ДВКЛ достаточно часто поражает костный мозг. Однако детального изучения гемопоэза при ДВКЛ не проводилось. Исследование активационного иммунофенотипа ДВКЛ, опухолевого микроокружения, а также состояния гемопоэза при диффузной В-крупноклеточной лимфоме представляют актуальную задачу. Её решение будет способствовать более глубокому пониманию механизмов активации опухолевых клеток и состояния интратуморального иммунитета, а также нарушений в системе кроветворения, таргетное воздействие на которые может помочь в разработке патогенетических подходов лечения ДВКЛ. ЦЕЛЬЮ нашей работы явилось комплексное изучение диагностической и прогностической роли экспрессии активационных антигенов опухолевых клеток при диффузной В-крупноклеточной лимфоме. Задачи исследования: 1. Изучить прогностическую роль клинических и лабораторных факторов прогноза (IPI) в условиях современного лечения ДВКЛ. 2. Охарактеризовать состояние гемопоэза у больных ДВКЛ. 3. Изучить роль изменений кроветворения в прогнозе ДВКЛ. 4. Оценить значение мембранных и цитоплазматических обще-В-клеточных маркеров в диагностике ДВКЛ и разработке показаний к лечению ритуксимабом. 5. Изучить роль экспрессии молекул HLA-DR при ДВКЛ (диагностика, связь с иммунофенотипом и микроокружением, влияние на гемопоэз, клиника и прогноз). 6. Изучить роль экспрессии молекул CD38 при ДВКЛ (диагностика, связь с иммунофенотипом и микроокружением, влияние на гемопоэз, клиника и прогноз). 7. Изучить роль экспрессии общелейкоцитарного антигена CD45 при ДВКЛ (диагностика, связь с иммунофенотипом и микроокружением, влияние на гемопоэз, клиника и прогноз). 8. Изучить роль экспрессии рецепторов CR2 (CD21) и FcεRII (CD23) на клетках ДВКЛ (диагностика, связь с иммунофенотипом и микроокружением, влияние на гемопоэз, клиника и прогноз). 9. Изучить роль экспрессии антигена CD10 при ДВКЛ (диагностика, связь с иммунофенотипом и микроокружением, влияние на гемопоэз, клиника и прогноз). 10. Изучить роль экспрессии антигена Ki-1 (CD30) при ДВКЛ (диагностика, связь с иммунофенотипом и микроокружением, влияние на гемопоэз, клиника и прогноз). 11. Оценить роль клеточного состава (Т-клетки, плазмоциты, макрофаги, фолликулярные дендритные клетки двух субпопуляций) микроокружения при ДВКЛ (диагностика, связь с иммунофенотипом и микроокружением, влияние на гемопоэз, клиника и прогноз). Научная новизна. На большом клиническом материале (338 больных диффузной В- крупноклеточной лимфомой) проведено изучение роли клинических факторов прогноза (IPI) и установлено, что ведущим из них в прогнозе в условиях современного лечения является стадия заболевания, другие факторы IPI либо тесно ассоциированы со стадией (ECOG, наличие более одного очага экстранодального поражения), либо утратили свое прогностическое значение (возраст больных, уровень ЛДГ в сыворотке крови). Впервые показано, что В-линейная природа ДВКЛ в 100% случаев подтверждается обнаружением цитоплазматической детерминанты антигена CD20 (L26), однако, экспрессия CD19 и мембранных CD20 может быть слабой и в редких случаях отрицательной, что высоко коррелирует (p<0,001) с утратой экспрессии общелейкоцитарного антигена CD45. Характерными особенностями гемопоэза у больных ДВКЛ являются увеличение процента бластов в миелограмме и изменения эритробластограммы (снижение базофильных и полихроматофильных нормобластов, увеличение процента оксифильных форм с повышением индекса созревания эритрокариоцитов в 86% случаев). Нарушения гемопоэза у больных ДВКЛ имеют прогностическое значение: повышение бластных клеток (>=1%) ухудшает общую выживаемость больных (р=0,048); задержка созревания клеток гранулоцитарного ряда с увеличением числа нейтрофильных миелоцитов или снижением процента сегментоядерных нейтрофилов также ухудшают прогноз (р=0,008 и р= 0,003). Снижение показателей общей выживаемости наблюдается при увеличении процента оксифильных нормобластов в миелограмме. HLA-DR-негативный вариант ДВКЛ составляет 9,3% случаев (32 из 331), характеризуется благоприятным прогнозом, крайней редкостью (2,8%) двух и более экстранодальных локализаций. Опухоль не имеет иных специфических иммунофенотипических признаков, характеризуется сниженной Т-клеточной инфильтрацией, достоверно более редким снижением нейтрофильных метамиелоцитов. Экспрессия CD38 наблюдается в 55,9% (184 из 329) и не влияет на прогноз ДВКЛ. Иммунобиологические особенности CD38-позитивных ДВКЛ состоят в более выраженной интратуморальной инфильтрации клетками опухолевого микроокружения (макрофагами, плазмоцитами, зрелыми Т-лимфоцитами), чаще присутствуют CD23+ ФДК. Опухоль характеризуется спецификой иммунофенотипа (CD21, CD23), связью с гемопоэзом (сегментоядерные нейтрофилы, плазмоциты), более низкими уровнями ЛДГ. К редким вариантам относится CD45-негативная ДВКЛ – 3,9% (13 из 332). Опухоль наблюдается при III, IV стадиях и характеризуется чертами иммунологической анаплазии: снижением CD19, CD20 (p<0,001), экспрессией в 55,6% случаев антигена Ki-1 CD30. Экспрессия рецепторов CD21 и CD23 высоко коррелирует между собой и наблюдается в 12,4% (33 из 266) и 12,0% (39 из 326) ДВКЛ, соответственно. Эти две группы ДВКЛ совершенно различны. CD21-позитивные лимфомы в сравнении с CD21-негативными чаще наблюдаются у женщин (р=0,046) и характеризуются частым отсутствием признаков неблагоприятного прогноза. Установлена достоверная связь экспрессии CD21 с уровнями промиелоцитов и лимфоцитов в костном мозге. В CD21+ группе ДВКЛ не наблюдали CD30-позитивных случаев (р=0,098). CD23+ ДВКЛ характеризуются неблагоприятным прогнозом (р=0,029) и наблюдается у лиц более молодого возраста (р=0,002), вдвое чаще повышены уровни сегментоядерных нейтрофилов в костном мозге. Отмечена корреляция экспрессии CD23 с CD38 на опухолевых клетках, высокая частота выраженных интратуморальных Т-клеточных реакций при CD23+ иммунофенотипе. Впервые установлено, что особую группу ДВКЛ представляют CD30позитивные случаи (23,9% - 21 из 88), характеризующиеся хорошим прогнозом (все больные живы, срок наблюдения до 110 мес), р=0,02. Установлены связь с эритропоэзом (отсутствие повышения оксифильных нормобластов) в миелограмме и отсутствие выраженных реакций плазмоцитов в опухолевом микроокружении. Убедительно доказано, что из числа клеток микроокружения (макрофагов – CD163+, плазмоцитов – CD38++, фолликулярных дендритных клеток двух субпопуляций –CD21+, CD23+ и Т-лимфоцитов – CD3, CD5, CD7) наиболее клинически важными являются Т-лимфоциты. Наличие Т-клеточной интратуморальной иммунной реакции (CD7) характеризует группу ДВКЛ с благоприятным прогнозом (р=0,021) по выживаемости и отсутствию двух и более экстранодальных локализаций. Т-клеточная инфильтрация связана с активационными маркерами опухоли, наличием фолликулярных дендритных клеток и макрофагов микроокружения. Научно-практическая значимость. В работе убедительно показано, что основными направлениями совершенствования результатов лечения ДВКЛ являются ранняя диагностика и повышение частоты достижения рмиссий при проведении программного лечения ДВКЛ. Ритуксимаб улучшает результаты лечения ДВКЛ за счет повышения частоты полных ремиссий у больных на 11,6%, достоверно повышает 8-летнюю общую выживаемость больных (р=0,047) и может быть рекомендован к включению в схемы программного лечения больных ДВКЛ. Исследование иммунофенотипа клеток ДВКЛ на свежезамороженных (криостатных) срезах опухолевой ткани существенно расширяет возможности рутинной иммуногистохимии за счет изучения маркеров активации (HLA-DR, CD38), пан-В-клеточных антигенов (CD19, мембранные CD20), пан-Т-клеточных (CD7) в дополнение к стандартно используемым CD45, CD20 (L26), CD163, CD30, CD3, CD5, CD10, CD23, CD21. Это позволяет диагностировать редкие варианты лимфом, оценивать особенности иммунофенотипа во взаимосвязи с клетками микроокружения опухоли. Отсутствие мембранной экспрессии CD20 по нашим наблюдениям встречается в 1,5% случаев ДВКЛ (4 из 272 больных) и должно учитываться при назначении препарата Ритуксимаб (моноклональные антитела к мембранной детерминанте антигена CD20). Работа на основе обширных иммунологических, гематологических и клинических исследований позволила рекомендовать внедрение в клинику дифференцированного подхода к лечению больных ДВКЛ: не нуждаются в интенсификации лечения больные с прогностически благоприятными иммуноподвариантами ДВКЛ (HLA-DR-негативный, CD30-позитивный, CD45-негативный, случаи с наличием Т-клеточной инфильтрации); нуждаются в интенсификации лечения прогностически неблагоприятные варианты (CD10-позитивный, CD23-позитивный); отдельного патогенетического подхода к коррекции заслуживают прогностически значимые нарушения гемопоэза при ДВКЛ и роль экспрессии CD38 в индукции микроокружения. ГЛАВА I. ОБЗОР ЛИТЕРАТУРЫ. БИОЛОГИЧЕСКАЯ И КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ. Общие положения. Диффузная В-крупноклеточная лимфома (ДВКЛ) является самым частым вариантом лимфом у взрослых. Она составляет 25-30% неходжкинских лимфом в западных странах и встречается с еще большей частотой в восточных странах. Применение современных иммунохимиотерапевтических протоколов позволяет излечивать более половины больных ДВКЛ (Sehn L.H. et al., 2007). Эта нозологическая единица, в действительности, является гетерогенной и может быть подразделена на клинически и биологически различающиеся подгруппы, причем даже в предеах этих подгрупп отмечается выраженная гетерогенность по молекулярным маркерам и течению заболевания (Perry A.M. et al., 2012). Существует множество В-клеточных лимфом, представленных крупными клетками. К их числу относятся первичная медиастинальная (тимическая) Вкрупноклеточная лимфома, внутрисосудистая В-крупноклеточная лимфома, ДВКЛ, ассоциированная с хроническим воспалением, лимфоматоидный гранулематоз, ALK-позитивная В-крупноклеточная лимфома, плазмобластная лимфома, ДВКЛ, возникающая при HHV8-ассоциированной мультицентрической болезни Кастльмана, первичная лимфома серозных полостей. Выделяют подтипы ДВКЛ: ДВКЛ, богатая Т-клетками и гистиоцитами, первичная ДВКЛ ЦНС, первичная кожная ДВКЛ нижних конечностей (leg-type), EBV-позитивная ДВКЛ пожилых. Описаны пограничные случаи неклассифицированной В-клеточной лимфомы с признаками, промежуточными между ДВКЛ и лимфомой Беркитта или ДВКЛ и классической лимфомой Ходжкина. Несмотря на многообразие вариантов ДВКЛ, преобладающее число случаев не удается соотнести ни с одним из них. Эту группу ДВКЛ чаще упрощенно называют ДВКЛ, иначе не специфицированная (дословный перевод с английского “not otherwise specified”). На наш взгляд, более правильно было бы называть эту группу лимфом «ДВКЛ, не оговоренная ни в одной из рубрик классификации ВОЗ», т.е. ДВКЛ, не подходящая ни под один из разделов, перечисленных нами выше (обозначим сокращенно как нДВКЛ). Существуют различные подходы к выделению вариантов нДВКЛ. Морфологически нДВКЛ разделяют на центробластную, иммунобластную и анапластическую. На основании молекулярных исследований выделят GCB-тип (сходство с клетками активированными зародышевых В-клетками). центров) и ABC-тип Иммуногистохимическими (сходство методами с также выделяют GCB-тип и субтип, непохожий на клетки зародышевых центров (nonGCB), а также редкий CD5-позитивный подтип ДВКЛ. Многообразие терминологических обозначений, тем не менее, отчетливо демонстрирует стремление подразделить нДВКЛ на 2 группы - подтип, имеющий сходство с клетками зародышевых центров (GCB), и подтип, не имеющий подобного сходства (non-GCB). Использование наименования «АВС» (активированные В-клетки) на наш взгляд является не совсем точным и нуждается в конкретизации, так как клетки зародышевых центров – это тоже активированные В-клетки вторичных иммунных ответов). Очевидно одно: ДВКЛ - это очень крупная, весьма гетерогенная по своему клиническому течению и ответу на терапию группа лимфом, и выделение подтипов в пределах нДВКЛ с точки зрения индивидуализации лечения и улучшения его результатов является насущной задачей онкогематологии. Диагностика, лечение и прогноз ДВКЛ. Диагностика ДВКЛ проводится по биопсийному материалу опухолевой ткани морфологически и иммуногистохимическим методомами. Главным является подтверждение В-клеточной природы опухоли, что необходимо для назначения лечебного препарата Ритуксимаб (моноклональные антитела к антигену CD20). Иммуногистохимическая диагностика диффузной В-крупноклеточной лимфомы в настоящее время хотя и является комплексной, но в то же время чрезвычайно упрощена. Комплексность диагностики включает, в первую очередь, разграничение герминального и АВС-типов. Упрощение состоит в том, что на практике зачастую при морфологический картине диффузной крупноклеточной лимфомы вполне достаточно подтвердить ее В-клеточную природу на основании иммуногистохимического обнаружения антигена CD20. Поскольку подтверждение проводится по парафиновым блокам, то чаще всего используются наиболее надежные антитела L26 (CD20). Это необходимо для выбора правильного лечения, которое при ДБКЛ включает применение Мабтеры или ритуксимаба. Моноклональные антитела к CD20 (ритуксимаб) взаимодействуют с внеклеточным доменом антигена и вызывают гибель этих клеток различными механизмами. Парадокс состоит в том, что диагностические антитела L26 распознают не внеклеточный домен CD20, а цитоплазматическую углеводную детерминанту антигена. Примеры практически полного отсутствия антигена на мембране, но четкой реакции с антителами L26 на срезах хорошо известны. Наиболее типичный из них - В-ХЛЛ. При ДВКЛ слабая экспрессия CD20 на мембране злокачественных клеток описана. При диагностике таких редких вариантов ДВКЛ очень важно использовать несколько антител к В-клеточным антигенам, так как экспрессия CD20 может быть достаточно слабой или даже отсутствовать (Bertram H.C. et al., 2001; Hoeller S. et al., 2009). Существуют два варианта отсутствия CD20 антигена на мембране клеток диффузной В-крупноклеточной лимфомы: 1. Отсутствие антигена при диагностике; 2. Отсутствие CD20 антигена, индуцируемое терапией анти-CD20 антителами (Мабтерой). Второй вариант является наиболее частым и может носить как обратимый характер, когда экспрессия антигена восстанавливается в сроки от 1 до 7 месяцев, так и быть необратимым в течение периода наблюдения (Maeshima A.H. et al., 2013; Dumann B.B. et al., 2012; Hiraga J. et al., 2009; Ferreri A.J. et al., 2007; Iguchi T. et al., 2004; Venugopal P. et al., 1999). В процессе терапии Мабтерой описана утрата CD20, которая явилась результатом делеции гена CD20 (Nakamaki T. et al., 2012). Первичные (de novo) CD20-негативные ДВКЛ встречаются, главным образом у HIV-позитивных больных, но могут иметь место и при HIV-негативном статусе (Teruya-Feldstein J. et al., 2004). Наибольшая выборка (28 больных, 1,9% от всех изученных ДВКЛ) представлена китайскими исследователями (Li Y.J. et al., 2012). CD20-негативные лимфомы имели ряд особенностей и характеризовались худшим прогнозом в сравнении с обычными CD20-позитивными ДВКЛ. Показано, что важным прогностияческим параметром при ДВКЛ является оценка уровней мембранной экспрессии молекулы CD20 на злокачественных клетках (Suzuki Y. et al., 2012). Стандартная система стадирования ДВКЛ предложена на конференции в Анн-Арборе в 1971 г (Carbone P.P. et al., 1971) и модификации Costwalds (Lister T.A. et al., 1989). Эта система стадирования отражает количество участков поражения и их отношение к диафрагме, наличие В-симптомов (лихорадка >38C в течение по меньшей мере трех последовательных дней, ночные поты, потеря веса >10% в течение 6 месяцев перед установлением диагноза), а также наличие экстранодальной опухоли. Тщательный сбор анамнеза и физикальное исследование – наиболее важные факторы в обследовании больного. Физикальное исследование включает оценку всех увеличенных лимфатических узлов, запись участка и размера всех увеличенных лимфатических узлов, оценку кольца Вальдейера, наличия гепатоспленомегалии, опухолевых масс. Наличие поражения или кожи, отсутствие наличия В-симптомов пальпируемых должно быть документировано, другие симптомы могут указывать на специфические участки поражения. Оценка общего состояния по шкале ECOG важна у всех больных, в особенности у тех, которые идут в клинические исследовательские протоколы. Лабораторные исследования, рутинно выполняемые у больных неходжкинскими лимфомами, включают полный анализ крови для оценки резервов костного мозга и оценку лейкоцитарной формулы с тщательным исследованием периферической крови на предмет наличия циркулирующих лимфомных клеток. Биохимические анализы сыворотки крови включают оценку функции печени и почек. Лактат дегидрогеназа (ЛДГ) также является важным индикатором опухолевой активности и включена в международный прогностический индекс (IPI) (A predictive model.., 1993). Уровень мочевой кислоты может способствовать отбору больных с повышенным риском мочекислой нефропатии. У всех больных должны быть проведены тесты на HIV, HBV и HCV. Аспирация и биопсия костного мозга должны выполняться у всех больных. Рекомендованы билатеральные биопсии костного мозга, поскольку они повышают частоту обнаружения поражения костного мозга на 10-20%. Однако адекватный (> 2 см) унилатеральный образец костного мозга обычно достаточен. Состояние костного мозга и, в частности, гемопоэза при диффузной Вкрупноклеточной лимфоме изучены недостаточно. Эти вопросы освещались в отечественной и зарубежной литературе в 70-е – 80-е годы прошлого (ХХ) века, то есть до широкого внедрения морфоиммунологических классификаций лимфом, отдельные публикации (Долгих Т.Ю. и соавт., 2011) и подробные обзорные статьи появляются в самое последнее время (Френкель М.А., 2014). В основном авторы сосредоточены на оценке вовлечения костного мозга в злокачественный процесс, так как хорошо известно, что поражение костного мозга при диффузной прогностическое В-крупноклеточной значение. Этому во лимфоме многом имеет неблагоприятное соответствуют положения, выработанные в классификации Лугано в июне 2011г (Cheson B.D. et al., 2014). При всех вариантах неходжкинских лимфом, за исключением ДВКЛ, стандартом остается унилатеральная биопсия костного мозга (2,5 см) наряду с иммуногистохимическим исследованием и проточной цитометрией. Аспирация и биопсия костного мозга должны выполняться у всех больных. Билатеральные биопсии костного мозга, поскольку они повышают частоту обнаружения поражения костного мозга на 10-20%. Однако адекватный (> 2 см) унилатеральный образец костного мозга обычно достаточен (Martelli M. et al., 2013 ). При ДВКЛ ПЭТ-КТ является более чувствительным методом, чем трепанобиопсия костного мозга. Однако при небольшом (10-20% опухолевых клеток в костном мозге) диффузном поражении ПЭТ-КТ может не обнаружить вовлечение костного мозга (Carr R. et al., 1998; Pelosi E. et al., 2011; Berthet L. et al., 2013; Khan A.B. et al., 2013). У больных с ранними стадиями ДВКЛ морфологически вовлечение костного мозга выявляется редко при отсутствии поражения костного мозга по данным ПЭТ. Эти больные, обычно, имеют другие факторы, соответствующие поздним стадиям или плохому прогнозу (Khan A.B. et al., 2013; Adams H.J. et al., 2014). При отрицательных данных ПЭТ-КТ биопсия костного мозга показана для установления поражения с дискордантной гистологией в тех случаях, когда это определяется требованиями протокола или ведения больного (Paone G. et al., 2009). Значение анализа костного мозга необходимо определить еще и потому, что в самое последнее время необходимость проведения биопсии костного мозга при ДВКЛ ставится под сомнение. Проведя исследования у 113 больных ДВКЛ, ученые из Нидерландов пришли к заключению, что изучение костного мозга позволяет точнее стратифицировать больных ДВКЛ на группы риска в соответствии с критериями NCCN-IPI, однако, это не имеет значения для принятия решения о выборе химиотерапии. Авторы делают вывод о том, что в условиях современного лечения и стратификации на группы риска биопсия костного мозга может быть исключена из числа рутинных методов стадирования ДВКЛ (Adams H.J.A., de Klerk J.M.H. et al., 2014). Общепринятая точка зрения состоит в том, что конкордантное вовлечение костного мозга при ДВКЛ существенно ухудшает прогноз (5-летняя общая выживаемость в этих случаях составляет 10%), что не зависит от групп риска в соответствии с IPI (Campbell J. et al., 2006). Минимальное поражение костного мозга (менее 10% опухолевых клеток) не влияет на прогноз. При повышении процента опухолевых клеток в костном мозге возрастает частота конкордантного поражения, то есть такого типа поражения, при котором опухолевые клетки в костном мозге также представлены как субстрат крупноклеточной лимфомы, а не как мелкие лимфоидные элементы. Эти данные подтверждают более ранние результаты Robertson E. et al. (1991) относительно высокой частоты полных ремиссий в группе крупноклеточных лимфом с дискордантным поражением костного мозга, однако, риск возникновения рецидива у этих больных был всё же выше, чем у больных без поражения костного мозга. Таким образом, до настоящего времени предметом дискуссий является клиническое значение минимального (до 10%) поражения костного мозга при ДВКЛ. Анализу состояния гемопоэза не уделяется должного внимания. Дополнительные исследования при ДВКЛ могут включать люмбальную пункцию для оценки цитологии ликвора, позволяющей установить субклиническое поражение мозговых оболочек, а также МРТ головного мозга у больных с высоким риском прогрессирования по центральной нервной системе. Позитронная эмиссонная томография (ПЭТ) с 18 фтордезоксиглюкозой является в настоящее время стандартной процедурой как для стадирования, так и для оценки ответа. Многие исследования указывают на то, что результаты ПЭТ по окончании лечения хорошо предсказывают продолжительность выживаемости без прогрессирования и общую выживаемость при агрессивных лимфомах с наличием или отсутствием резидуальных опухолевых масс, обнаруживаемых компьютерной томографией. ПЭТ способна различать резидуальные опухолевые массы от некрозов и фиброзов. Комбинация китериев 50%/международного Воркшопа (IWC) и ПЭТ оценена ретроспективно у 54 больных неходжкинскими лимфомами. На основе этого исследования международный проект по гармонизации (IHP) представил новые рекомендации по критериям ответа для агрессивных злокачественных лимфом, включающие ПЭТ в определение ответа в конце лечения (Seam P. Et al., 2007; Cheson B. Et al., 2009; Juweid M.E. et al., 2007). ПЭТ не следует использовать для мониторинга, главным образом, из-за многочисленных ложно позитивных данных, а также из-за того, что повышение чувствительности обнаружения опухолевых масс не находит отражения в улучшении клинических результатов. ДВКЛ, находящиеся дополнительных в особых «специфических» экстранодальных подходов к участках, стадированию, требуют которые различаются от локализации поражения, причем особое значение это имеет при первичных лимфомах ЦНС (Ferreri A.J. et al., 2007), тестикулярных ДВКЛ (Zucca E. Et al., 2003; ) и ДВКЛ желудка (Ferreri A.J. et al., 2007a). Клиническая картина и анамнез заболевания играют важную роль в прогнозе ДВКЛ. Каждая группа ДВКЛ, а также морфологические, клинико-патологические варианты заболевания имеют различия в клинической картине, поведении и чувствительности к проводимому лечению. Разумеется, невозможно описать клиническую картину и анамнез заболевания для каждой категории ДВКЛ. Неспецифицированная ДВКЛ встречается у взрослых с медианой возраста в седьмой декаде, однако диапазон возраста широк, и заболевание может встречаться у детей. Клиническая картина, течение и прогноз неспецифицированной ДВКЛ вариабельны, зависят, главным образом, от экстранодальных участков возникновения опухоли. Наиболее часто у больных отмечается появление быстро увеличивающихся, часто бессимптомных опухолевых образований в области елиничного лимфатического узла или экстранодально. Более чем у 40% больных поражение является экстранодальным. Локализованные опухоли выявляются у 20% больных. Диссеминированная экстранодальная ДВКЛ наблюдатся менее часто, причем у 1/3 этих больных имеют место общие симптомы. В целом, ДВКЛ – это крайне агрессивные, но потенциально излечимые опухоли. Частота излечения особенно высока у больных с ограниченной болезнью, 5-летняя выживаемость без прогрессирования (PFS) у этих пациентов достигает 80-85%. У больных с распространенными ДВКЛ или с симптоматической болезнью имеют пятилетнюю PFS приблизительно 50%. Прогностические факторы при ДВКЛ могут быть разделены на таковые, относящиеся к пациенту (возраст, статус по шкале Карновского), и факторы, относящиеся собственно пролиферирующая к опухоли фракция, наличие (стадия, опухолевая экстранодального нагрузка, поражения). Сывороточные уровни ЛДГ, уровни β2-микроглобулина, пролиферирующая фракция являются индикаторами агрессивности заболевания. Важную роль в прогнозе ДВКЛ играет терапевтическая тактика, применяемая у больных. Некоторые экстранодальные участки, такие как головной мозг (Ferreri A.J. et al., 2011) или яички (Zucca E. Et al., 2003) требуют особого лечения, и ДВКЛ, возникающая в этих зонах, является особой категорией с плохим прогнозом. Степень ответа после первичного лечения с высокой степенью вероятности предсказывает прогноз. Международный прогностический индекс (IPI) и скорректированный для возраста IPI (aaIPI) разработаны как модели предсказания исходов на основе клинических факторов при оценке прогноза более чем у 4000 больных (таблица 1) (A predictive model.., 1993). Доказано, что эти модели являются более точными, чем классификация АНН-Арбор в предсказании выживания. aaIPI, который включает стадию, уровень ЛДГ и статус по шкале ECOG, наиболее часто используется в клинической практике и полезен в стратификации больных моложе и старше 60 лет. Обновленная версия разработана в эру ритуксимаба (R-IPI) (Sehn L.H. et al., 2007). В различных исследованиях ДВКЛ доказано, что IPI является надежным фактором, и единственным критерием прогноза ДВКЛ даже в эру ритуксимаба (Ziepert M. Et al., 2011). Таблица 1 Группы риска ДВКЛ в соответствие с международными прогностическими индексами (Martinelli M. et al., 2013) IPI Группа риска aa-IPI Количество IPI факторов Группа риска Количество IPI факторов Низкий риск 0 или 1 Низкая 0 Низкий 2 Низкая 1 промежуточный промежуточная Высокий Высокая 3 промежуточный 2 промежуточная Высокий 4 или 5 Высокая 3 IPI факторы Возраст старше 60 лет (не используется для aa-IPI) Стадия заболевания III/IV Повышенные уровни лактат дегидрогеназы Состояние по шкале ECOG >=2 Более 1 экстранодального участка (не используется в aa-IPI) aa-IPI – скорректированный для возраста международный прогностический индекс; ECOG – Eastern Cooperative Oncology Group (международная кооперативная прогностическая группа). В 2013 году в журнале “Annals of oncology” (Ghielmini M. et al., 2013) были опубликованы рекомендации Европейского общества по медицинской онкологии по лечению ДВКЛ. Рекомендации выработаны в ходе консенсусной 11-й конференции ESMO в Лугано 18 июня 2011 года. Уровень доказательности и степень рекомендованности были адаптированы из системы градации общества инфекционных болезней американской-США службы общественного здоровья (по Dykewicz C.A., 2001): I. Доказательство из рандомизированного по меньшей контролируемого мере одного крупного исследования хорошего методологического качества (низкая возможность предвзятости) или мета-анализа хорошо проведенных больших рандомизированных испытаний без гетерогенности II. Небольшие рандомизированные рандомизированных испытаний исследования с подозрением из на крупных возможную тенденциозность (более низкое методологическое качество) или мета- анализы подобных испытаний или исследований, продемонстрировавших гетерогенность III. Проспективные когортные исследования IV. Ретроспективные когортные исследования или контролируемые (casecontrol) испытания V. Исследования без контрольных групп, описания случаев, мнение экспертов A. Сильное доказательство эффективности со значительной клинической пользой - сильно рекомендовано B. Сильное или умеренное доказательство эффективности, но с ограниченной клинической пользой – в общем рекомендовано C. Недостаточно доказательств эффективности или пользы, не перевешивает риск недостатков (побочных эффектов, стоимости, т.п.) – необязательно использовать. D. Умеренное доказательство против эффективности или побочного результата – в общем, не рекомендовано E. Сильное доказательство против эффективности или побочных явлений – никогда не рекомендовано В рекомендациях ESMO дается ответ на целый ряд насущных вопросов диагностики и лечения ДВКЛ. Например, могут ли результаты молекулярной биологии, иммуногистохимического разделения на подгруппы и клинические прогностические индексы использоваться для принятия решений о том или ином виде лечения? Ответ таков. Диагноз ДВКЛ должен быть установлен опытным гематопатологом, с классификацией ВОЗ помощью (2008). иммуногистохимии, Профили генной в соответствии экспрессии (GEP) с могут разграничить по меньшей мере 2 главных подтипа ДВКЛ (GCB и ABC), которые являются генетически различными болезнями (Alizadeh A.A. et al., 2000). Эти заболевания характеризуются различным ответом при использовании только химиотерапии или в комбинации с ритуксимабом (Rosenwald A. et al., 2002). GEP всё еще считается исследовательским инструментом в силу сложностей применения в рутинной практике: требуются свежие образцы ткани, и метод дорогостоящий. Несколько иммуногистохимических алгоритмов были разработаны с целью замещения GEP (Hans C.P. et al., 2004), но они имеют ограниченную воспроизводимость, и до настоящего времени нет доказанной полезности в помощи лечебным решениям (Gutierrez-Garcia G. et al., 2011). Консорциум Lunenburg продемонстрировал отсутствие улучшения IPI за счет включения иммуногистохимических маркеров (Salles G. et al., 2011), хотя некоторые молекулярные маркеры, такие как экспрессия c-myc или лимфомы двойных трансформаций (double-hit lymphoma), наблюдаемые у ограниченного числа больных, характеризуются значительно худшим прогнозом, чем основная группа ДВКЛ (Aukema S.M. et al., 2011). IPI для агрессивных лимфом был определен примерно 20 лет назад (Shipp M.A. et al., 1993) и остается в настоящее время наиболее важным клиническим инструментом оценки прогноза у больных с впервые диагностированными ДВКЛ. Этот индекс установлен в эру до ритуксимаба, поэтому возник вопрос о ценности показателя при внедрении в клиническую практику иммунохимиотерапии. Существуют предложения улучшить IPI: раковое агентство Британской Колумбии предложило ревизованный IPI (R-IPI) для больных, которые лечились с использованием ритуксимаба (Sehn L.H. et al., 2007). Исследователи из США представили модифицированный прогностический индекс для пожилых больных старше 70 лет (E-IPI) (Advani R.H. et al., 2010). Главным ограничением этих предложений является сравнительно небольшое число больных и отсутствие воспроизводимости. В анализе большой когорты больных, проспективно леченных в рандомизированном исследовании с использованием иммунохимиотерапии, IPI сохранил свое прогностическое значение (Ziepert M. et al., 2010). Таким образом, вклад различных биомаркеров, так же как и подразделения на GCB и не-GCB в оценку прогноза всё еще имеет ограниченное значение в эру ритуксимаба, и IPI остается наиболее важным прогностическим инструментом. Рекомендации ESMO (Лугано, 2011). Рекомендация 1.1. иммуногистохимические Оценка алгоритмы профилей выделения генной подтипов экспрессии ДВКЛ и являются обещающими инструментами, но остаются необязательными и не являются готовыми для выбора клинических решений. Уровень доказательности – IV. Степень рекомендации – С. Рекомендация 1.2. IPI остается наиболее мощным прогностическим инструментом. Модифицированные прогностические шкалы (R-IPI и E-IPI) недостаточно оценены и не рекомендованы для рутинного использования. Уровень доказательности IPI – I. Степень рекомендации – А. Лечение ДВКЛ. Для молодых пациентов с хорошим профилем риска (низкий или промежуточный низкий IPI) стандартом лечения является R-CHOP, и, основываясь на результатах протокола MINT, на участки bulky disease рекомендована лучевая терапия (Pfreunschuh M. et al., 2006). Существует различие между низким риском по IPI, промежуточным-низким и низким риском по IPI c наличием bulky результаты disease. лечения в Интенсификация последних химиотерапии подгруппах, судя может по улучшить результатам рандомизированного исследования, сравнившего R-ACVBP с R-CHOP (Recher C. et al., 2011), лучевая терапии не применялась в обоих рукавах исследования. Для молодых пациентов с высоким-промежуточным или высоким IPI единства в подходах к лечению нет. В этой подгруппе больных результаты RCHOP 21 или R-CHOP 14 менее удовлетворительны с 3-летней PFS < 50%. Сравнение R-CHOP 14 и R-CHOP 21 не выявило преимуществ у больных ДВКЛ (Cunningham D. et al., 2011). Регулярно используются более интенсивные режимы такие как ACVBP и CHOEP14 (Coiffier B. et al., 1989; Trumper L. et al., 1994). Преимуществ высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток при мета-анализе 13 рандомизированных исследований не установлено (Greb A. et al., 2008). Таким образом, у молодых пациентов с хорошими показателям по факторам риска (низкий риск без конгломератов лимфоузлов) рекомендовано 6 курсов RCHOP 21 (уровень доказательности I, сила рекомендаций – А). Для молодых пациентов с низким-промежуточным IPI риском или низким риском с наличием конгломератов лимфоузлов рекомендовано либо 6 курсов RCHOP 21 с последующей лучевой терапией на участки, где были конгломераты лимфоузлов, либо интенсифицированный доказательности II, сила рекомендации В. режим (R-ACVBP). Уровень Не существует стандартного лечения для молодых пауиентов с высокимпромежуточным или высоким риском по IPI. R-CHOP21 может быть недостаточен, и допустимы более интенсивные режимы (R-CHOP14 или R-ACVBP) с консолидацией высокодозной химиотерапией с трансплантацией аутологичных стволовых клеток. Уровень доказательности II, сила рекомендации – В. Стандартное лечение больных пожилого возраста должно основываться на общем состоянии здоровья (коморбидности). Там, где возможно, следует проводить 8 курсов R-CHOP21 или 6 курсов R-CHOP14 + 2R. Уровень доказательности I, сила рекомендации – А. Если достигнута полная ремиссия после 4 курсов R-CHOP21, то общее количество курсов можно сократить до 6. Для больных старше 80 лет без существенной дисфункции сердца рекомендуется 6 курсов R-миниCHOP21. Стандарты и клинические рекомендации по диагностике и лечению ДВКЛ в России базируются на общепринятых в мире подходах (Поддубная И.В., Савченко В.Г., 2013; Тумян Г.С. и соавт., 2013). Как видно, в области диффузной В-крупноклеточной лимфомы за последние 20 лет главным прорывом в диагностике было обнаружение профилей генной экспрессии и соотнесение их с клетками зародышевых центров и активированными В-клетками, а в лечении – применение анти-CD20 моноклональных антител ритуксимаба. В эру до применения ритуксимаба частота длительных ремиссий была 5060%. Доказано, что очень ценным является международный прогностический индекс (IPI) (Armitage J.O. et al., 1998). Считается, что в связи с улучшением результатов лечения ДВКЛ в эру ритуксимаба (Coiffier B. et al., 2007), значение IPI несколько снизилось (Sehn L.H. et al., 2007). Молекулярно-биологические основы выделения вариантов ДВКЛ. Настоящим прорывом в понимании биологии нДВКЛ и, что самое главное, в понимании вектора движения в совершенствовании лечения этого грозного заболевания явилась статья Alizadeh A.A. et al. (2000). Эта публикация, написанная 31 автором из ведущих американских медицинских научных центров в журнале Nature, на долгие годы заслонила все остальные исследования в области ДВКЛ. Действительно, методический уровень статьи чрезвычайно высок – проведено 1,8 млн измерений генной экспрессии в 128 анализах майкроэррэй (микрочипах) из 96 образцов нормальных и злокачественных лимфоцитов. На основании полученных данных выделены профили генной экспрессии, характерные для всех В-клеток, Вклеток зародышевых центров, активированных В-клеток и т.д. Идентифицированы 2 молекулярно различных формы ДВКЛ, которые имели профили генной экспрессии, характерные для различных стадий В-клеточной дифференцировки. При одном из этих типов экспрессировались гены, характерные для клеток зародышевых центров, при другом – гены, обычно индуцируемые при активации периферических В-клеток крови in vitro. Данная работа открыла ряд фундаментальных аспектов биологии ДВКЛ, но в то же время дала очень многое для понимания нормальной В-клеточной дифференцировки, активации и пролиферации. Учитывая важный клинический аспект работы – лучший прогноз при ДВКЛ GCB-типа, становится понятным тот интерес, который она побудила. Статья цитируется в классификациях ВОЗ 2003 и 2008 годов, ее положения стали хрестоматийными. Вместе с тем, клинический аспект данной статьи не столь доказателен как фундаментальный. Дело в том, что исследование проведено на маленькой группе больных ДВКЛ (40 больных) – 19 больных с GCB-типом и 21 больной с ABC-типом ДВКЛ. И хотя различия в прогнозе между этими группами достоверны (р=0,01), они все же далеки от той достоверности, с которой прогностические группы подразделяются у тех же больных на основании признаков, внесенных в международный прогностический индекс IPI, p=0,002. Далее авторы приводят в качестве примера возможность разделения ДВКЛ низкого риска на группы благоприятного и неблагоприятного прогноза на основании профилей генной экспрессии. Группы еще более малочисленны (14 и 10 больных), и полученные данные на грани достоверности, р=0,05. По существу, вновь открытый признак (профили генной экспрессии) не дал преимуществ в выделении прогностических групп в сравнении с IPI. Однако данные авторов, сделанные на небольшой выборке больных, были подтверждены в более обширных исследованиях. Так, Rosenwald A. et al. (2002) установили помимо 2 описанных типов (GCB, ABC) еще третий тип, при котором клетки ДВКЛ не могли быть отнесены к GCB или ABC. Транслокации bcl-2 и амплификации c-rel обнаруживались только в подгруппе GCB. У больных этой подгруппы отмечены наилучшие показатели 5-летней выживаемости. Проведен анализ индивидуальных генов, образцы экспрессии которых коррелировали с выживаемостью. Большинство этих генов относились к 4 сигнатурам: В-клеток зародышевых центров, пролиферирующих клеток, реактивных стромальных и иммунных клеток лимфатических узлов, а также генов главного комплекса гистосовместимости II класса. Авторы использовали 17 генов для конструкции предиктора общей выживаемости после химиотерапии. Важно отметить, что данный предиктор, основанный на профилях генной экспрессии, и международный прогностический индекс (IPI) являлись независимыми признаками. Две группы ДВКЛ, выявляемые на основании профилей генной экспрессии, характеризовались различными хромосомными аберрациями. Так, для АВС-типа частыми являются амплификации 3q, 18q21-q22, делеции 6q21-q22, в то время как для GCB-типа частыми являются амплификации 12q12 (Bea S. et al., 2005; Tagawa H. Et al., 2005). Большое число случаев GCB-типа несут перестройку гена BCL2 (De Paepe P. et al., 2005; Huang J.Z. et al., 2002). Метод оценки профилей генной экспрессии является достаточно трудоемким, в силу чего не нашел широкого применения в клинике. Предприняты попытки заменить профили генной экспрессии на иммуногистохимические маркеры, позволяющие разграничить клетки зародышевых центров от других (постфолликулярных) активированных В-клеток. Следует отметить, что иммунобластный вариант ДВКЛ, а также центробластные варианты с наличием полиморфных центробластоподобных клеток или с высоким содержанием иммунобластов более типчны для подгруппы АВС-ДВКЛ, но встречаются и при GCB-АВС. По этим причинам разграничить GCB и ABC-подтипы ДВКЛ на морфологическом уровне не представляется возможным. Более точную информацию дает применение иммуногистохимического метода для разграничения этих двух типов ДВКЛ (Hans C.P. et al., 2004). Описано значительное число иммуногистохимических маркеров, так или иначе взаимосвязанных с прогнозом ДВКЛ. Неблагоприятными прогностическими признаками являются экспрессия BCL2, ингибитора апоптоза, сцепленного с Ххромосомой (XIAP), IRF4/MUM1, циклина D2, циклина D3, р53, CD5, FOXP1, PKC-β, ICAM1, HLA-DR и с-FLIP, к числу благоприятных относят BCL6, CD10, LMO2 (Adida C. et al., 2000; Barrans S.L. et al., 2004; Berglund M. et al., 2005; Colombo L. et al., 2003; De Paepe P. et al., 2005;Gaskoyne R.D. et al., 1997; Hans C.P. et al., 2005; Hermine O. et al., 1996; Iqbal J. et al., 2006; Miller T.P. et al., 1988; Muris J.J. et al., 2005;Veelken H. Et al., 2007). Результаты, представленные в этих публикациях, подчас противоречивы, что затрудняет их клиническое использование. Внедрение в клиническую практику ритуксимаба (моноклональных антител против антигена CD20) существенно улучшило результаты лечения ДВКЛ (Coiffer B. et al., 2007). При этом неблагоприятная прогностическая роль экспрессии BCL2, так же как и благоприятная прогностическая роль BCL6 были утрачены (Mounier N. et al., 2003; Mounier N. et al., 2006; Winter J.N. et al., 2006). Наиболее широкое распространение для выделения групп больных ДВКЛ с хорошим и плохим прогнозом и подтверждения молекулярной классификации на GCB и ABC-типы получил классификатор Хэнса (Hans classifier), в котором при иммуногистохимическом исследовании учитывается экспрессия CD10, BCL6, IRF4/MUM1 (Hans C.P. et al., 2004). К сожалению, и в этом случае результаты подтверждаются не всеми авторами (Amen F. et al., 2007; Colomo L. et al., 2003; Lossos I.S. et al., 2006; Moscowitz C.H. et al., 2005; Nyman H. et al., 2007; van Imhoff G.W. et al., 2006). Считается, что изучение других иммуногистохимических маркеров, таких как циклин D2, BCL2 и LMO2 может улучшить предсказание прогноза при ДВКЛ (Amen F. et al., 2007; Natkunam Y. et al., 2008). Маркеры CD10, BCL6, IRF4, LMO2, GCET1 и FOXP1 экспрессированы на клетках ДВКЛ вариабельно, их комбинации представляют собой основу алгоритмов иммуногистохимического воспроизведения GEP (Meyer P.N. et al., 2011; Choi W.W. et al., 2009; Hans C.P. et al., 2003). Вместе с тем, единства в научной медицинской среде относительно возможности использования GEP и иммуногистохимических суррогатных маркеров GEP не существует, и на сегодняшний день они не рекомендованы к клиническому использованию для диагностики вариантов ДВКЛ и принятия лечебных решений (Ghelmini M. et al., 2013). В классификации ВОЗ 2008 года отмечается, что использование иммуногистохимических панелей для оценки прогностических групп в настоящее время не имеет значения в рутинной клинической практике (Stein H. Et al., 2008). Это подтверждает ранее высказывавшиеся мнения о том, что главным ограничением в использовании иммуногистохимических критериев являются проблемы с воспроизводимостью и интерпретацией некоторых иммуногистохимических окрасок (De Jong D. et al., 2007; Zu Y. et al., 2005). Ненадежность этих данных обусловлена целым рядом причин. Использованный метод может быть недостаточно точным или стандартизованным для надежной воспроизводимости получаемых данных. Биомаркеры часто исследуются иммуногистохимически на фиксированных в формалине парафиновых блоках. Ткани могут быть подвергнуты неодинаковой обработке, а сам иммуногистохимический метод в целом не стандартизован в отношении антител, методов восстановления антигена, системы детекции и используемых инструментов. Система счета также часто является субъективной, и разные исследователи используют различные критерии (Chan W.C., 2013). Определенным указанием на прогноз является пролиферативный индекс. В ранних работах при ДВКЛ высокий пролиферативный индекс (Ki-67) имел неблагоприятное прогностическое значение (Miller T.P. et al., 1994). Это подтверждено в одной работе с анализом профилей генной экспрессии (Rosenwald A. et al., 2002). Однако другие работы не подтвердили прогностическую роль индекса Ki-67 (Cools J. et al., 2002; Saez A.I. et al., 2004; Winter J.N. et al., 2006; Zhang A. et al., 1999). Нормальные неопухолевые аналоги ДВКЛ, активация В-лимфоцитов, роль активационных антигенов в прогнозе. В понимании биологии ДВКЛ полезно обратиться к нормальной дифференцировке и активации В-лимфоцитов. Нормальным неопухолевым аналогом ДВКЛ является периферическая активированная В-клетка зародышевого центра или В-клетки постгерминальных этапов дифференцировки. Есть все основания считать, что именно в углубленном изучении В-клеточного иммунного ответа кроется путь к поиску новых патогенетических и иммунологических подходов к лечению данной опухоли. Остановимся на посткостномозговых этапах созревания и активации Влимфоцитов. С током крови наивные В-лимфоциты попадают в лимфатические узлы и заселяют первичные фолликулы. Первичные фолликулы состоят из малых лимфоцитов, большинство из которых не имеет признаков активации. Чаще всего эти клетки имеют изотип IgM+IgD или IgM. Лимфоидные клетки фолликулов поликлональны по и легким полипептидным цепям мембранных иммуноглобулинов. Антигены CD23, CD10, CD38 отсутствуют. Лимфоциты экспрессируют на мембране CD19, CD20, HLA-DR, CD21, CD22, CD24, CD37 - их иммунологический фенотип является характерным для периферических В-клеток. Первичная активация В-клеток происходит в Т-клеточных областях периферических лимфоидных органов: паракортикальной зоне лимфатических узлов и лимфоидной ткани слизистых, а также в периартериолярных лимфоидных муфтах селезенки. Последствия связывания иммуноглобулиновых рецепторов Влимфоцитов с антигеном во многом зависят от свойств самого антигена. Тимус-независимые антигены первого типа способны поликлонально активировать определенные В-клетки без учета антигенной специфичности гипервариабельной области поверхностного иммуноглобулинового рецептора. Эти молекулы вызывают пролиферацию и дифференцировку большинства В-клеток и поэтому часто называются В-клеточными митогенами. Тимус-независимые антигены второго типа (например, пневмококковый полисахарид) способны стимулировать В-клетки непосредственно без вовлечения Т-клеток. Процесс осуществляется через комплементарным мультивалентное иммуноглобулиновым присоединение этих рецепторам, с антигенов которыми к они перекрестно реагируют. В основном тимус-независимые антигены ведут к IgМответам, которые не сопровождаются формированием B-клеток памяти. Для активации В-клеток тимус-зависимыми антигенами необходимо взаимодействие с Т-хелперами. Т-хелперы узнают мембранные антигены только в ассоциации с молекулами HLA-II класса. Перекрестное связывание поверхностных рецепторов В-клеток индуцирует ранние активационные процессы. Полимерные тимус-независимые антигены второго типа с повторяющимися детерминантами, перекрестно связывают иммуноглобулиновые рецепторы, обычно эти антигены экспрессированы на поверхности макрофагов. Компоненты комплемента могут активировать В-клетки через CD21 (CR2). Поликлональный активатор вирус Эпштейна-Барр (EBV) и CD23 тоже связываются с CR2/CD21-рецептором. T-клеточный активационый сигнал связан с продукцией Т-клетками ИЛ-4, который способствует переходу покоящихся В-клеток в стадию G1 клеточного цикла. Стимулированный В-лимфоцит приобретает многочисленные поверхностные рецепторы для ростовых факторов, выделяемых Т-хелперами, и в этом состоянии он готов к пролиферации - основному процессу в следующей фазе иммунного ответа. Пролиферация клона обеспечивается факторами. Тимус-независимые деление В-клеток, растворимыми Т-клеточными поликлональные активаторы стимулируют взаимодействуя не только с иммуноглобулиновыми рецепторами, но и с другими структурами поверхностной мембраны. Большое значение в процессе иммунологической защиты имеет Т-зависимый иммунологический ответ, который отличается большим разнообразием реакций. В процессе Т-зависимой активации на мембране В-лимфоцитов появляется молекула CD23 как активационный антиген. Активация В-клеток под действием тимус-зависимых антигенов происходит при участии Т-хелперных клеток и интердигитирующих дендритических клеток (ИДК) в паракортикальной зоне. В-лимфоциты взаимодействуют с активированными антигенпрезентирующими ИДК CD4+ Т-хелперными клетками. ИДК являются специфическим для Т-клеточных зон лимфатических узлов типом дендритных клеток. Они соединяются между собой и с другими клетками посредством субмикроскопических отростков. Обнаруживаются также в соответствующих зонах селезенки, миндалин и мозговом веществе тимуса. ИДК характеризуются высокой экспрессией молекул HLA-II класса, не имеют на мембране CD23. Основная роль ИДК состоит в презентировании антигенных пептидов Т-клеткам. При активации Т-хелперных клеток молекула CD28 на CD4+ лимфоцитах связывается с ее лигандом CD80 на интердигитирующих клетках. Взаимодействие контактным Т- и В-лимфоцитов (клетка-клетка) и с осуществляется помощью двумя цитокинов. способами В - контактных взаимодействиях принимают участие со стороны В-клеток молекулы CD40, LFA-1, LFA-3 и комплементарные им структуры Т-лимфоцитов - лиганд CD40 (появляется на активированных Т-клетках), ICAM-1 и CD2. Основными цитокинами, синтезируемыми Т-хелперными лимфоцитами и поддерживающими активацию и пролиферацию антиген-специфичных В-клеток являются ИЛ-4, а также ИЛ-5, ИЛ6, ИЛ-10. Отражением процесса активации является появление на мембране Влимфоцита молекулы CD23, повышенная экспрессия молекул HLA-II, а затем утрата мембранного IgD. Активированные в паракортикальной зоне CD23+ В-клетки утрачивают IgD и поступают в фолликул. Они начинают быстро пролиферировать, что приводит к изменению структуры фолликула с образованием внутри него зародышевого центра. В условиях микроокружения зародышевого центра происходит многоступенчатый процесс антигензависимого созревания и дифференцировки Вклеток, который ведет к созданию плазматических клеток и В-клеток памяти. В базальной (она иначе называется темной) зоне зародышевого центра активированные В-лимфоциты утрачивают CD23 и превращаются в крупные бластные формы (центробласты), которые активно пролиферируют. Для центробластов характерна экспрессия CD77, CD38, отсутствие IgD, практически полное отсутствие IgM, сниженные уровни CD44 и L-селектинов. Большинство этих клеток гибнет апоптозом, поскольку ген анти-апоптоза bcl-2 в центробластах не функционирует. Разрушенные погибшие клетки поглощаются макрофагами зародышевых центров, носящими название макрофагов инородных тел (tingible-body macrophages). Выжившие В-клетки уменьшаются в размере, их ядро сморщивается, становится как бы расщепленным (центроциты). На центроцитах вновь появляются мембранные Ig. Эти лимфоидные элементы уже прошли этап изотипического переключения и экспрессируют IgG, IgA или IgE. В результате соматических гипермутаций центроциты приобретают высокий аффинитет к антигену. Они вариабельно экспрессируют CD23. На части клеток зародышевых центров присутствуют антигены CD10, а также активационные антигены CD25 и CD71. Одна из точек зрения состоит в том, что при продолжающейся антигенной стимуляции центроциты способны трансформироваться во вторичные В-бласты, экспрессирующие молекулу CD30 (Andre-Schwartz et al., 1995). Из центроцитов формируются В-клетки памяти и плазматические клетки. Это происходит в апикальной светлой зоне зародышевого центра фолликула, густо населенной CD23+ фолликулярными дендритическими клетками. Фолликулярные дендритические клетки обсыпаны огромным количеством антигена, к которому формируется ответ в данном зародышевом центре. Антиген на поверхности ФДК удерживается в виде иммунных комплексов с антителами и комплементом. Это происходит благодаря тому, что ФДК экспрессируют широкий набор Fcрецепторов (CD23, CD16, CD32) и рецепторов комплемента (CD35, CD21, CD11b). Антиген, присутствующий на ФДК, преподносится В-клеткам. ФДК локализуются только внутри лимфоидных фолликулов и характеризуются в основном их способностью связывать большое количество иммунных комплексов с Fc- или С3b-рецепторами. Фолликулярные дендритические клетки реагируют как дополнительные элементы в В-клеточном ответе как в первичных фолликулах, так и в зародышевых (герминативных) центрах фолликулов в лимфоидной ткани. ФДК не фагоцитируют, но связывают и сохраняют на своей поверхности комплексы антиген-антитело. Гетерогенность ФДК подтверждается тем, что молекулы CD23 экспрессированы только на субпопуляции этих клеток. CD23-положительные ФДК локализуются в апикальной светлой зоне зародышевого центра фолликула лимфатического узла. Рецепторы CD21 экспрессированы на ФДК как в первичных фолликулах, так и в светлых центрах. Направленность дифференцировки В-лимфоцитов - в клетки памяти или в плазмоциты - регулируется в апикальной светлой зоне зародышевых центров. Связывание молекулы В-лимфоцитов CD40 с соответствующим лигандом, присутствующим на активированных Т-клетках, ведет к формированию В-клеток памяти. Плазмоцитарная дифференцировка В-лимфоцитов происходит после их взаимодействия с растворимым фрагментом CD23 или с антигеном CD23, присутствующим на ФДК. В этих взаимодействиях участвует рецептор CD21 и ИЛ1. Таким образом, гетерогенность периферических В-клеток в процессе их активации характеризуется изменениями их иммунофенотипа по экспрессии CD21, CD23, CD10, CD38. Поскольку представляется перспективным изучение ДВКЛ по экспрессии этих молекул, остановимся подробнее на характеристике каждой из них. В литературе есть сообщения, свидетельствующие о важности изучения активационных антигенов на клетках ДВКЛ. Linderoth J. et al. (2003) показано, что экспрессия CD23 может идентифицировать прогностически более благоприятную группу ДВКЛ. Авторы провели исследование у 405 больных агрессивными лимфомами. Больные были включены в исследование в период с 1989 по 1994 годы. Критерием включения были возраст больных от 18 до 67 лет, диагноз лимфомы высокой степени злокачественности в соответствие с Кильской классификацией и стадия заболевания II-IV. После пересмотра препаратов в исследование включены 125 случаев – 107 центробластный вариант, 14 – иммунобластный, 4 – богатая Т-клетками и гистиоцитами лимфома. Большинство случаев были позитивны по bcl-6 (97%), 51% - СD10+. Экспрессия CD10 не влияла на прогноз. 16% случаев были CD23-позитивными. CD23+ случаи (20 наблюдений) имели тенденцию к лучшему прогнозу (р=0,033). Все CD23-позитивные случаи экспрессировали CD40. По данным авторов экспрессия CD40 свидетельствовала о благоприятном прогнозе (р=0,027). Положительная прогностическая роль экспрессии CD23 при ДВКЛ отмечалась и в более ранней работе (Schuurman H.J. et al., 1988). Молекулы HLA-II класса так же, как и HLA-I, являются примитивными рецепторами для антигенных пептидов (в этом случае речь идет о пептидных фрагментах, экзогенных антигенов, поступающих в клетку путем фагоцитоза или пиноцитоза), которые в комплексе с молекулами HLA-II транспортируются из цитоплазмы на мембрану клетки для распознавания Т-хелперными (CD4) лимфоцитами. Молекулы HLA-II класса состоят из 2 полипептидных цепей - и . Как и молекулы HLA-I, молекулы HLA-II характеризуются сочетанием чрезвычайного разнообразия и наличием общности структуры. Разнообразие является следствием полигении, полиморфизма и кодоминантности экспрессии соответствующих генов. Полигения заключается в наличии 3 генов, получивших название HLA-DR, HLA-DP, HLA-DQ. Полиморфизм - это наличие множества аллелей каждого гена. Так, для генов -цепей HLA-DR существует 137 аллелей, HLA-DP - 66, HLA-DQ - 25. Полиморфизм генов -цепей выражен в значительно меньшей степени - 2, 8 и 16 аллельных вариантов соответственно. Отражением общности структуры молекул HLA-II класса является тот факт, что все они служат лигандами для рецептора CD4 Т-хелперных лимфоцитов. Как мы уже отмечали, молекулы HLA-DR не относятся к активационным антигенам В-лимфоцитов. Эти молекулы присутствуют на В-клетках всех этапов дифференцировки, начиная от незрелых костномозговых предшественников и заканчивая зрелыми В-лимфоцитами. Антиген утрачивается только на плазматических клетках – конечном этапе дифференцировки В-лимфоцитов. Вместе с тем, молекулы HLA-DR являются активационными антигенами Т-клеток и поэтому рассматриваются в данном разделе. Утрата молекул HLA-DR при Вклеточных лимфомах известна давно и считается признаком аберрантности и анаплазии. В одной из последних работ (Berndt H.-W. et al., 2009) значение утраты HLA-DR рассматривается с клинических позиций, с точки зрения влияния на прогноз. Оценка экспрессии HLA-DR на опухолевых клетках ДВКЛ проведена у 301 больного. К отрицательным случаям относили только те, где процент положительных клеток был менее 1%. Эта группа включала 60 наблюдений (19,9%), что является достаточно высокой частотой для данного редкого варианта ДВКЛ. HLA-DR-негативные ДВКЛ характеризовались плохим прогнозом – укорочением как бессобытийной (р=0,014), так и общей выживаемости (р<0,001). Из числа изученных 22 иммунологических показателей экспрессия HLA-DR явилась самым сильным предсказателем прогноза по общей выживаемости. Помимо HLA-DR на неблагоприятными факторами прогноза при оценке общей выживаемости являлись экспрессия BCL2 (р=0,015) и отсутствие сети фолликулярных дендритных клеток CD23+ (p=0,011). В этом исследовании экспрессия BCL6 встречалась чаще при центробластных лимфомах (85,5%) в сравнении с иммунобластными (р=0,001). Различий в частоте экспрессии CD10, BCL2, IgD, IgM, IRF4 между центробластными и иммунобластными лимфомами не отмечалось. Прогностически более благоприятным по бессобытийной выживаемости был центробластный вариант как в однофакторном, так и в многофакторном анализе (р=0,002). На основании этих данных иммунобластный вариант отнесен к факторам неблагоприятного прогноза. Отсутствие экспрессии HLA-DR наблюдалось значительно чаще при лимфомах ЦНС, яичка или яичников (8 из 15 случаев, 53,3%), чем при лимфомах других органов (52 из 286, 18,2%, р=0,003). В литературе имеются указания на неблагоприятную прогностическую роль утраты HLA-DR при ДВКЛ (Miller T.P. et al., 1988; Rybski J.A. et al. et al., 1991; Rimsza L.M. et al., 2004; Rimsza L.M. et al., 2007). В работе Rimsza L.M. et al. (2007) приводятся данные обширного исследования экспрессии HLA-DRA как антигена, дающего достаточно полное представление об экспрессии генов HLA-II класса. Относительную экспрессию гена оценивали путем вычисления флуоресцентного отношения образца к контролю (на чипы кДНК наслаивали контрольную мРНК пула клеточных линий и опухолевой мРНК). Даже для порогового уровня в 10% получена достоверная корреляция отсутствия генов HLA-DRA c ухудшением общей выживаемости. С нарастанием уровней экспрессии HLA-DRA до 25%, 50% и более прогноз ухудшался. Интересно отметить, что 8 из 10 негативных по экспрессии HLA-DRA случаев при сопоставлении с данными иммуногистохимии также были полностью отрицательными. Однако в 2 наблюдениях иммуногистохимически отмечен необычный цитоплазматический или точечный тип экспрессии HLA-DR. Во всех 12 положительных на основании GEP случаев иммуногистохимически также отмечен мембранный/цитоплазматический тип реакции. Очень важное наблюдение сделано в данной работе относительно взаимосвязи экспрессии HLA-DR c уровнями инфильтрации опухоли CD8 цитотоксическими лимфоцитами: в HLA-DR-негативных случаях инфильтрация была минимальной. Причем отмечено, что низкие уровни инфильтрации ДВКЛ CD8+ лимфоцитами ассоциируются с ухудшением выживаемости больных. Следует отметить, что в данной работе группа крупноклеточных лимфом была весьма гетерогенной, она включала центробластные, полиморфные, мономорфные, иммунобластные, Беркитто-подобные и плазмобластные лимфомы. Исключение из анализа плазмобластых и Беркиттоподобных лимфом не снижало прогностическое значение утраты экспрессии молекул HLA-DR. Следует отметить, что делеция генов МНС является достаточно распространенным явлением при экстранодальных лимфомах в иммунопривелигированных участках, таких как ЦНС и яички. По данным авторов 60% лимфом таких локализаций характеризовались полной потерей генов МНС I класса в сравнении с 10% случаев нодальных лимфом. Экспрессия MHC II класса была утрачена в 56% лимфом иммунопривилегированных зон в сравнении с 5% нодальных лимфом (Riemersma S.A. et al., 2000). Чрезвычайно интересен вопрос о возможности утраты антигена CD45 при ДВКЛ. CD45 является дифференцировочным пан-лейкоцитарным антигенов. Он представлен на всех ядросодержащих клетках крови, костного мозга, лимфоидных тканей за исключением эритрокариоцитов. На нормальных клетках- предшественниках костного мозга экспрессия CD45 более слабая, чем на лимфоцитах. При опухолях крови CD45 слабо экспрессирован вплоть до полного отсутствия при острых лейкозах и лимфомах из клеток-предшественников, множественной миеломе, крупноклеточной анапластической лимфоме. При диффузной В-крупноклеточной экспрессирован на достаточно лимфоме высоком этот антиген, уровне. как Вместе правило, с тем, иммуногистохимически документированные случаи отсутствия CD45 при ДВКЛ описаны, чаще при экстранодальной локализации опухоли (Lasota J. et al., 1996; Donner L.R. et al., 2001; Inaba T. et al., 2008; Nath P. et al. 2010). Как правило, эти случаи характеризовались признаками анаплазии с экспрессией цитокератинов или ALK. Описаны случаи диагностики нодальной CD45-негативной ДВКЛ методом проточной цитометрии (Palmeira C. et al., 2012). Клетки характеризовались достаточно яркой экспрессией CD19 и CD20, были позитивны по CD10 и слабо – по CD38. Отсутствие CD45 в этом случае было убедительно подтверждено с помощью 4 различных клонов анти-CD45 антител. При диагностике таких редких вариантов ДВКЛ очень важно использовать несколько антител к В-клеточным антигенам, так как экспрессия CD19 может отсутствовать, а CD20 может быть достаточно слабой (Bertram H.C. et al., 2001). Одним из наиболее интересных маркеров ДВКЛ является активационный антиген CD38 (АДФ-рибозил-циклаза/цаклическая АДФ-рибозил гидролаза) – эктоэнзим, функции и роль при лимфомах которого до конца не изучены (Lund F. et al., 1999; Кондратьева Н.Е., 2005). Антиген имеет широкий спектр экспрессии в гемопоэтической ткани – клетки-предшественники, тимоциты, клетки зародышевых центров, активированные Т-клетки (Sandoval-Montes C. et al., 2005), плазматические клетки, NK-клетки. Данный энзим участвует в активации Т- и Влимфоцитов, так как он ассоциирован с TCR/CD3 и В-клеточным рецептором. Интересно то, что роль данного белка на различных этапах дифференцировки Вклеток различна: в зрелых В-клетках зародышевых центров он обладает антиапоптотической активностью, а в костномозговых В-линейных предшественниках – проапоптотической активностью (Pfister M. et al., 2001). В экспериментальных работах показано, что экспрессия CD38 повышает чувствительность лимфомных клеточных линий к рецептор-опосредованному апоптозу (Gregorini A. et al., 2006). Экспрессия CD38 в нормальных зародышевых центрах выше, чем при фолликулярных лимфомах, что в ряде случаев используется в дифференциальной диагностике (Mantei K. et al., 2009). Особенно высокие уровни мембранной и цитоплазматической экспрессии антигена отмечаются в плазмоцитах, что в клинике используется для идентификации плазмоцитов при диагностике и мониторинге остаточной болезни при множественной миеломе (van Dongen J.J.M. et al., 2012). При периферических лимфомах CD38 привлек наибольшее внимание при ВХЛЛ, так как в этих случаях он позволяет разделять заболевание на группы с различным прогнозом (является прогностически неблагоприятным маркером) и коррелирует с мутационным статусом (Hus I. et al., 2006; Malavasi F. et al., 2011). Показано, что экспрессия CD38 при В-ХЛЛ может регулироваться на уровне псевдофолликулов лимфатических узлов неопухолевым микроокружением (Patten P.E.M. et al., 2008). При диффузных В-крупноклеточных лимфомах экспрессия CD38 наблюдается довольно часто, однако, систематизированных исследований с характеристикой диагностической и прогностической ценности антигена не проводилось. Антиген сильно экспрессирован во всех случаях лимфомы Беркитта, при плазмобластном варианте, синдроме Рихтера, а также при ДВКЛ с сочетанием транслокации t(14;18) и реаранжировки 8q24/cMYC (Le Gouill S. et al., 2007). В последние годы интерес к экспрессии CD38 при лимфомах обусловлен еще и тем, что получены лечебные моноклональные антитела Даратумумаб против антигена CD38, которые способны вызывать гибель CD38-позитивных опухолевых клеток (de Weers M. et al., 2011). Одним из наиболее новых, клинически значимых направлений иммунодиагностики ДВКЛ явилось описание в 2013 году особого, прогностически благоприятного варианта заболевания с экспрессией антигена CD30 на мембране злокачественных клеток (Hu S. et al., 2013; Chan W.C. et al., 2013). CD30 является членом суперсемейства рецепторов факторов некроза опухоли (TNFR). Первоначально CD30 был обнаружен как мембранный маркер клеток Ходжкина и Рида-Стернберга при классической лимфоме Ходжкина (Durkop H. Et al., 1992). Антиген CD30 также экспрессирован на нескольких типах Т- и В-клеточных крупноклеточная неходжкинских лимфома, лимфом, первичная таких как медиастинальная анапластическая В-крупноклеточная лимфома, клональные лимфопролиферативные расстройства, вызванные врусом Эпштейна-Барр, а также при реактивных состояниях таких как инфекционный мононуклеоз (De Leval L. et al., 2010). CD30 – это активационный маркер, индуцируемый in vitro митогенными сигналами. В норме он экспрессируется Т- и В-иммунобластами в парафолликулярной области и и периферическим ободком зародышевых центров у здоровых лиц. Подобное высокорестриктированное распределение экспрессии CD30 делает его идеальной мишенью иммунотерапии моноклональными антителами у больных с CD30+ лимфомами. Брентуксимаб ведотин – лекарственный конъюгат моноклональных антител к CD30 - в настоящее время разрешен FDA . Этот препарат вызывает значительные ответы при рефрактерной лимфоме Ходжкина и ее рецидивах, а также при системной анапластической крупноклеточной лимфоме ( Younes A. et al., 2010; Fanale M.A. et al., 2012; Pro B. et al., 2012; Gopal A.K. et al., 2012; Chen R. et al., 2012). Хорошо известен благоприятный прогноз анапластической крупноклеточной лимфомы и первичной медиастинальной В-крупноклеточной лимфомы в сравнении с CD30-негативными Т- и В-клеточными лимфомами (Fallini B. et al., 1999; Medeiros L.J. et al., 2007; Savage K. J. et al., 2006; Inghirami G. et al., 2011). Однако значение экспрессии CD30 при неспецифицированной ДВКЛ длительное время оставалось неясным. Ранние исследования в маленьких группах больных, получавших лечение циклофосфамидом, доксорубицином, винкристином и преднизолоном (CHOP), давали противоречивые результаты (Noorduyn L.A. et al., 1994; Maes B. et al., 2001). И лишь последние исследования (Hu S. et al., 2013) убедительно доказали, что экспрессия CD30 идентифицирует новую подгруппу больных ДВКЛ с очень хорошим клиническим исходом. Авторы изучили экспрессию CD30 у 903 больных с впервые установленным диагнозом ДВКЛ. Больные получали иммунохимиотерапию R-CHOP. Изучены клинико-морфологические признаки, молекулярные и генетические изменения, профили генной экспрессии, а также результаты лечения. Экспрессия CD30 наблюдалась у 14% больных ДВКЛ. У больных CD30+ ДВКЛ отмечены лучшие результаты общей 5-летней выживаемости (79% и 59% соответственно, р=0,001), а также выживаемости без прогрессирования (р=0,003). Благоприятное прогностическое значение экспрессии CD30 отмечалось как в группах GCB, так и АВС. Профили генной экспрессии выявили повышение экспрессии генов , подавляющих активацию NFkB и выживаемости лимфоцитов, а также подавление генов, кодирующих сигналинг В-клеточного рецептора, пролиферацию, а также выраженные цитокиновые и стромальные сигнатуры у больных CD30+ ДВКЛ, указывая на различные молеклярные основы благоприятного прогноза CD30+ ДВКЛ. Всё это вместе взятое указывает на то, что CD30+ ДВКЛ является отдельной подгруппой ДВКЛ. Опухолевое микроокружение. В последние годы очень важная роль в исследовании неходжкинстких лимфом уделяется характеристике не только опухолевого субстрата, но и клеток неопухолевого микроокружения. Наибольшее распространение эти исследования получили при фолликулярной лимфоме. Изучение профилей генной экспрессии опухолевой ткани фолликулярной лимфомы позволило установить, что иммунный ответ 1 (IR1) определяется присутствием Т-лимфоцитов, а иммунный ответ 2 (IR2) – макрофагов. Данные профили генной экспрессии имели четкую связь с прогнозом фолликулярной лимфомы. Т-клеточный ответ (IR1) определял благоприятный прогноз, а выраженная макрофагальная реакция, напротив, неблагоприятный (Dave S.S. et al., 2004). Дальнейшие исследования, направленные на углубленное изучение данного феномена иммуногистохимическим методом, подтвердили первоначальные генные находки (Farinha P. et al., 2005) – была установлена неблагоприятная роль выраженной макрофагальной реакции (CD68) при фолликулярных лимфомах. При диффузной В-крупноклеточной лимфоме подобные исследования также ведутся. Установлена неблагоприятная роль повышения интратуморальных макрофагов (CD68), связанная с развитием химиорезистентности у больных ДВКЛ (Marinaccio C. et al., 2014; Cai Q.C. et al., 2012). Вместе с тем, единого мнения относительно роли макрофагов в прогнозе ДВКЛ не существует. Одна из точек зрения свидетельствует о благоприятной роли инфильтрации CD68+ макрофагами и неблагоприятной роли CD163+ макрофагов (Nam S.J. et al., 2014). Наличие CD4+ Т-клеточной инфильтрации ДВКЛ имеет связь с благоприятным прогнозом, и данный факт сохраняет свое значение в эру ритуксимаба (Ahearne M.J. et al., 2014; Keane C. et al., 2014). Т-клеточная (CD3) и CD8+ инфильтрации ДВКЛ играли благоприятную роль при первичных костных ДВКЛ (Rajnai H. et al., 2014). Инфильтрация ДВКЛ Т-клетками памяти и наличие дендритических клеток явились факторами благоприятного прогноза, а CD8+ Т-клетки играли неблагоприятную роль (Galand С. et al., 2012). В 1019 случаях различных лимфом (Tzankov et al., 2008) проведена оценка распределения и биологической значимости регуляторных клеток на основании маркера FOXP3, так как он дает возможность более точного определения этой клеточной популяции (Hori S et al, 2003; Fontenot JD et al, 2005) и необходим для осуществления супрессорной функции Т-регуляторных клеток. Количество FOXP3+ Т-клеток при В- и Т-клеточных лимфомах было различным – от 0 до 882 клеток на мм2, а при классической лимфоме Ходжкина от 0 до 626клеток на мм2. Наиболее высокие цифры были при фолликулярной лимфоме, ангиоиммунобластных Т-клеточных лимфомах, классической лимфоме Ходжкина с нодулярным склерозом, первичной медиастинальной В- крупноклеточной лимфоме и периферических Т-клеточных лимфомах, низкие значения отмечались при лимфомах маргинальной зоны, мантийноклеточных лимфомах и богатой лимфоцитами классической лимфоме Ходжкина. При всех вариантах первичной диффузной В-крупноклеточной лимфомы установлена достоверная взаимосвязь между количеством FOXP3+ клеток/мм2 и числом CD3+ T-лимфоцитов, однако не выявлено взаимосвязи с количеством CD4+ тумор-инфильтрирующих лимфоцитов. При ДВКЛ, развивающейся из ФЛ, отмечено снижение количества FOXP3+ Т-клеток (33/мм2) в сравнении с ФЛ (94/мм2), в то время как при развитии ДВКЛ из ХЛЛ или из лимфомы маргинальной зоны изменений числа FOXP3+ Т-клеток не отмечено. Важно отметить, что при ДВКЛ абсолютное число FOXP3+ клеток имело прогностическую значимость, было взаимосвязано с показателями общей выживаемости. Считается, что иммунный ответ оказывает сильное влияние на клинический исход после химиотерапии. Экспрессия генов МНС II класса коррелирует с благоприятным прогнозом (Miller T.P. et al., 1988; Rosenwald A. et al., 2002; Veelken H. et al., 2007). Потеря экспрессии генов и белка MHC II у больных ДВКЛ коррелирует со сниженным количеством CD8 T-клеток и худшими результатами лечения (Rimza L.M. et al., 2004). Таким образом, ДВКЛ является наиболее частой периферической агрессивной лимфомой взрослых, современные методы лечения, включающие ритуксимаб, позволяют достичь излечения примерно у половины больных. Совершенствование диагностики заболевания может быть связано с более точной оценкой мембранной экспрессии антигена CD20. Важную роль в прогнозе заболевания может сыграть изучение фенотипа ДВКЛ, прогностической значимости экспрессии активационных антигенов опухолевых клеток и клеток микроокружения. ГЛАВА II. ХАРАКТЕРИСТИКА БОЛЬНЫХ И МЕТОДЫ ИССЛЕДОВАНИЯ. Настоящая работа выполнена в отделении химиотерапии гемобластозов НИИ клинической онкологии ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН (директор – академик РАН и РАМН М.И.Давыдов). Для решения поставленных задач исследованы 338 больных диффузной Вкрупноклеточной лимфомой. Исследование проведено у 338 больных диффузной В-крупноклеточной лимфомой (164 мужчины и 174 женщины) в возрасте от 14 до 90 лет (медиана 58). Всем больным диагноз диффузной В-крупноклеточной лимфомы был установлен иммуноморфологическим методом в ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН с 1995 по 2009г. В исследование включены только больные неспецифицированной диффузной В-крупноклеточной лимфомой (ДВКЛ), больные со специфическими вариантами ДВКЛ (лимфомы ЦНС, первичная медиастинальная В-крупноклеточная лимфома и т.д.) были исключены из анализа. Анализ клинических факторов и результатов лечения проведен у больных, проходивших обследование и лечение в поликлинике для взрослых или в отделении химиотерапии гемобластозов ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН. Всем больным было проведено стандартное общеклиническое обследование, включающее современные методы диагностики онкогематологических заболеваний. Морфологическая диагностика диффузной В-крупноклеточной лимфомы производилась в отделе патологической анатомии опухолей человека НИИ клинической онкологии ФГБУ РОНЦ им. Н. Н. Блохина РАМН (зав. – проф. А.И. Карселадзе) по результатам гистологического исследования опухолевой ткани в соответствии лимфоидной с тканей критериями Всемирной классификации Организации опухолей кроветворной Здравоохранения 2008 и года (Swerdlow S.H. et al., 2008). Материал биопсии фиксировали в нейтральном формалине, заливали в парафин, окрашивали гематоксилином и эозином, пикрофуксином, метиловым зеленым – пиронином (по Браше). Исследование гемопоэза. Забор костного мозга производился в объеме 0,3 – 0,5ml. Полученный материал помещался в вакутейнер с консервантом К2ЭДТА, тщательно перемешивался, маркировался и направлялся в лабораторию. Морфологическое исследование пунктатов костного мозга проведено в лаборатории иммунологии гемопоэза РОНЦ им. Н.Н. Блохина (зав. лабораторией проф. Н.Н.Тупицын) ведущим научным сотрудником д.м.н. профессором М.А.Френкель. В лаборатории определялась клеточность аспирата на гематологическом анализаторе Micros 60, подсчитывалось число мегакариоцитов в камере Горяева, приготавливались 6 мазков пунктата для морфологического исследования. Мазки фиксировались с помощью красителей методом Май-Грюнвальда и окрашивались по Романовскому-Гимзе, затем промывались проточной водой и высушивались. Далее двумя экспертами-гемоцитологами выполнялось микроскопическое исследование костного мозга - подсчет и описание миелограммы. Мазки изучали под иммерсионным увеличением (100х10). Подсчитывались: клеточность костного мозга, число мегакариоцитов и определялся состав (характер) аспирата (однородный или полиморфный), а так же наличие несвойственных клеточных элементов для нормального костного мозга. Подсчет осуществлялся двумя врачами. В качестве норм показателей аспиратов костного мозга и периферической крови использовались данные Соколова В. В. и Грибовой И. А. (1972), эти расчетные показатели соответствуют M±1,5σ и включает до 80 – 90% нормальных наблюдений. Более полную информацию для оценки костномозгового кроветворения получали при расчете индексов миелограммы: - индекс созревания нейтрофилов (ИСН) отражает соотношение молодых (юных) нейтрофильных гранулоцитов к зрелым нейтрофилам костного мозга. В норме данное соотношение составляет 0,5 – 0,9. - индекс созревания эритрокариоцитов (ИСЭ) показывает соотношение гемоглобинизированых эритрокариоцитов (полихроматофильных и оксифильных) к количеству всех клеток эритроидного ростка. Нормальное значение этого индекса составляет 0,7 – 0,9. - лейкоэритробластическое соотношение (Л/Э). Это индекс процентного соотношения суммы гранулоцитов общему содержанию ядерных элементов эритроидного ряда (от пронормобластов до оксифильных нормобластов). В норме соотношение составляет 2,1 – 4,5. Приводим в качестве примера основные показатели миелограммы с указанием норм, используемых в лаборатории иммунологии гемопоэза РОНЦ имени Н.Н.Блохина. МИЕЛОГРАММА N ист.болезни Ф.И.О. Диагноз Миелокариоциты Дата Отделение: (41,6-195) Бласты Мегакариоциты в препарате: (0,2-0,6) Гранулоцитарный росток Промиелоциты Миелоциты Метамиелоциты Палочкоядерные Сегментоядерные Сумма гранулоцитов Индекс созревания нейтрофилов (1,0-4,1) нейтроф (7,0-12,2) (8,0-15,0) (12,8-23,7) (13,1-24,1) эозиноф (0-1,0) (0-1,2) (0,1-1,2) (0,4-2,4) (57,1-66,5) (0,5-0,9) базофилы 0-0,4 Моноцитарный росток Монобласты Промоноциты Моноциты 0 0 (0,7-3,1) Лимфоидный росток Лимфоидные клетки Пролимфоциты Лимфоциты 0 0 (4,3-13,7) Плазмобласты Проплазмоциты Плазмат. клетки 0 0 (0,1-1,8) Эритроидный росток Пронормобласты Нормобласты базофильные Нормобласты полихроматофильные Нормобласты оксифильные Сумма клеток эритроидного ряда Индекс созревания эритроидных клеток Лейко-эритробластическое соотношение После дифференцированного (0,2-1,1) (1,4-4,6) (8,9-16,9) (0,8-5,6) (14,5-26,5) (0,7-0,9) (2,1-4,5) подсчета миелограммы оценивались морфологические особенности клеток, кинетика их созревания и составлялось заключение по миелограмме в целом. В описании миелограммы отмечалось наличие качественных и количественных особенностей отдельных ростков кроветворения и морфологических признаков патологически измененных клеток. По результатам подсчета клеточного состава и соотношения клеток костного мозга и их морфологических особенностей формулировалось заключение. Иммунологическое исследование опухолевых клеток для установления варианта неходжкинской лимфомы осуществлялось в соответствии с критериями классификации ВОЗ (2008). Иммунофенотипирование клеток материала биопсии опухоли в большинстве случаев проводилось методом иммунофлуоресцентного окрашивания свежезамороженных (криостатных) срезов в лаборатории иммунологии гемопоэза НИИ клинической онкологии ФГБНУ «РОНЦ им. Н. Н. Блохина» к.м.н. в.н.с. Е.Н.Шолоховой. Панель моноклональных антител включала антитела к Влинейным антигенам (CD19, CD20, CD21, CD23, СD37), Т-линейным антигенам (CD3, CD5, CD7), антигенам гистиоцитов и макрофагов (CD163), антигенам фолликуляных дендритных клеток (CD21, CD23), антигенам плазматических клеток (CD38), нелинейным антигенам (CD10, CD38, HLA-DR), общелейкоцитарному антигену CD45, антитела к bcl-2. Иммунофенотипирование опухолевых клеток и клеток микроокружения с помощью моноклональных антител по криостатным срезам. Непрямая реакция поверхностной иммунофлуоресценции (РИФ) на криостатных срезах. Замороженные срезы (толщина 4-6 мкм) помещали по три среза на поверхность обезжиренных предметных стекол. Срезы фиксировали в ацетоне при комнатной температуре в течение 4 секунд. Перед окраской антителами срезы фиксировали в течение 10 минут в ацетоне при 4С. Последующие этапы реакции проводили при комнатной температуре во влажной камере. Инкубировали срезы 10 минут в среде 199 рН 7,2-7,4. Моноклональные антитела наносили на 30 минут. Отмывали в среде 199 10 минут. Наносили ФИТЦ-меченные F(ab)’2 –фрагменты антисыворотки против глобулинов белой мыши на 30 минут. Отмывали в среде 199 10 минут. Клетки консервировали 50% глицерином на физиологическом растворе. Срезы накрывали покровным стеклом, и характеризовали антигенположительные клетки и структуры. Специфические реакции учитывали на микроскопе Axioplan-2 (Германия). Прямая реакция иммунофлуоресценции на криостатных срезах. Срезы опухолевой ткани фиксировали в ацетоне, как описано выше. Отмывали в среде 199 10 минут. Затем наносили ФИТЦ- меченые антисыворотки против иммуноглобулинов человека или моноклональные антитела и инкубировали 30 минут. Отмывали в среде 199 10 минут. Клетки консервировали 50% глицерином на физиологическом растворе и учитывали специфическое свечение на люминисцентном микроскопе. Учет реакций. После реакции иммунофлуоресценции препараты просматривали на люминисцентном микроскопе Axioplan (Германия) при увеличении объектива х25 или х40, окуляра х10. Положительными считали клетки, имеющие поверхностное или цитоплазматическое свечение. Реакция клеток в контроле отсутствовала. Иммунофенотипирование опухолевых клеток. При иммунофенотипировании опухолевых клеток результаты реакций учитывали полуколичественным методом: Отрицательная реакция (-): менее 10% антигенположительных опухолевых клеток. Мозаичная реакция (+/-): антиген присутствовал на части (от 10% до 80%) опухолевых клеток. Мономорфная реакция (+): антиген экспрессируется большинством (более 80%) опухолевых клеток. Иммунофенотипирование клеток неопухолевого микроокружения (Т-клетки, фолликулярные дендритные клетки, плазмоциты, макрофаги). При иммунофенотипировании клеток неопухолевого микроокружения в гистологических срезах опухоли выделяли 3 типа иммунных реакций: отрицательная реакция - антигенположительные клетки не определяются или определяются небольшое их количество в препарате; умеренный тип антигенположительных небольшими группами; реакции клеток, - умеренное расположенных количество разрозненно или выраженный тип реакции - множество антигенположительных клеток в срезе, могут встречаться крупные группы и инфильтраты из этих клеток. Для установления степени распространенности опухолевого процесса использовалась классификация, принятая в Ann Arbor (1971г.) и дополненная в Costswald (1989). Распределение пациентов по стадиям приведено в таблице 2. Таблица 2. Распределение больных диффузной В-крупноклеточной лимфомой по стадиям (Ann Arbor, 1971) Стадия заболевания Число пациентов Абс % I 13 10,7 II 35 28,7 III 15 12,3 IV 59 48,4 Факторы прогноза при диффузной В-крупноклеточной лимфоме оценивали на основе международного прогностического индекса – IPI. С учетом возраста больных использовали скорректированный IPI (aaIPI). На основании этих индексов выделяли группы риска диффузной В-крупноклеточной лимфомы: низкий риск, низкий промежуточный риск, высокий промежуточный риск, высокий риск. Общее состояние пациентов оценивали по шкале ECOG в баллах: 0 – нет симптомов заболевания, 1 – есть симптомы, но работоспособность и повседневная активность сохранены, 2 – пациент проводит менее половины дневного времени в постели, 3 – пациент проводит в постели половину дневного времени и более, 4 – пациент не встает, требует ухода. В ФГБУ «РОНЦ имени Н.Н.Блохина» больные получали стандартную полихимиотерапию, применяемую при лечении диффузной В-крупноклеточной лимфомы, в абсолютном большинстве случаев – протокол CHOP. В последние годы обязательным компонентом проводимого лечения были моноклональные CD20 антитела (ритуксимаб), протокол R-CHOP. В работе была проведена оценка эффективности примененных методов полихимиотерапии. Анализ непосредственных и отдаленных результатов терапии проведен с учетом международных стандартизованных критериев ответа на лечение при неходжкинских лимфомах (Cheson B.D. et al.,1999). Полные ремиссии устанавливались только при полном отсутствии всех проявлений болезни по клиническим данным и результатам обследования, а также при исчезновении симптомов, обусловленных опухолью, нормализации уровня лактатдегидрогеназы, размеров ранее увеличенных органов и состава костного мозга при повторных обследованиях. Основным условием полной ремиссии являлось сокращение размеров лимфатических узлов до состояния, когда они полностью перестают пальпироваться, либо не определяются инструментальными методами обследования. Частичные ремиссии устанавливались при уменьшении всех поражений более чем на 50% и отсутствии новых. Стабилизацией заболевания расценивалось состояние, при котором не отмечено ни регрессии опухоли в процессе полихимиотерапии, ни прогрессирования с увеличением опухолевой массы или появлением новых очагов поражения. Рецидив/прогрессирование заболевания характеризовались появлением новых очагов поражения, либо возобновлением роста опухоли в зонах первичного поражения, более чем на 25%. Отдаленные результаты лечения оценивались путем построения кривых выживаемости: общая выживаемость (overall survival - OS) – для построения кривой, отражающей общую выживаемость, сроки жизни больных рассчитывались от даты установления диагноза до смерти от любой причины или до даты последней явки больного; Статистическая обработка результатов исследования проводилась с использованием программы SPSS 16.0 for Windows. Статистический анализ общей выживаемости с расчетом медианы и сроков жизни больных производился по методике Kaplan-Meier (1958). ГЛАВА III. РОЛЬ КЛИНИЧЕСКИХ И ЛАБОРАТОРНЫХ ФАКТОРОВ В ПРОГНОЗЕ ДВКЛ Основной целью работы была оценка значимости результатов углубленного иммунологического исследования опухолевой ткани (иммунофенотип опухоли, роль микроокружения) и гемоцитологического анализа клеток костномозгового пунктата в клиническом течении и прогнозе ДВКЛ. Однако прежде, чем анализировать эти специальные данные мы оценили, насколько стандартные клинические и лабораторные признаки сохраняют свое прогностическое значение в условиях современного лечения диффузной В-крупноклеточной лимфомы. В работе оценены факторы прогноза, учитываемые при формировании групп риска в соответствии с Международным прогностическим индексом (IPI) и расцениваемые как неблагоприятные: возраст больных 60 лет и старше, III и IV стадии болезни, повышенные уровни лактат-дегидрогеназы, оценка по шкале ECOG >= 2, наличие более одного экстранодального участка поражения. Кроме того, изучена роль суммарного балла IPI, а также принадлежность больного к той или иной группе риска (низкий, промежуточный низкий, промежуточный высокий, высокий). Согласно Международному прогностическому индексу большой прогностической ценностью характеризуется возраст больных. Принято считать, что прогноз у больных 60 лет и старше значительно хуже, чем у больных моложе 60 лет. В анализируемой нами группе больных возраст пациентов был в диапазоне от 14 до 90 лет (медиана 56 лет). Больных 60 лет и старше (прогностически не благоприятная группа) было 153. Анализ общей выживаемости проведен у 135 больных, из них к прогностически неблагоприятной (старше 60 лет) группе относилось 50 (37%). Сравнение показателей общей выживаемости не выявило различий в зависимости от возраста пациентов, р=0,65 (рисунок 1). Как видно из представленных графиков общей выживаемости, не установлено прогностической значимости пожилого возраста больных. У больных моложе 60 лет средний период наблюдения составил 100,8±121,3 мес (80,7-121,3 мес); медиана 71,0±36,7 мес. В старшей возрастной группе средняя продолжительность наблюдения составила 111,0±17,2 мес (77,3-144,7 мес), медиана 57,0±21,1 мес. Рисунок 1. Выживаемость больных ДВКЛ различных возрастных групп: моложе 60 лет, 60 лет и старше. Важным фактором международного прогностического индекса, ухудшающим прогноз ДВКЛ, являются поздние стадии заболевания. В нашем исследовании подтверждено, что стадия заболевания имела отчетливое влияние на прогноз у больных ДВКЛ (р=0,013 /тест Бреслоу/ - 0,054 /тест лог-ранк/), рисунок 2. Больных с I стадией - 10, со II-й – 31, с III-й – 13, с IV-й – 47. По мере нарастания стадии заболевания кривые выживаемости снижаются и прогноз ухудшается. Как видно на представленном графике (рис. 2), кривые общей выживаемости больных с III и IV стадиями соответствуют значительно меньшей продолжительности жизни больных, чем при I и II стадиях. Рис. 2. Выживаемость больных ДВКЛ в зависимости от стадии заболевания. Поскольку фактором неблагоприятного прогноза в международном прогностическом индексе является наличие у больных III и IV стадий, мы сравнили показатели общей выживаемости больных с I и II стадиями (41 больной) с выживаемостью больных III и IV стадиями (60 больных), рис. 3. Получены высокодостоверные результаты, р по логранк 0,01, по Бреслоу 0,005, по ТаронУорен 0,007. Рис. 3. Сравнение общей выживаемости больных I-II и III-IV стадиями диффузной Вкрупноклеточной лимфомы. Одним из важных показателей, учитываемых при определении группы риска в соответствии с международным прогностическим индексом IPI, является уровень лактатдегидрогеназы в сыворотке крови больных ДВКЛ. Повышенные уровни фермента расцениваются как прогностически неблагоприятный признак. Уровни ЛДГ были оценены у 97 больных, они находились в диапазоне 228,0 – 5090,0, медиана 583. Нормальные значения ЛДГ имели место у 30 больных (30,5%), повышенные – у 67 (69,5%). Общая выживаемость оценена у 78 больных: нормальные уровни ЛДГ – 26, повышенные – 52. Различия в выживаемости между этими группами были близки к достоверным (р = 0,133-0,168), рисунок 4. Рисунок 4. Кривые общей выживаемости больных ДВКЛ в зависимости от уровней ЛДГ в сыворотке крови (сплошная линия – нормальные уровни; пунктирная линия – повышенные уровни). Общая активность пациентов, оцениваемая по шкале ECOG, также достоверно влияла на прогноз ДВКЛ. Выживаемость оценена у 75 больных. У 37 больных с наличием ECOG >=2 прогноз был достоверно хуже (р=0,01) в сравнении с больными с ECOG <2 (38 больных), рисунок 5. Рисунок 5. Выживаемость больных ДВКЛ при различных уровнях активности по шкале ECOG. Сплошная линия – ECOG менее 2; пунктирная линия – ECOG >=2. У 109 (33,4%) больных ДВКЛ анализируемой нами группы имела место экстранодальная локализация опухолевого поражения. По частоте встречаемости экстранодальные локализации ДВКЛ распределились следующим образом, таблица 3. Таблица 3. Характеристика экстранодальных локализаций ДВКЛ Экстранодальная локализация Количество наблюдений Желудок 34 Кожа 7 Яички 8 Мягкие ткани 43 Селезенка 5 Кишечник 2 Орбита 1 Печень 3 Корень языка 1 Гортань 1 Легкое 1 Влагалище 2 Большой сальник 1 Всего 109 Показатели общей выживаемости больных ДВКЛ оценены у 134 больных, из них с наличием экстранодальной опухоли – 49. Сравнение кривых выживаемости у больных с наличием экстранодальной локализации опухолевого поражения и у больных с отсутствием такового представлены на рисунке 6. Как видно, достоверного влияния на прогноз наличие экстранодальной опухоли не оказывало, р=0,45-0,608. Рисунок 6. Кривые выживаемости больных ДВКЛ с наличием экстранодальной опухоли и без таковой. Следует отметить, что в индексе IPI к прогностически неблагоприятным относятся случаи ДВКЛ с наличием 2 и более экстранодальных очагов поражения. В целом по группе ДВКЛ наличие 2 и более экстранодальных локализаций отмечено в 38 случаях. При оценке прогноза у 103 больных подобных наблюдений было 33. Они характеризовались достоверно худшими показателями общей выживаемости в сравнении с больными, у которых было не более 1 участка экстранодального поражения при диффузной В-крупноклеточной лимфоме, р=0,005-0,027, рисунок 7. Рисунок 7. Показатели выживаемости больных ДВКЛ при наличии не менее 2 участков экстранодального поражения являются более низкими. Учитывая тот факт, что наличие 2 и более очагов экстранодального поражения, как правило, ассоциировалось с распространенными стадиями ДВКЛ, мы провели соответствующий анализ. Действительно, III-IV стадии ДВКЛ в группе пациентов с наличием 2 и более экстранодальных поражений встречались в 97,4% случаев, лишь в 1 наблюдении была I-II стадия. По этим причинам, определить, что важнее в прогнозе ДВКЛ – поздние стадии или наличие 2 и более экстранодальных поражений достаточно сложно. Это обусловлено тем, что распространенность процесса может определяться генерализованным нодальным поражением, а изолированные ДВКЛ двух и более экстранодальных зон по нашим данным встречаются редко. Мы оценили, насколько сумма баллов IPI влияет на прогноз ДВКЛ. По суммарному баллу IPI больные распределились следующим образом: 0 баллов – 15 больных, 1 – 18, 2 – 6, 3 – 3, 4 – 24, 5 – 12. Как видно, при нарастании числа факторов неблагоприятного прогноза выживаемость ухудшалась, р = 0,076-0,103. Кривые выживаемости представлены на рисунке 8. Рисунок 8. Общая выживаемость больных ДВКЛ в зависимости от суммы факторов неблагоприятного прогноза, р = 0,076-0,103. В зависимости от количества неблагоприятных прогностических факторов при ДВКЛ выделяют группы риска. К группе низкого риска (0 или 1 фактор неблагоприятного прогноза) низкому/промежуточному риску нами (2 отнесены фактора) 33 – больных, 6 больных, к к промежуточному/высокому (3 фактора) – 3, к высокому (4 или 5 факторов) – 36. Сравнение кривых выживаемости показало существование близких к достоверным (р=0,081-0,095) различий в прогнозе больных в зависимости от их принадлежности к той или иной группе риска, рисунок 9. Рисунок 9. Общая выживаемость больных ДВКЛ в зависимости от группы риска по IPI. Поскольку выживаемость в группах низкого и низкого промежуточного риска не различалась, эти группы были объединены. Аналогичным образом поступили с группами промежуточного высокого и высокого риска. Таким образом, в каждой из групп было по 39 больных. Разделение больных на эти 2 категории свидетельствует о наличии достоверных различий (р=0,01) в прогнозе между ними (выживаемость оценена у 78 больных, по 39 в каждой группе), рисунок 10. Рисунок 10. Общая выживаемость выживаемость больных ДВКЛ в группах условно «низкого риска» (включены больные групп низкого и промежуточного низкого рисков по IPI) и условно «высокого риска» (включены больные групп высокого и промежуточного высокого рисков по IPI). Таким образом, из числа оцененных нами клинико-лабораторных признаков, включенных в систему оценки групп риска по IPI, только три – стадия болезни, показатель активности больного по ECOG, наличие не менее двух экстранодальных зон опухолевого поражения – были достоверно связаны с прогнозом. Следует отметить, что ECOG напрямую взаимосвязан со стадией ДВКЛ и был >=2 только при распространенных стадиях ДВКЛ. Аналогичные связи имели место в анализируемой группе больных и для 2 и более экстранодальных локализаций опухоли. На основании полученных данных можно заключить, что, по-видимому, наиболее важным фактором неблагоприятного прогноза из числа включенных в IPI является наличие у больного III или IV стадий ДВКЛ. Показатели IPI на сегодняшний день остаются наиболее важными и достоверными в предсказании прогноза заболевания на момент диагностики ДВКЛ, до начала специфического лечения. Вместе с тем, хорошо известно, что при абсолютном большинстве неходжкинских лимфом и острых лейкозов чувствительность к проводимой терапии, полнота полученного эффекта являются важнейшим прогностическим фактором. Эффективность терапии оценена нами у 105 больных ДВКЛ. Выделены следующие типы ответа на проведенную терапию: Полная ремиссия (CR) Частичная ремиссия (PR) Стабилизация процесса Прогрессирование Полные ремиссии достигнуты у 24 больных (23%), частичные ремиссии – у 59 (56%), стабилизация – у 10 (10%) и прогрессирование – у 12 (11%). Таким образом, в 83% случаев достигнут выраженный клинический эффект – полная или частичная ремиссия при ДВКЛ. Влияние эффекта терапии на общую выживаемость оценено в 86 случаях: полная ремиссия – 17 пациентов, частичная – 51, стабилизация процесса – 9, прогрессирование заболевания – 9. У больных с полной или частичной ремиссиями результаты лечения были достоверно более хорошими, чем при стабилизации или прогрессировании заболевания, рисунок 11. Рисунок 11. Влияние непосредственного эффекта лечения на общую выживаемость больных ДВКЛ. Различия в выживаемости в зависимости от эффекта лечения были высокодостоверными, р = 0,001 (лог-ранк). Таким образом, достижение полной или, по крайней мере, частичной ремиссии должно являться главной целью при проведении терапии ДВКЛ. Следует отметить, что хотя результаты лечения в группах больных с достигнутыми полными или частичными ремиссиями достоверно не различались, верхняя кривая на графике, характеризующая наилучшие результаты лечения, соответствует полной ремиссии. Стабилизацию процесса, также как и прогрессирование на фоне терапии следует относить к неудачам лечения. Разумеется, непосредственный эффект терапии определяется схемой проведенного лечения. Как мы уже отмечали, лечение больных ДВКЛ проводится достаточно однотипно, и в нашем исследовании абсолютное большинство пациентов получали лечение по схеме CHOP. Однако в последние годы обязательным компонентом лечения стали моноклональные антитела к антигену CD20 (Ритуксимаб). Мы оценили, насколько добавление ритуксимаба к схемам CHOP (R-CHOP) улучшает результаты лечения больных ДВКЛ. Ритуксимаб был использован у 36 из 121 больного ДВКЛ, получавшего лечение в РОНЦ имени Н.Н.Блохина. Анализ общей выживаемости проведен у 100 больных, из которых 29 получали ритуксимаб. Как видно из графика общей выживаемости (ри. 12), статистически значимого влияния на прогноз препарат не оказывал: р по лог-ранк – 0,625; Бреслоу – 0,405; Тарон-Уорен – 0,460. Средние и медианы времени дожития больных сравниваемых групп были достаточно высокими (до 142 мес), они представлены в таблице 4. Таблица 4 Средние и медианы времени дожития в группах больных ДВКЛ, получавших и не получавших ритуксимаб Среднее Ритуксимаб Оценка a Медиана 95% доверительный 95% доверительный интервал интервал Ст. Нижняя Верхняя ошибка граница граница Оценка Ст. Нижняя Верхняя ошибка граница граница нет 102,692 10,944 81,242 124,142 55,000 26,528 3,006 106,994 есть 107,848 17,386 73,770 141,925 104,000 42,327 21,038 186,962 Всего 105,058 9,369 86,695 123,422 88,000 41,462 6,735 169,265 a. Оценивание ограничивается наибольшим временем дожития, если оно является цензурированным. Рисунок 12. Анализ выживаемости больных ДВКЛ в зависимости от включения ритуксимаба в схемы программного лечения (весь период наблюдения): сплошная кривая (0) – без рутуксимаба; пунктирная кривая (1) – с применением ритуксимаба. При анализе эффекта лечения в группах с добавлением ритуксимаба и без такового (таблица 5), статистически значимой связи не получено (р=0,64). Однако, обращает на себя внимание тот факт, что частота полных ремиссий в группе больных, получавших ритуксимаб, составила 31,3%, что значительно выше, чем частота полных ремиссий в группе сравнения (без ритуксимаба) – 19,7%. Соответственно этому, при применении ритуксимаба снизился процент случаев прогрессирования, стабилизации и частичных ремиссий. Всё это говорит о важном значении добавления ритуксимаба к программному лечению ДВКЛ. Таблица 5. Взаимосвязь показателей непосредственного ответа на лечение с применением ритуксимаба Эффект Полная ремиссия Ритуксимаб нет Частота % в строке есть Частота % в строке Итого Частота % строке Частичная Прогресси- Стабилиремиссия рование зация Итого 14 42 8 7 71 19,7% 59,2% 11,3% 9,9% 100,0% 10 16 3 3 32 31,3% 50,0% 9,4% 9,4% 100,0% 24 58 11 10 103 23,3% 56,3% 10,7% 9,7% 100,0% Внимательное рассмотрение кривых выживаемости, представленных на рисунке 12, указывает на то, что результаты анализа общей выживаемости достаточно серьезно различаются в группах больных, получавших и не получавших ритуксимаб, в течение первых 8 лет с момента постановки диагноза и начала терапии. Мы провели анализ 8-летней общей выживаемости больных ДВКЛ в зависимости от включения ритуксимаба в схемы лечения. Данные представлены на рисунке 13. Рисунок 13. 8-летняя выживаемость больных в зависимости от включения ритуксимаба в схемы программного лечения: сплошная кривая (0) – без рутуксимаба; пунктирная кривая (1) – с применением ритуксимаба. Как видно, получены высокодостоверные результаты – 8-летняя выживаемость больных ДВКЛ, получавших ритуксимаб, значительно выше, чем у больных, не получавших данный препарат, р=0,047 (тест лог-ранк). Следовательно, добавление ритуксимаба в схемы программного лечения ДВКЛ позволяет существенно увеличить частоту полных ремиссий (с 19% до 33%) и достоверно улучшить 8-летнюю выживаемость больных ДВКЛ. ЗАКЛЮЧЕНИЕ Анализ клинических факторов прогноза убедительно доказывает, что в условиях современной терапии ДВКЛ градация на группы риска в соответствии с международным прогностическим индексом (IPI) сохраняет свое значение и взаимосвязана с прогнозом ДВКЛ. Вместе с тем, такие признаки неблагоприятного прогноза как пожилой возраст больных (60 лет и старше) утратили свое значение. Повышенный уровень ЛДГ также не имел достоверной связи с выживаемостью больных ДВКЛ. Наличие двух и более зон экстранодального опухолевого поражения явилось важным фактором неблагоприятного прогноза, однако, как правило, наблюдалось при поздних стадиях ДВКЛ. По существу, главным фактором неблагоприятного прогноза явились поздние стадии опухоли (и взаимосвязанный с ними ECOG). Очень важным является достижение полной ремиссии при проведении специфического лечения у больных ДВКЛ, именно эта группа пациентов характеризуется наилучшими результатами лечения и большей продолжительностью жизни. На основании полученных нами данных можно заключить, что главным направлением улучшения прогноза ДВКЛ в современных условиях является совершенствование ранней диагностики болезни. Диагностика ДВКЛ на ранних стадиях позволит существенно улучшить прогноз при этой крайне неблагоприятной, агрессивной форме неходжкинских злокачественных лимфом. Другим важным направлением улучшения результатов лечения ДВКЛ является совершенствование терапии заболевания, достижение максимального числа полных клинико-гематологических ремиссий. Как показали наши исследования, добавление ритуксимаба к схемам лечения ДВКЛ позволяет повысить частоту полных ремиссий на 11,6% и достоверно (р=0,047) улучшает общую 8-летнюю выживаемость больных. На наш взгляд полезную информацию может дать более точная оценка прогноза на этапе диагностики опухоли, дополнение существующих клинических критериев прогноза, отраженных в Международном прогностическом индексе, молекулярными критериями, дающими наиболее полную информацию об особенностях опухолевого роста и возможной резистентности к терапии. Выделение резистентных форм ДВКЛ и разработка методов преодоления резистентности к программному лечению – одна из наиболее актуальных задач совершенствования терапии ДВКЛ. В последующих главах нами демонстрируется возможность реализации данного подхода на основе состояния костномозгового кроветворения у больных, а также особенностей иммунофенотипа и состава клеток опухолевого микроокружения при диффузной В-крупноклеточной лимфоме. ГЛАВА IV. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ПОКАЗАТЕЛЕЙ ГЕМОПОЭЗА У БОЛЬНЫХ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМОЙ. Исследование костного мозга широко используется для оценки степени распространенности опухолевого процесса у больных ДВКЛ. При анализе клинического значения состояния костномозгового кроветворения при ДВКЛ нами были отобраны 118 миелограмм без явного поражения костного мозга. В исследование включены только миелограммы больных, у которых проводилось иммунофенотипирование опухоли по свежим (криостатным) срезам. Это сделано с целью анализа взаимосвязи первичного фенотипа опухоли с особенностями кроветворения у больных ДВКЛ. Процентное содержание основных клеточных элементов в анализируемых миелограммах представлено в таблице 6. Таблица 6. Уровни основных клеточных элементов в костного мозге больных ДВКЛ Показатель Минимум N 9 Максимум Среднее Стд. ошибка Клеточность (х10 /л) 118 15,00 462,00 86,0212 7,25721 Бластные клетки 118 ,00 5,70 1,4780 ,09141 Промиелоциты 118 ,00 2,80 ,4534 ,04309 Миелоциты 118 1,60 20,50 9,4102 ,34039 Метамиелоциты 118 2,40 14,80 7,8686 ,23066 Палочкоядерные 118 4,50 32,40 21,0890 ,49891 Сегментоядерные 118 2,10 54,20 20,8797 ,79601 Индекс созр. гранулоц. 118 ,10 1,30 ,4614 ,02088 Моноциты 118 ,00 8,00 2,4576 ,13362 Лимфоциты 118 1,60 24,00 11,6729 ,48364 Плазматические клетки 118 ,00 3,20 ,9025 ,06934 Базофильные 118 ,00 7,60 1,2873 ,11191 Полихроматофильные 118 ,80 30,20 9,1703 ,54573 Оксифильные 118 1,60 33,80 10,8153 ,57010 Сумма эритрокариоцитов 118 3,60 64,40 21,3517 1,12212 Индекс созр. эритр. кл. 118 ,80 1,00 ,94 ,003 Лейко-эритроидн. соотн. 118 0,4 18,9 4,2525 0,28509 Нейтрофилы:: Нормобласты: Ориентируясь на показатели нормы, мы выделили различные типы изменений по каждому показателю – снижение, нормальное содержание или повышение процентного содержания клеток. Данные представлены в таблице 7. Таблица 7. Частота изменений показателей миелограммы у больных ДВКЛ Показатель Характер изменений признака (n=118) миелограммы Снижение Норма Повышение Клеточность 36 (30,5)* 73 (61,9) 9 (7,6) Мегакариоциты 21 (17,8) 90 (76,3) 7 (5,9) Бласты 0 (0) 36 (30,5) /<1%/ 82 (69,5) />=1%/ Промиелоциты 100 (84,7) 18 (15,3) 0 Миелоциты 32 (27,2) 62 (52,5) 24 (20,3) Метамиелоциты 61 (51,7) 57 (48,3) 0 Палочкоядерные 5 (4,2) 75 (63,6) 38 (32,2) Сегментоядерные 19 (16,1) 61 (51,7) 38 (32,2) Сумма гранулоцитов 33 (28,0) 47 (39,8) 38 (32,2) Индекс созревания 66 (56,0) 47 (39,8) 5 (4,2) Моноциты 9 (7,6) 76 (64,4) 33 (28,0) Лимфоциты 10 (8,5) 65 (55,1) 43 (36,4) Плазматическ. клетки 12 (10,2) 92 (78,0) 14 (11,8) Нормобласты 81 (68,6) 35 (29,7) 2 (1,7) 67 (56,8) 39 (33,1) 12 (10,2) 0 27 (22,9) 91 (77,1) 38 (32,2) 50 (42,4) 30 (25,4) 0 16 (13,6) 102 (86,4) Нейтрофилы: нейтрофилов базофильные Нормобласты полихроматофильные Нормобласты оксифильные Сумма клеток эритроидного ряда Индекс созревания эритроидных клеток Лейко-эритробласти- 27 (22,9) 49 (41,5) 42 (35,6) ческое отношение *Абсолютное число (процент) Наряду с отклонениями в сторону снижения или повышения тех или иных показателей миелограммы, наблюдающимися у определенного процента больных, мы обнаружили типичные нарушения гемопоэза, характерные для значительной части больных ДВКЛ и взаимосвязанные с прогнозом заболевания: повышение процента бластных клеток в миелограмме, изменения в гранулоцитарном ряду дифференцировки, ускоренное созревание эритрокариоцитов. Остановимся подробно на каждом показателе миелограммы. Клеточность костного мозга изучена в 118 случаях ДВКЛ. Среднее количество миелокариоцитов в мкл костного мозга составило 86,0±7,3 х 10 3 (диапазон от 15 до 462 тыс). Клеточность была снижена у 36 больных (30,5%), находилась в нормальных пределах (41,6 – 195 тыс/мкл) у 73 больных (61,9%), гиперклеточный костный мозг наблюдали лишь в 9 случаях (7,6%). При оценке роли клеточности костного мозга нами не выявлено связи с прогнозом заболевания (общей выживаемостью) у 59 больных ДВКЛ, р=0,79. Интересные данные получены при анализе процентного содержания бластных клеток в миелограмме. Диапазон содержания бластных клеток в нормальной миелограмме колеблется от 0,2 до 0,6%. В нашей выборке среднее содержание бластов составило 1,50,09%, диапазон от 0 до 5,7%. Даже если относить к повышенным уровням таковые с наличием более 1% бластов, то повышение процента бластов отмечается у 69,5% больных. Увеличение процента бластов в миелограмме выше нормы (>0,6%) не играло роли в прогнозе ДВКЛ (не получено достоверной связи с общей выживаемостью). Однако использование в качестве порогового уровня >=1% бластов оказалось информативным. В этом случае нормальное содержание бластов отмечено у 36 больных (30,5%), повышенное – у 82 (69,5%). Выживаемость была прослежена у 57 больных ДВКЛ (максимальный срок наблюдения – 10 лет). У 17 больных содержание бластных клеток было близко к норме (<1%), у 40 больных содержание бластных клеток было повышено (>= 1%). Нормальные уровни бластных клеток были достоверно взаимосвязаны с лучшим прогнозом у больных ДВКЛ, р=0,048%, рисунок 14. Рисунок 14. Кривые общей выживаемости в группах больных ДВКЛ с нормальным и повышенным (>=1%) содержанием бластных клеток в миелограмме. Следовательно, вполне возможно, что частота поражения костного мозга при ДВКЛ и прогностическое значение этого фактора недооцениваются. В литературе существуют указания на необходимость проведения билатеральной трепанобиопсии с иммуногистохимическим исследованием (по показаниям) для более точной оценки поражения костного мозга. Это обусловлено тем, что при ДВКЛ в отличие от лейкозов имеет место очаговое поражение костного мозга. Действительно, в одном из случаев ДВКЛ с наличием в пунктате костного мозга 1,4% бластных клеток (больной Б-н) нами проведена трепанобиопсия костного мозга с иммуногистохимическим исследованием. Преобладали мелкие клетки – Тлимфоциты (CD3+) и В-лимфоциты (CD20+) c формированием нодулей, в центре некоторых из них отмечалась сеть CD21+ фолликулярных дендритных клеток. На одном из участков среза паратрабекулярно отмечено плотное скопление крупных клеток с ядерной атипией и бластной структурой хроматиа, позитивных в реакции на CD20. Это позволило установить минимальное поражение костного мозга при ДВКЛ в данном случае. Учитывая тот факт, что главным клиническим фактором, ухудшающим прогноз ДВКЛ, является наличие у больного III/IV стадий заболевания, мы сопоставили, насколько повышение уровня бластов в миелограмме до 1% и выше ассоциировано со степенью распространенности процесса, таблица 8. Таблица 8. Взаимосвязь между увеличением процента бластов в миелограмме и стадией ДВКЛ. Стадия Частота, %% Процент бластов <1% I/II Частота, % в стадии I/II III/IV Частота, % в стадии III/IV Итого Частота %% Итого >=1% 7 12 19 36,8% 63,2% 100,0% 11 28 39 28,2% 71,8% 100,0% 18 40 58 31,0% 69,0% 100,0% Как видно из таблицы 8, эти признаки не взаимосвязаны, р=0,55. Следовательно, повышение уровня бластов в миелограмме является признаком неблагоприятного прогноза, не взаимосвязанным со степенью распространенности процесса – наличием поздних (III-IV) стадий заболевания. Повышение уровня бластных клеток было взаимосвязано лишь с одним из иммунофенотипических признаков первичной опухоли – экспрессией рецептора CD21. Одновременное исследование экспрессии CD21 на опухолевых клетках и анализ гемопоэза проведены у 110 больных ДВКЛ. Положительная реакция отмечена в 14 случаях (12,7%), что точно совпадает с частотой экспрессии CD21 в целом по группе (33/226, 12,4%). В CD21-позитивной группе ДВКЛ уровни бластных клеток составили 1,99±0,35% (n=14), что достоверно выше (р=0,032), чем в CD21-негативной группе (1,4±0,09%, n=96). Следует отметить, что экспрессия CD21 на опухолевых клетках наблюдается значительно реже, чем прогностически значимое повышение уровня бластов (>=1%) в миелограмме (у 69,5% больных). Мегакариоциты. Уровень мегакариоцитов оценен у 118 больных ДВКЛ. Снижение их количества в миелограмме отмечено в 21 случае (17,8%). Нормальные уровни – в 90 (76,3%), повышение – лишь у 7 больных (5,9%). Показатели выживаемости оценены у 59 больных ДВКЛ:со сниженными уровнями мегакариоцитов – 11, с нормальными – 44, с повышеннными – 4. Достоверных различий в выживаемости между группами не обнаружено, р-0,16-0,38. Промиелоциты. При оценке уровней промиелоцитов в костном мозге больных ДВКЛ мы придерживались норм Соколова и Грибовой (1972): 1,0-4,1%. У больных ДВКЛ среднее содержание промиелоцитов составило 0,45±0,04% (диапазон от 0 до 2,8%). В большинстве случаев отмечались сниженные уровни промиелоцитов – 100 больных (84,7%), у остальных 18 больных – нормальные уровни (15,3%). Показатели выживаемости оценены у 59 больных этой группы: у 53 промиелоциты были снижены, у 6 – повышены. На выживаемость больных ДВКЛ этот показатель не влиял (р=0,1), несколько лучшие результаты были в группе с нормальным содержанием промиелоцитов. Нейтрофильные миелоциты при ДВКЛ находились в диапазоне 1,6-20,5%, среднее 9,4±0,34%. Нормальные уровни этих клеток составляют от 7 до 12,2%, подобные значения отмечены у 62 больных (52,5%). Сниженные уровни имели место у 32 больных (27,2%), повышенные – у 24 (20,3%). Показатели выживаемости изучены у 59 больных (снижение нейтрофильных миелоцитов – 16, норма – 27, повышение – 16). Повышение уровней нейтрофильных миелоцитов достоверно ассоциировалось с ухудшением общей выживаемости больных, р=0,014. При сравнении выживаемости больных в 2 группах (с нормальным /n=25/ и повышенным /n=15/ числом нейтрофильных миелоцитов в миелограмме) получены высокодостоверные различия, р=0,008, рисунок 15. Рисунок 15. Кривые общей выживаемости больных ДВКЛ в зависимости от числа нейтрофильных миелоцитов. Метамиелоциты нейтрофильные. Содержание метамиелоцитов оценено в костном мозге 118 больных ДВКЛ. Сниженные уровни (менее 8%) отмечены у 61 пациента (51,7%), нормальные (8,0-15,0%) – у 57 (48,3%), повышенние уровня метамиелоцитов не наблюдали ни в одном случае. Оценка выживаемости проведена у 59 больных (29 со сниженными и 30 с нормальными уровнями метамиелоцитов). Взаимосвязи процентного содержания метамиелоцитов с показателем общей выживаемости не выявлено, р = 0,98. Палочкоядерные нейтрофилы. Уровни этих клеток в миелограмме оценены у 118 больных ДВКЛ. Процентное содержание было сниженным (менее 12,8%) лишь у 5 больных (4,2%), нормальным (12,8-23,7%) – у 75 (63,6%), повышенным – у 38 (32,2%). Взаимосвязь с выживаемостью оценена у 59 пациентов (снижены – 3, норма – 37, повышены - 19). Выживаемость больных ДВКЛ не была связана с уровнями палочкоядерных нейтрофилов в костном мозге (р=0,56). Наихудший прогноз имели больные со сниженными уровнями палочкоядерных нейтрофилов, но, поскольку эта группа малочисленна (3 больных), различия не достоверны. Сегментоядерные нейтрофилы. Содержание этих клеток в костном мозге оценено у 118 больных ДВКЛ. Средние уровни сегментоядерных нейтрофилов в миелограмме составили 20,9±0,8%, диапазон 2,1-54,2%. В 19 (16,1%) случаях отмечалось снижение процента сегментоядерных нейтрофилов менее 13,1%, у 61 больного (51,7%) – нормальные уровни, у 38 (32,2%) пациентов отмечались повышенные (более 24,1%) уровни. Выживаемость оценена у 59 больных ДВКЛ (снижение – 9, норма – 28, повышение – 22). Случаи с нормальными и повышенными уровнями не различались по прогнозу, а пациенты со снижением сегментоядерных нейтрофилов характеризовались плохим прогнозом. При сравнении показателей выживаемости в трех группах различия были близки к достоверным, р=0,084. При попарном сравнении групп больных с различным содержанием сегментоядерных нейтрофилов различия были еще более значимыми. Сравнение выживаемости в группах больных ДВКЛ со сниженным /n=9/ и повышенным /n=26/ содержанием сегментоядерных нейтрофилов костного мозга выявило достоверные различия, р= 0,003, рис. 16. Рис. 16. Выживаемость больных ДВКЛ в группах с повышенным содержанием сегментоядерных нейтрофилов костного мозга и со сниженным количеством этих клеток. Таким образом, при анализе гранулоцитарного ростка гемопоэза у больных ДВКЛ получены новые, весьма интересные данные. Два главных фактора влияли на прогноз – уровень нейтрофильных миелоцитов и содержание сегментоядерных форм. Мы не обнаружили взаимосвязи повышения уровня нейтрофильных миелоцитов с иммунофенотипическими признаками первичной опухоли. Снижение уровня сегментоядерных нейтрофилов наблюдалось вдвое чаще у больных с CD38+ иммунофенотипом ДВКЛ (20,3% и 10,2%). При оценке по таблицам сопряженности признаков экспрессия CD38 на клетках ДВКЛ была достоверно взаимосвязана с уровнем сегментоядерных нейтрофилов в костном мозге больных, р=0,016. Установлена также взаимосвязь уровней сегментоядерных нейтрофилов в костном мозге с экспрессией антигена CD45 на клетках первичной опухоли. Процент сегментоядерных нейтрофилов в CD45-негативной группе был достоверно выше, чем в случаях экспрессии антигена на опухолевых клетках: 27,76,3% (n=6) и 20,50,8% (n=112), соответственно, р=0,046. Следует отметить, что в CD45-негативной группе ДВКЛ не было ни одного случая снижения сегментоядерных нейтрофилов, в то время как в группе сравнения (CD45+) снижение сегментоядерных клеток наблюдалось в 17% случаев. Уровни сегментоядерных нейтрофилов были взаимосвязаны также с экспрессией антигена CD23 на опухолевых клетках. Однако, повышения частоты случаев со сниженным процентом сегментоядерных нейтрофилов (как признака неблагоприятного прогноза) не отмечали. При оценке взаимосвязи показателей миелограммы с клетками опухолевого микроокружения значимая связь снижения уровня сегментоядерных нейтрофилов отмечена с наличием в опухолевых срезах CD23+ ФДК. При наличии CD23+ ФДК снижение сегментоядерных гранулоцитов наблюдалось вдвое реже, чем в случаях отсутствия этих клеток (9,1% и 17,0%, р=0,008). Эозинофильные гранулоциты. В нормальной миелограмме клетки этого типа малочисленны. Содержание эозинофильных миелоцитов в норме не превышает 1%. В анализируемой группе 118 больных ДВКЛ эозинофильные миелоциты составили от 0 до 4%, в среднем 0,4±0,05%; повышенные уровни отмечены лишь в 4 случаях. Содержание эозинофильных метамиелоцитов в норме не превышает 1,2%. В анализируемой группе 118 больных ДВКЛ эозинофильные миелоциты составляли от 0 до 1,8%, в среднем 0,4±0,04%; повышенные уровни отмечены у 3 больных. Содержание палочкоядерных эозинофильных гранулоцитов в норме колеблется от 0,1 до 1,2%. В анализируемой группе 118 больных ДВКЛ палочкоядерные эозинофилы составили от 0 до 2,0%, в среднем 0,5±0,04%; повышенные уровни отмечены в 6 наблюдениях, отсутствие этих клеток в миелограмме отмечено у 22 больных ДВКЛ (18,6%). Сегментоядерные эозинофилы в норме составляют 0,4-2,4% клеток в миелограмме. В анализируемой группе 118 больных ДВКЛ содержание этих клеток составило от 0 до 8%, в среднем 1,0±0,09%. Повышение сегментоядерных эозинофилов отмечено у 6 больных, снижение – у 12 (10,1%). Базофильные гранулоциты. В нормальной миелограмме миелоциты, метамиелоциты, палочкоядерные клетки этого типа отсутствуют и лишь для сегментоядерных форм допускается наличие до 0,4% клеток. При оценке 118 миелограмм не отмечено повышения базофилов ни в одном случае, у абсолютного большинства больных их содержание было равно 0. Суммарное содержание клеток гранулоцитарного ростка было снижено у 33 больных (28,0%), находилось в нормальном диапазоне (57,1-66,5%) у 47 (39,8%), было повышено у 38 (32,2%). В среднем гранулоциты составили 62,0±0,99%, диапазон – от 25,8 до 81,4%. Индекс созревания гранулоцитов был сниженным в 66 случаях (56,0%), нормальным (0,5-0,9) у 47 больных (39,8%), повышенным – лишь в 5 случаях (4,2%). Взаимосвязь между суммарным содержанием гранулоцитов и индексом созревания гранулоцитов была близка к достоверной (Хи-квадрат=8,7; р=0,069), таблица 9. Таблица 9. Взаимосвязь между суммарным содержанием гранулоцитов и индексом созревания гранулоцитов в костном мозге больных ДВКЛ. Сумма гранулоцитов Частота %% снижена Частота %% в строке норма Частота %% в строке повышена Частота %% в строке Итого Частота %% в строке Индекс созревания нейтрофилов снижен норма повышен Итого 16 12 4 32 50,0% 37,5% 12,5% 100,0% 25 20 1 46 54,3% 43,5% 2,2% 100,0% 25 12 0 37 67,6% 32,4% ,0% 100,0% 66 44 5 115 57,4% 38,3% 4,3% 100,0% Мы оценили влияние на прогноз ДВКЛ общего содержания гранулоцитов у 59 больных (снижено – 17, норма – 19, повышено – 23). Никаких различий в кривых выживаемости не отмечено, р=0,97. Влияние индекса созревания гранулоцитов на выживаемость оценено у 59 больных (снижен – 33, норма – 21, повышен – 5). Этот признак не влиял на выживаемость, р=0,4. Процентное содержание моноцитов костного мозга больных ДВКЛ составило в среднем 2,5±1,4% (0-9%). Сниженные уровни отмечены у 9 больных (7,6%), нормальные (0,7-3,1%) – у 76 (64,4%), повышенные – у 33 (28,0%). Выживаемость оценена у 59 больных (сниженные уровни моноцитов – 5, нормальные – 40, повышенные – 14). Уровни моноцитов костного мозга не имели связи с общей выживаемостью больных ДВКЛ, р=0,58. Лимфоциты. У больных ДВКЛ уровни лимфоцитов костного мозга находились в диапазоне 1,6-24,0%, среднее 11,7±0,5%. Лишь у 10 больных отмечено снижение процента лимфоцитов (8,5%), в большинстве случаев лимфоциты были в нормальном диапазоне (4,3-13,7%) – 65 больных (55,1%), у 43 пациентов (36,4%) отмечены повышенные уровни лимфоцитов костного мозга. Анализ общей выживаемости больных в зависимости от уровня лимфоцитов костного мозга проведен в 59 наблюдениях (сниженные уровни – 5, нормальные – 36, повышенные – 18). Уровни лимфоцитов костного мозга не имели связи с общей выживаемостью больных ДВКЛ, р=0,42. Содержание плазмоцитов костного мозга изучено у 118 больных ДВКЛ. Средние уровни плазмоцитов составили 0,90,07% (диапазон 0 – 3,2%). Снижение процента плазмоцитов отмечено у 12 больных (10,2%), нормальные уровни (0,11,8%) – у 92 (78%), повышенные – у 14 (11,8%). Взаимосвязь уровней плазмоцитов костного мозга с общей выживаемостью оценена у 59 больных (сниженные уровни – 5, нормальные – 40, повышенные – 14). Уровни плазмоцитов не имели взаимосвязи с прогнозом ДВКЛ, р=0,58. Эритроидный росток костного мозга у больных ДВКЛ. Нормобласты базофильные. Этот тип клеток проанализирован в костном мозге 118 больных ДВКЛ. Средние уровни базофильных нормобластов составили 1,30,1% (диапазон 0-7,6%). Сниженные уровни имели место в 81 случае (68,6%), вдвое реже отмечалось нормальное содержание этих клеток – 35 больных (29,7%), лишь в 2 случаях (1,7%) имело место повышение базофильных нормобластов. Взаимосвязь уровней базофильных нормобластов с общей выживаемостью больных ДВКЛ оценили у 59 больных (снижение – 40, норма – 18, повышение – лишь в 1 случае). Никакой связи с прогнозом заболевания (общей выживаемостью) не отмечено, р=0,86. Нормобласты полихроматофильные. В костном мозге 118 больных ДВКЛ этот тип клеток составил в среднем 9,20,5% (диапазон от 0,4 до 30,2%). У большинства больных отмечено снижение этих клеток – 68 (57,6%), у 38 (32,2%) – нормальные уровни, у 12 (10,2%) уровни полихроматофильных нормобластов были повышены. Какая-либо связь с общей выживаемостью, изученная в 59 случаях ДВКЛ (снижение полихроматофильных нормобластов – 33, норма – 20, повышение – 6), отсутствовала, р=0,57. Нормобласты оксифильные. В костном мозге 118 больных ДВКЛ этот тип клеток составил в среднем 10,80,6% (диапазон от 1,6 до 33,8%). У большинства больных отмечено повышение процента этих клеток – 91 (77,1%), у 27 (22,9%) – нормальные уровни. Изменение характера эритробластограммы установлено у 64,4% больных ДВКЛ. В норме дифференцировка эритрокариоцитов описывается характерной кривой с пиком содержания клеток на уровне полихроматофильных нормобластов. Эритробластограмма при диффузной В-крупноклеточной лимфоме в большинстве случаев (76 больных, 64,4%) характеризовалась пиком содержания эритрокариоцитов на уровне оксифильных форм, у трети больных (39 больных, 33,1%) эритробластограмма была нормальной (преобладали полихроматофильные нормобласты) и лишь в 3 наблюдениях (2,5%) отмечены равные пропорции полихроматофилов и оксифилов. В связи с этим интересно отметить, что индекс созревания эритрокариоцитов был повышен в 86,4% случаев. Это, несомненно, является типичным для ДВКЛ и новым, установленным нами признаком данного заболевания. Нормальные уровни оксифильных нормобластов характеризовали группу более благоприятного прогноза (n=12) в сравнении с группой больных с повышением оксифильных форм (n=43), р=0,041, рисунок 17. Рисунок 17. Кривые общей выживаемости больных ДВКЛ в зависимости от числа оксифильных нормобластов в миелограмме. Из числа изученных иммунофенотипических маркеров ДВКЛ (подробно описаны в следующей главе) только экспрессия антигена CD30 была взаимосвязана с содержанием оксифильных нормобластов в миелограмме. У больных с наличием антигена CD30 на клетках ДВКЛ уровни оксифильных нормобластов были близки к норме (в среднем 6,961,1%, n=10) в то время как при отсутствии антигена уровни оксифильных нормобластов были повышены (11,841,37%, n=26), p=0,044. Следовательно, экспрессия на клетках ДВКЛ антигена CD30 характеризуют группу больных, для которых прогностически неблагоприятные изменения гемопоэза (увеличение процента оксифильных нормобластов) не являются характерными. Интересно отметить, что группа CD30-позитивных больных ДВКЛ в целом характеризовалась благоприятным прогнозом (глава 5). Обусловлено ли это особенностями взаимосвязи с системой гемопоэза или особенностями роста опухолевых клеток, их чувствительностью к полихимиотерапии – предмет дальнейших исследований. Суммарное содержание клеток эритроидного ряда. В костном мозге 118 больных ДВКЛ эритрокариоциты составили в среднем 21,41,1% (диапазон от 3,8 до 64,4%). У большинства больных отмечено нормальное процентное содержание этих клеток – 50 (42,4%), у 38 (32,2%) – сниженные уровни, в 30 случаях (25,4%) – повышение. Не отмечено достоверной связи с общей выживаемостью при изучении 59 случаев ДВКЛ (повышение уровня эритрокариоцитов – 14, норма – 25, снижение 20), р=0,1-0,095. Индекс созревания эритроидных клеток. Индекс созревания эритрокариоцитов был повышен в 86,4% случаев, что, несомненно, является типичным для ДВКЛ и новым, установленным нами признаком данного заболевания. Лейко-эритробластическое соотношение. Сниженные уровни показателя отмечены у 27 больных (22,9%), нормальные (2,1-4,5) – у 49 больных (41,5%), повышенные – у 42 больных (35,6%). Выживаемость оценена у 59 больных (снижение – 13, норма – 23, повышение – 23). Группа больных с повышенным лейкоэритробластическим соотношением характеризовалась наилучшими показателями выживаемости, различия близки к достоверным, р=0,08. РЕЗЮМЕ Три главных признака, характеризующих взаимосвязь гемопоэза с прогнозом ДВКЛ, впервые установлены в нашей работе: уровень бластных клеток в миелограмме, изменения в гранулоцитарном ростке дифференцировки и изменения в эритроидном ростке дифференцировки. Нормальное содержание бластных клеток в миелограмме было характерным для группы больных ДВКЛ с более благоприятным прогнозом, а в случаях повышения уровня бластных клеток до 1% и выше отмечено достоверное (р=0,048) укорочение общей выживаемости больных. Эта группа (с повышенным уровнем бластов) была весьма многочисленной и составила 69,5% среди больных ДВКЛ. Повышение уровня бластов до 1% и выше не имело достоверной связи с III/IV стадиями ДВКЛ. В ряде случаев при повышении уровня бластов в костном мозге иммуногистохимически подтверждено поражение костного мозга. По-видимому, у больных с повышенным содержанием бластных клеток в костном мозге требуется более точное определение степени распространенности процесса по костному мозгу и проведение по показаниям иммуногистохимического исследования трепанобиоптатов костного мозга. Важно отметить, что уровни бластов в костном мозге были взаимосвязаны с иммунофенотипом ДВКЛ – экспрессией на опухолевых клетках маркера CD21. Установление этого факта открывает новые возможности исследований патогенетического каскада событий, влияющих на гемопоэз при ДВКЛ. Интересные и важные в научном и практическом аспектах данные получены при анализе гранулоцитарного ростка гемопоэза у больных ДВКЛ. Два главных фактора влияли на прогноз – уровень нейтрофильных миелоцитов и содержание сегментоядерных ухудшало форм. прогноз Повышение ДВКЛ (р=0,008). процента нейтрофильных Снижение уровня миелоцитов сегментоядерных нейтрофилов также ухудшало прогноз ДВКЛ (р=0,003). Следует отметить, что 2 эти фактора не являются редкими и встречаются в 20,3% и 16,1% больных ДВКЛ, соответственно. В целом, совокупность этих признаков свидетельствует о некотором нарушении (задержке) гранулоцитарной дифференцировки у больных ДВКЛ. Следует отметить, что хотя эти 2 признака, характеризующих гранулоцитарную дифференцировку и ухудшающие прогноз у больных ДВКЛ, были достоверно взаимосвязаны между собой (Хи-квадрат = 19,0; р=0,001 по таблицам сопряженности признаков), в группе с повышенными уровнями нейтрофильных миелоцитов пропорция больных со сниженным количеством сегментоядерных форм составила лишь 8,3%, таблица 10. Таблица 10. Взаимосвязь между уровнями нейтрофильных миелоцитов и нейтрофильных сегментоядерных клеток в костном мозге больных ДВКЛ. Миелоциты Сегментоядерные клетки снижены снижены Частота %% в ряду норма Частота %% в ряду повышены Частота %%в ряду Итого Частота %% в ряду норма повышены Итого 10 10 12 32 31,3% 31,3% 37,5% 100,0% 7 31 24 62 11,3% 50,0% 38,7% 100,0% 2 20 2 24 8,3% 83,3% 8,3% 100,0% 19 61 38 118 16,1% 51,7% 32,2% 100,0% Очень важно и то, что уровень нейтрофильных миелоцитов не имел никакой связи с поздними стадиями заболевания (р=0,86), таблица 11. Таблица 11. Взаимосвязь между уровнем нейтрофильных миелоцитов и стадией ДВКЛ Миелоциты Стадия I,II снижены Частота %% в ряду норма Частота %% в ряду повышены Частота %% в ряду Итого Частота %% в ряду Итого III,IV 5 13 18 27,8% 72,2% 100,0% 8 15 23 34,8% 65,2% 100,0% 4 10 14 28,6% 71,4% 100,0% 17 38 55 30,9% 69,1% 100,0% Вместе с тем, у больных ДВКЛ со сниженными уровнями сегментоядерных нейтрофилов в миелограмме в 90% случаев наблюдались поздние (III/IV) стадии ДВКЛ, взаимосвязь близка к достоверной (р=0,1), таблица 12. Таблица 12. Взаимосвязь между уровнями сегментоядерных нейтрофилов в миелограмме и стадией ДВКЛ Сегментоядерные нейтрофилы Стадия I,II снижены Частота %% в ряду норма Частота %% в ряду повышены Частота %% в ряду Итого Частота %% в ряду Итого III,IV 1 10 11 9,1% 90,9% 100,0% 12 17 29 41,4% 58,6% 100,0% 4 11 15 26,7% 73,3% 100,0% 17 38 55 30,9% 69,1% 100,0% Изменения в гранулоцитарном ряду дифференцировки в костном мозге больных ДВКЛ, ассоциированные с прогнозом заболевания, были взаимосвязаны с иммунофенотипом первичной опухоли и клетками опухолевого микроокружения. Это, в-первую очередь, касается снижения уровня сегментоядерных нейтрофилов. Данный показатель имел достоверную связь с CD38+ и CD45-негативным иммунофенотипами ДВКЛ, а также с наличием CD23+ фолликулярных дендритических клеток в опухолевой ткани. Изменения в эритроидном ряду дифференцировки у больных ДВКЛ характеризовались снижением уровней базофильных и полихроматофильных нормобластов у большинства оксифильных форм у 77% больных, больных. а также Нормальные повышением уровни процента оксифильных нормобластов характеризовали группу более благоприятного прогноза в сравнении с группой больных с повышением оксифильных форм. Сниженных уровней оксифильных нормобластов мы не наблюдали ни в одном случае. Таким образом, у больных ДВКЛ наблюдаются не только характерные изменения гемопоэза, затрагивающие гранулоцитарный и эритроидный ростки, но и прогностически значимые нарушения гранулоцитарной и эритроидной дифференцировки. Гемопоэз при различных стадиях ДВКЛ. Учитывая важное прогностическое значение стадии ДВКЛ, мы оценили показатели гемопоэза в зависимости от стадии процесса. Сравнили I/II и III/IV стадии поскольку именно такая градация предусмотрена в IPI, и при объединении I и II стадий, а также III и IV стадий возможно сформировать более крупнее группы сравнения, что важно для достоверности статистического анализа. Результаты сравнения представлены в таблице 13. Таблица 13. Сравнение среднего содержания различных клетчных типов костного мога больных ДВКЛ при ранних (I, II) и поздних (III, IV) стадиях заболевания Показатель Стадия Кол-во Среднее Станд. больных Р ошибка среднего Клеточность I,II 17 85,8235 13,02528 III,IV 38 93,8553 14,45179 I,II 17 1,9529 ,36270 III,IV 38 1,3684 ,12087 I,II 17 ,5412 ,17215 III,IV 38 ,4132 ,06874 Нейтр. I,II 17 9,6294 1,00102 миелоциты III,IV 38 9,6605 ,69992 Нейтр. I,II 17 8,0882 ,51105 метамиелоц. III,IV 38 7,6684 ,38242 Нейтр. I,II 17 22,9118 ,90975 палочкояд. III,IV 38 20,0421 ,95454 Нейтр. I,II 17 19,3471 1,17930 сегментояд. III,IV 38 20,7132 1,80682 Сумма I,II 17 62,4647 2,06175 гранулоц. III,IV 38 60,6211 2,15992 Индекс. созр. I,II 17 ,4529 ,04123 бласты Промиелоц. 0,73 0,057 0,4 0,98 0,53 0,07 0,63 0,6 0,47 гранулоцитов III,IV 38 ,5118 ,05051 Моноциты I,II 17 2,1941 ,22401 III,IV 38 2,3553 ,21740 I,II 17 12,0471 1,45355 III,IV 38 10,2474 ,79220 I,II 17 1,1118 ,26176 III,IV 38 ,8895 ,12428 Нормоциты I,II 17 1,2176 ,26874 базофильные III,IV 38 1,5105 ,21868 Нормоциты I,II 17 9,4588 1,07481 полихроматоф. III,IV 38 10,1132 1,07940 Нормоциты I,II 17 9,5706 1,01835 Оксифильн. III,IV 38 12,3026 1,19481 Сумма эритрокарио- I,II 17 20,2235 2,18503 цитов III,IV 38 24,1816 2,29231 Индекс созревания I,II 17 ,5118 ,02407 эритрокариоц. III,IV 38 ,4921 ,01900 Лейко-эритроидное I,II 17 3,8471 ,50345 соотношение III,IV 38 3,8658 ,47749 Лимфоциты Плазмоциты 0,66 0,25 0,390 0,44 0,71 0,16 0,29 0,55 0,98 Как видно из представленных данных, уровни большинства показателей не различались при ранних и продвинутых стадиях ДВКЛ. Следует отметить, что уровень бластных клеток, повышение которого до 1% и более в костном мозге больных ДВКЛ расценено нами как прогностически не благоприятный признак, был выше при I/II стадиях в сравнении с III/IV стадиями. Это лишний раз свидетельствует о самостоятельном значении уровня бластных клеток, не зависящем от стадии ДВКЛ, и необходимости учета данного фактора при определении вовлеченности костного мозга при ДВКЛ. Нарастание оксифильных нормобластов наблюдается при III/IV стадиях ДВКЛ в сравнении с I/II стадиями (различия не достоверны). Группа больных с нарастанием уровня оксифильных нормобластов характеризовалась нами как прогностически менее благоприятная. Это наблюдение чрезвычайно интересно, так как открывает новый патогенетический механизм реакции гемопоэза на распространенность процесса при ДВКЛ. ГЛАВА V. ИММУНОФЕНОТИП ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ. В данной главе мы рассмотрим основные иммунофенотипические маркеры, используемые для диагностики и характеристики ДВКЛ. V.1. УСТАНОВЛЕНИЕ В-ЛИНЕЙНОЙ ПРИНАДЛЕЖНОСТИ ДВКЛ С ЦЕЛЬЮ НАЗНАЧЕНИЯ ИММУНОТЕРАПИИ РИТУКСИМАБОМ. Иммуногистохимическая диагностика диффузной В-крупноклеточной лимфомы в настоящее время является комплексной и в то же время чрезвычайно упрощена. Комплексность диагностики включает, в первую очередь, разграничение герминального и АВС-типов. Упрощение состоит в том, что на практике зачастую при морфологический картине диффузной крупноклеточной лимфомы вполне достаточно подтвердить ее В-клеточную природу. Поскольку подтверждение проводится по парафиновым блокам, то чаще всего используются наиболее надежные антитела L26 (CD20). Установление В-клеточной природы опухоли необходимо для выбора правильной тактики лечения, которое при ДВКЛ включает применение Мабтеры или Ритуксимаба – моноклональных антител к антигену CD20. Эти антитела (ритуксимаб) взаимодействуют с внеклеточным доменом антигена В-клеток CD20 и вызывают гибель этих клеток различными механизмами. Парадокс состоит в том, что антитела к L26, используемые для диагностики ДВКЛ, распознают не внеклеточный домен CD20, а цитоплазматическую углеводную детерминанту антигена. Примеры практически полного отсутствия антигена на мембране, но четкой реакции с антителами L26 на срезах хорошо известны. Наиболее типичный из них - В-ХЛЛ. При ДВКЛ слабая или отрицательная экспрессия CD20 на мембране злокачественных клеток также описана. Для диагностики ДВКЛ мы пользовались иммуногистохимическим методом на криостатных срезах и использовали различные типы моноклональных антител к CD20, в том числе антитела к мембранному экстрацеллюлярному домену. В числе таких антител - отечественные антитела LT20 (А.В.Филатов, «Сорбент», Россия). Реакция антител LT20 с опухолевыми клетками ДВКЛ в ряде случаев была слабой или невыразительной, не дающей оснований установить В-клеточную природу опухоли. Для подтверждения диагноза мы использовали антитела L26. Реакция с антителами LT20 и L26 во всех случаях ставилась на серийных криостатных срезах опухолевой ткани. Сопоставление использования двух типов антител представлено в таблице 13. Таблица 13 Сопоставление двух типов антител к CD20 (LT20 и L26) при диагностике ДВКЛ МКА Тип реакции CD20 Отрицат. (LT20) Реакция L26 слабая яркая Итого 1* 3 4 Слабая 0 18 18 Яркая 1 20 21 2 41 43 Итого *Количество больных Видно, что в трех случаях отсутствия мембранного антигена и в 18 случаях слабой реакции цитоплазматическая детерминанта L26 четко выявлялась и позволяла подтвердить диагноз. Данный раздел работы подтверждает, что антитела к CD20, клон L26 позволяют с наибольшей точностью подтвердить диагноз В-крупноклеточной лимфомы. Вместе с тем, встает серьезный вопрос о том, насколько правомочно применять Мабтеру в случаях слабой или отрицательной экспрессии CD20. Для ответа на этот вопрос, по-видимому, потребуются дополнительные исследования с оценкой мембранной экспрессии антигена и соотнесением полученных данных с чувствительностью ДВКЛ к ритуксимабу. С практической точки зрения можно отметить следующее: 1. Наиболее полно и точно В-клеточная природа крупноклеточных лимфом может быть верифицирована с использованием антител к CD20, клон L26. Для диагностики ДВКЛ методом выбора является иммуногистохимическое окрашивание с антителами L26 по парафиновым блокам. 2. Для установления мембранной экспрессии антигена с целью назначения Мабтеры (ритуксимаба) целесообразно проводить окрашивание на CD20 по криостатным срезам (например, в непрямом иммунофлуоресцентном методе) с использованием моноклональных антител к экстрацеллюлярному домену антигена CD20. Хорошо известно, что уровни мембранной экспрессии пан-В-клеточных (CD19) и пан-Т-клеточных маркеров (CD7) убывают по мере дифференцировки клеток от незрелых предшественников к эффекторным этапам периферических лимфоцитов. ДВКЛ является периферической лимфомой, и мы оценили диагностическую ценность антител к CD19 у этих больных. Оценка проведена на основе сопоставления с цитоплазматической экспрессией обще-В-клеточного антигена CD20 (L26). Следует отметить, что в рутинной практике мы обычно не использовали антитела L26. Они применялись только в тех случаях, когда экспрессия мембранных маркеров (CD19, CD20) являлась недостаочной для диагноза. В нашем исследовании отобрано 61 наблюдение (из 338), при которых верификация диагноза была необходима. Во всех этих случаях диагноз был подтвержден на основании использования антител L26. Данные представлены в таблице 14. Таблица 14 Сопоставление антител к CD19 и CD20 (L26) в диагностике ДВКЛ МКА Тип реакции CD19 Реакция CD20 (L26) Слабая Яркая Итого Отрицат. 1* 7 8 Слабый 1 36 37 Сильный 0 16 16 2 59 61 Итого *Количество больных Из 61 случая, при котором определение CD19 проведено в параллели с антителами L26, в 45 отмечена слабая или отрицательная реакция на CD19. В данной выборке признаки (L26, CD19) не были взаимосвязаны между собой, р=0,26 (по таблицам сопряженности признаков). Таким образом, в случаях слабой и даже отрицательной реакции на CD19 подтверждение диагноза ДВКЛ целесообразно проводить с использованием антител L26. При параллельном использовании антител к CD19 и СD20 (к мембранному домену) выявлено высокое совпадение результатов (р=0,000), таблица 15. Таблица 15 Параллельное использование антител CD19 и антител к мембранному домену CD20 в диагностике ДВКЛ МКА Тип реакции CD19 Реакция CD20 (LT-20) Отрицат. слабая сильная Итого отрицат 3* 2 1 6 слабая 1 22 48 71 сильная 0 0 193 193 4 24 242 270 Итого *Количество больных У 193 из 270 больных (71,5%) выявлена выраженная экспрессия обоих антигенов. У 22 больных (8,1%) экспрессия обоих антигенов была слабой и лишь в 3 случаях (1,1%) экспрессия антигенов отсутствовала. Частота различных типов экспрессии CD19 и CD20 суммирована в таблице 16. Таблица 16 Частота подтверждения В-клеточной природы ДВКЛ антителами к CD19 и CD20 Маркер Тип реакции антител отрицательный слабый Всего выраженный CD19 10 (3%)* 81 (24,6%) 238 (70%) 329 (100%) CD20 4 (1,5%) 24 (8,8%) 244 (71,8%) 272 (100%) CD20 (L26) 0 2 (2,9%) 67 (97,1%) 69 (100%) *Количество больных (процент) Таким образом, в целом частота отрицательных и слабоположительных по CD20 случаев ДВКЛ невелика, составляет 10,3%. Однако именно эти случаи нуждаются в дополнительной верификации с целью назначения Мабтеры. Как показали наши исследования, для подтверждения В-клеточной природы ДВКЛ и ее периферического происхождения очень полезными являются антитела к CD37. Интересен анализ того, насколько экспрессия СD19 и CD20 соотносится с экспрессией CD45. Экспрессия антигена CD19 высоко коррелировала с CD45. В пределах CD45-негативных опухолей частота случаев отрицательных или слабоположительных по CD19 была достоверно выше (77%, 10 из 13), чем в группе CD45-положительных ДВКЛ – только 25% (80 из 312). Связь между этими признаками высоко достоверна (Хи-квадрат=16,4; р=0,000). Еще более высокая степень корреляции получена для мембранного антигена CD20. Частота случаев отрицательной или слабо положительной реакции на CD20 в пределах CD45-негативных ДВКЛ была в 6 раз выше, чем при CD45-позитивных опухолях (50% и 8,2%, соответственно). Признаки достоверно взаимосвязаны (Хиквадрат=22,2; р=0,000). Следовательно, уменьшение экспрессии мембранных молекул CD20 и CD19 на клетках ДВКЛ достоверно чаще наблюдается в CD45-негативных опухолях. Как мы уже отмечали, зрело-В-клеточная природа во всех этих случаях была верифицирована на основании цитоплазматической экспрессии CD20 (L26). V.2. ДОПОЛНИТЕЛЬНЫЕ ИММУНОФЕНОТИПИЧЕСКИЕ МАРКЕРЫ ДВКЛ. В этой главе дается детальное описание иммунофенотипических особенностей ДВКЛ и клеток микроокружения. Внимание уделено маркерам опухолевых клеток, обычно не используемым для диагностики ДВКЛ, взаимосвязанными с активацией или иными биологическими особенностями клеток опухоли. Детально охарактеризована клиническая картина особых вариантов ДВКЛ на основе совокупности признаков, включенных в перечень Международного прогностического индекса. Детально описываются взаимосвязи особых иммунофенотипических вариантов с кроветворением у больных ДВКЛ. Мы остановимся на следующих маркерах: HLA-DR, CD23, CD38, CD45, CD21, CD10, CD30, CD5, CD7, CD3, CD163. V.2.1. Молекулы гистосовместимости II класса – HLA-DR Наиболее дискутабельными с позиций необходимости использования при диагностике ДВКЛ являются молекулы гистосовместимости II класса – HLA-DR. Данные маркеры практически не используется при иммуногистохимической диагностике по парафиновым блокам. Это обусловлено, с одной стороны, сложностями выявления (хотя моноклональные антитела для выявления HLA-DR по парафиновым блокам имеются), а, с другой, - отсутствием четкой необходимости использования антител ввиду неполной ясности диагностической значимости антигена. В ранних работах отсутствие экспрессии HLA-DR при ДВКЛ рассматривали как прогностически неблагоприятный фактор (Spier C.M. et al., 1988). Молекулы HLA-DR присутствуют на всех В-клетках вне зависимости от их стадии дифференцировки, активированных Т-клетках, макрофагах, что указывает на отсутствие их диагностической ценности в установлении варианта лимфомы. При исследовании на материале свежезамороженных опухолевых срезов антиген четко выявляется. Наши данные подтвердили высокую частоту экспрессии HLA-DR при ДВКЛ. Исследование проведено на опухолевых срезах 331 больного ДВКЛ. Частота экспрессии составила 90,7% (299 из 331). К отрицательным случаям относили только те наблюдения, где молекула HLA-DR отсутствовала на всех или значительной части опухолевых клеток, случаи со слабой интенсивностью экспрессии относили к позитивным. В первую очередь нас интересовало, насколько 32 случая HLA-DRнегативной ДВКЛ формируют особую группу с точки зрения прогноза и ответа на терапию. Общая выживаемость была оценена у 136 больных ДВКЛ (11 – HLA-DRнегативных и 125 – HLA-DR-позитивных). По всем критериям оценки достоверности различий в выживаемости отмечена значимость молекул HLA-DR опухолевых клеток в прогнозе ДВКЛ: тест Лог-Ранк (Мантела-Кокса) р=0,041; тест Бреслоу (генерализованный Вилкоксона) р=0,044; Тарон-Уоре р=0,038. Кривые выживаемости больных ДВКЛ в зависимости от экспрессии молекул HLA-DR на опухолевых клетках представлены на рисунке 17. Рисунок 17. Выживаемость больных ДВКЛ в группах с наличием (сплошная линия) или отвутствием (пунктирная линия) экспрессии молекул HLA-DR на опухолевых клетках. Как видно, выживаемость больных HLA-DR-негативной группы значительно лучше, медиана выживаемости не достигается, в то время как в группе сравнения (HLA-DR-позитивной) она составила 55 мес. Характеристика показателей выживаемости представлена в таблице 17. Таблица 17 Средние и медианы времени дожития в HLA-DR(+) и HLA-DR(-) группах больных ДВКЛ Среднее a Медиана 95% доверительный 95% доверительный интервал HLADR Оценка Ст. Нижняя Верхняя ошибка граница граница HLA-DR- 152,120 18,281 116,290 HLA-DR+ 112,689 11,486 90,176 интервал Оценка 187,950 . 135,201 Ст. ошибка . 55,000 Нижняя Верхняя граница граница . 19,920 . 15,957 94,043 Всего 119,919 11,155 98,056 141,782 80,000 26,441 28,176 131,824 a. Оценивание ограничивается наибольшим временем дожития, если оно является цензурированным. Сравнительная клиническая характеристика HLA-DR-негативной и HLA-DRпозитивной групп больных ДВКЛ. Возраст. Средний возраст больных HLA-DR-негативной группы ДВКЛ составил 56,2±3,2 года (n=32), что не отличалось от HLA-DR-позитивной группы (53,1±1,1 года, n=293), p=0,38. В HLA-DR-негативной группе частота больных пожилого возраста составила 56,3% (18 из 32), что не отличалось от HLA-DRпозитивной группы – 45,4% (133 из 299), р=0,16. Пол. В HLA-DR-негативной группе было 15 мужчин (46,9%) и 17 женщин (53,1%), а в HLA-DR-позитивной – 147 (49,2%) и 152 (50,8%), соответственно. Связи экспрессии HLA-DR на клетках ДВКЛ с полом больных не отмечено (Хиквадрат- 0,06; р=0,85). Стадия ДВКЛ. Распределение больных в соответствие со стадиями ДВКЛ представлено в таблице 18. Достоверной связи экспрессии HLA-DR на злокачественных клетках ДВКЛ со стадией заболевания не обнаружено (Хиквадрат = 0,7; р=0,88). Таблица 18 Частота встречаемости различных стадий в пределах HLA-DR-позитивных и HLA-DR-негативных вариантов ДВКЛ. Экспрессия HLAСтадия DR I II III IV HLA-DR-отрицат. 2 (15,4)* 3 (23,1) 2 (15,4) 6 (46,2) HLA-DR-позитивн. 10 (9,4) 32 (30,2) 13 (12,3) 51 (48,1) *Количество (процент в строке) В индексах IPI к числу неблагоприятных факторов прогноза отнесены III и IV стадии ДВКЛ. Частота III,IV стадий в пределах HLA-DR-негативной группы составила 61,5% (8 из 13), а в пределах HLA-DR-позитивной – 60,4% (64 из 106). Какая-либо связь со стадиями отсутствовала, Хи-квадрат=0,07; р=1. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. В HLA-DR-негативной группе средние уровни ЛДГ составили 599,7±57,4 (n=11) ед/мл, а у больных с экспрессией антигена на опухолевых клетках – 750,9±73,4 (n=84). Различия не достоверны, р=0,46. Повышенные уровни ЛДГ в HLA-DR-негативной группе наблюдались у 8 больных (72,7%), а в группе сравнения – у 58 больных (69%), взаимосвязь между признаками отсутствует, р=1,0. Экстранодальные локализации. Частота наличия экстранодальных локализаций была несколько выше (45%) при отсутствии HLA-DR на опухолевых клетках, чем в случаях экспрессии (32%) антигена (таблица 19), однако, взаимосвязь не достоверна, р=0,15. Таблица 19. Экстранодальные локализации ДВКЛ в зависимости от экспрессии HLA-DR на опухолевых клетках Маркер Есть/ нет HLADR Нет Показатель нет Частота 31 54,8% 45,2% 100,0% 197 94 291 67,7% 32,3% 100,0% 214 108 322 66,5% 33,5% 100,0% опухолевых клетках частота Частота Частота % в HLA-DR При отсутствии антигена на Итого 14 % в HLA-DR Итого есть 17 % в HLA-DR Есть Экстранодальные исследования биопсийного материала различных локализаций была следующей, таблица 20. Таблица 20. Локализации биопсии HLA-DR-негативных ДВКЛ Локализация Частота Процент Желудок 1 3,2 Кожа 1 3,2 Яичко 3 9,7 Забрюшинные лимфатические узлы 2 6,5 Шейные лимф.узлы 7 22,6 Паховые лимф.узлы 2 6,5 Мягкие ткани 9 29,0 Миндалины 2 6,5 Подмышечные лимфатические узлы 1 3,2 Надключичные лимфатические узлы 3 9,7 31 100,0 Итого Как видно из таблицы, наиболее частыми экстранодальными локализациями биопсии при HLA-DR-негативной ДВКЛ являлись мягкие ткани. Поражение мягких тканей у больных ДВКЛ анализируемой нами группы отмечено в 43 случаях. У 9 больных (20,9%) установлена HLA-DR-негативная опухоль. Это вдвое чаще, чем в целом по группе больных ДВКЛ. Еще более частыми HLA-DR негативные ДВКЛ являются при локализации опухоли в яичке – 3 из 8 наблюдений (37,5%). Если взять группу больных ДВКЛ с наличием неблагоприятного по IPI признака – двух или более участков экстранодального поражения, то лишь в 1 из 36 случаев (2,8%) мы наблюдали HLA-DR-негативный иммунофенотип опухоли. Следовательно, для прогностически неблагоприятной группы больных ДВКЛ с наличием 2 и более экстранодальных зон поражения наличие ассоциированного с благоприятным прогнозом HLA-DR-негативного иммунофенотипа не является характерным, эти признаки выглядят скорее как взаимоисключающие, таблица 21. Таблица 21 Взаимосвязь экспрессии HLA-DR c наличием двух и более зон экстранодального поражения Маркер Есть/ нет HLADR нет Показатель Кол-во экстранодальных зон менее 2 Частота % в HLA-DR есть Итого 30 1 31 96,8% 3,2% 100,0% 259 35 294 88,1% 11,9% 100,0% 289 36 325 88,9% 11,1% 100,0% Частота % в HLA-DR Частота % в HLA-DR Итого >= 2 Уровень значимости связи между наличием 2 или более экстранодальных локализаций и экспрессией HLA-DR не носил достоверной связи (р=0,23), однако, сам факт наличия лишь 1 случая с двумя или более экстранодальными локализациями говорит о том, что эти 2 признака сочетаются редко. Рассматриваемый пример с HLA-DR-негативным иммунофенотипом и наличием более 2 экстранодальных локализаций интересен тем, что поражение при ДВКЛ касалось почек, щитовидной железы, мягких тканей, и, несмотря на IV стадию процесса, результаты лечения были хорошими. У молодой больной (17 лет) применение 5 циклов ВАЕМ позволило получить полную ремиссию, продолжающуюся к моменту анализа данных более 140 мес. Этот пример хорошо иллюстрирует тот факт, что даже при наличии неблагоприятных признаков IPI, таких как IV стадия заболевания и более 2 экстранодальных очагов поражения, результаты лечения могут определяться иммунобиологическими особенностями опухоли. В данном случае к таким особенностям можно отнести отсутствие экспрессии HLA-DR на злокачественных клетках. Мы сопоставили экспрессию HLA-DR неблагоприятного прогноза по IPI, таблица 22. с частотой признаков Таблица 22 Взаимосвязь экспрессии HLA-DR с признаками неблагоприятного прогноза по IPI Количество неблагоприятных признаков по IPI HLA-DR 0 1 2 3 4 5 нет 1 (8,3)* 4 (33,3) 2 (16,7) 1 (8,3) 3 (25,0) 1 (8,3) есть 13 (15,5) 24 (28,6) 4 (4,8) 3 (3,6) 25 (29,8) 15 (17,9) *Количество (процент в строке) Как видно, в HLA-DR-негативной группе отмечена несколько меньшая частота случаев с наличием пяти признаков IPI и более высокая частота случаев с наличием 2 признаков, однако достоверной связи между экспрессией HLA-DR и IPI не установлено. Аналогичным образом, не установлено связи и с группами риска, выделяемыми на основе количества IPI (p=0,33), таблица 23. Таблица 23 Взаимосвязь экспрессии HLA-DR на опухолевых клетках ДВКЛ с группами риска Маркер Есть/ нет нет HLADR Показатель Группа риска низкий Частота % в HLA-DR есть Итого Итого 2 1 4 12 41,7% 16,7% 8,3% 33,3% 100,0% 37 4 3 40 84 44,0% 4,8% 3,6% 47,6% 100,0% 42 6 4 44 96 43,8% 6,3% 4,2% 45,8% 100,0% Частота % в HLA-DR Высокий 5 Частота % в HLA-DR Низк-промежут. Высок-промежут Таким образом, отсутствие экспрессии молекул HLA-DR при диффузной Вкрупноклеточной лимфоме следует рассматривать как достаточно редкий и информативный признак. Частота подобных случаев ДВКЛ при анализе иммунофенотипических данных 331 больного составила 9,7% (32 больных). Группа HLA-DR-негативных ДВКЛ характеризовалась достоверно более благоприятным прогнозом. Признак не был достоверно связан со стадией ДВКЛ, но имел взаимоисключающий экстранодального поражения. характер с наличием 2 и более очагов Взаимосвязь экспрессии HLA-DR с показателями гемопоэза при ДВКЛ. Мы сопоставили средние значения количественных показателей миелограммы в группах больных ДВКЛ с наличием и отсутствием HLA-DR на опухолевых клетках, таблица 24. Таблица 24 Сопоставление средних значений количественных показателей миелограммы при HLADR-позитивном и HLA-DR-негативном иммунофенотипах ДВКЛ Показатель DR Миелокариоц. Стд. ошибка HLAСреднее N Р среднего Негат. 15 92,9333 20,33891 Позит. 102 85,6520 7,85202 Негат. 15 1,6733 ,33953 Позит. 102 1,4539 ,09362 Негат. 15 ,5733 ,18086 Позит. 102 ,4363 ,04239 Нейтрофильн. Негат. 15 10,3667 1,18312 миелоциты Позит. 102 9,2814 ,35370 Нейтрофильн. Негат. 15 8,4200 ,74771 метамиелоц. Позит. 102 7,8098 ,24275 Палочкоядер. Негат. 15 22,5000 1,26080 нейтрофилы Позит. 102 20,9039 ,54537 Сегментояд. Негат. 15 21,5800 2,32035 нейтрофилы Позит. 102 20,7676 ,85935 Сумма Негат. 15 65,6467 1,72093 гранулоцитов Позит. 102 61,5412 1,11116 Индекс созр. Негат. 15 ,4733 ,05646 нейтрофилов Позит. 102 ,4613 ,02272 Моноциты Негат. 15 2,6200 ,44015 Позит. 102 2,4441 ,14082 Негат. 15 10,1867 1,32168 Позит. 102 11,8235 ,51938 Негат. 15 ,9133 ,25909 Позит. 102 ,8882 ,07007 0,74 3 (х10 /мкл) Бласты Промиелоц. Лимфоциты Плазмоциты 0,43 0,29 0,29 0,38 0,29 0,74 0,17 0,85 0,66 0,26 0,9 Нормобласты Негат. 15 1,1133 ,21928 базофильн. Позит. 102 1,3118 ,12550 Нормобласты Негат. 15 8,1067 ,84827 полихромат. Позит. 102 9,3657 ,61717 Нормобласты Негат. 15 9,5667 1,06653 оксифильн. Позит. 102 10,9578 ,63891 Сумма эритро- Негат. 15 18,7600 1,80013 Позит. 102 21,7304 1,26893 Индекс созрев. Негат. 15 ,943 ,008 кариоцитов эритрокариоц. Позит. 102 ,942 ,003 Лейко-эритр. Негат. 15 4,1133 ,50652 соотношение Позит. 102 4,2892 ,32154 0,56 0,45 0,42 0,38 0,89 0,84 Как видно, среднее содержание основных клеточных типов в миелограмме не различалось в зависимости от экспрессии HLA-DR на клетках ДВКЛ. Сумма гранулоцитов была несколько выше в HLA-DR-негативных случаях (65,6±1,7%, n=15) в сравнении с HLA-DR-позитивными (61,5±1,1, n=102), однако, различия недостоверны. Другой вариант анализа, по таблицам сопряженности признаков был проведен нами для всех показателей, представленных в миелограмме, с целью оценки взаимосвязей с HLA-DR-фенотипом. В таблице 25 представлены результаты анализа. Таблица 25 Оценка взаимосвязи экспрессии HLA-DR на опухолевых клетках с показателями миелограммы больных ДВКЛ Показатель миелограммы Клеточность Мегакариоциты Бласты Промиелоциты Нейтрофильные миелоциты Градации Снижена Нормальная Повышена Снижены Норма Повышены Менее 1% >=1% Снижены Норма снижены норма Экспрессия HLA-DR HLA-DR(+) HLA-DR(-) 30 (29,4)* 5 (33%) 65 (63,7) 8 (53,3) 7 (6,9) 2 (13,3) 19 (18,6) 1 (6,7) 77 (75,5) 13 (86,7) 6 (5,9) 1 (6,7) 33 (32,4) 3 (20) 69 (67,6) 12 (80) 87 (85,3) 12 (80) 15 (14,7) 3 (20) 28 (27,5) 4 (26,7) 55 (53,9) 6 (40) Хи-квадрат; P 1,0; 0,6 1,3; 0,5 0,9; 0,4 0,3; 0,7 1,9; 0,4 Нейтрофильные метамиелоциты Палочкоядерные нейтрофилы Сегментоядерные нейтрофилы Сумма клеток гранулоцитарного ростка Индекс созревания гранулоцитов Моноциты Лимфоциты Плазматические клетки Нормобласты базофильные Нормобласты полихроматофильные Нормобласты оксифильные Сумма леток эритроидного ростка Индекс Созревания эритроцитов ЛейкоЭритробластическое соотношение повышены Снижены норма Снижены Норма повышены Снижены норма повышены Снижена Норма повышена Снижен Норма повышен Снижение Норма повышены Снижены Норма повышены снижены норма повышены Снижены Норма повышены Снижены Норма повышены Норма повышены Снижена Норма повышена Норма 19 (18,6) 56 (54,9) 46 (45,1) 4 (3,9) 67 (65,7) 31 (30,4) 18 (17,6) 50 (49) 34 (33,4) 31 (30,4) 39 (38,2) 32 (31,4) 59 (57,8) 38 (37,3) 5 (4,9) 9 (8,8) 63 (61,8) 30 (29,4) 7 (6,9) 56 (54,9) 39 (38,2) 9 (8,8) 82 (80,4) 11 (10,8) 70 (68,6) 30 (29,4) 2 (2,0) 58 (56,9) 32 (31,4) 12 (11,8) 24 (23,5) 78 (76,5) 34 (33,3) 40 (39,2) 28 (27,5) 15(14,7) 5 (33,3) 4 (26,6) 11 (73,4) 1 (6,6) 7 (46,7) 7 (46,7) 1 (6,7) 10 (66,7) 4 (26,7) 1 (6,7) 8 (53,3) 6 (40) 6 (40) 9 (60) 0 (0) 0 (0) 12 (80) 3 (20) 3 (20) 9 (60) 3 (20) 3 (20) 10 (66,7) 2 (13,3) 11 (73,3) 4 (26,7) 0 (0) 9 (60) 6 (40) 0 (0) 3 (20) 12 (80) 4 (26,7) 9 (60) 2 (13,3) 1 (6,7) повышен Снижено Норма повышено 87 (85,3) 25 (24,5) 40 (39,2) 37 (36,3) 14 (93,3) 2 (13,3) 8 (53,3) 5 (33,3) 4,2; 0,041 2,0; 0,4 1,9; 0,4 3,7; 0,15 3,2; 0,2 2,4; 0,3 3,9; 0,14 1,98; 0,4 0,4; 0,8 2,1; 0,35 0,09; 0,76 2,5; 0,28 0,72; 0,35 1,4; 0,5 *Количество (процент в пределах HLA-DR-позитивной или HLA-DR-негативной групп) Как видно из представленных данных, достоверную связь с экспрессией HLA-DR на опухолевых клетках имели только уровни нейтрофильных метамиелоцитов в костном мозге больных ДВКЛ. Частота снижения этих клеток в HLA-DR-позитивной группе была вдвое выше, чем в HLA-DR-негативной. Нормальные уровни нейтрофильных метамиелоцитов были в 1,5 раза выше в HLADR-негативной группе в сравнении с позитивной группой. Иными словами, снижение уровней нейтрофильных метамиелоцитов, наблюдаемое у большинства больных ДВКЛ, для HLA-DR-негативных опухолей не является характерным. Иммунофенотипические взаимосвязи с экспрессией молекул HLA-DR. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, рецептор комплемента CR2 (CD21), FcεRII (CD23), CD10, CD30, CD38, таблица 26. Таблица 26 Взаимосвязь экспрессии HLA-DR с другими иммунофенотипическими признаками ДВКЛ Показатель Градации CD45 Отсутствует Присутствует отсутствует Часть клеток Все клетки отсутствует Часть клеток Все клетки отсутствует присутствует отсутствует Часть клеток Все клетки отсутствует Часть клеток Все клетки CD21 CD23 CD38 CD10 CD30 Экспрессия HLA-DR HLA-DR(+) HLA-DR(-) 10 (3,4) 3 (9,4) 286 (96,6) 29 (90,6) 207 (87,3) 25 (92,6) 17 (7,2) 1 (3,7) 13(5,5) 1 (3,7) 257 (88,3) 27 (84,4) 23 (7,9) 5 (15,6) 11 (3,8) 0 (0) 126 (42,9) 16 (50,0) 168 (57,1) 16 (50,0) 197 (93,8) 25 (92,6) 8 (3,8) 1 (3,7) 5 (2,4) 1 (3,7) 53 (74,6) 12 (80,0) 12 (16,9) 2 (13,3) 6 (8,5) 1 (6,7) Хи-квадрат; P 2,7; 0,12 0,6; 0,72 3,2; 0,2 0,6; 0,44 0,17; 0,93 0,2; 0,91 Как видно из представленных данных, какая-либо связь экспрессии молекул HLA-DR с другими маркерами опухолевых клеток ДВКЛ отсутствовала. Связь экспрессии HLA-DR с клетками микроокружения. В числе маркеров микроокружения мы оценили макрофаги (D11, CD163), Тлимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23), таблица 27. Таблица 27 Взаимосвязь экспрессии HLA-DR с клетками опухолевого микроокружения Показатель Градации Макрофаги D11 (CD163) отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные Фолликулярные дендритные клетки (CD21) Фолликулярные дендритные клетки CD23 CD5 CD7 CD3 Плазмоциты CD38++ Экспрессия HLA-DR HLA-DR(+) HLA-DR(-) 59 (20,3) 2 (6,3) 181 (62,2) 23 (71,9) 50 (17,5) 7 (21,9) 190 (80,2) 25 (92,6) 40 (16,9) 1 (3,7) 7 (3,0 1 (3,7) 257 (88,3) 27 (84,4) 23 (7,9) 5 (15,6) 11 (3,8) 0 (0) 88 (29,6) 13 (40,6) 176 (59,3) 19 (59,4) 33 (11,1) 0 (0) 90 (30,2) 12 (37,5) 176 (59,1) 20 (62,5) 32 (10,7) 0 (0) 71 (33,6) 12 (44,4) 118 (55,9) 15 (55,6) 22 (10,4) 0 (0) 191 (65,0) 19 (59,4) 76 (25,9) 12 (37,5) 27 (9,2) 1 (3,1) Хи-квадрат; P 3,7; 0,098 3,7; 0,12 3,2; 0,2 4,7; 0,02 4,0; 0,029 3,6; 0,049 2,8; 0,24 Представленные в таблице данные убедительно свидетельствуют о том, что утрата экспрессии HLA-DR находит отражение в количественном составе клеток опухолевого микроокружения. Достоверные данные получены в отношении Тлимфоцитов – мы не наблюдали ни одного случая выраженной Т-клеточной реакции при HLA-DR-негативном иммунофенотипе ДВКЛ, в то время как в случаях наличия HLA-DR на опухолевых клетках частота выраженной Тлимфоцитарной инфильтрации была на уровне 10-11%. Заключение. В данном разделе нами описана новая группа ДВКЛ с HLA-DR-негативным иммунофенотипом. Иммунологические особенности этих опухолей состоят в том, что при них практически не наблюдается выраженной инфильтрации зрелыми Тлимфоцитами. Отличия показателей гемопоэза от основной группы ДВКЛ состоят в том, что не наблюдается снижения уровня нейтрофильных метамиелоцитов. При HLA-DR-негативных ДВКЛ практически не встречается двух или более экстранодальных локализаций опухоли (2,8%). Прогноз HLA-DR-негативных ДВКЛ достоверно более благоприятен, чем в основной группе ДВКЛ. V.2.2. Экспрессия АДФ-рибозил-циклазы (CD38) на опухолевых клетках ДВКЛ. Весьма интересными при диагностике ДВКЛ являются молекулы CD38. Данный маркер практически не используется при иммуногистохимической диагностике лимфом по парафиновым блокам. Это обусловлено, с одной стороны, сложностями выявления (хотя моноклональные антитела для выявления CD38 по парафиновым блокам имеются), а, с другой, - отсутствием четкой необходимости использования антител ввиду неполной ясности диагностической значимости антигена. Молекулы CD38 присутствуют на активированных В-клетках, В-клетках светлых центров фолликулов лимфатических узлов, плазмоцитах, В-лимфоидных предшественниках, активированных Т-клетках, макрофагах, что указывает на отсутствие их линейной или стадийной специфичности. При исследовании на материале свежезамороженных опухолевых срезов антиген четко выявляется. Наши данные подтвердили высокую частоту экспрессии СD38 при ДВКЛ. Исследование проведено на опухолевых срезах 329 больных ДВКЛ. Частота экспрессии составила 55,9% (184 из 329) – в 70 случаях (21,2%) отмечена экспрессия на части клеток, в 114 случаях (34,7%) на всех клетках. В первую очередь нас интересовало, насколько CD38-позитивные случаи ДВКЛ формируют особую группу с точки зрения прогноза и ответа на терапию. Общая выживаемость была оценена у 136 больных ДВКЛ (61 – CD38-негативных, 27 – с экспрессией CD38 на части опухолевых клеток и 48 – CD38 мономорфно позитивных). Как видно на рисунке 18, достоверной связи с прогнозом не отмечено, р=0,34. Рисунок 18. Выживаемость больных ДВКЛ в зависимости от экспрессии молекул CD38 на опухолевых клетках. Как видно, выживаемость больных CD38-негативной и частично позитивной групп несколько лучше, чем при мономорфной экспрессии антигена. Сравнение групп с положительной экспрессией (мономорфно и мозаично) и отрицательных по CD38 не выявило достоверности различий, р=0,87. Сравнение случаев отрицательных и мономорфно положительных по CD38 также не выявило различий (р=0,46). Наиболее близкими к достоверным были различия между частично положительными (27 наблюдений) и мономорфно наблюдений) по CD38 случаями ДВКЛ, рисунок 19. положительными (48 Рисунок 19. Мономорфная экспрессия CD38 ухудшает прогноз ДВКЛ. Клиническая характеристика больных ДВКЛ, различающихся по экспрессии CD38 на опухолевых клетках. Возраст. Средний возраст больных CD38-негативной группы ДВКЛ составил 54,3±1,5 года (n=142), что не отличалось от СD38-позитивной группы (52,97±1,4 года, n=180), p=0,52. В CD38-негативной группе частота больных пожилого возраста была выше 51,4% (79 из 142), чем в CD38-позитивной группе – 42,8% (77 из 180), р=0,12. Пол. CD38-негативная группа: мужчин 71(49%), женщин 74(51%); CD38позитивная группа: мужчин 67 (47,3%), женщин - 97 (52,7%). соответственно. Связи экспрессии CD38 на клетках ДВКЛ c полом больных не отмечено (р=0,62). Стадия ДВКЛ. Распределение больных в соответствие со стадиями ДВКЛ представлено в таблице 28. Достоверной связи экспрессии CD38 злокачественных клетках ДВКЛ со стадией заболевания не обнаружено (р=0,62). на Таблица 28 Частота встречаемости различных стадий в зависимости от экспрессии CD38 на клетках ДВКЛ. Экспрессия CD38 Стадия I II III IV CD38-отрицат. 8 (15,1)* 15 (28,3) 6 (11,3) 24 (45,3) CD38-позитивн. 5 (7,6) 19 (28,8) 9 (13,6) 33 (50,0) *Количество (процент в строке) В индексах IPI к числу неблагоприятных факторов прогноза отнесены III и IV стадии ДВКЛ. Частота III,IV стадий в пределах CD38-негативной группы составила 56,6% (30 из 53), а в пределах CD38-позитивной – 63,6% (64 из 88). Какая-либо связь со стадиями отсутствовала, р=0,44. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. В CD38-негативной группе средние уровни ЛДГ составили 615,0±61,7 (n=40) ед/мл, а у больных с экспрессией антигена на опухолевых клетках – 812,0±104,8 (n=54). Различия не достоверны, р=0,52. Повышенные уровни ЛДГ в CD38-негативной группе наблюдались у 22 больных (55%), а в группе сравнения – у 42 больных (77,8%), взаимосвязь между признаками является достоверной, р=0,019. Следовательно, экспрессия активационного антигена CD38 на опухолевых клетках характерна для группы больных ДВКЛ с достоверно более частым повышением уровня ЛДГ. Экстранодальные локализации. Прогностически неблагоприятная группа ДВКЛ с наличием 2 и более экстранодальных локализаций встречалась у 17 из 140 больных CD38-негативной группы (12,1%) и у 19 из 183 больных (10,4%) в CD38-позитивной группе. Признаки не связаны, р=0,62. Мы сопоставили экспрессию CD38 с частотой признаков неблагоприятного прогноза по IPI, таблица 29. Таблица 29 Взаимосвязь экспрессии CD38 с признаками неблагоприятного прогноза по IPI CD38 0 9 (22,5)* 6 (10,9) нет есть Количество неблагоприятных признаков по IPI 1 2 3 4 10 (25,0) 3 (5,0) 1 (2,5) 10 (25,0) 16 (29,1) 4 (7,2) 3 (5,5) 18 (32,7) *Количество (процент в строке) 5 8 (20,0) 8 (14,5) Как видно, в CD38-негативной и в CD38-позитивной группах частота встречаемости количества неблагоприятных признаков по IPI была сходной, достоверной связи не установлено, р=0,599. Аналогичным образом, не установлено связи и с группами риска, выделяемыми на основе количества неблагоприятных признаков IPI (p=0,8). Взаимосвязь экспрессии CD38 с показателями гемопоэза при ДВКЛ. Сопоставили средние значения количественных показателей миелограммы в группах с наличием и отсутствием CD38 на опухолевых клетках, таблица 30. Таблица 30 Сопоставление средних значений количественных показателей миелограммы при CD38позитивном и CD38-негативном иммунофенотипе ДВКЛ Показатель Стд. ошибка CD38 Миелокариоц. Отр. Среднее N P среднего 49 99,5102 13,61495 Положит. 69 76,4420 7,66815 Отр. 49 1,5000 ,15180 Положит. 69 1,4623 ,11414 Отр. 49 ,3878 ,05262 Положит. 69 ,5000 ,06323 Нейтрофильн. Отр. 49 9,8408 ,59770 миелоциты 69 9,1043 ,39817 Нейтрофильн. Отр. 49 8,1878 ,38485 метамиелоц. 69 7,6420 ,28370 Палочкоядер. Отр. 49 21,9959 ,71163 нейтрофилы Положит. 69 20,4449 ,68108 Сегментояд. Отр. 49 20,4612 1,13873 нейтрофилы Положит. 69 21,1768 1,10059 0,12 3 (х10 /мкл) Бласты Промиелоц. Положит. Положит. 0,84 0,2 0,29 0,25 0,13 0,67 Сумма Отр. 49 1,0816 ,10847 гранулоцитов Положит. 69 1,0145 ,09572 Индекс созр. 49 ,4582 ,02855 нейтрофилов Положит. 69 ,4638 ,02956 Моноциты Отр. 49 2,3184 ,23123 Положит. 69 2,5565 ,15934 Отр. 49 11,4245 ,74003 Положит. 69 11,8493 ,64236 Отр. 49 ,9469 ,09162 Положит. 69 ,8710 ,09953 Нормобласты Отр. 49 1,1551 ,12417 базофильн. 69 1,3812 ,16973 Нормобласты Отр. 49 8,6000 ,76207 полихромат. 69 9,5754 ,76119 Нормобласты Отр. 49 10,6490 ,75799 оксифильн. Положит. 69 10,9333 ,81722 Сумма Отр. 49 20,3959 1,44884 эритро- Положит. 69 22,0304 1,62372 Индекс Отр. 49 ,94 ,004 созрев. Положит. 69 ,95 ,005 Отр. 49 4,2143 ,39985 69 4,2797 ,39873 Лимфоциты Плазмоциты Отр. Положит. Положит. 0,9 0,38 0,67 0,59 0,32 0,38 0,8 0,48 0,14 кариоцитов 0,41 эритрокариоц. Лейко-эритр. соотношение Положит. 0,9 Как видно, среднее содержание основных клеточных типов в миелограмме не различалось в зависимости от экспрессии CD38 на клетках ДВКЛ. Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с CD38-фенотипом. В таблице 31 представлены результаты анализа. Таблица 31 Оценка взаимосвязи показателей гемопоэза с CD38-фенотипом ДВКЛ Показатель Градации Экспрессия CD38 Хи-квадрат; P CD38(-) CD38(+) Клеточность Снижена 12 (24,5) 24 (34,8) 0,19 Нормальная 31 (63,3) 42 (80,9) Повышена 6 (12,2) 3 (4,3) Мегакариоциты Снижены 9 (18,4) 12 (17,4) 0,99 Бласты Промиелоциты Нейтрофильные миелоциты Нейтрофильные метамиелоциты Палочкоядерные нейтрофилы Сегментоядерные нейтрофилы Сумма клеток гранулоцитарного ростка Индекс созревания гранулоцитов Моноциты Лимфоциты Плазматические клетки Нормобласты базофильные Нормобласты полихроматофильные Нормобласты оксифильные Сумма клеток эритроидного ростка Индекс Созревания эритроцитов ЛейкоЭритробластическое соотношение Норма Повышены Менее 1% >=1% Снижены Норма снижены норма повышены Снижены норма Снижены Норма повышены Снижены норма повышены Снижена Норма повышена Снижен Норма повышен Снижение Норма повышены Снижены Норма повышены снижены норма повышены Снижены Норма повышены Снижены Норма повышены Норма повышены Снижена Норма повышена Норма 37 (75,5) 3 (6,1) 16 (32,7) 33 (67,3) 55 (79,7) 14 (20,3) 12 (24,5) 24 949,0) 13 (26,5) 22 (44,9) 27 (55,1) 1 (2,0) 29 (59,2) 19 (38,8) 5 (10,2) 33 (67,3) 11 (22,4) 12 (24,5) 21 (42,9) 16 (32,7) 24 (49,0) 24 (49,0) 1 (2,0) 5 (10,2) 31 (63,3) 13 (26,5) 2 (4,1) 31 (63,3) 16 (32,7) 2 (4,1) 44 (89,8) 3 (6,1) 25 (71,4) 14 (28,6) 0 (0) 28 (57,1) 18 (36,7) 3 (6,1) 11 (22,4) 38 (77,6) 15 (30,6) 24 (49,0) 10 (20,4) 5 (10,2) 53 (76,8) 4 (5,8) 20 (29,0) 49 (71,0) 45 (91,8) 4 (8,2) 20 (29,0) 38 (55,1) 11 (15,9) 39 (56,5) 30 (43,5) 4 (5,8) 46 (66,7) 19 (27,5) 14 (20,3) 28 (40,6) 27 (39,1) 21 (30,4) 26 (37,7) 22 (31,9) 42 (60,9) 23 (33,3) 4 (5,8) 4 (5,8) 45 (65,2) 20 (29,0) 8 (11,6) 34 (49,3) 27 (39,1) 10 (14,5) 48 (69,6) 11 (15,9) 46 (66,7) 21 (30,4) 2 (2,9) 40 (58,0) 20 (29,0) 9 (13,0) 16 (23,2) 53 (76,8) 23 (33,3) 26 (37,7) 20 (29,0) 11 (15,9) повышен Снижено Норма повышено 44 (89,8) 9 (18,4) 25 (51,0) 15 (30,6) 58 (84,1) 18 (26,1) 24 (34,8) 27 (39,1) 0,67 0,07 0,37 0,21 0,31 0,016 *Количество (процент в пределах CD38-позитивной или CD38-негативной групп) 0,76 0,18 0,18 0,2 0,03 0,46 0,39 0,93 0,42 0,36 0,21 Как видно из представленных данных, достоверную связь с экспрессией CD38 на опухолевых клетках имели только уровни сегментоядерных нейтрофилов и плазматических клеток в костном мозге больных ДВКЛ. Нормальные уровни обоих этих клеточных типов в CD38-позитивной группе отмечались в 1,5 раза реже, чем в группе сравнения (CD38-негативные ДВКЛ). Иммунофенотипические взаимосвязи с экспрессией молекул СD38. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, рецептор комплемента CR2 (CD21), FcεRII (CD23), CD10, CD30. Отсутствие корреляции с HLA-DR описано в предыдущем разделе. Данные представлены в таблице 32. Таблица 32 Взаимосвязь экспрессии CD38 с другими иммунофенотипическими маркерами ДВКЛ. Показатель Градации CD45 Отсутствует Присутствует отсутствует присутствует отсутствует присутствует отсутствует присутствует отсутствует присутствует CD21 CD23 CD10 CD30 Экспрессия CD38 CD38(-) CD38(+) 4 (2,2) 9 (6,2) 178 (97,8) 136 (93,8) 105 (92,1) 127 (84,7) 9 (7,9) 23 (15,3) 132 (91,7) 153 (85,0) 12 (8,3) 27 (15,0) 93 (93,0) 129 (94,2) 7 (7,0) 8 (5,8) 24 (70,6) 40 (78,4) 10 (29,4) 11 (21,6) Хи-квадрат; P 3,4; 0,065 3,4; 0,048 3,4; 0,047 0,72 0,41 Как видно из представленных данных, связь экспрессии молекул CD38 на опухолевых клетках ДВКЛ наблюдается с активационными антигенами CD21 и CD23: в CD38-позитивной группе частота данных маркеров вдвое выше. Связь экспрессии CD38 с клетками микроокружения. В числе клеток микроокружения мы оценили макрофаги (D11, CD163), Тлимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23). Данные представлены в таблице 33. Таблица 33 Взаимосвязь CD38+ иммунофенотипа ДВКЛ с клетками опухолевого микроокружения. Показатель Градации Макрофаги D11 (CD163) отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные Фолликулярные дендритные клетки (CD21) Фолликулярные дендритные клетки CD23 CD5 CD7 CD3 Плазматические клетки CD38++ Экспрессия CD38 CD38(-) CD38(+) 37 (26,4) 25 (13,8) 91 (65,0) 110 (60,8) 12 (8,6) 46 (25,4 99 (86,8) 116 (77,3) 13 (11,4) 28 (18,7) 2 (1,8) 6 (4,0) 137 (95,1) 151 (84,4) 7 (4,9) 25 (14,0) 0 (0) 3 (1,7) 64 (44,4) 38 (20,7) 71 (49,3) 123 (66,8) 9 (6,3) 23 (12,5) 65 (44,8) 38 (20,7) 73 (50,3) 122 (66,3) 7 (4,8) 24 (13,0) 51 (51,0) 33 (23,9) 45 (45,0) 88 (63,8) 4 (4,0) 17 (12,3) 77 (53,1) 33 (23,9) 55 (37,9) 88 (63,8) 13 (9,0) 17 (12,3) Хи-квадрат; P 19,1; 0,000 4,0; 0,14 10,6; 0,006 22,1; 0,000 24,4; 0,000 20,3; 0,000 20,3; 0,000 Представленные в таблице данные убедительно свидетельствуют о том, что экспрессия CD38 на клетках ДВКЛ находит отражение в количественном составе клеток опухолевого микроокружения. Достоверные данные получены в отношении Т-лимфоцитов, макрофагов, плазмоцитов, фолликулярных дендритных клеток CD23+. Все это свидетельствует об особых иммунобиологических свойствах CD38позитивных диффузных В-крупноклеточных лимфом. Заключение. В данном разделе нами описана группа ДВКЛ с экспрессией на опухолевых клетках антигена CD38. Иммунобиологические особенности этих опухолей состоят в том, что они сопровождаются выраженной интратуморальной инфильтрацией практически всеми клетками, входящими в состав опухолевого микроокружения – макрофагами, плазмоцитами, зрелыми Т-лимфоцитами. Кроме того, при CD38+ ДВКЛ в 4 раза чаще, чем в группе сравнения (CD38-) наблюдается присутствие в опухолевых срезах выраженного количества фолликулярных дендритных клеток CD23+. Данный антиген (CD23), также как и CD21 вдвое чаще присутствуют и на клетках опухоли, что является несомненной иммунофенотипической особенностью CD38-позитивных ДВКЛ. Отмечены иммунологического субтипа ДВКЛ определенные связи (CD38-позитивного) с данного особенностями гемопоэза – реже, чем в группе сравнения (CD38-негативной) отмечены нормальные диапазоны сегментоядерных нейтрофилов и плазмоцитов (эти клетки либо повышены, либо снижены). В группе CD38+ ДВКЛ вдвое реже, чем при CD38(-) ДВКЛ наблюдались повышенные уровни сывороточной ЛДГ. Вместе с тем, прогноз при мономорфной экспрессии CD38 на опухолевых клетках был значительно хуже (хотя и не достоверно), чем при отсутствии антигена на всех или части опухолевых клеток. Можно заключить, что ДВКЛ с подобными характеристиками ранее не были описаны. Это особенно важно, поскольку CD38позитивные опухоли представляют не минорную группу, а практически половину всех диффузных В-крупноклеточных лимфом. V.2.3. Общелейкоцитарный антиген CD45. Крайне редко встречаются CD45-негативные опухоли. Обычно ДВКЛ характеризуются отчетливой экспрессией этого антигена. Он может отсутствовать на анапластических крупноклеточных лимфомах и лимфомах из клетокпредшественниц. При ДВКЛ отсутствие антигена может быть иммунологическим признаком анаплазии. При исследовании 332 случаев ДВКЛ отсутствие общелейкоцитарного антигена отмечено лишь в 13 (3,9%). В первую очередь нас интересовало, насколько CD45-негативные случаи ДВКЛ формируют особую группу с точки зрения прогноза и ответа на терапию. Общая выживаемость была оценена у 135 больных ДВКЛ (6 – CD45-негативных, 129 – с экспрессией CD45 на опухолевых клетках. Как видно на рисунке 20, достоверной связи с прогнозом не отмечено, р=0,29. . Рисунок 20. Выживаемость больных ДВКЛ в зависимости от экспрессии молекул CD45 на опухолевых клетках. Кривая выживаемости CD45-негативной группы отражает несколько лучшую выживаемость, возможно, для окончательного суждения необходим набор большего материала в CD45-негативной группе. Средняя длительность наблюдения в CD45-негативной группе составила 106,118,4 мес (70 - 142 мес), медиана не достигается. В CD45+ группе – 118,111,3 мес (95,9 – 140,2), медиана – 57 мес. Клиническая характеристика больных ДВКЛ, различающихся по экспрессии CD45 на опухолевых клетках. Возраст. Средний возраст больных CD45-негативной группы ДВКЛ составил 52,9±5,1 года (n=13), что не отличалось от СD45-позитивной группы (53,6±1,0 года, n=312), p=0,9. В CD45-негативной группе частота больных пожилого возраста была несколько выше 53,8% (7 из 13), чем в CD45-позитивной группе – 46,85% (77 из 312), р=0,6. Пол. CD45-негативная группа: мужчин - 4 (30,8%), женщин 9 (69,2%); CD45-позитивная группа: мужчин 158 (49,5%), женщин - 161 (50,5%). соответственно. Связи экспрессии CD45 на клетках ДВКЛ c полом больных не отмечено (р=0,19). Стадия ДВКЛ. Распределение больных в соответствие со стадиями ДВКЛ представлено в таблице 33. Несмотря на небольшое количество больных (118) и малочисленность выборки CD45-негативных случаев (4), все эти случаи были с поздними стадиями заболевания (III-IV), что обеспечило высокую достоверность связи экспрессии CD45 на злокачественных клетках ДВКЛ со стадией заболевания (р=0,002). Таблица 33 Частота встречаемости различных стадий в группах больных ДВКЛ, различающихся по экспрессии CD45 на опухолевых клетках Экспрессия CD45 I CD45-отрицат. 0 (0)* CD45-позитивн. 13 (11,4) *Количество (процент в строке) II 0 (0) 34 (29,8) Стадия ДВКЛ III 3 (75,0) 12 (10,5) IV 1(25,0) 55 (48,2) В индексах IPI к числу неблагоприятных факторов прогноза отнесены III и IV стадии ДВКЛ. Частота III, IV стадий в пределах CD45-негативной группы составила 100%, а в пределах CD45-позитивной – 48,8%. Однако в этом случае связь со стадиями отсутствовала, р=0,098. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. Анализ уровней ЛДГ провести не удалось, так как у всех 94 больных, у которых были известны уровни ЛДГ, отмечена экспрессия CD45 на клетках ДВКЛ. Экстранодальные локализации. Прогностически неблагоприятная группа ДВКЛ с наличием 2 и более экстранодальных локализаций встречалась у 1 из 13 больных CD45-негативной группы (7,7%) и у 34 из 312 больных (10,9%) в CD45-позитивной группе. Признаки не связаны, р=0,72. Сопоставить экспрессию CD45 с частотой признаков неблагоприятного прогноза по IPI не удалось, так как у всех 95 больных с известными признаками IPI отмечена экспрессия CD45 на опухолевых клетках. Взаимосвязь экспрессии CD45 с показателями гемопоэза при ДВКЛ. Сопоставили средние значения количественных показателей миелограммы в группах с наличием и отсутствием CD45 на опухолевых клетках. Достоверные различия получены только в отношении сегментоядерных нейтрофилов, количество которых в CD45-негативной группе было выше: 27,76,3% (n=6) и 20,50,8% (n=112), соответственно, р=0,046. Следует отметить, что в CD45негативной группе было всего 6 наблюдений. По этой причине анализ по таблицам сопряженности признаков не проводили. Иммунофенотипические взаимосвязи экспрессии молекул СD45 при ДВКЛ. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены, рецептор комплемента CR2 (CD21), FcεRII (CD23), CD10, CD30. Отсутствие корреляции с HLA-DR и CD38 описано в предыдущих разделах. Данные представлены в таблице 34. Таблица 34 Связь экспрессии CD45 с иммунофенотипическими маркерами ДВКЛ Показатель Градации CD21 отсутствует присутствует отсутствует присутствует отсутствует присутствует отсутствует присутствует CD23 CD10 CD30 Экспрессия CD45 CD45(-) CD45(+) 11 (91,7) 222 (87,4) 1 (8,3) 32 (12,6) 11 (84,6) 275 (88,4) 2 (15,4) 36 (11,6) 13 (100) 210 (93,3) 0 15 (6,7) 4 (44,4) 62 (79,5) 5 (55,6) 16 (20,5) Хи-квадрат; P 0,19; 0,7 0,18; 0,7 0,9 (0,33) 5,4; 0,02 Достоверные связи обнаружены с экспрессией CD30: в CD45-негативной группе частота экспрессии антигена составила 55,6%, в то время как в основной группе ДВКЛ – 20,5%, что в 2,5 раза ниже. Следует отметить, что количество больных, обследованных на экспрессию CD30 опухолевыми клетками частота исследования CD30 была ниже, чем количество больных, обследованных на предмет экспрессии других маркеров (87 случаев). Исследование проводилось лишь в тех случаях, когда к этому были прямые указания – например, дифференциальная диагностика с анапластической крупноклеточной лимфомой. Обнаружение экспрессии антигенов зрелых В-клеток позволило во всех этих случаях диагностировать ДВКЛ. Однако, экспрессия в 55,6% случаев антигена CD30 (Ki-1) свидетельствует о том, что CD45-негативные ДВКЛ имеют черты иммунологической анаплазии. Связь экспрессии CD45 с клетками микроокружения. В числе клеток микроокружения оценили макрофаги (D11, CD163), Тлимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23). Данные представлены в таблице 35. Таблица 35 Связь CD45-иммунофенотипа с реакцией клеток микроокружения при ДВКЛ Показатель Градации Макрофаги D11 (CD163) отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные Фолликулярные дендритные клетки (CD21) Фолликулярные дендритные клетки CD23 CD5 CD7 CD3 Плазматические клетки CD38++ Экспрессия CD45 Хи-квадрат; P CD45(-) CD45(+) 3 (23,1) 59 (19,0) 0,98; 0,6 9 (69,2) 195 (62,7) 1 (7,7) 57 (18,3) 10 (83,3) 207 (81,5) 0,4; 0,8 2 (16,7) 39 (15,4) 0 (0) 8 (3,1) 12 (92,3) 277 (89,1) 0,21; 0,9 1 (7,7) 31 (10,0) 0 (0) 3 (1,0) 6 (46,2) 98 (30,9) 2,3; 0,31 7 (53,8) 186 (58,7) 0 (0) 33 (10,4) 6 (46,2) 99 (31,1) 2,2; 0,33 7 (53,8) 187 (58,8) 0 (0) 32 (10,1) 6 (46,2) 78 (34,7) 1,7; 0,4 7 (53,8) 125 (55,6) 0 (0) 22 (9,8) 6 (46,2) 205 (65,3) 2,6; 0,28 6 (46,2) 82 (26,1) 1 (7,7) 27 (8,6) Представленные в таблице данные свидетельствуют об отсутствии какойлибо связи клеток опухолевого микроокружения с CD45-негативным иммунофенотипом ДВКЛ. Заключение. В данном разделе нами описана группа ДВКЛ с отсутствием экспрессии на опухолевых клетках антигена CD45. Иммунофенотип этих опухолей не имеет связи с клетками микроокружения. Экспрессия CD30 в 55,6% CD45-негативных случаев указывает на то, что отсутствие CD45 можно, по-видимому, рассматривать как признак анаплазии этих лимфом. Малочисленность данной группы лимфом не позволила достоверно оценить связи с гемопоэзом, обнаруженные достоверные различия в среднем содержании нейтрофильных гранулоцитов, нуждаются в подтверждении на большем клиническом материале. Интересно отметить, что CD45-негативные опухоли были представлены только III и IV стадиями, что достоверно отличает их от группы сравнения. Прогноз в этой группе больных был несколько более благоприятным, однако, различия не являются статистически значимыми. V.2.4. Экспрессия CR2-рецептора комплемента (CD21) на клетках ДВКЛ. Следующим изученным нами маркером, экспрессируемым на клетках ДВКЛ, явился CR2 антиген (рецептор комплемента), который в нормальных лимфатических узлах экспрессирован на клетках фолликулов и фолликулярных дендритных клетках. Согласно номенклатуре лейкоцитарных антигенов он носит название CD21. При исследовании на материале свежезамороженных опухолевых срезов антиген четко выявляется. Наши данные указывают на невысокую частоту экспрессии СD21 при ДВКЛ. Исследование проведено на опухолевых срезах 266 больных ДВКЛ. Частота экспрессии составила 12,4% (33 из 266) – в 18 случаях (6,8%) отмечена экспрессия на части опухолевых клеток, в 15 случаях (5,6%) на всех клетках опухоли. В первую очередь нас интересовало, насколько CD21-позитивные случаи ДВКЛ формируют особую группу с точки зрения прогноза и ответа на терапию. Общая выживаемость была оценена у 114 больных ДВКЛ (99 – CD21-негативных, 8 – с экспрессией CD21 на части опухолевых клеток и 7 – CD21 мономорфно позитивных). Достоверной связи с прогнозом не отмечено, р=0,8. Аналогичным образом, отсутствовала связь с прогнозом при разделении больных на 2 группы – антиген-позитивную (все или часть опухолевых клеток позитивны, 15 больных) и антиген-негативную (99 больных). Различия в прогнозе также отсутствовали, р=0,86; рис. 21. Рисунок 21. Экспрессия CD21на опухолевых клетках не влияет на прогноз ДВКЛ. Клиническая характеристика больных ДВКЛ, различающихся по экспрессии CD21 на опухолевых клетках. Возраст. Средний возраст больных CD21-негативной группы ДВКЛ составил 54,2±1,2 года (n=228), что не отличалось от СD21-позитивной группы (55,2±3,2 года, n=32), p=0,78. В CD21-негативной группе частота больных пожилого возраста была несколько выше 48,7% (111 из 228), чем в CD21-позитивной группе – 40,6% (13 из 32), р=0,39. Пол. CD21-негативная группа: мужчин 121(51,9%), женщин 112 (48,1%); CD21позитивная группа: мужчин 11 (33,3%), женщин - 22 (66,7%). соответственно. Связь экспрессии CD21 на клетках ДВКЛ c полом больных достоверная (р=0,046): в CD21+ группе достоверно преобладают женщины. Стадия ДВКЛ. Распределение больных в соответствие со стадиями ДВКЛ представлено в таблице 36. Достоверной связи экспрессии CD21 на злокачественных клетках ДВКЛ со стадией заболевания не обнаружено (р=0,58). Таблица 36 Частота встречаемости различных стадий ДВКЛ в зависимости от экспрессии CD21 на опухолевых клетках Экспрессия CD21 I CD21-отрицат. 9 (10,5)* CD21-позитивн. 2 (11,8) *Количество (процент в строке) Стадия II 22 (25,6) 7 (41,2) III 12 (14,0) 2 (11,8) IV 43 (50,0) 6 (35,3) В индексах IPI к числу неблагоприятных факторов прогноза отнесены III и IV стадии ДВКЛ. Частота III,IV стадий в пределах CD21-негативной группы составила 64,0% (55 из 86), а в пределах CD21-позитивной – 47,1% (8 из 17). Cвязь со стадиями отсутствовала, р=0,19. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. В CD21-негативной группе средние уровни ЛДГ составили 689,2±58,3 (n=65) ед/мл, а у больных с экспрессией антигена на опухолевых клетках – 583,9±88,2 (n=14). Различия не достоверны, р=0,43. Повышенные уровни ЛДГ в CD21-негативной группе наблюдались у 45 больных (69,2%), а в группе сравнения – у 7 больных (50,0%), взаимосвязи между признаками нет, р=0,17. Экстранодальные локализации. Прогностически неблагоприятная группа ДВКЛ с наличием 2 и более экстранодальных локализаций встречалась у 26 из 230 больных CD21-негативной группы (11,3%) и у 5 из 183 больных (10,4%) в CD38-позитивной группе. Признаки не связаны, р=0,62. Мы сопоставили экспрессию CD21 с частотой признаков неблагоприятного прогноза по IPI, таблица 37. Таблица 37 Взаимосвязь экспрессии CD21 на опухолевых клетках ДВКЛ с признаками неблагоприятного прогноза по IPI Количество неблагоприятных признаков по IPI 0 1 2 3 4 5 8 (12,1)* 19 (28,8) 3 (4,5) 4 (6,1) 20 (30,3) 12 (18,2) 5 (37,5) 3 (21,4) 2 (14,3) 0 (0) 4 (28,6) 0 (0) *Количество (процент в строке) CD21 нет есть Как видно, в CD21-негативной и в CD21-позитивной группах частота встречаемости количества неблагоприятных признаков по несколько IPI различалась (Хи-квадрат= 9,3; р=0,096; по некоторым признакам /отношение правдоподобия, линейно-линейная связь/ взаимосвязь между признаками была близка к достоверной, р=0,052). В CD21-позитивной группе втрое чаще отмечалось отсутствие признаков неблагоприятного прогноза и отсутствовала группа пациентов с наличием 5 признаков неблагоприятного прогноза. Не установлено связи и с группами риска, выделяемыми на основе количества IPI (p=0,24), таблица 38. Таблица 38 Связь экспрессии CD21 на опухолевых клетках с группами риска ДВКЛ. Маркер Есть/ Показатель нет CD21 нет Частота % в CD21 есть Частота % в CD21 Итого Частота % в CD21 Группа риска низкий низкий-промежут. высокий-промеж. высокий Итого 27 3 4 32 66 40,9% 4,5% 6,1% 48,5% 100,0% 8 2 0 4 14 57,1% 14,3% ,0% 28,6% 100,0% 35 5 4 36 80 43,8% 6,3% 5,0% 45,0% 100,0% При подразделении на 2 группы (высокий и низкий риск), различия были близки к достоверным, р=0,07. Это обусловлено вдвое более низкой частотой больных группы высокого риска в CD21-позитивных случаях. Взаимосвязь экспрессии CD21 с показателями гемопоэза при ДВКЛ. Сопоставили средние значения количественных показателей миелограммы в группах с наличием и отсутствием CD21 на опухолевых клетках, таблица 39. Таблица 39 Сравнение средних уровней количественных показателей миелограммы у больных ДВКЛ в зависимости от экспрессии CD21 на опухолевых клетках Показатель Стд. ошибка CD21 Миелокариоц. Отр. Среднее N Р среднего 96 82,5677 7,85977 14 90,4286 15,60518 Отр. 96 1,4073 ,09000 Положит 14 1,9929 ,35121 Отр. 96 ,4177 ,04217 Положит 14 ,6857 ,20830 Нейтрофильн. Отр. 96 9,1656 ,34533 миелоциты 14 9,8643 1,10262 Нейтрофильн. Отр. 96 7,8479 ,26696 метамиелоц. 14 8,0357 ,47942 Палочкоядер. Отр. 96 21,2833 ,56468 нейтрофилы 14 19,5500 1,37124 0,72 3 (х10 /мкл) Положит . Бласты 0,032 . Промиелоц. 0,05 . Положит 0,48 . Положит 0,8 . Положит 0,27 . Сегментояд. Отр. 96 20,7781 ,87432 нейтрофилы Положит 14 20,8786 2,72873 96 61,7542 1,13819 14 61,6500 2,54007 96 ,4505 ,02231 14 ,5143 ,06701 96 2,4615 ,13898 0,97 . Сумма Отр. гранулоцитов Положит 0,97 . Индекс созр. Отр. нейтрофилов Положит 0,32 . Моноциты Отр. 0,31 Положит 14 2,0643 ,36126 Отр. 96 11,9250 ,51539 Положит 14 9,9000 1,49883 Отр. 96 ,9479 ,07947 Положит 14 ,7071 ,19958 Нормобласты Отр. 96 1,2854 ,12494 базофильн. 14 1,4357 ,36997 Нормобласты Отр. 96 9,0885 ,61985 полихромат. 14 10,6286 1,59517 Нормобласты Отр. 96 10,8740 ,65643 оксифильн. 14 11,6357 1,62675 . Лимфоциты 0,17 . Плазмоциты 0,28 . Положит 0,67 . Положит 0,38 . Положит 0,68 . Сумма Отр. 96 21,3448 1,27612 эритро- Положит 14 23,7000 3,38891 кариоцитов . Индекс Отр. 96 ,94 ,004 Положит эритрокариоц. . 14 ,95 ,008 Лейко-эритр. 96 4,2708 ,31760 14 4,1071 ,97369 созрев. Отр. соотношение Положит 0,51 0,616 0,86 . Как видно, среднее содержание основных клеточных типов в миелограмме не различалось в зависимости от экспрессии CD21на клетках ДВКЛ. Различия касались бластов и промиелоцитов – их процент был выше в CD21+ группе. Анализ, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с CD21-фенотипом. В таблице 40 представлены результаты анализа. Таблица 40 Взаимосвязь между экспрессией CD21 на опухолевых клетках и показателями гемопоэза у больных ДВКЛ Показатель Градации Клеточность Снижена Нормальная Повышена Снижены Норма Повышены Менее 1% >=1% Снижены Норма снижены норма повышены Снижены норма Снижены Норма повышены Снижены норма повышены Снижена Норма повышена Снижен Норма повышен Снижение Норма повышены Снижены Норма повышены снижены норма повышены Снижены Норма повышены Снижены Норма повышены Норма повышены Мегакариоциты Бласты Промиелоциты Нейтрофильные миелоциты Нейтрофильные метамиелоциты Палочкоядерные нейтрофилы Сегментоядерные нейтрофилы Сумма клеток гранулоцитарного ростка Индекс созревания гранулоцитов Моноциты Лимфоциты Плазматические клетки Нормобласты базофильные Нормобласты полихроматофильные Нормобласты оксифильные Экспрессия CD21 CD21(-) CD21(+) 31 (32,3) 3 (21,4) 58 (60,4) 10 (71,4) 7 (7,3) 1 (7,1) 17 (17,7) 1 (7,1) 73 (76,0) 12 (85,1) 6 (6,3) 1 (7,1) 30 (31,3) 3 (21,4) 66 (68,7) 11 (78,6) 84 (87,5) 9 (64,3) 12 (12,5) 5 (35,7) 27 (28,1) 3 (21,4) 51 (53,1) 8 (57,1) 18 (18,8) 3 (21,4) 48 (50,0) 9 (64,3) 48 (50,0) 5 (35,7) 4 (4,2) 1 (7,1) 59 (61,5) 10 (71,4) 33 (34,4) 3 (21,4) 14 (14,6) 5 (35,7) 53 (55,2) 4 (28,6) 29 (30,2) 5 (35,7) 26 (27,1) 6 (42,9) 41 (42,7) 2 (14,3) 29 (30,2) 6 (42,9) 53 (55,2) 8 (57,1) 39 (40,6) 5 (35,7) 4 (4,2) 1 (7,1) 8 (8,3) 1 (7,1) 59 (61,5) 12 (85,7) 29 30,2) 1 (7,1) 5 (5,2) 4 (28,6) 55 (57,3) 6 (42,9) 36 37,5) 4 (28,6) 9 (9,4) 3 (21,4) 75 (78,1) 9 (64,3) 12 (12,5) 2 (14,3) 65 (67,7) 9 (64,3) 29 (30,2) 5 (35,7) 2 (2,1) 0 (0) 55 (57,3) 7 (50,0) 32 (33,3) 4 (28,6) 9 (9,4) 3 (21,4) 23 (24,0) 3 (21,4) 73 (76,0) 11 (78,6) Хи-квадрат; P 0,7; 0,7 0,99; 0,6 0,6; 0,5 5,0; 0,025 0,3; 0,9 1,0; 0,32 1,1; 0,59 5,0; 0,08 4,2; 0,12 0,3; 0,85 3,5; 0,17 8,9; 0,012 2,0; 0,38 0,4; 0,8 1,8; 0,4 0,04; 0,84 Сумма клеток эритроидного ростка Индекс Созревания эритроцитов ЛейкоЭритробластическое соотношение Снижена Норма повышена Норма 31 (32,3) 41 (42,7) 24 (25,0) 13 (13,5) 4 (28,6) 5 (35,7) 5 (35,7) 2 (14,3) повышен Снижено Норма повышено 83 (86,5) 22 (22,9) 40 (41,7) 34 (35,4) 12 (85,7) 5 (35,7) 4 (28,6) 5 (35,7) 0,73; 0,7 0,006; 0,6 1,3; 0,5 *Количество (процент в пределах CD21-позитивной или CD21-негативной групп) Как видно из представленных данных, достоверную связь с экспрессией CD21 на опухолевых клетках имели только уровни промиелоцитов и лимфоцитов в костном мозге больных ДВКЛ. Нормальные уровни промиелоцитов в CD21позитивной группе отмечались в 3 раза чаще, чем в группе сравнения CD21негативных ДВКЛ. Однако в группе CD21-позитивных ДВКЛ в 6 раз чаще отмечены сниженные уровни лимфоцитов костного мозга. Иммунофенотипические взаимосвязи с экспрессией рецептора СD21. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, HLA-DR, FcεRII (CD23), CD10, CD38, CD30. Данные представлены в таблице 41. Отсутствие корреляции с HLA-DR и CD45, а также наличие корреляции с CD38 описано в предыдущих разделах. Таблица 41 Взаимосвязь экспрессии CD21 с иммунофенотипическими маркерами ДВКЛ Показатель Градации CD23 отсутствует присутствует отсутствует присутствует отсутствует присутствует CD10 CD30 Экспрессия CD21 CD21(-) CD21(+) 210 (90,5) 21 (70,0) 22 (9,5) 9 (30,0) 174 (94,6) 21 (91,3) 10 (5,4) 2 (8,7) 40 (67,8) 6 (100) 19 (32,2) 0 Хи-квадрат; P 10,7; 0,001 0,4; 0,5 2,7; 0,098 Как видно из представленных данных, связь экспрессии молекул CD21 на опухолевых клетках ДВКЛ наблюдается только с активационными антигенами CD23. Обращает на себя внимание факт отсутствия CD30 в случаях экспрессии CD21, эти маркеры могут являться взаимоисключающими, однако, для подтверждения этого факта потребуется накопление большего числа наблюдений; в анализируемой выборке связь недостоверна (р=0,098). Связь экспрессии CD21 с клетками микроокружения. В клеток микроокружения мы оценили макрофаги (D11, CD163), Тлимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23), таблица 42 Таблица 42 Взаимосвязь между экспрессии CD21 на клетках ДВКЛ и клетками микроокружения Показатель Градации Макрофаги D11 (CD163) отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные Отсутствуют Единичные Многочисленные Отсутствуют Единичные многочисленные Фолликулярные дендритные клетки (CD21) Фолликулярные дендритные клетки CD23 CD5 CD7 CD3 Плазматические клетки CD38++ Экспрессия CD21 Хи-квадрат; P CD21(-) CD21(+) 42 (18,7) 8 (24,2) 0,9; 0,65 141 (62,7) 18 (54,5) 42 (18,7) 7 (21,2) 190 (81,5) 27 (81,8) 1,4; 0,49 37 (15,9) 4 (12,1) 6 (2,6) 2 (6,1) 208 (89,7) 27 (90) 1,6; 0,44 22 (9,5) 2 (6,7) 2 (0,9) 1 (3,3) 76 (32,8) 12 (36,4) 2,4; 0,3 132 (56,9) 15 (45,5) 24 (10,3) 6 18,2) 77 (33) 12 (36,4) 2,6; 0,27 133 (57,1) 15 (45,5) 23 (9,9) 8 (18,2) 67 (36,8) 8 (33,3) 1,5; 0,47 99 (54,4) 12 (50,0) 16 (8,8) 4 (16,70 143 (61,6) 25 (78,1) 3,6; 0,17 66 (28,4) 6 18,8) 23 (9,9) 1 (3,1) Представленные в таблице данные свидетельствуют о том, что экспрессия CD21 на клетках ДВКЛ не связана с количественным составом клеток опухолевого микроокружения. Заключение. В данном разделе нами описана ДВКЛ с экспрессией на опухолевых клетках рецептора CD21. Иммунобиологические особенности этих опухолей состоят в том, что экспрессия CR2 на опухолевых клетках высоко достоверно коррелирует с экспрессией другого рецептора опухолевых клеток – низкоаффинного рецептора для IgE. Клетки микроокружения не взаимосвязаны с экспрессией на опухоли рецептора CD21. Позитивные по CD21 ДВКЛ характеризуются достоверно более частым снижением лимфоцитов и повышением среднего процента бластных клеток костного мозга в сравнении с CD21-негативными ДВКЛ. Патогенетический механизм этого явления пока не совсем ясен. С клинических позиций интересно то, что в CD21-позитивной группе преобладали женщины и отмечалось меньшее число признаков неблагоприятного прогноза по IPI: не было случаев с наличием 5 признаков, преобладали больные с отсутствием этих признаков. V.2.5. Экспрессия низкоаффинного Fc рецептора II для IgE (FcεRII) Низкоаффинный Fc рецептор II для IgE (FcεRII) в нормальных лимфатических узлах экспрессирован на клетках светлых центров фолликулов, активированных В-клетках и фолликулярных дендритных клетках. Согласно номенклатуре лейкоцитарных антигенов он носит название CD23. При исследовании на материале свежезамороженных опухолевых срезов антиген четко выявляется. Наши данные указывают на невысокую частоту экспрессии СD23 при ДВКЛ. Исследование проведено на опухолевых срезах 326 больных ДВКЛ. Частота экспрессии составила 12,0% (39 из 326) – в 28 случаях (8,6%) отмечена экспрессия на части клеток, в 11 случаях (3,4%) на всех клетках. CD23-позитивные случаи ДВКЛ формируют особую группу с точки зрения прогноза и ответа на терапию. Общая выживаемость была оценена у 133 больных ДВКЛ (114 – CD23-негативных, 19 –CD23 позитивных). Как видно на рисунке 5.6, кривые выживаемости существенно расходятся, и только после 160 мес (через 14 лет) различия нивелируются. В целом достоверной связи с прогнозом не отмечено, р=0,15, рисунок 22. Рисунок 22. Выживаемость больных ДВКЛ в зависимости от экспрессии CD23 на опухолевых клетках. В CD23-негативной группе среднее время дожития составило 124,6±12,3 мес (100,4 – 148,8 мес), медиана – 88 мес. В CD23+ группе – 69,7±18,5 мес (33,5-105,9), медиана – 25 мес. Если взять 10-летний период наблюдения (15 больных CD23+ и 92 CD23-), то различия в выживаемости высокодостоверны, р=0,029 (лог-ранк тест), рисунок 23. Рисунок 23. Достоверное ухудшение прогноза в CD23-позитивной группе ДВКЛ при 10летнем периоде наблюдения за больными. Следует отметить, что речь идет о взрослых больных, средний возраст которых при диагностике превышал 54 года, поэтому период наблюдения в 10 лет можно считать вполне достаточным. На основе этих данных можно сделать обоснованное заключение о том, что CD23-позитивные ДВКЛ характеризуются худшим прогнозом в сравнении с CD23-негативной группой. Таким образом, интересный аспект работы заключается еще и в том, что 2 маркера фолликулярных дендритных клеток, экспрессированные в норме на клетках фолликулов (CD21) или только светлых центров (CD23), по-разному влияют на прогноз ДВКЛ. Как было показано в предыдущем разделе, экспрессия этих маркеров на клетках ДВКЛ коррелирует между собой. Однако, плохим прогностическим фактором является только экспрессия CD23-маркера, в норме экспрессированного на клетках светлых центров фолликулов лимфатических узлов. Следовательно, не все маркеры светлых центров могут быть использованы для отнесения группы ДВКЛ к прогностически более благоприятному GCB-типу. Несомненно, вопрос о принадлежности клеток ДВКЛ к GCB-типу нуждается в дальнейшем изучении. Клиническая характеристика больных ДВКЛ, различающихся по экспрессии CD23 на опухолевых клетках. Возраст. Средний возраст больных CD23-негативной группы ДВКЛ составил 54,7±1,1 года (n=281), что было достоверно выше, чем в СD23-позитивной группе (45,1±2,9 года, n=38), p=0,002. В CD23-негативной группе частота больных пожилого возраста была вдвое выше 49,8% (140 из 281), чем в CD23-позитивной группе – 26,3% (10 из 38), р=0,006. Пол. CD23-негативная группа: мужчин 141 (49,1%), женщин 146 (50,9%); CD23позитивная группа: мужчин 17 (43,6%), женщин - 22 (56,4%). соответственно. Связь экспрессии CD23 на клетках ДВКЛ c полом больных отсутствовала (р=0,52). Стадия ДВКЛ. Распределение больных в соответствие со стадиями ДВКЛ представлено в таблице 43. Достоверной связи экспрессии CD23 на злокачественных клетках ДВКЛ со стадией заболевания не обнаружено (р=0,75). Таблица 43 Частота встречаемости различных стадий в зависимости от экспрессии CD23 на клетках ДВКЛ. Экспрессия CD23 Стадия I II III IV CD23-отрицат. 10 (9,9)* 28 (27,7) 14 (13,9) 49 (48,5) CD23-позитивн. 2 (12,5) 6 (37,5) 1 (6,3) 7 (43,8) *Количество (процент в строке) В индексах IPI к числу неблагоприятных факторов прогноза отнесены III и IV стадии ДВКЛ. Частота III,IV стадий в пределах CD23-негативной группы составила 62,4% (63 из 101), а в пределах CD23-позитивной – 50% (8 из 16). Cвязь со стадиями отсутствовала, р=0,35. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. В CD23-негативной группе средние уровни ЛДГ составили 684,8±70,7 (n=76) ед/мл, а у больных с экспрессией антигена на опухолевых клетках – 953,9±178,0 (n=17). Различия не достоверны, р=0,12. Обращает на себя внимание тот факт, что в прогностически неблагоприятной группе CD23+ ДВКЛ уровни ЛДГ были значительно выше. Повышенные уровни ЛДГ в CD23-негативной группе наблюдались у 50 из 76 больных (65,8%), и значительно чаще в группе сравнения (CD23-позитивной) – у 14 из 17 больных (82,4%), взаимосвязи между признаками нет, р=0,18. Экстранодальные локализации. Прогностически неблагоприятная группа ДВКЛ с наличием 2 и более экстранодальных локализаций встречалась у 34 из 281 больного CD23-негативной группы (12,1%) и у 1 из 39 больных (2,6%) в CD23-позитивной группе. Взаимосвязь между признаками близка к достоверной, р=0,052. Следовательно, в прогностически неблагоприятной группе CD23+ ДВКЛ частота двух и более экстранодальных локализаций менее 3%. Мы сопоставили экспрессию CD23 с частотой признаков неблагоприятного прогноза по IPI, таблица 44. Таблица 44 Взаимосвязь экспрессии CD23 с признаками неблагоприятного прогноза по IPI CD23 нет есть 0 12 (15,6) 2 (11,8) Количество неблагоприятных признаков по IPI 1 2 3 4 5 20 (26) 5 (6,5) 4 (5,2) 23 (29,9) 13 (16,9) 7 (41,2) 1 (5,9) 0 4 (23,5) 3 (17,6) *Количество (процент в строке) Как видно, в CD23-негативной и в CD23-позитивной группах частота встречаемости количества неблагоприятных признаков по IPI почти не различалась (Хи-квадрат = 2,3; р=0,8). Не установлено связи и с группами (низкого риска, промежуточного низкого риска, промежуточного высокого риска, высокого риска), выделяемыми на основе количества IPI (p=0,7), таблица 44. Таблица 44 Взаимосвязь экспрессии CD23 на опухолевых клетках ДВКЛ с группами риска маркер Есть/ нет показатель Группа риска низкий нет CD23 Частота % в CD23 есть Частота % в CD23 Итого Частота % в CD23 Низкий-промежут. Высокий-промеж. высокий Итого 32 5 4 36 77 41,6% 6,5% 5,2% 46,8% 100,0% 9 1 0 7 17 52,9% 5,9% ,0% 41,2% 100,0% 41 6 4 43 94 43,6% 6,4% 4,3% 45,7% 100,0% При подразделении на 2 группы (высокий и низкий риск), различия также были недостоверным, р=0,42. Взаимосвязь экспрессии CD23 с показателями гемопоэза при ДВКЛ. Мы сопоставили средние значения количественных показателей миелограммы в группах с наличием и отсутствием CD23 на опухолевых клетках. Среднее содержание основных клеточных типов в миелограмме не различалось в зависимости от экспрессии CD23 (96 больных антиген-негативной группы и 21 больной CD23-позитивной группы) на клетках ДВКЛ. Анализ, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с CD23-фенотипом. В таблице 45 представлены результаты анализа. Таблица 45 Взаимосвязь экспрессии CD23 на опухолевых клетках ДВКЛ с уровнями сегментоядерных нейтрофилов в костном мозге больных Показатель Градации Сегментоядерные нейтрофилы Снижены норма повышены Экспрессия CD23 CD23(-) CD23(+) 15 (15,6) 4 (19,0) 55 (57,3) 6 (28,6) 26 (27,1) 11 (52,4) Хи-квадрат; P 6,3; 0,042 *Количество (процент в пределах CD23-позитивной или CD23-негативной групп) Достоверную связь с экспрессией CD23 на опухолевых клетках имели только уровни сегментоядерных нейтрофилов в костном мозге больных ДВКЛ. Повышенные уровни этих клеток в CD23-позитивной группе отмечались в 2 раза чаще, чем в группе сравнения (CD23-негативные ДВКЛ). Иммунофенотипические взаимосвязи с экспрессией рецептора СD23. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген HLA-DR, CD45, CD21, CD10, CD38, CD30. Отсутствие корреляции с HLA-DR и CD45, а также наличие корреляции с CD38 и CD21 описано в предыдущих разделах. Данные представлены в таблице 46. Таблица 46 Взаимосвязь экспрессии СD23 с экспрессией CD10 и CD30 Показатель CD10 CD30 Градации отсутствует присутствует отсутствует присутствует Экспрессия CD23 CD21(-) CD21(+) 192 (94,6) 11 (5,4) 61 (77,2) 18 (22,8) 28 (87,5) 4 (12,5) 4 (57,1) 3 (42,9) Хи-квадрат; P 2,3; 0,12 1,4; 0,24 Как видно из представленных ранее данных, связь экспрессии молекул CD23 на опухолевых клетках ДВКЛ наблюдается только с активационными антигенами CD23 и CD38. Связь экспрессии CD23 с клетками микроокружения. В числе клеток микроокружения оценили макрофаги (D11, CD163), Тлимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23), таблица 47. Таблица 47 Связь экспрессии CD23 на клетках ДВКЛ с клетками микроокружения Показатель Градации Макрофаги D11 (CD163) отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные Фолликулярные дендритные клетки (CD21) Фолликулярные дендритные клетки CD23 CD5 Экспрессия CD23 Хи-квадрат; P CD23(-) CD23(+) 56 (20,0) 6 (15,8) 0,5; 0.78 174 (62,1) 24 (63,2) 50 (17,9) 8 (21,1) 192 (83,1) 22 (71,0) 3,1; 0,22 32 (13,9) 8 (25,8) 7 (3,0) 1 (3,2) 254 (88,5) 35 (92,1) 2,4; 0,3 31(10,8) 2 (5,3) 2 (0,7) 1 (2,6) 93 (32,5) 8 (24,2) 3,0; 0,22 166 (58,0) 25 (57,6) многочисленные отсутствуют единичные многочисленные CD3 Отсутствуют Единичные Многочисленные Плазматические Отсутствуют клетки CD38++ Единичные многочисленные CD7 27 (9,5) 94 (32,8) 167 58,2) 26 (9,1) 74 (36,5) 113 (55,7) 16 (7,9) 184 (64,6) 76 (26,7) 25 (8,8) 6 15,4) 8 (20,5) 25 (64,1) 6 (15,1) 8 (24,2) 19 (57,6) 6 (18,2) 24 (61,5) 13 (33,3) 2 (5,1) 3,2; 0,2 4,5; 0,051 1,2; 0,56 Представленные в таблице данные свидетельствуют о том, что экспрессия CD23 на клетках ДВКЛ в наибольшей степени связана связана с количественным составом T-клеток опухолевого микроокружения. При использовании Т-клеточных маркеров CD7 и CD5 частота выраженной реакции Т-клеток в CD23-позитивной группе в 1,5 раза выше, чем в случаях отсутствия CD23 на опухолевых клетках. При использовании специфического маркера Т-клеток CD3 частота выраженных реакций в 2,5 раза выше в CD23-позитивной группе, и взаимосвязь близеа к достоверной (р=0,051). Разница в данных между CD3, CD5 CD7 может быть обусловлена тем, что CD7 помимо Т-клеток присутствует на NK-клетках, а CD5 – на некоторых В-клетках. Следовательно, экспрессия CD23 на клетках ДВКЛ взаимосвязана с несколько более выраженной зрело-Т-клеточной инфильтрацией. Заключение. В данном разделе нами описана группа ДВКЛ с экспрессией на опухолевых клетках рецептора CD23. Частота встречаемости этой группы среди ДВКЛ составляет 12% (39 из 326 больных). Иммунобиологические особенности этих опухолей состоят в том, что экспрессия FcεRII на опухолевых клетках высоко достоверно коррелирует с экспрессией другого рецептора опухолевых клеток – рецептора комплемента CR2. Т-клетки микроокружения взаимосвязаны с экспрессией CD23 и нарастают в антигенпозитивной группе. Из числа показателей гемопоэза CD23-позитивный фенотип ассоциирован только с достоверным увеличением процентного содержания сегментоядерных нейтрофилов в миелограмме. Объяснения данному факту пока нет, и, по-видимому, углубленное изучение кроветворения при периферических лимфомах может пролить свет на понимание патогенеза данного явления. С клинических позиций интересно то, что CD23-позитивная группа больных характеризовалась значительно более худшим прогнозом, снижением показателей выживаемости в сравнении с CD23-негативной группой пациентов, причем достоверно преобладали лица молодого возраста. V.2.6. Нейтральная эндопептидаза (CD10) Следующим изученным маркером, экспрессируемым на клетках ДВКЛ, явилась нейтральная эндопептидаза. В нормальных лимфатических узлах антиген представлен на клетках светлых центров фолликулов. Согласно номенклатуре лейкоцитарных антигенов он носит название CD10. При исследовании на материале свежезамороженных опухолевых срезов антиген четко выявляется. Наши данные указывают на низкую частоту экспрессии СD10 при ДВКЛ. Исследование проведено на опухолевых срезах 238 больных ДВКЛ. Частота экспрессии составила 6,3% (15 из 238) – в 9 случаях (3,8%) отмечена экспрессия на части клеток, в 6 случаях (2,5%) на всех клетках. Интерес к этому антигену обусловлен тем, что он используется как один из иммуногистохимических маркеров GCB-типа ДВКЛ. В первую очередь нас интересовало, насколько CD10-позитивные случаи ДВКЛ формируют особую группу с точки зрения прогноза и ответа на терапию. Общая выживаемость была оценена у 96 больных ДВКЛ (92 – CD10-негативных, 4 – CD10-позитивных). Несмотря на крайнюю малочисленность CD10-позитивной группы больных ДВКЛ, все эти пациенты характеризовались крайне неблагоприятным прогнозом и погибли в сроки до 2 лет, что позволило расценить экспрессию CD10 как неблагоприятный признак, имеющий достоверную связь с прогнозом, р=0,035 (лог-ранк тест), рисунок 23. Среднее время дожития в CD10негативной группе составило 114,5±14,2 мес, (86,7-142,3 мес); медиана – 57 мес. В антиген позитивной группе – 16,8±4,0 мес (8,9-24,6 мес); медиана 14 мес. Рисунок 23. Неблагоприятный прогноз при CD10+ ДВКЛ. Клиническая характеристика больных ДВКЛ, различающихся по экспрессии CD10 на опухолевых клетках. Возраст. Средний возраст больных CD10-негативной группы ДВКЛ составил 54,9±1,2 года (n=220), что не отличалось от СD10-позитивной группы (58,1±4,2 года, n=14), p=0,5. В CD10-негативной группе частота больных пожилого возраста была несколько ниже 50,0% (110 из 220), чем в CD10-позитивной группе – 64,3% (9 из 14), р=0,3. Пол. CD10-негативная группа: мужчин 113(50,7%), женщин 110 (49,3%); CD10позитивная группа: мужчин 9 (60%), женщин - 6 (40%), р=0,48. Стадия ДВКЛ. Сопоставление со стадиями проведено у 84 больных, из них с экспрессией CD10 всего трое (1 – III стадия и 2 – IV стадия). Ввиду малочисленности CD10+ больных не оценивали связь с факторами IPI, концентрацией ЛДГ Экстранодальные локализации. Прогностически неблагоприятная группа ДВКЛ с наличием 2 и более экстранодальных локализаций встречалась у 2 из 13 больных CD10-положительной группы (15,4%) и вдвое чаще в CD10-негативной группе (73 из 218, 33,5%), р-0,18. Взаимосвязь экспрессии CD10 с показателями гемопоэза при ДВКЛ. При сопоставлении средних значений количественных показателей миелограммы в группах с наличием и отсутствием CD10 на опухолевых клетках различия касались только промиелоцитов, таблица 48. Таблица 48 Среднее содержание промиелоцитов в CD10+ и CD10-негативной группах ДВКЛ. Показатель Стд. ошибка CD10 Промиелоциты нет есть Среднее N Р среднего 108 ,45 ,05 10 ,2 ,06 0,053 (0,000) Среднее содержание основных клеточных типов в миелограмме не различалось в зависимости от экспрессии CD10 на клетках ДВКЛ. Различия касались только промиелоцитов – их процент был ниже в CD10+ группе. Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с CD10-фенотипом. Ни с одним клеточным типом взаимосвязи не установлено. Иммунофенотипические взаимосвязи с экспрессией антигена СD10. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, HLA-DR, CD21, FcεRII (CD23), CD38, CD30. Отсутствие корреляции с HLA-DR и CD45, CD38, CD21, CD23 описано в предыдущих разделах. Оценить связь между CD10 и CD30 не удалось, так как все 69 больных, у которых были изучены оба антигена, относились к CD10-негативной группе. Связь экспрессии CD10 с клетками микроокружения. В числе клеток микроокружения мы оценили макрофаги (D11, CD163), Тлимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23), таблица 49. Таблица 49 Взаимосвязь экспрессии CD10 на опухолевых клетках с клетками микроокружения Показатель Градации Макрофаги D11 (CD163) отсутствуют единичные многочисленные отсутствуют единичные многочисленные отсутствуют единичные многочисленные Отсутствуют Единичные Многочисленные Отсутствуют Единичные многочисленные Фолликулярные дендритные клетки (CD21) Фолликулярные дендритные клетки CD23 CD3 Плазматические клетки CD38++ Экспрессия CD10 Хи-квадрат; P CD10(-) CD10(+) 43 (19,7) 0 4,2; 0,033 131 (60,1) 10 (66,7) 44 (20,2) 5 (33,3) 157 (80,5) 10 (83,3) 1,4; 0,5 32 (16,4) 1 (8,3) 6 (3,1) 1 (8,3) 194 (88,2) 14 (93,3) 0,4; 0,8 23 (10,5) 1 (6,7) 3 (1,4) 0 76 (36,5) 4 (30,8) 0,6; 0,7 113 (54,3) 7 (53,8) 19 (9,1) 2 (15,4) 140 (63,1) 8 (53,3) 0,6; 0,7 62 (27,9) 5 (33,3) 20 (9) 2 (13,3) Представленные в таблице данные свидетельствуют о том, что экспрессия CD10 на клетках ДВКЛ не связана с количественным составом клеток опухолевого микроокружения. Исключением являются интратуморальные макрофаги, выраженная реакция которых в CD10+ случаях наблюдается в у 33,3% больных (в 1,5 раза выше, чем в группе сравнения), что при оценке по ряду тестов является достоверным (р=0,033). Заключение. В данном разделе нами описана группа ДВКЛ с экспрессией на опухолевых клетках рецептора CD10. Частота этого варианта низкая – 6,3% среди ДВКЛ (15 из 238 случаев). Больные характеризовались плохим прогнозом, CD10+ ДВКЛ практически не имели связи с гемопоэзом, а также с иммунофенотипическими маркерами опухоли. Этот тип лимфом характеризуется несколько более выраженной макрофагальной инфильтрацией. Для окончательного заключения о значении диагностики данного редкого варианта ДВКЛ необходимо дальнейшее накопление клинических данных. V.2.7. Ki-1 антиген (CD30) Следующим маркером, изученным нами на клетках ДВКЛ, явился антиген Ki-1, который согласно номенклатуре лейкоцитарных дифференцировочных антигенов носит название CD30. При исследовании на материале свежезамороженных опухолевых срезов антиген четко выявляется. Наши данные указывают на весьма значительную частоту экспрессии СD30 при ДВКЛ. Исследование проведено на опухолевых срезах 88 больных ДВКЛ. Частота экспрессии составила 23,9% (21 из 88) – в 14 случаях (15,9%) отмечена экспрессия на части клеток, в 7 случаях (8,0%) - на всех опухолевых клетках. В первую очередь нас интересовало, насколько CD30-позитивные случаи ДВКЛ формируют особую группу с точки зрения прогноза и ответа на терапию. Общая выживаемость была оценена у 31 больного ДВКЛ (23 – CD30-негативных, 8 – CD30- позитивных). Ни один из 8 больных CD8-позитивной группы не умер за период наблюдения до 110 мес, что объясняет высокую достоверность связи экспрессии антигена с выживаемостью (рисунок 24), р=0,02. Рисунок 24. Высокие показатели выживаемости в группе CD30-позитивных больных. Клиническая характеристика больных ДВКЛ, различающихся по экспрессии CD30 на опухолевых клетках. Возраст. Средний возраст больных CD30-негативной группы ДВКЛ составил 50,6±2,1 года (n=67), что не отличалось от СD30-позитивной группы (48,5±3,9 года, n=21), p=0,6. В CD30-негативной группе частота больных пожилого возраста была 32,8% (22 из 67), а в CD30-позитивной группе – 33,3% (7 из 21), р=0,97. Пол. CD30-негативная группа: мужчин 39 (58,2%), женщин 28 (41,8%); CD30позитивная группа: мужчин 9 (42,9%), женщин - 12 (57,1%), р=0,22. Стадия ДВКЛ. Распределение больных по стадиями ДВКЛ представлено в таблице 50. Достоверной связи экспрессии CD30 на злокачественных клетках ДВКЛ со стадией заболевания не обнаружено (р=0,75). Таблица 50 Частота встречаемости различных стадий в зависимости от экспрессии CD30 на клетках ДВКЛ. Экспрессия CD30 I CD30-отрицат. 1 (5)* CD30-позитивн. 0 *Количество (процент в строке) Стадия II 7 (35) 1 (16,7) III 2 (10) 1 (16,7) IV 10 (50) 4 (66,6) В индексах IPI к числу неблагоприятных факторов прогноза отнесены III и IV стадии ДВКЛ. Частота III,IV стадий в пределах CD30-негативной группы составила 60% (12 из 20), а в пределах CD30-позитивной – 83,3% (5 из 6). Cвязь со стадиями отсутствовала, р=0,29. Обращает на себя внимание тот факт, что даже несмотря на высокую частоту III-IV стадий заболевания в CD30-позитивной группе, показатели выживаемости в ней были хорошими – ни один больной не умер в сроки наблюдения до 110 мес. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. В CD30-негативной группе средние уровни ЛДГ составили 995,9±261,6 (n=17) ед/мл, а у больных с экспрессией антигена на опухолевых клетках – 662,3±163,3 (n=4). Различия не достоверны, р=0,56. Повышенные уровни ЛДГ в CD30-негативной группе наблюдались у 14 больных (82,4%), а в группе сравнения – у 3 больных (75,0%), взаимосвязи между признаками нет, р=0,74. Экстранодальные локализации. Прогностически неблагоприятная группа ДВКЛ с наличием 2 и более экстранодальных локализаций встречалась у 5 из 65 больных CD30-негативной группы (7,7%) и у 1 из 21 больного (4,8%) в CD30-позитивной группе. Признаки не связаны, р=0,65. При анализе в зависимости от количества факторов риска (IPI) связи не обнаружено (р=0,9), следует отметить, что в CD30+ группе было всего 4 больных, в группе сравнения -17. Взаимосвязь экспрессии CD30 с показателями гемопоэза при ДВКЛ. Мы сопоставили средние значения количественных показателей миелограммы в группах с наличием и отсутствием CD30 на опухолевых клетках. Результаты достоверных различий представлены в таблице 51. Таблица 51 Показатели гемопоэза, различающиеся между группами CD30-позитивной и CD30-негативной ДВКЛ Показатель Стд. ошибка CD30 Среднее N Р среднего Сумма нет 26 61,5 2,5 гранулоцитов есть 10 69,9 2,4 Нормобласты нет 26 11,84 1,37 оксифильные есть 10 6,96 1,1 Сумма нет 26 23,3 2,55 эритрокариоц. есть 10 14,88 2,4 Лейко-эритро- нет 26 3,86 ,51 бластич. соотн. есть 10 5,90 ,93 0,022 0,044 0,025 0,049 Как видно, среднее содержание нескольких клеточных типов в миелограмме различалось в зависимости от экспрессии CD30 на клетках ДВКЛ. Различия касались суммарного содержания клеток гранулоцитарного ростка – их процент был выше в CD30+ группе. Кроме того, в этой группе практически не были повышены в отличие от CD30-негативных ДВКЛ уровни оксифильных нормобластов. Суммарное среднее содержание эритрокариоцитов в CD30+ группе было более низким (в пределах нормы) в сравнении с CD30-негативной группой. Подобные изменения отразились на величине лейко-эритроидного соотношения, которое было выше в CD30-позитивной группе. Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с CD30+ фенотипом (10 больных) и CD30- фенотипом (26 больных). В таблице 52 представлены результаты анализа. Таблица 52 Взаимосвязь экспрессии CD30 на опухолевых клетках ДВКЛ с клетками гранулоцитарного и эритроидного ростков Показатель Градации Сумма клеток гранулоцитарного ростка Нормобласты полихроматофильные Снижена Норма повышена Снижены Норма повышены Экспрессия CD30 CD30(-) CD30(+) 7 (26,9) 0 (0) 10 (38,8) 3 (30) 9 (34,6) 7(70) 12 (46,2) 9 (90) 11 (42,3) 0 3 (11,5) 1 (10) Хи-квадрат; P 4,9; 0,038 6,6; 0,036 *Количество (процент в пределах CD30-позитивной или CD30-негативной групп) Достоверную связь с экспрессией CD30 на опухолевых клетках имели суммарное содержание гранулоцитов в костном мозге (чаще отмечено повышение при CD30+ фенотипе) и процент полиморфноядерных нормобластов (чаще отмечено снижение при CD30+ фенотипе). Иммунофенотипические взаимосвязи с экспрессией антигена СD30. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, HLA-DR, FcεRII (CD23), CD10, CD38. Явных взаимосвязей с экспрессией каких-либо антигенов не выявлено, что описано в предыдущих разделах. Связь экспрессии CD30 с клетками микроокружения. В числе клеток микроокружения мы оценили макрофаги (D11, CD163), Тлимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23). Результаты представлены в таблице 53. Таблица 53 Взаимосвязь экспрессии CD30 на клетках ДВКЛ с клетками микроокружения Показатель Градации Макрофаги D11 (CD163) отсутствуют единичные многочисленные отсутствуют единичные многочисленные Фолликулярные дендритные клетки (CD21) Экспрессия CD30 Хи-квадрат; P CD30(-) CD30(+) 12 (18,2) 1 (4,8) 2,3; 0,3 40 (60,6) 15 (71,4) 14 (21,4) 5 (23,8) 38 (82,6) 14 (73,7) 2,4; 0,3 6 (13) 5 (26,3) 2 (4,4) 0 Фолликулярные дендритные клетки CD23 CD3 отсутствуют единичные 58 (89,2) 7 (10,8) 18 (85,7) 3 (14,3) 0,2; 0,7 Отсутствуют Единичные Многочисленные Плазматические Отсутствуют клетки CD38++ Единичные многочисленные 11 (22,4) 28 (57,1) 10 (20,4) 42 (65,6) 13 (20,3) 9 (14,5) 6 (28,6) 13 (61,9) 2 (9,5) 10 (47,6) 10 (47,6) 1 (4,8) 1,3; 0,5 6,4; 0,04 Представленные в таблице данные свидетельствуют о том, что экспрессия CD30 на клетках ДВКЛ связана только с количеством инфильтрирующих опухоль плазмоцитов – выраженная реакция этих клеток не характерна для CD30+ ДВКЛ. Заключение. В данном разделе нами описана группа ДВКЛ с экспрессией на опухолевых клетках антигена CD30. Для опухолей этой группы не характерна выраженная плазмоклеточная реакция микроокружения. Позитивные по CD30 ДВКЛ характеризуются достоверно более частым увеличением суммарного процента клеток гранулоцитарного ростка, нормальным содержанием оксифильных нормобластов, а также более низким средним уровнем суммарного содержания эритрокариоцитов (в пределах нормы), что отражается на более высоком лейкоэритроидном соотношении в данной группе. С клинических позиций интересно то, что в CD30-позитивная группа характеризовалась наиболее благоприятным прогнозом (ни один больной не умер в сроки наблюдения до 110 мес). V.3. Роль клеток опухолевого микроокружения в клиническом течении и прогнозе ДВКЛ. Как уже отмечалось в предыдущих разделах, нами изучены макрофаги (CD163), плазматические клетки (CD38++), 2 популяции фолликулярных дендритических клеток (CD21, CD23), а также зрелые Т-лимфоциты (CD3, CD5, CD7) в срезах биопсийного материала опухолевой ткани больных лимфомой. V.3.1. Уровни макрофагов (D11, CD163) в ткани ДВКЛ. Макрофаги изучены у 326 больных. В 63 случаях (19,3%) выявлялись единичные клетки или их практически полное отсутствие, в остальных 263 наблюдениях (80,7%) наблюдалась умеренная (205 случаев, 62,9%) или выраженная (58 случаев, 17,8%) макрофагальная реакция. Роль того или иного типа реакции макрофагов в прогнозе ДВКЛ оценена у 134 больных – 28 с отсутствием реакции макрофагов, 85 с умеренным типом реакции и 21 с выраженной макрофагальной инфильтрацией. Как видно на рисунке 24, уровень инфильтрации ткани ДВКЛ макрофагами не влиял на продолжительность жизни больных ДВКЛ, р=0,97. Рисунок 24. Уровень инфильтрации опухолевой ткани макрофагами не влияет на продолжительность жизни больных ДВКЛ. Клиническая характеристика больных ДВКЛ, различающихся по степени инфильтрации опухолевой ткани макрофагами (CD163+). Возраст. Средний возраст больных, у которых практически полностью отсутствовала макрофагальная инфильтрация опухолевых срезов ДВКЛ, не отличался от возраста больных с наличием умеренной или выраженной макрофагальной реакции: 51,6±2,4 года (n=63) и 53,9±1,1 (n=256), соответственно, р=0,38. Вместе с тем больные с наличием выраженной инфильтрации опухолевой ткани макрофагами (n=58) были более старшего возраста (57,9±2,2), чем больные с умеренной инфильтрацией или отсутствием таковой (52,4±1,2, n=261), p=0,04. Пропорция лиц старшей возрастной группы увеличивалась при нарастании макрофагальной инфильтрации (отсутствие-умеренная-выраженная): 39,7% - 46% 55,2%, р=0,2. Пол. Пропорция макрофагальной мужчин и женщин инфильтрации была в группах примерно с различными одинаковой. типами Уровень макрофагальной инфильтрации ткани ДВКЛ не связан с полом больных, р=0,3. Стадия ДВКЛ. Частота поздних (III-IV) стадий возрастала при нарастании макрофагальной инфильтрации (минимальная-умеренная-выраженная) – 52,4%59,5%-65,2%, однако достоверности взаимосвязи мы не отметили (р=0,69). Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. Уровни ЛДГ снижались по мере нарастания макрофагальной инфильтрации (минимальная-умереннная-выраженная): 862,3±127,5 (n=19), 731,2±95,7 (n=59), 581,6±50,99 (n=17), причем различия между группами с отсутствием инфильтрации и выраженной инфильтрацией были на грани достоверности, р=0,052. Это интересное наблюдение свидетельствует о том, что нарастание интратуморальной иммунореактивности макрофагов, возможно, препятствует проявлениям биологической активности опухоли. Экстранодальные локализации. Частота двух и более экстранодальных локализаций опухоли при минимальной инфильтрации макрофагами составила 12,9% (2 из 62), при умеренной – 10,9% (22 из 202), при выраженной – 7,3% (4 из 55), признаки не связаны, р=0,6. При анализе в зависимости от количества факторов риска (IPI) связи не обнаружено (р=0,4). Взаимосвязь уровней макрофагальной инфильтрации (CD163) с показателями гемопоэза при ДВКЛ. Мы оценили средние значения количественных показателей миелограммы (процентное содержание каждого из клеточных типов, а также средние величины индексов) в зависимости от уровня макрофагальной инфильтрации ткани ДВКЛ. Сопоставили 1. Уровни при минимальной инфильтрации макрофагами и при умеренной инфильтрации 2. Уровни при минимальной инфильтрации макрофагами и при умеренной + выраженной инфильтрации 3. Уровни при минимальной инфильтрации макрофагами и при выраженной инфильтрации 4. Уровни при умеренной инфильтрации макрофагами и при выраженной инфильтрации 5. Уровни при выраженной инфильтрации макрофагами и при умеренной инфильтрации+минимальной инфильтрации Нами не выявлено достоверных различий в среднем содержании различных клеток и индексов при проведении этих типов сопоставлений (р>0,05). Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с уровнями макрофагальной инфильтрации (минимальной и умеренной/выраженной). Взаимосвязей не установлено, р>0,05. Иммунофенотипические взаимосвязи с уровнями макрофагальной инфильтрации СD163. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген HLA-DR, CD45, FcεII (CD23), CD10, CD38, CD30. Как продемонстрировано в предыдущих разделах, уровни макрофагальной инфильтрации были взаимосвязаны только в с CD38+ иммунофенотипом ДВКЛ. Связь макрофагальной инфильтрации с клетками микроокружения. В числе клеток опухолевого микроокружения нами оценены Т-лимфоциты (CD3, CD5, CD7), плазмоциты (CD38), а также фолликулярные дендритные клетки (CD21, CD23), таблица 54. Таблица 54 Взаимосвязь уровней макрофагальной инфильтрации с другими клеточными типами опухолевого микроокружения Показатель Градации Фолликулярные дендритные клетки (CD21) Фолликулярные дендритные клетки (CD23) CD5 отсутствуют единичные многочисленные отсутствуют единичные многочисленные Отсутствуют Единичные Многочисленные Отсутствуют Единичные Многочисленные Отсутствуют Единичные Многочисленные Отсутствуют Единичные многочисленные CD7 CD3 Плазматические клетки CD38++ Уровень CD163+ макрофагов Минимальн. Умеренн. Выраженн. 42 (84) 128(80,5) 40 (81,6) 8 (16) 26 (16,4) 6 (12,2) 0 5 (3,1) 3 (6,1) 57 (91,9) 171(86,8) 53 (91,4) 5 (8,1) 25 (12,7) 3 (5,2) 0 1 (0,5) 2 (3,4) 34 (54,8) 58 (28,4) 10 (17,2) 25 (40,3) 123(60,3) 41 (70,7) 3 (4,8) 23 (11,3) 7 (12,1) 35 (55,6) 59 (28,9) 9 (15,5) 25 (39,7) 123(60,3) 42 (72,4) 3 (4,8) 22 (10,8) 7 (12,1) 26 (59,1) 50 (33,3) 8 (17,8) 16 (36,4) 86 (57,3) 31 (68,9) 2 (4,5) 14 (9,3) 6 (13,3) 45 (72,6) 121(60,2) 42 (72,4) 15 (24,2) 58 (28,9) 12 (20,7) 2 (3,2) 22 (10,9) 4 (6,9) Хиквадрат; P 3,5; 0,48 Представленные в таблице данные свидетельствуют о том, что 7,86; 0,097 22,4; 0,000 24,6; 0,000 17,5; 0,002 6,5; 0,16 уровни макрофагальной инфильтрации (CD163) в ткани ДВКЛ взаимосвязаны с большинством клеток микроокружения. Однако достоверные взаимосвязи получены только для Т-лимфоцитов. Эти связи заключаются в том, что при умеренной и выраженной реакции макрофагов уровень инфильтрации Т-клетками также возрастает. Заключение. В данном разделе нами проанализирована роль выраженности макрофагальной инфильтрации (CD163+) опухолевой ткани ДВКЛ. Уровень макрофагальной инфильтрации достоверно положительно коррелировал с Тклеточной инфильтрацией, оцениваемой по всем трем маркерам (CD3, CD5, CD7). Выраженность макрофагальной инфильтрации зависела от иммунофенотипических особенностей ДВКЛ и нарастала при экспрессии CD38 на опухолевых клетках. Макрофагальная инфильтрация не была связана с гемопоэзом у больных ДВКЛ. Из числа клинико-лабораторных данных отмечены более низкие уровни ЛДГ и более старший возраст больных с наличием выраженной макрофагальной инфильтрации. Выраженность инфильтрации опухолевой ткани макрофагами не влияла на прогноз больных ДВКЛ. V.3.2. Уровни плазматических клеток (CD38++) микроокружения в ткани ДВКЛ. Уровни плазмоклеточной реакции изучены у 329 больных ДВКЛ. В 212 случаях (64,4%) выявлялись единичные клетки или их практически полное отсутствие, в остальных 117 наблюдениях (35,6%) наблюдалась умеренная (89 случаев, 27,1%) или выраженная (28 случаев, 8,5%) плазмоклеточная реакция. Роль того или иного типа реакции плазмоцитов в прогнозе ДВКЛ оценена у 136 больных – 89 с отсутствием реакции плазмоцитов, 38 с умеренным типом реакции и 9 с выраженной плазмоклеточной инфильтрацией. Как видно на рисунке 24, уровень инфильтрации ткани ДВКЛ плазмоцитами продолжительность жизни больных ДВКЛ, р=0,907. не влиял на Рисунок 24. Уровень инфильтрации опухолевой ткани плазматическими клетками (CD38++) не влияет на продолжительность жизни больных ДВКЛ. Клиническая характеристика больных ДВКЛ, различающихся по степени инфильтрации опухолевой ткани плазмоцитами (CD38++). Возраст. Средний возраст больных, у которых практически полностью отсутствовала плазмоклеточная инфильтрация опухолевых срезов ДВКЛ, составил 53,3±1,3 года (n=208), в группе с умеренной инфильтрацией - 54±1,9 года (n=87), а у больных с выраженной инфильтрацией – 54,3±3,3 года; различия между группами недостоверны. Пол. Пропорция плазмоклеточной мужчин и женщин инфильтрации была в группах примерно с различными одинаковой. типами Уровень плазмоклеточной инфильтрации ткани ДВКЛ не связан с полом больных, р=0,3. Стадия ДВКЛ. плазмоклеточной Частота инфильтрации поздних (III-IV) стадий при нарастании (минимальная-умеренная-выраженная) была следующей – 59,3%-70,4%-33,3%, однако, достоверности взаимосвязи мы не отметили (р=0,22). Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. Уровни ЛДГ по мере нарастания плазмоклеточной инфильтрации (минимальная-умеренная-выраженная) были следующими: 765,5±84,2 (n=72), 594,1±56,9 (n=17), 662,0±188,0 (n=5). Достоверной связи плазмоклеточной инфильтрации с уровнями ЛДГ не было, р>0,05. Экстранодальные локализации. Частота двух и более экстранодальных локализаций опухоли при минимальной инфильтрации макрофагами составила 12,8%, при умеренной – 9,2%, при выраженной – 4,0%, признаки не связаны, р=0,33. При анализе в зависимости от количества факторов риска (IPI) связи не обнаружено (р=0,68). Взаимосвязь уровней плазмоклеточной инфильтрации (CD38++) с показателями гемопоэза при ДВКЛ. Мы сопоставили средние значения количественных показателей миелограммы (процентное содержание каждого из клеточных типов, а также средние величины индексов) в зависимости от уровня плазмоклеточной инфильтрации ткани ДВКЛ. Сопоставили: 1. Уровни при минимальной инфильтрации плазматическими клетками и при умеренной инфильтрации 2. Уровни при минимальной инфильтрации плазматическими клетками и при умеренной + выраженной инфильтрации 3. Уровни при минимальной инфильтрации плазматическими клетками и при выраженной инфильтрации 4. Уровни при умеренной инфильтрации плазматическими клетками и при выраженной инфильтрации 5. Уровни при выраженной инфильтрации плазматическими клетками и при умеренной инфильтрации+минимальной инфильтрации. Нами установлено, что клеточность костного мозга достоверно различалась между группами больных ДВКЛ с наличием минимальной и умеренной инфильтрации опухолевой ткани плазмоцитами: 74,9±8,8 (n=71) и 111,5±14,6 (n=36), p=0,026. Других особенностей гемопоэза в зависимости от уровней инфильтрации плазмоцитами первичной опухоли не отмечено. Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с уровнями плазмоклеточной инфильтрации. В таблице представлены только достоверные взаимосвязи (таблица 55). Таблица 55 Связь инфильтрации опухоли плазмоцитами с клеточностью костного мозга, уровнями лимфоцитов и моноцитов и миелокариоцитов при ДВКЛ Показатель Градации Миелокариоциты Снижены норма повышены Снижены норма повышены Снижены норма повышены Моноциты Лимфоциты Инфильтрация плазмоцитами CD38 Хи-квадрат; P слабая умеренная высокая 26 (36,6) 5 (13,9) 5 (45,5) 9,1; 0,047 42 (59,2) 26 (72,2) 5 (45,5) 3 (4,2) 5 (13,9) 1 (9,1) 2 (2,8) 4 11,1) 3 (27,3) 13,1; 0,011 48 (67,6) 25 (69,4) 3 (27,3) 21 (29,6) 7 (19,4) 5 (45,5) 10 (14,1) 0 0 8,5; 0,018 34 (47,9) 24 (66,7) 7 (63,6) 27 (38) 12 (33,3) 4 (36,4) Как видно, при высокой плазмоклеточной инфильтрации повышается доля гипоклеточных образцов костного мозга, вместе с тем, отсутствуют образцы со сниженным процентом лимфоцитов. В этой группе больных в 45% случаев уровни моноцитов повышены, чего не наблюдается у больных с минимальной и умеренной плазмоклеточной инфильтрацией опухоли. Иммунофенотипические взаимосвязи с уровнями плазмоклеточной инфильтрации СD38. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, HLA-DR, CR2 (CD21), FcεRII (CD23), CD10, CD38, CD30. Как продемонстрировано в предыдущих разделах, уровни плазмоклеточной инфильтрации были взаимосвязаны только с экспрессией CD38 на опухолевых клетках ДВКЛ. Связь плазмоклеточной инфильтрации с клетками микроокружения. В числе клеток микроокружения мы оценили Т-лимфоциты (CD3, CD5, CD7), а также фолликулярные дендритные клетки (CD21, CD23) и макрофаги. Отсутствие связи уровней интратуморальных CD38++ клеток с макрофагальной инфильтрацией описано в предыдущем разделе. Данные по фолликулярным дендритным клеткам и Т-лимфоцитам представлены в таблице 56. Таблица 56 Взаимосвязь плазмоклеточной инфильтрации ДВКЛ с фолликулярными дендритными клетками и Т-лимфоцитами микроокружения. Показатель Градации Уровень CD38++ плазмоцитов ХиМинимальн. Умеренн. Выраженн. квадрат; P Фолликулярные отсутствуют 142 (84,5) 59 (81,9) 14 (58,3) 14,5; 0,006 дендритные единичные 21 (12,5) 10 (13,9) 10 (41,7) клетки (CD21) многочисленные 5 (3,0) 3 (4,2) 0 Фолликулярные отсутствуют 187 (90,3) 79 (88,8) 22 (81,5) 4,6; 0,3 дендритные единичные 17 (8,2) 10 (11,2) 5 (18,5) клетки (CD23) многочисленные 3 (1,4) 0 0 CD5* Отсутствуют 75 (35,5) 22 (24,7) 5 (17,9) 6,0; 0,2 Единичные 117 (55,5) 57 (64,0) 20 (71,4) Многочисленные 19 (9,0) 10 (11,2) 3 (10,7) *Данные по CD7 и CD3 аналогичны; р для CD7 – 0,12; для CD3 – 0,28. Представленные в таблице данные свидетельствуют о том, что уровни плазмоклеточной инфильтрации (CD38++) в ткани ДВКЛ не взаимосвязаны с большинством клеток микроокружения. Единственный тип клеток, с которым плазмоциты высокодостоверно взаимосвязаны, это фолликулярные дендритные клетки CD21+: при выраженной плазмоклеточной реакции почти в половине случаев (41,7%) в срезах присутствуют фолликулярные дендритные клетки CD21+. Заключение. В данном разделе нами проанализирована роль выраженности плазмоклеточной инфильтрации (CD38++) опухолевой ткани ДВКЛ. Уровень плазмоклеточной инфильтрации достоверно коррелировал только с фолликулярными дендритными клетками из числа клеток микроокружения. Выраженность плазмоклеточной иммунофенотипических особенностей инфильтрации ДВКЛ зависела (экспрессии CD38) от . Плазмоклеточная инфильтрация была связана с гемопоэзом у больных ДВКЛ – показателями клеточности, содержанием лимфоцитов и моноцитов, индексом созревания эритрокариоцитов. Не отмечено связи с клинико-лабораторными данными. Выраженность инфильтрации опухолевой ткани плазматическими клетками не влияла на прогноз больных ДВКЛ. V.3.3. Фолликулярные дендритические клетки (CD21+ и CD23+). В опухолевых срезах ДВКЛ могут присутствовать в различных количествах фолликулярные дендритные клетки. Мы изучили 2 типа этих клеток – CD21+ (присутствуют в фолликулах вне зависимости от наличия в них светлых центров) и CD23+ (характерны для светлых центров). CD21-позитивные фолликулярные дендритические клетки. Оценка наличия CD21-позитивных фолликулярных дендритических клеток (ФДК) проведена у 266 больных ДВКЛ. Наличие CD21+ ФДК установлено в 18,4% (49 больных) – в 41 случае выявлялись единичные клетки (15,4%) и у 8 больных большое количество этих клеток (3,0%). Роль CD21+ ФДК в прогнозе ДВКЛ оценена у 114 больных – 95 с отсутствием ФДК, 15 с наличием единичных клеток и 4 с выраженным количеством ФДК. Как видно на рисунке 25, уровень ФДК при ДВКЛ не влиял на продолжительность жизни больных ДВКЛ, р=0,34. Рисунок 25. Уровень CD21+ ФДК в ткани ДВКЛ не влияет на продолжительность жизни больных. Клиническая характеристика больных ДВКЛ с наличием и отсутствием CD21+ ФДК в опухолевой ткани. Возраст. Средний возраст больных, у которых полностью отсутствовали CD21+ ФДК в опухолевых срезах ДВКЛ, составил 54,4±1,2 года (n=214), в группе с наличием этих клеток – 53,9±2,8 года (n=46), различия между группами недостоверны, р=0,86. Пол. Пропорция мужчин и женщин в группах, различающихся по уровням CD21+ ФДК, была примерно одинаковой, р=0,53. Стадия ДВКЛ. Частота поздних (III-IV) стадий при отсутствии CD21+ ФДК была 59,8% (52 из 87), а при наличии этих клеток – 68,8% (11 из 16), р=0,5. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. Уровни ЛДГ у больных с отсутствием CD21+ ФДК составил 679,0±58,6 (n=65), а при наличии этих клеток - 631,6±78,6 (n=14), достоверной связи не было, р>0,05. Экстранодальные локализации. Частота двух и более экстранодальных локализаций опухоли при отсутствии CD21+ ФДК составила 13,1%, а при наличии – 6,3%, признаки не связаны, р=0,19. При анализе в зависимости от количества факторов риска (IPI) связи не обнаружено (р=0,54). Взаимосвязь наличия CD21+ ФДК в опухолевых срезах ДВКЛ с показателями гемопоэза. Мы сопоставили средние значения количественных показателей миелограммы (процентное содержание каждого из клеточных типов, а также средние величины индексов) в зависимости от уровня плазмоклеточной инфильтрации ткани ДВКЛ, таблица 56. Таблица 56 Взаимосвязь плазмоклеточной инфильтрации ткани ДВКЛ с индексом созревания гранулоцитов в костном мозге и лейко-эритробластическим отношением показатель Стд. ошибка CD21 Индекс созр. отр Среднее N Р среднего 96 0,47 0,02 гранулоцитов положит 14 0,37 0,04 Лейко-эритр. отр 96 3,96 0,28 отношение положит 14 6,20 1,4 0,027 0,011 Нами установлено, что индексы созревания гранулоцитов достоверно различаются между группами с отсутствием и с наличием CD21+ ФДК, p=0,027. Лейко-эритробластическое соотношение было выше нормы и достоверно отличалось от такового в группе сравнения (т.е. от такового у больных с отсутствием CD21+ ФДК в опухолевых срезах). Других особенностей гемопоэза в зависимости от наличия или отсутствия CD21+ ФДК в срезах первичной опухоли не отмечено. Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с уровнями CD21+ ФДК в опухолевой ткани. Достоверных связей не выявлено ни по одному из анализируемых параметров. Близкие к достоверным взаимосвязи (р=0,07) отмечены для сегментоядерных нейтрофилов и оксифильных нормобластов. Иммунофенотипические взаимосвязи с наличием ФДК СD21+ в срезах ДВКЛ. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, HLA-DR, CR2 (CD23), FcεRII (CD23), CD10, CD38, CD30. Как продемонстрировано в предыдущих разделах, наличие CD21+ ФДК не было взаимосвязано с иммунофенотипом ДВКЛ. Связь наличия CD21+ ФДК с клетками микроокружения. В числе маркеров микроокружения мы оценили Т-лимфоциты (CD3, CD5, CD7), а также фолликулярные дендритные клетки (CD23). Отсутствие связи с макрофагальной и наличие взаимосвязи с плазмоклеточной инфильтрацией описано в предыдущем разделе. Данные по Т-лимфоцитам и CD23+ ФДК представлены в таблице 57. Таблица 57 Взаимосвязи наличия ФДК (CD21+) в ткани ДВКЛ с клетками микроокружения Показатель Фолликулярные дендритные клетки (CD23) CD5 Градации отсутствуют единичные многочисленные Отсутствуют Единичные Многочисленные CD7 Отсутствуют Единичные Многочисленные CD3 Отсутствуют Единичные Многочисленные Наличие CD21+ ФДК Отсутствуют Присутствуют 210 (98,1) 25 (52,1) 4 (1,9) 20 (41,7) 0 3 (6,3) 81 (37,5) 7 (14,3) 111 51,4) 36 (73,5) 24 (11,1) 6 (12,2) 82 (37,8) 7 (14,3) 112 (51,6) 36 (73,5) 23 (10,6) 6 (12,2) 69 (41,1) 6 (15,8) 83 (49,4) 28 (73,7) 16 (9,5) 4 (10,5) Хиквадрат; P 90,4; 0,000 10,0; 0,007 10,1; 0,006 8,9; 0,012 Представленные в таблице данные свидетельствуют о том, что наличие CD21+ ФДК в ткани ДВКЛ высоко достоверно коррелирует с наличием другого типа ФДК – CD23+. Что особенно важно, присутствие CD21+ ФДК ассоциируется с большей частотой умеренных и выраженных реакций зрелых Т-клеток в опухолевой ткани. Заключение. В данном разделе нами проанализирована роль наличия фолликулярных дендритных клеток CD21+ в опухолевой ткани ДВКЛ. Наличие этих клеток достоверно коррелировало с клетками микроокружения (Т-клетки, плазмоциты) и с другой субпопуляцией ФДК – CD23+. Наличие CD21+ ФДК не зависело от иммунофенотипических особенностей ДВКЛ. Присутствие фолликулярных дендритных клеток (CD21+) было связано с гемопоэзом у больных ДВКЛ – индексом созревания гранулоцитов, лейко-эритробластическим соотношением. Не отмечено связи с клинико-лабораторными данными и прогнозом ДВКЛ. CD23-позитивные фолликулярный дендритические клетки. Оценка наличия CD23-позитивных фолликулярных дендритических клеток (ФДК) проведена у 325 больных ДВКЛ. Наличие CD23+ ФДК установлено в 11,1% (36 больных) – в 33 случаях выявлялись единичные клетки (10,2%) и у 3 больных большое количество этих клеток (0,9%). Роль CD23+ ФДК в прогнозе ДВКЛ оценена у 132 больных – 116 с отсутствием ФДК, 16 с наличием этих клеток. Как видно на рисунке, наличие CD23+ ФДК при ДВКЛ не влияло на продолжительность жизни больных ДВКЛ, р=0,65, рисунок 26. Рисунок 26. Уровень CD23+ ФДК в ткани ДВКЛ не влияет на продолжительность жизни больных. Клиническая характеристика больных ДВКЛ с наличием и отсутствием CD23+ ФДК в опухолевой ткани. Возраст. Средний возраст больных, у которых полностью отсутствовали CD23+ ФДК в опухолевых срезах ДВКЛ, составил 53,3±1,1 года (n=283), в группе с наличием этих клеток – 56,6±2,96 года (n=35), различия между группами недостоверны, р=0,3 Пол. Пропорция мужчин и женщин в группах, различающихся по уровням ФДК, была примерно одинаковой, р=0,86. Стадия ДВКЛ. Частота поздних (III-IV) стадий при отсутствии ФДК была 59,2% (61 из 103), а при наличии этих клеток – 76,9% (10 из 13), р=0,22. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. Уровни ЛДГ у больных с отсутствием ФДК составил 726,5±73,3 (n=82), а при отсутствии этих клеток - 786,1±164,8 (n=10), достоверной связи не было, р=0,79. Экстранодальные локализации. Частота двух и более экстранодальных локализаций опухоли при отсутствии CD23+ ФДК составила 11,0% (31 из 283), а при наличии – 11,1 (4 из 36)%, признаки не связаны, р=0,98. При анализе в зависимости от количества факторов риска (IPI) связи не обнаружено (р=0,71). Взаимосвязь наличия CD23+ ФДК в опухолевых срезах ДВКЛ с показателями гемопоэза. Мы сопоставили средние значения количественных показателей миелограммы (процентное содержание каждого из клеточных типов, а также средние величины индексов) в зависимости от наличия или отсутствия CD23+ ФДК в ткани ДВКЛ, табл. 58. Таблица 58 Показатели гемопоэза, взаимосвязанные с наличием CD23+ ФДК в ткани ДВКЛ показатель Стд. ошибка CD23 ФДК Индекс созр. отр гранулоцитов положит Лейко-эритр. отр отношение положит Среднее N Р среднего 106 0,47 0,02 11 0,34 0,04 106 3,997 0,25 11 6,95 1,66 0,012 0,002 Нами установлено, что индексы созревания гранулоцитов достоверно различаются между группами с отсутствием и с наличием CD23+ ФДК, p=0,012. Лейко-эритробластическое соотношение было выше нормы и достоверно отличалось от такового в группе сравнения (т.е. от такового у больных с отсутствием CD23+ ФДК в опухолевых срезах). Других особенностей гемопоэза в зависимости от наличия или отсутствия CD23+ ФДК в срезах первичной опухоли не отмечено. Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с уровнями ФДК в опухолевой ткани. Достоверные взаимосвязи представлены в таблице 59. Таблица 59 Изменения в гранулоцитарном ростке гемопоэза, взаимосвязанные с наличием CD23+ ФДК в ткани ДВКЛ Показатель Градации Сегментоядерные нейтрофилы Снижены Норма повышены Снижен Норма повышен Индекс созревания гранулоцитов CD23+ ФДК нет есть 18 (17,0) 1 (9,1) 59 (55,7) 2 (18,2) 29 (27,3) 8 (72,7) 56 (52,8) 10 (90,9) 45 (42,5) 1 (9,1) 5 (4,7) 0 Хи-квадрат; P 9,6; 0,008 5,9; 0,02 Иммунофенотипические взаимосвязи с наличием ФДК СD23+ в срезах ДВКЛ. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, HLA-DR, CR2 (CD21), CD10, CD38, CD30. Как продемонстрировано в предыдущих разделах, наличие CD23+ ФДК было взаимосвязано с иммунофенотипом ДВКЛ – экспрессией CD38. Связь наличия CD23+ ФДК с клетками микроокружения. В числе маркеров микроокружения мы оценили Т-лимфоциты (CD3, CD5, CD7). Наличие связи с СD21+ ФДК, а также отсутствие связи с плазмоклеточной и макрофагальной инфильтрациями описано в предыдущем разделе. Анализ связи с Т-клетками представлен в таблице 60. Таблица 60. Взаимосвязь наличия CD23+ ФДК с Т-клетками опухолевого микроокружения Показатель Градации Отсутствуют Единичные Многочисленные CD7 Отсутствуют Единичные Многочисленные CD3 Отсутствуют Единичные Многочисленные CD5 Наличие CD23+ ФДК ХиОтсутствуют Присутствуют квадрат; P 96 (33,3) 5 (13,9) 9,8; 0,007 167 (58,0) 23 (63,9) 25 (8,7) 8 (22,2) 97 (33,6) 5 (13,9) 10,4; 0,005 168 (58,1) 23 (63,9) 24 (8,3) 8 (22,2) 79 (37,8) 3 (11,5) 7,3; 0,026 112 (53,6) 19 (73,1) 18 (8,6) 4 (15,4) Представленные ранее данные свидетельствуют о том, что наличие CD23+ ФДК в ткани ДВКЛ высоко достоверно коррелирует с наличием другого типа ФДК – CD21+. Что особенно важно, присутствие CD23+ ФДК ассоциируется с более чем 85% частотой умеренных и выраженных реакций зрелых Т-клеток в опухолевой ткани. Заключение. В данном разделе нами проанализирована роль наличия фолликулярных дендритных клеток CD23+ в опухолевой ткани ДВКЛ. Наличие этих клеток достоверно коррелировало с Т-клетками микроокружения (CD3, CD5, CD7) и с другой субпопуляцией ФДК – CD21+. Наличие CD23+ ФДК зависело от иммунофенотипических особенностей ДВКЛ (экспрессия CD38). Присутствие фолликулярных дендритных клеток (CD23+) было связано с гемопоэзом у больных ДВКЛ – большей частотой повышения уровня сегментоядерных нейтрофилов, снижением индекса созревания гранулоцитов. Не отмечено связи с клиниколабораторными данными и прогнозом ДВКЛ. V.3.4. Уровни T-лимфоцитов в опухолевом микроокружении ДВКЛ и их клиническое значение. Полуколичественная оценка Т-лимфоцитов в срезах ДВКЛ проведена с использованием трех маркеров: CD3, CD5, CD7. Как было продемонстрировано в предыдущих разделах, количество клеток, выявляемых этими маркерами, хорошо коррелировало между собой. В таблице 61 представлена частота выраженности Тклеточной реакции при использовании 3 типов антител. Таблица 61 Типы инфильтрации опухолевой ткани ДВКЛ Т-лимфоцитами Маркер Тип реакции Т-клеток в ткани ДВКЛ слабая умеренная выраженная CD3 84 (35)* 134 (55,8) 22 (9,2) CD5 105 (31,5) 195 (58,6) 33 (9,9) CD7 105 (31,5) 195 (58,6) 33 (9,9) *количество (процент в строке) Всего 240 333 333 Оценена роль каждого из Т-клеточных маркеров в прогнозе ДВКЛ. CD5 оценен у 137 больных): единичные клетки – 46 больных, наличие умеренной или выраженной реакции – 91 больной. CD7+ лимфоциты в прогнозе ДВКЛ оценены у 137 больных: 47 – отрицательная реакция, 90 – умеренная или выраженная реакция. CD3+ лимфоциты: 39 отрицательная реакция, 58 – наличие умеренной или выраженной реакции. Различия в выживаемости были недостоверны по всем трем маркерам, р>0,05. Наиболее близкие к достоверны данные получены для CD7 (p log-rank – 0,061; Breslow – 0,059; Tarone Waren – 0,061). Лучшие показатели выживаемости были в группе с больных ДВКЛ с наличием Т-клеточной инфильтрации. Мы обратили внимание на тот факт, что к выраженной Т-клеточной инфильтрации могут быть отнесены случаи с наличием сохранных Т-клеточных зон в опухолевой ткани, что не в полной мере соответствует выраженной инфильтрации опухоли. Если исключить из анализа эту немногочисленную группу больных, то различия в выживаемости больных с наличием Т-клеточной (CD7) инфильтрации и с отсутствием таковой становятся достоверными, р=0,038 (логранк), рисунок 27. Рисунок 27. Достоверное увеличение продолжительности жизни больных с умеренной Тклеточной инфильтрацией опухоли (n=76) в сравнении с больными, у которых инфильтрация отсутствовала (n=47). Учитывая большую клиническую значимость установленного факта, мы провели клинические, гематологические и иммунологические сопоставления в этих 2 группах больных. Клиническая характеристика больных ДВКЛ с отсутствием CD7+ Т-клеточной инфильтрации и с наличием умеренной инфильтрации ткани ДВКЛ CD7+ Т-лимфоцитами Возраст. Средний возраст больных, у которых полностью отсутствовали CD7+ Т-лимфоциты в опухолевых срезах ДВКЛ, составил 54,3±1,8 года (n=104), в группе сравнения – 52,9±1,3 года (n=193), различия между группами недостоверны, р=0,53 Пол. Пропорция мужчин и женщин в группах, различающихся по уровням ФДК, была примерно одинаковой, р=0,8. Стадия ДВКЛ. Частота поздних (III-IV) стадий при отсутствии CD7 была 69% (29 из 42), а при наличии этих клеток – 54,5% (36 из 66), р=0,13. Уровень лактат-дегидрогеназы (ЛДГ) в сыворотке крови. Уровни ЛДГ у больных с отсутствием CD7 составил 660,9±68,2 (n=34), а при наличии этих клеток - 793,9±107,9 (n=53), достоверной связи не было, р=0,36. Экстранодальные локализации. Частота двух и более экстранодальных локализаций опухоли при отсутствии CD7+ составила 16,5% (17 из 103), а при наличии – 7,8% (15 из 193), признаки достоверно взаимосвязаны, р=0,021. При анализе в зависимости от количества факторов риска (IPI) связи не обнаружено (р=0,27). Взаимосвязь наличия CD7+ Т-лимфоцитов в опухолевых срезах ДВКЛ с показателями гемопоэза. Мы сопоставили средние значения количественных показателей миелограммы (процентное содержание каждого из клеточных типов, а также средние величины индексов) в зависимости от наличия умеренной Т-клеточной инфильтрации (63 больных) или отсутствия таковой (42 больных) при ДВКЛ. Ни по одному из анализируемых показателей достоверных различий не получено. Другой вариант анализа, по таблицам сопряженности признаков был проведен для всех клеточных типов, идентифицируемых в миелограмме, для оценки взаимосвязей с уровнями Т-клеточной инфильтрации в опухолевой ткани. Достоверных связей не выявлено ни по одному из анализируемых параметров. Иммунофенотипические взаимосвязи с наличием ФДК СD7+ в срезах ДВКЛ. В числе иммунофенотипических маркеров клеток ДВКЛ нами оценены общелейкоцитарный антиген CD45, HLA-DR, CR2 (CD21), CD23, CD10, CD38, CD30. Как продемонстрировано в предыдущих разделах, наличие Т-клеточной инфильтрации было взаимосвязано с экспрессией активационных антигенов HLADR и CD38 на опухолевых клетках ДВКЛ. Связь Т-клеточной инфильтрации ткани ДВКЛ с клетками микроокружения. В числе маркеров микроокружения мы оценили фолликулярные дендритные клетки (CD23, CD21), плазмоциты CD38++ и макрофаги CD163+. Как уже было отмечено в предыдущих разделах, Т-клеточная реакция в опухоли взаимосвязана с макрофагальной реакцией и наличием фолликулярных дендритных клеток в опухолевой ткани. Заключение. Роль Т-клеточной инфильтрации первичной опухоли представляется, пожалуй, наиболее интригующей при ДВКЛ, поскольку именно с этими клетками связывают своего рода иммунореактивность организма в ответ на опухоль. И наши данные на очень большом материале (более 300 больных) позволили выделить типы реакций CD3, CD5, CD7 Т-клеток в опухолевой ткани. Как оказалось, ДВКЛ с наличием интратуморальной Т-клеточной реакции, действительно, формируют вполне очерченную группу. Уровень Т-клеток тесно связан с опухолевым микроокружением – макрофагами и фолликулярными дендритными клетками обоих изученных типов (CD21+ и CD23+). Т-клеточная реакция напрямую зависит от иммунофенотипических особенностей опухоли и, что особенно важно, экспрессии активационных антигенов HLA-DR и CD38. В числе клинических особенностей лимфом с Т-клеточной инфильтрацией – достоверно более редкая частота встречаемости такого признака неблагоприятного прогноза как наличие двух и более экстранодальных локализаций опухоли. И, наконец, Т-клеточная инфильтрация ДВКЛ характеризовала группу более благоприятного прогноза, что убедительно доказано при более чем 10 летнем наблюдении за больными. Все это позволяет сделать заключение о целесообразности дальнейшего изучения и использования в клинике такого нового показателя как Т-клеточная инфильтрация опухоли. ГЛАВА VI. ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ. Диффузная В-крупноклеточная лимфома – это самая частая лимфома высокой степени злокачественности у взрослых, которая составляет до 35% от всех неходжкинских лимфом. Это очень агрессивная лимфома, которая быстро прогрессирует и характеризуется высокой летальностью. Успехи в лечении данного варианта лимфом связаны в основном с внедрением на рубеже 2000-х годов в клиническую практику ритуксимаба (моноклональных антител против антигена CD20). Современное состояние диагностики и лечения ДВКЛ нельзя назвать удовлетворительным. Несомненный прорыв в понимании биологии данной лимфомы связан с установлением существования в пределах ДВКЛ двух болезней (Alizadeh A.A., 2000). Одна из них ближе по биологическому происхождению к клеткам светлых центров (GCB-тип), другая – к активированным периферическим В-лимфоцитам крови (АВС-тип). Эти типы ДВКЛ принципиально различаются по клиническому течению, ответу на и прогнозу. Их установление знаменовало собой триумф молекулярной биологии в диагностике неходжкинских лимфом, так как потребовало колоссальной работы по оценке профилей генной экспрессии как опухолевых, так и нормальных В-лимфоцитов. Ученые онкогематологи восприняли данное открытие с надеждой на создание подходов к дифференцированному лечению ДВКЛ в зависимости от гистогенеза опухолевых клеток, улучшению показателей выживаемости, снижению смертности. К сожалению, этим надеждам не суждено было осуществиться. Метод оценки профилей генной экспрессии является высокотехнологичным, но в то же время сложным и дорогостоящим, что затруднило его широкое продвижение в клинику. Предложенные в замен «суррогатные» иммуногистохимические методы не обладали той точностью и предиктивной силой как GEP, и не нашли широкого применения в клинике. Множество биологических параметров, непосредственно связанных как с опухолью, так и с организмом, рассматриваются как прогностические факторы при ДВКЛ. Данная область исследований является важным направлением понимания патогенеза заболевания и разработки новых терапевтических подходов. Вместе с тем, использование этих факторов для принятия лечебных решений является исследовательским. GEP (профили генной экспрессии) злокачественных клеток и опухолевого микроокружения являются наиболее интересным подходом к выявлению биологической гетерогенности ДВКЛ. Установлено 2 различных подкласса ДВКЛ – GC (профиль зародышевого центра) и ABC (профиль активированных В-клеток). Эти подклассы имеют различные генетические маркеры, пути активации и клинические исходы (Lenz G. et al., 2008; Alizadeh A.A. et al., 2000; Shipp M.A., 2002; Rosenwald A. et al., 2002). В качестве потенциальных суррогатов предложена иммуногистохимия на CD10, BCL-6 и MUM1. По мнению отдельных авторов использование этих маркеров имеет сходное значение с GEP (Hans C.P. et al., 2004). В рекомендациях ESMO 2011 (Ghelmini M. et al., 2013) оценка профилей генной экспрессии и иммуногистохимическое определение подтипов ДВКЛ расценивается как обещающий инструмент исследования, но не являющийся обязательным и не относящийся к разряду тестов, на основании которых принимаются клинические решения. Согласно рекомендациям Европейского общества медицинских онкологов (ESMO) на сегодняшний день уровень доказательности метода расценивается как IV, а рекомендованность к клиническому использованию как «С», то есть эти данные не могут на сегодняшний день быть учтены при принятии клинических решений. В настоящее время требуются дальнейшие исследования прежде, чем GEP или иммуногистохимия будут применены в клинической практике. Вместе с тем, некоторые предварительные данные свидетельствуют о том, что определенные лекарства являются более активными лишь в одной из подгрупп GEP или при рецидивирующей ДВКЛ (Dunleavy K. et al., 2009). Недавнее ретроспективное исследование показало, что терапия леналидомидом ассоциирована с достоверно большей частотой ответов при АВС-ДВКЛ в сравнении с GCB-ДВКЛ (HernandezIlizaliturri F.J. et al., 2011). По существу единственным и наиболее мощным прогностическим инструментом при ДВКЛ являются клинические прогностические индексы (IPI), в том виде, в каком они были изначально предложены, а не их последующие модификации (R-IPI, E-IPI). Вся прогностическая информация относительно выбора лечения больного по-прежнему базируется на возрасте больного, стадии ДВКЛ, общем состоянии по шкале ECOG, уровнях ЛДГ и наличии двух и более экстранодальных локализаций опухоли. Как показали наши исследования, не все эти факторы в современных условиях влияют на прогноз ДВКЛ. Так возраст больных полностью утратил прогностическое значение, роль повышенных уровней ЛДГ близка к достоверной, но все же не достоверна. Информативными, прогностически неблагоприятными остаются III-IV стадии заболевания, тесно связанный с ними показатель ECOG и наличие двух или более экстранодальных локализаций опухолевого поражения. Важно отметить, что наличие двух и более экстранодальных зон поражения в 98% случаев наблюдалось при III-IV стадиях ДВКЛ, лишь один больной относился к I-II стадиям. По этим причинам проанализировать раздельно прогностическую роль стадии и наличия двух экстранодальных локализаций опухоли не представляется возможным. По существу, стадия заболевания является определяющей в прогнозе ДВКЛ. Не описано никаких биологических параметров, которые могли бы способствовать уточнению прогноза и индивидуализации лечения больных ДВКЛ. В своей работе мы исходили из того, что ДВКЛ является гемопоэтической опухолью с тропностью к гемопоэтической ткани, т.е. к костному мозгу. И второе – это В-клеточная лимфома из периферических В-лимфоцитов, находящихся в состоянии активации. Поражение костного мозга при ДВКЛ может быть конкордантным или дискордантным. При конкордантном поражении в костном мозге также обнаруживаются клетки ДВКЛ. При дискордантном поражении в костном мозге могут обнаруживаться клональные В-лимфоциты. При исследовании аспиратов костного мозга морфологическим методом явные признаки поражения – наличие лимфоидных, типа бластных клеток отмечено лишь в 2 случаях. У большинства больных было отмечено незначительное (менее 5%) повышение процента бластов в миелограмме и в части случаев – повышение (как правило, небольшое) процента лимфоцитов. На основании тщательного анализа нами были отобраны 118 миелограмм для анализа особенностей гемопоэза у больных ДВКЛ. Случаи с явным разбавлением костного мозга периферической кровью, а также случаи поражения костного мозга были исключены из исследования. Наряду с вариациями гемопоэза, встречающимися с той или иной частотой у больных ДВКЛ, мы отметили типичные для всей группы ДВКЛ изменения гемопоэза. В первую очередь, это повышение процента бластов в миелограмме. При использовании верхнего порогового уровня 1% (при норме до 0,6%) повышенные уровни бластов отмечены почти у 70% больных. Вполне возможно, что частота поражения костного мозга при ДВКЛ и прогностическое значение этого фактора недооцениваются. необходимость проведения В литературе билатеральной существуют указания трепанобиопсии на с иммуногистохимическим исследованием (по показаниям) для более точной оценки поражения костного мозга. Это обусловлено тем, что при ДВКЛ в отличие от лейкозов имеет место очаговое поражение костного мозга (Chigrinova E.V. et al. 2006). Изменения в эритроидном ряду дифференцировки у больных ДВКЛ характеризовались относительным снижением уровней базофильных и полихроматофильных нормобластов у большинства больных, а также повышением процента оксифильных форм у 77% больных. Нормальные уровни оксифильных нормобластов характеризовали группу более благоприятного прогноза в сравнении с группой больных с повышением оксифильных форм. Сниженных уровней оксифильных нормобластов мы не наблюдали ни в одном случае. Индекс созревания эритрокариоцитов был повышен в 86,4% случаев, что, несомненно, является типичным для ДВКЛ и новым, установленным нами признаком данного заболевания. Наши данные свидетельствуют о необходимости детального изучения эритропоэза у больных ДВКЛ. Следует отметить, что у здорового взрослого человека соотношения между отдельными частями эритрона как совокупности всех эритроидных клеток организма (Сарычева Т.Г., Козинец Г.И., 2001) являются стабильными (Ланг Г.Ф., 1939; Рябов С.И., 1971; Carli P.M. et al., 1988; Ferdinand P.M. et al., 1985). Вопросы номенклатуры клеток эритрона детально обсуждались в 80-е годы прошлого (ХХ) века (Ткачева Т.В., Шардаков В.И., 1978), однако, в настоящее время существует консенсус в наименовании костномозговых эритрокариоцитов, и мы в своей работе придерживались общепринятых обозначений. При характеристике соотношения количества костномозговых эритрокариоцитов различных этапов дифференцировки ранее широко применялись так называемые парциальные эритробластограммы эритробластограммы. здоровых лиц Для характерно нормальной преобладание полихроматофильных форм над оксифильными (Владимирская Е.Б., 2011; Адылов М.А., Хамзалиев Б.Х., 1990). При железодефицитных анемиях и длительных геморрагиях изменения касаются в основном резкого возрастания самых ранних морфологически распознаваемых этапов эритроидной дифференцировки, в частности базофильных нормобластов (Адылов М.А., Хамзалиев Б.Х., 1990). При гемолитических анемиях наиболее типичным изменением в эритробластограмме является нарастание пропорции оксифильных форм нормобластов, которые численно превышают количество полихроматофильных нормобластов (Е.Б.Владимирская, 2011). В эксперименте на крысах при изучении состояния эритрона в отдаленные сроки после лучевой травмы установлены существенные изменения эритробластограммы: возрастание доли базофильных, больших и средних полихроматофильных нормобластов при одновременном значительном снижении числа малых полихроматофильных и ортохромных (оксифильных) нормобластов (Перминова О.А., 1985). Эритробластограмма у больных ДВКЛ в большинстве случаев напоминала таковую при гемолитических анемиях. Интересно отметить, что нарастание оксифильных нормобластов было отмечено ранее при плоскоклеточном раке головы и шеи, в особенности при наличии микрометастазов в костном мозге (Тимонина Е.Г. и соавт. 2009). На начальных этапах опухолевого роста в экспериментальных моделях одними из ранних признаков со стороны эритрона является уменьшение периода жизни эритроцитов и нарастание ретикулоцитов в крови (Чернова Е.Н. и соавт., 1992). На наш взгляд, подобные изменения эритрона у больных ДВКЛ должны явиться предметом дальнейшего углубленного изучения как на морфологическим уровне, так и на уровне иммунофенотипа эритрокариоцитов. Эти исследования могли бы пролить свет на понимание того, существует ли связь между увеличением процента бластов у абсолютного большинства больных и нарушением (ускорением) костномозговой эритроидной дифференцировки, также наблюдаемой у большинства больных. Увеличение процента бластных клеток в костном мозге больных ДВКЛ выше 1% по нашим данным является прогностически неблагоприятным признаком. Этот факт не может быть объяснен только за счет возможности диссеминации на поздних стадиях ДВКЛ поскольку средний процент бластов был более высоким при I,II в сравнении с III,IV стадиями. С прогностической точки зрения чрезвычайно интересно, что увеличение процента нейтрофильных миелоцитов и снижение сегментоядерных нейтрофилов характеризовали группу ДВКЛ менее благоприятного прогноза. С точки зрения гранулоцитарной дифференцировки оба эти признака могут характеризовать некоторую задержку созревания на уровне нейтрофильных миелоцитов, однако, для расшифровки данного феномена потребуются дополнительные, в том числе иммунофенотипические исследования. Следует отметить, что ближайшие к миелоцитам клетки гранулоцитарной дифференцировки (промиелоциты и метамиелоциты) не были увеличены ни в одном случае. Интересно отметить, что прогностически значимые нарушения гемопоэза у больных ДВКЛ были взаимосвязаны с иммунофенотипом опухоли. С повышенным содержанием бластов в костном мозге был взаимосвязан лишь один из опухолевых антигенов – CD21. Совершенно очевидно, что малочисленная группа CD21+ ДВКЛ представляет лишь минорную пропорцию больных с повышенным содержанием бластных клеток в миелограмме. Расшифровка состава бластов при ДВКЛ – опухолевые клетки, клеткипредшественники и т.д. – позволит точнее определить, что же, в действительности, играет ли роль в прогнозе заболевания - метастатическое поражение костного мозга или особенности гемопоэза? Наибольшее число иммунофенотипических маркеров опухолевых клеток ДВКЛ и маркеров микроокружения были взаимосвязаны с гранулоцитарным ростком гемопоэза и, в частности, со снижением уровней сегментоядерных нейтрофилов. К числу таких иммунофенотипических признаков относились CD38, CD45, а из числа маркеров микроокружения – наличие в опухолевой ткани CD23+ фолликулярных дендритных клеток. Утрата экспрессии CD45 и снижение уровней сегментоядерных нейтрофилов носят взаимоисключающий характер. Однако в силу малочисленности CD45негативной группы обсуждать механизм влияния данного иммунофенотипа на гемопоэз не представляется возможным. Потребуется дальнейшее накопление материала. Иная ситуация наблюдается при рассмотрении ДВКЛ с экспрессией антигена CD38. Иммунобиологические особенности CD38+ ДВКЛ состоят в том, что эти опухоли характеризуются выраженной интратуморальной инфильтрацией практически всеми клетками, входящими в состав опухолевого микроокружения – макрофагами, плазмоцитами, зрелыми Т-лимфоцитами. Кроме того, при CD38+ ДВКЛ в 4 раза чаще, чем в группе сравнения (CD38-) наблюдается присутствие в опухолевых срезах выраженного количества фолликулярных дендритных клеток CD23+. Именно этот тип клеток опухолевого микроокружения имел наиболее значимую связь со снижением сегментоядерных нейтрофилов в костном мозге. Для понимания механизмов влияния CD23+ ФДК на гемопоэз целесообразно, на наш взгляд, провести исследования при фолликулярной лимфоме, где этот тип клеток (CD23+) в большом количестве представлен практически в каждом случае. Изменения в эритроидном ряду дифференцировки у больных ДВКЛ характеризовались относительным снижением уровней базофильных и полихроматофильных нормобластов у большинства больных, а также повышением процента оксифильных форм у 77% больных. Нормальные уровни оксифильных нормобластов характеризовали группу более благоприятного прогноза в сравнении с группой больных с повышением оксифильных форм. Сопоставление с первичным иммунофенотипом выявило интересную закономерность – при экспрессии CD30 на клетках опухоли возрастания уровней оксифильных нормобластов не наблюдается, и это прогностически наиболее благоприятная группа больных (ни один из пациентов не умер в сроки наблюдения от 6 до 110 мес). Обсуждение полученных результатов во многом затруднено тем, что данные по анализу гемопоэза у больных ДВКЛ не приводились ни зарубежными, ни российскими исследователями. Как правило, показатели гемопоэза оцениваются только с позиций гематологической токсичности того или иного препарата или схемы лечения. Вместе с тем, как показали наши исследования, существуют типичные для ДВКЛ изменения гемопоэза, заслуживающие изучения для понимания патогенетических связей костного мозга с первичной опухолью. Влияние нарушений гемопоэза, связанных с ухудшением прогноза, может явиться предметом разработки патогенетических воздействий для коррекции соответствующих изменений. Особенно важно, что прогностические факторы из числа отклонений от нормы в миелограмме, не связаны с признаками прогноза, перечисленными в IPI, и, в частности, с таким важнейшим признаком неблагоприятного прогноза как поздние (III, IV) стадии распространенности опухолевого процесса. При обсуждении иммунологического диагностического аспекта работы необходимо отметить следующее. Верификация диагноза на основании крупного размера клеток, диффузного характера роста опухоли и экспрессии специфического маркера В-клеток CD20 (L26) стала рутинной практикой в диагностике ДВКЛ. В программы лечения широко вошел ритуксимаб (протокол RCHOP), который позволил существенно улучшить результаты терапии. Для назначения данного препарата вполне достаточно верифицировать В-клеточную природу опухоли на основании экспрессии CD20 (L26). Производится это иммуногистохимически при окраске парафиновых срезов биопсийного материала опухоли. Наши исследования подтвердили, что наилучшим реагентом для установления В-клеточной природы крупноклеточных лимфом, то есть для установления диагноза ДВКЛ, являются антитела L26. Вместе с тем, важно помнить, что антитела L26 распознают внутрицитоплазматическую детерминанту CD20, а лечебный препарат ритуксимаб связывается с внеклеточной мембранной детерминантой. Может ли быть такая ситуация когда антигенная детерминанта в цитоплазме присутствует, а мембранная экспрессия белка является слабой или даже отрицательной? Ответ на этот вопрос утвердительный – подобная ситуация имеет место при такой периферической Вклеточной лимфоме как В-ХЛЛ. При ДВКЛ этот вопрос изучен в значительно меньшей степени. Тем не менее, хорошо известно, что существуют два варианта отсутствия CD20 антигена на мембране клеток диффузной В-крупноклеточной лимфомы: 1. Отсутствие антигена при диагностике; 2. Отсутствие CD20 антигена, индуцируемое терапией анти-CD20 антителами (Мабтерой). Второй вариант является наиболее частым и может носить обратимый характер (Maeshima A.H. et al., 2013; Dumann B.B. et al., 2012; Hiraga J. et al., 2009; Ferreri A.J. et al., 2007; Iguchi T. et al., 2004; Venugopal P. et al., 1999). Первичные (de novo) CD20-негативные ДВКЛ встречаются, главным образом у HIV-позитивных больных, но могут иметь место и при HIV-негативном статусе (Teruya-Feldstein J. et al., 2004). Единичные публикации свидетельствуют о том, что в редких случаях ДВКЛ экспрессия CD20 и CD19 на мембране опухолевых клеток может быть слабой или отсутствовать (Bertram H.C. et al., 2001). При проведении расширенного исследования CD19 (329 больных) и мембранного CD20 (272 больных) мы установили, что отсутствие мембранного CD20 может наблюдаться в 1,5% случаев ДВКЛ (4 наблюдения). Наибольшая выборка (28 больных, 1,9% от всех изученных ДВКЛ) представлена китайскими исследователями (Li Y.J. et al., 2012). CD20-негативные лимфомы имели ряд особенностей и характеризовались худшим прогнозом в сравнении с обычными CD20-позитивными ДВКЛ. Важным параметром для прогноза ДВКЛ является оценка уровней мембранной экспрессии молекулы CD20 на злокачественных клетках (Suzuki Y. Et al., 2012). Наши данные по частоте CD20-негативных ДВКЛ полностью совпадают с данными китайских исследователей. Показания к назначению ритуксимаба у этой крайне редкой категории больных могут явиться предметом дальнейшего изучения. Важно то, что нами впервые показана необходимость оценки мембранного CD20 при ДВКЛ. Интересно отметить, что случаи отсутствия или слабой экспрессии CD19 и мембранного CD20 достоверно чаще встречаются при CD45-негативных ДВКЛ, что, по-видимому, является отражением их иммунологической анаплазии. Практическими выводами из данного раздела работы является следующее: o Наилучшим реагентом для выявления В-клеточной природы крупноклеточных лимфом, то есть для установления диагноза ДВКЛ, являются антитела L26. Для установления диагноза ДВКЛ методом выбора является иммуногистохимическое окрашивание по парафиновым блокам. o Для установления назначения мембранной мабтеры экспрессии целесообразно антигена использовать с целью метод флуоресцентной иммуногистохимии по криостатным срезам или метод проточной циофлуориметрии с использованием моноклональных антител к CD20, распознающих экстрацеллюлярные мембранные детерминанты антигена. Крайне редкие иммуногистохимически документированные случаи отсутствия CD45 при ДВКЛ описаны, чаще при экстранодальной локализации опухоли (Lasota J. et al., 1996; Donner L.R. et al., 2001; Inaba T. et al., 2008; Nath P. et al. 2010). Как правило, эти случаи характеризовались признаками анаплазии с экспрессией цитокератинов или ALK. Описаны случаи отсутствия CD45 при диагностике нодальной ДВКЛ методом проточной цитометрии (Palmeira C. et al., 2012). Систематизированные исследования антигена при ДВКЛ не проводились. Наши данные впервые дают представление о частоте CD45-негативного варианта ДВКЛ – 3,9% (13 из 332 случаев). Утрата антигена наблюдалась на поздних (III, IV) стадиях опухолевой прогрессии (р=0,002). Дополнительным признаком анаплазии явилась высокая частота экспрессии антигена Ki-1 (CD30) при CD45-негативных ДВКЛ (55,6%). Наши исследования не позволили установить связь отсутствия CD45 с гемопоэзом и факторами микроокружения, однако, учитывая крайнюю малочисленность данной группы больных (3,9% среди ДВКЛ), для окончательного ответа на эти вопросы потребуется дальнейшее накопление материала. Молекулы HLA-II класса (HLA-DR) являются в пределах В-клеток обще-Вклеточным антигеном, то есть присутствуют на всех этапах дифференцировки Влимфоцитов. Отсутствие экспрессии этих молекул – хорошо известный факт при ДВКЛ. Считается, что HLA-DR-негативные В-крупноклеточные лимфомы чаще встречаются при экстранодальной локализации опухоли, причем наиболее часто – в иммунологически «привилегированных» зонах, таких как головной мозг и яичко. В нашем исследовании частота HLA-DR-негативных лимфом составила 9,3% (32 из 331). Больных с лимфомами головного мозга в нашей выборке не было. Наиболее частыми экстранодальными локализациями биопсии при HLA-DR-негативной ДВКЛ являлись мягкие ткани: 9 из 43 экстранодальных опухолей, изученных иммунологически, были HLA-DR-негативными (20,9%). Это вдвое чаще, чем в целом по группе больных ДВКЛ. Еще более частыми HLA-DR негативными являются ДВКЛ яичка – 3 из 8 наблюдений (37,5%). По данным Тумян Г.С. и соавт. (2008) добавление ритуксимаба к программам CHOP (R-CHOP) позволяет существенно улучшить результаты лечения больных диффузной В- крупноклеточной лимфомой с поражением яичка. В детском возрасте описаны немногочисленные ДВКЛ с поражением яичка и удовлетворительными результататми лечения (Валиев Т.Т. и соавт., 2013). По данным Brendt H.-W. et al. (2009) частота HLA-DR-негативных ДВКЛ составила 19,9% (60/301), что вдвое выше, чем в нашей выборке. Авторы применяли иной методический подход, и к негативным случаям относили только те, где процент позитивных опухолевых клеток не превышал 1%. Авторы подтверждают, что отсутствие экспрессии HLADR наблюдалось значительно чаще при лимфомах ЦНС, яичка или яичников (8 из 15 случаев, 53,3%), чем при лимфомах других органов (52 из 286, 18,2%, р=0,003). В работе Rimsza L.M. et al. (2007) приводятся данные обширного исследования экспрессии HLA-DRA как антигена, дающего достаточно полное представление об экспрессии генов HLA-II класса. В этом случае оценка проводилась на основании относительной экспрессии генов HLA-DRA по подавлению флуоресцентного сигнала с помощью кДНК из опухолевых клеток. Следует отметить, что даже при полной делеции генов HLA на основании данного метода в 20% случаев (2 из 10) иммуногистохимически выявлялась экспрессия HLA-DR. Это достаточно высокая частота расхождений и ложно отрицательных результатов молекулярного метода. Как правило, отрицательные по экспрессии HLA-DR диффузные Вкрупноклеточные лимфомы характеризуются низкими уровнями Т-клеточной инфильтрации. Это положение было подтверждено и в нашей работе: частота выраженных Т-клеточных (CD3) интратуморальных иммунных реакций в HLADR-негативной группе ДВКЛ была достоверно ниже. Обычно, негативный по экспрессии генов HLA-II класса фенотип ДВКЛ связывают с плохим прогнозом (Miller T.P. et al., 1988; Rybski J.A. et al. et al., 1991; Rimsza L.M. et al., 2004; Rimsza L.M. et al., 2007). В нашей работе отсутствие экспрессии HLA-DR характеризовало группу достоверно более благоприятного прогноза ДВКЛ. По-видимому, различия в данных относительно прогноза могут быть обусловлены рядом причин. В нашей выборке отсутствовали больные с прогностически неблагоприятными диффузными В-крупноклеточными лимфомами ЦНС, при которых частота HLA-DR-негативного фенотипа особенно высока. В изученной нами группе больных ДВКЛ были представлены только неспецифицированные варианты заболевания. Важную роль играет также метод учета HLA-DR-негативных случаев. Как мы уже отмечали, использование RT-PCR дает ложно положительные результаты в 25% случаев, причины расхождения с иммуногистохимическим методом не совсем понятны. Кроме того, нами использован люминисцентный метод, и учитывались только полностью негативные случаи. Слабую или присутствующую только в части клеток экспрессию HLA-DR мы относили к DR-позитивным ДВКЛ. Как и в исследованиях зарубежных авторов, нами установлены особые черты HLA-DR-негативной группы ДВКЛ – частая экстранодальная локализация в иммунопривилегированных зонах, отрицательная корреляция с уровнями Т-клеточной инфильтрации. Следует отметить, что несмотря на высокую частоту отсутствия HLA-DR в экстранодальных опухолях, наличие двух эктранодальных локализаций (как неблагоприятный по IPI прогностический признак) в группе HLA-DR-негативных ДВКЛ наблюдалось крайне редко (2,8%). Положительное влияние отсутствия HLA-DR на прогноз было описано Л.А.Мазурком (2006) при крупноклеточных лимфомах с локализацией в средостении. Особенно интересным, было на наш взгляд описание группы больных ДВКЛ с наличием активационного антигена CD38 на опухолевых клетках. Это большая группа пациентов – 55,9% (184 из 329) от всех случаев ДВКЛ. Эту группу ДВКЛ можно назвать иммунореактивным вариантом опухоли, так как все типы иммунных интратуморальных реакций опухолевого микроокружения (Т-клетки, макрофаги, плазмоциты) были значительно более выраженными при CD38+ иммунофенотипе ДВКЛ. Из числа фолликулярных дендритных клеток только CD23-позитивные ФДК были взаимосвязаны с экспрессией CD38 на опухолевых клетках. В группе CD38+ ДВКЛ вдвое реже, чем при CD38-негативных ДВКЛ наблюдались повышенные уровни сывороточной ЛДГ. В целом, влияния на прогноз экспрессия CD38 не оказывала. Можно заключить, что ДВКЛ с подобными характеристиками ранее не были описаны. Это особенно важно, поскольку CD38-позитивные опухоли представляют не минорную группу, а практически половину всех диффузных Вкрупноклеточных лимфом. Впервые изучены лимфомы, характеризующиеся экспрессией рецепторов CD21 и CD23 на опухолевых клетках. Исследование CD21 проведено на опухолевых срезах 266 больных ДВКЛ. Частота экспрессии составила 12,4% (33 из 266). В группе CD21-позитивных лимфом достоверно преобладали женщины (67%), более часто отсутствовали признаки неблагоприятного прогноза. Нормальные уровни промиелоцитов в CD21-позитивной группе отмечались в 3 раза чаще, чем в группе сравнения (CD21-негативные ДВКЛ). Однако в группе CD21-позитивных ДВКЛ в 6 раз чаще отмечены сниженные уровни лимфоцитов костного мозга. При наличии на опухолевых клетках антигена CD21 у больных ДВКЛ никогда не отмечалось экспрессии CD30. В литературе есть сообщения, свидетельствующие о важности изучения активационных антигенов на клетках ДВКЛ. Linderoth J. et al. (2003) показано, что экспрессия CD23 на опухолевых клетках может идентифицировать прогностически более благоприятную группу ДВКЛ. Авторы провели исследование у 405 больных агрессивными лимфомами. Больные были включены в исследование в период с 1989 по 1994 годы. Критерием включения были возраст больных от 18 до 67 лет, диагноз лимфомы высокой степени злокачественности в соответствие с Кильской классификацией и стадия заболевания II-IV. После пересмотра препаратов в исследование включены 125 случаев – 107 центробластный вариант, 14 – иммунобластный, 4 – богатая Т-клетками и гистиоцитами. Большинство случаев были позитивны по bcl-6 (97%), 51% - СD10+. Экспрессия CD10 не влияла на прогноз. 16% случаев были CD23-позитивными. CD23+ случаи (20 наблюдений) имели тенденцию к лучшему прогнозу (р=0,033). Положительная прогностическая роль экспрессии CD23 при ДВКЛ отмечалась и в более ранних работах (Schuurman H.J. et al., 1988). Исследование CD23 проведено нами на опухолевых срезах 326 больных ДВКЛ. Частота экспрессии составила 12,0% (39 из 326). Установлено достоверное ухудшение прогноза в CD23-позитивной группе ДВКЛ, р=0,029 (лог-ранк тест). Средний возраст больных CD23-негативной группы ДВКЛ составил 54,7±1,1 года (n=281), что было достоверно выше, чем в СD23-позитивной группе (45,1±2,9 года, n=38), p=0,002. В CD23-негативной группе частота больных пожилого возраста была вдвое выше 49,8% (140 из 281), чем в CD23-позитивной группе – 26,3% (10 из 38), р=0,006. Cвязь экспрессии молекул CD23 на опухолевых клетках ДВКЛ наблюдается только с активационными антигенами CD21 и CD38. При использовании Т-клеточных маркеров CD7 и CD5 частота выраженной реакции Тклеток в CD23-позитивной группе установлена в 1,5 раза выше, чем в случаях отсутствия CD23 на опухолевых клетках. При использовании специфического маркера Т-клеток CD3 частота выраженных реакций была в 2,5 раза выше в CD23позитивной группе. С чем связаны различия в прогностической роли CD23 при ДВКЛ, полученные нами и приводимые в 2 зарубежных статьях, сказать достаточно сложно. По-видимому, в нашей работе осуществлен более тщательный отбор неспецифицированных ДВКЛ на основе критериев последней классификации ВОЗ (2008). В зарубежных работах контингент больных более широк и включает ряд специфических вариантов ДВКЛ. Исследование антигена CD10 проведено на опухолевых срезах 238 больных ДВКЛ. Частота экспрессии антигена была низкой и составила 6,3% (15 из 238). Вероятно, одной из причин низкой частоты CD10+ ДВКЛ является точная диагностика ДВКЛ и исключение CD10-позитивных фолликулярных лимфом и лимфом с трансформацией в изученной нами группе больных. Не исключено, что определенную роль сыграло использование иммунофлуоресцентного метода обнаружения антигена CD10. Несмотря на крайнюю малочисленность CD10позитивной группы больных ДВКЛ, все эти пациенты характеризовались крайне неблагоприятным прогнозом и погибли в сроки до 2 лет, что позволило расценить экспрессию CD10 как неблагоприятный признак, имеющий достоверную связь с прогнозом, р=0,035 (лог-ранк тест). Опухоли данного типа характеризуются несколько более выраженной макрофагальной инфильтрацией. Для окончательного заключения о значении диагностики данного редкого варианта ДВКЛ необходимо дальнейшее накопление клинических данных. Исследование CD30 проведено на опухолевых срезах 88 больных ДВКЛ. Частота экспрессии составила 23,9% (21 из 88). Ни один из 8 больных CD30позитивной группы не умер за период наблюдения (до 110 мес), что объясняет высокую достоверность связи экспрессии антигена с выживаемостью, р=0,02. Экспрессия CD30 на клетках ДВКЛ связана только с количеством инфильтрирующих опухоль плазмоцитов – выраженная реакция этих клеток не характерна для CD30+ ДВКЛ. Интересна связь CD30+ фенотипа с эритропоэзом у больных ДВКЛ: средние уровни оксифильных нормобластов в группе CD30+ были нормальными в отличие от остальной группы больных ДВКЛ, где они были повышенными. Следовательно, описанная нами специфичекая особенность гемопоэза у больных ДВКЛ, заключающаяся в повышении оксифильных нормобластов, видимо, не распространяется на CD30-позитивные варианты. Как мы уже отмечали, экспрессия данного антигена более типична для CD45негативных ДВКЛ и требует большей тщательности при верификации В-клеточной природы в процессе диагностики. Интересна некоторая закономерность, прослеживаемая для CD30- позитивных неходжкинских лимфом (Hu S. et al., 2013) – экспрессия CD30, как правило, ассоциирована с более благоприятным прогнозом. Это справедливо в отношении анапластической крупноклеточной лимфомой в сравнении с неспецифицированной Т-клеточной лимфомой, первичной медиастинальной Вклеточной лимфомой в сравнеии с неспецифицированной В-крупноклеточной лимфомой. И, наконец, открытое в последнее время и подтвержденное в настоящей работе более благоприятное течение CD30-позитивной В-крупноклеточной лимфомой в сравнении с CD30-негативными ДВКЛ. И все же механизмы развития повышенной чувствительности к терапии и, как следствие, лучшего прогноза CD30-позитивных ДВКЛ не ясны. В отличие от 2 других членов семейства рецепторов для факторов некроза опухоли (Fas и TNFR1) у CD30 отсутствует цитоплазматический домен смерти. Активация CD30 на линиях клеток сопровождалась сигналом к клеточной смерти или или остановке клеточного цикла (Gruss H.J. et al., 1994; Mir S.S. et al., 2000; Wright C.V. et al., 2007). Профили генной экспрессии (Hu S. et al., 2013) CD30+ ДВКЛ указывают на усиление экспрессии рецептора смерти FAS и снижение экспрессии ряда онкогенов (CDCA7L, FZD5, DTX1). Повышается экспрессия генов, усиливающих экспрессию негативных регуляторов пути NF-κB и лимфоцитарного выживания (I-κBα, TNFAIP3, TNFRAIP6, Подавляется TNIP2, множество генов, TRAF1, DUSP4, кодирующих NXN, SAMSN1, компоненты SOCS1). сигналинга и пролиферации В-клеточного рецептора (IgHμ, IgL, CD72, PKCβ, SH2D3CNF-ATc1, TCL1A, FOXp1, BACH2). Ингибиция этих путей может способствовать повышению чувствительности лимфомных клеток к химиотерапии. Обнаружение неполной В-клеточной программы при CD30+ ДВКЛ интересно по целому ряду причин. Помимо лимфомы Ходжкина и первичной медиастинальной В-крупноклеточной лимфомы, неполная В-клеточная программа наблюдается при нескольких других типах В-клеточных лимфом – первичной лимфоме серозных полостей, плазмобластной лимфоме, СD30-позитивной ДВКЛ. Сходным образом, некоторые типы CD30-позитивных Т-клеточных лимфом также демонстрируют вариабельную утрату Т-клеточных программ, включая подкласс неспецифицированных CD30-позитивных Т-клеточных лимфом, первичные кожные CD30-позитивные лимфопролиферативные заболевания, а также ALK+ и ALK- системную анапластическую крупноклеточную лимфому (Bonzheim I. et al., 2004; de Leval L. et al., 2007; Geissinger E et al., 2010). Однако, не ясно, существует ли причинно-следственная связь между экспрессией CD30 и утратой В- и Тклеточных программ. Особым разделом работы явилась оценка роли опухолевого микроокружения у больных ДВКЛ. Интратуморльные макрофаги (CD163+) были изучены у 326 больных. В 63 случаях (19,3%) выявлялись единичные клетки или их практически полное отсутствие, в остальных 263 наблюдениях (80,7%) наблюдалась умеренная или выраженная макрофагальная реакция. Уровень инфильтрации опухолевой ткани макрофагами не влиял на продолжительность жизни больных ДВКЛ. Макрофагальная инфильтрация достоверно положительно коррелировала с Тклеточной реакцией, оцениваемой по всем трем маркерам (CD3, CD5, CD7), и нарастала при экспрессии CD38 на опухолевых клетках. Макрофагальная инфильтрация не была связана с гемопоэзом у больных ДВКЛ. Из числа клиниколабораторных данных отмечены более низкие уровни ЛДГ и более старший возраст больных с выраженной макрофагальной инфильтрацией. Уровни плазмоклеточной реакции изучены у 329 больных ДВКЛ. В 212 случаях (64,4%) выявлялись единичные клетки или их практически полное отсутствие, в остальных 117 наблюдениях (35,6%) наблюдалась умеренная или выраженная плазмоклеточная реакция. Уровень плазмоклеточной инфильтрации опухоли достоверно коррелировал только с фолликулярными дендритными клетками из числа клеток опухолевого микроокружения. Выраженность плазмоклеточной инфильтрации зависела от иммунофенотипических особенностей ДВКЛ (экспрессии CD38) . Плазмоклеточная инфильтрация была связана с гемопоэзом у больных ДВКЛ – показателями клеточности, содержанием лимфоцитов и моноцитов, индексом созревания эритрокариоцитов. Не отмечено связи с клинико-лабораторными данными. Выраженность инфильтрации опухолевой ткани плазматическими клетками не влияла на прогноз больных ДВКЛ. Оценка наличия CD21-позитивных фолликулярных дендритических клеток (ФДК) проведена у 266 больных ДВКЛ. Наличие CD21+ ФДК установлено в 18,4% (49 больных) – в 41 случае выявлялись единичные клетки (15,4%) и у 8 больных большое количество этих клеток (3,0%). Нами установлено, что индексы созревания гранулоцитов достоверно различаются между группами с отсутствием и с наличием CD21+ ФДК, p=0,027. Других особенностей гемопоэза в зависимости от наличия или отсутствия ФДК в срезах первичной опухоли не отмечено. Наличие CD21+ ФДК достоверно коррелировало с клетками микроокружения (Т-клетки, плазмоциты) и с другой субпопуляцией ФДК – CD23+. Наличие CD21+ ФДК не зависело от иммунофенотипических особенностей ДВКЛ. Не отмечено связи с клиниколабораторными данными и прогнозом ДВКЛ. Оценка наличия CD23-позитивных фолликулярных дендритических клеток (ФДК) проведена у 325 больных ДВКЛ. Наличие CD23+ ФДК установлено в 11,1% (36 больных) – в 33 случаях выявлялись единичные клетки (10,2%) и у 3 больных большое количество этих клеток (0,9%). Нами установлено, что индексы созревания гранулоцитов достоверно различаются между группами с отсутствием и с наличием ФДК, p=0,012. Лейкоэритробластическое соотношение было выше нормы и достоверно отличалось от такового в группе сравнения (т.е. от такового у больных с отсутствием CD23+ ФДК в опухолевых срезах). Других особенностей гемопоэза в зависимости от наличия или отсутствия CD23+ ФДК в срезах первичной опухоли не отмечено. Наличие СD23+ ФДК достоверно коррелировало с Т-клетками микроокружения (CD3, CD5, CD7) и с другой субпопуляцией ФДК – CD21+. Наличие CD23+ ФДК зависело от иммунофенотипических особенностей ДВКЛ (экспрессия CD38). Присутствие фолликулярных дендритных клеток (CD23+) было связано с гемопоэзом у больных ДВКЛ – большей частотой повышения уровня сегментоядерных нейтрофилов, снижением индекса созревания гранулоцитов. Не отмечено связи с клинико-лабораторными данными и прогнозом ДВКЛ. В литературе имеются немногочисленные данные о прогностически неблагоприятной роли отсутствия сети фолликулярных дендритных клеток CD23+ при ДВКЛ (Brendt H.-W. et al., 2009). Т-клеточная инфильтрация опухоли изучена у 333 больных ДВКЛ по CD5 и CD7, у 240 больных по CD3. Типы реакций при использовании трех антител высоко коррелировали: слабая инфильтрация отмечена в 31,5-35% случаев, умеренная – в 55,8-58,6%, выраженная – в 9,2-9,9%. Влияние на прогноз этих типов инфильтрации было близко к достоверному, особенно – по CD7. При исключении из анализа немногочисленной группы больных с выраженным количеством Тклеток в срезах (в действительности, это может отражать не только инфильтрацию опухоли Т-лимфоцитами, но и сохранность Т-клеточных зон при частичном замещении ткани лимфатического узла опухолью) различия в прогнозе между группами с наличием инфильтрации и без таковой были достоверными, лучшие показатели выживаемости отмечены у больных с наличием Т-клеточной инфильтрации (р=0,038). Интересно отметить, что у больных с наличием Тклеточной инфильтрации вдвое реже имело место наличие двух и более экстранодальных локализаций опухоли. Различия между группами достоверны, р=0,021. Ни по одному из анализируемых показателей миелограммы достоверных различий между группами с наличием и отсутствием Т-клеточной инфильтрации не получено. Т-клеточная реакция в опухоли была взаимосвязана с экспрессией активационных антигенов HLA-DR и CD38 на клетках ДВКЛ, с уровнем макрофагальной реакции и наличием ФДК в опухолевой ткани. Роль Т-клеточной инфильтрации первичной опухоли представляется, пожалуй, наиболее интригующей при ДВКЛ, поскольку именно с этими клетками связывают своего рода иммунореактивность организма в ответ на опухоль. И наши данные на очень большом материале (более 300 больных) позволили выделить типы реакций CD3, CD5, CD7 Т-клеток в опухолевой ткани. Как оказалось, ДВКЛ с наличием интратуморальной Т-клеточной реакции, действительно, формируют вполне очерченную группу. Уровень Т-клеток тесно связан с опухолевым микроокружением – макрофагами и фолликулярными дендритными клетками обоих изученных типов (CD21+ и CD23+). Т-клеточная реакция напрямую зависит от иммунофенотипических особенностей опухоли и, что особенно важно, экспрессии активационных антигенов HLA-DR и CD38. В числе клинических особенностей лимфом с Т-клеточной инфильтрацией – достоверно более редкая частота встречаемости такого признака неблагоприятного прогноза как наличие двух и более экстранодальных локализаций опухоли. И, наконец, Т-клеточная инфильтрация ДВКЛ характеризовала группу более благоприятного прогноза, что убедительно доказано при более чем 10 летнем наблюдении за больными. Все это позволяет сделать заключение о целесообразности дальнейшего изучения и использования в клинике такого нового показателя как Т-клеточная инфильтрация опухоли. Современное состояние вопроса диагностики и лечения ДВКЛ характеризуется определенной стагнацией. Для принятия лечебных решений рекомендованы, предложенные 20 лет назад международные факторы прогноза, которые являются клиническими и во многом утратили свое значение. Перспективные для понимания биологии ДВКЛ и с точки зрения прогноза профили генной экспрессии позволяют выделить 2 биологически различных варианта ДВКЛ – родственный клеткам зародышевых центров (GCB) и активированным В-клеткам крови (АВС). Применение этих молекулярных подходов и иммуногистохимических суррогатных замен к клиническому использованию Европейским обществом медицинских онкологов не рекомендовано, так как является малодоказательным. Для лучшего понимания биологии ДВКЛ и роли различных факторов (клинических, гематологических, иммунологических) в прогнозе заболевания мы провели углубленные иммунологические исследования опухолевой ткани и состояния гемопоэза у 338 больных ДВКЛ. Из числа клинических факторов прогноза главным предиктором общей выживаемости явилась стадия заболевания. Прогноз при распространенных стадиях (III, IV) был достоверно хуже, чем при I, II стадиях, что полностью соответствует положениям IPI. Вместе с тем, два других неблагоприятных клинических признака прогноза (ECOG не менее 2 и наличие не менее двух экстранодальных локализаций опухоли) практически во всех случаях соотносились с III, IV стадиями процесса, и оценить их самостоятельное значение не представилось возможным. Что же касается возраста больных и повышенных уровней ЛДГ в сыворотке крови, то они не имели достоверного влияния на прогноз в анализируемой группе больных. Роль состояния гемопоэза в патогенезе и прогнозе ДВКЛ ранее не изучалась. Наши исследования показали, что существуют типичные для всей группы больных ДВКЛ нарушения процессов костномозгового кроветворения. Они касаются увеличения процента бластов, особенностей дифференцировки гранулоцитов и изменения эритробластограммы с возрастанием оксифильных форм и повышением индекса созревания эритроидных клеток. Возрастание бластных форм (>1%) и нарушение (торможение) дифференцировки нейтрофилов на уровне миелоцитов оказывало неблагоприятное влияние на прогноз. Причем влияние этих нарушений на общую выживаемость не было обусловлено или, по крайней мере, взаимосвязано со стадией ДВКЛ. Конечно, на сегодняшний день мы еще далеки от понимания патогенетических взаимосвязей гемопоэтической ткани с первичной опухолью. Определенные свидетельства взаимосвязи первичной опухоли с гемопоэзом исходят из того, что ДВКЛ, имеющие различный иммунофенотип, по разному влияют на гемопоэз. Например, снижение уровней нейтрофильных метамиелоцитов, наблюдаемое у большинства больных ДВКЛ, для HLA-DRнегативной группы не является характерным. У больных CD38+ группы ДВКЛ вдвое чаще наблюдается нормальный уровень сегментоядерных нейтрофилов (прогностически благоприятно в сравнении со сниженными уровнями). В CD21позитивной группе промиелоцитов. В в три CD23+ раза чаще группе наблюдаются вдвое чаще нормальные повышенные уровни уровни сегментоядерных нейтрофилов (прогностически благоприятно). В CD10+ группе ниже, чем в группе сравнения (CD10-) процент промиелоцитов. В CD30+ группе ниже процент оксифильных нормобластов, чем в группе сравнения (CD30-). Следовательно, характерные для большинства больных ДВКЛ или прогностически неблагоприятные изменения гемопоэза, наблюдаемые у больных ДВКЛ, могут быть обусловлены опухолями определенного иммунофенотипа или, напротив, нехарактерны для опухолей определенного иммунофенотипа. Выявление этих ассоциаций позволит глубже понять взаимосвязи иммунофенотипа первичной опухоли с гемопоэзом. Чрезвычайно важно понимание роли специфических иммунофенотипов в прогнозе и стимуляции опухолевого микроокружения при ДВКЛ. К числу наиболее «иммуногенных» ДВКЛ можно отнести CD38-позитивные опухоли. При них наблюдается наиболее пестрый состав микроокружения с достаточно выраженной реакцией всех клеточных типов – макрофагов, плазмоцитов, Т-лимфоцитов. Втрое чаще в опухолевой ткани присутствуют фолликулярные дендритные клетки. Сам по себе CD38+ иммунофенотип не связан с неблагоприятным прогнозом, однако, комплексность влияния на клетки микроокружения и гемопоэз свидетельствует о патогенетической важности выделения данного подварианта. Три признака ассоциированы с благоприятным прогнозом – отсутствие HLADR на опухолевых клетках, наличие CD30 и Т-клеточная инфильтрация опухоли. Два из этих признаков (отсутствие HLA-DR и экспрессию CD30) можно расценить как своего рода иммунологическую анаплазию опухолевых клеток. Не удивительно, поэтому, что и CD45-негативный вариант, коррелировавший с CD30, тоже отличался (недостоверно) благоприятным прогнозом. Ряд положений, на первый взгляд, противоречат друг другу. Так, например, HLA-DR-негативный вариант ассоциирован с более низкой частотой интратуморальных Т-клеточных ответов, а сниженные Т-клеточные ответы характеризуют группу менее благоприятного прогноза. Но здесь очень важно помнить, что группы с практически полным отсутствием Т-клеточной инфильтрации и наличием таковой почти равночисленны (44% и 56%), и HLA-DR-негативные опухоли представляют лишь небольшую фракцию среди случаев ДВКЛ со сниженной инфильтрацией. Другая иммунофенотипическая группа опухолей характеризуется неблагоприятным прогнозом. Сюда относятся CD10-позитивные ДВКЛ и CD23- позитивные ДВКЛ. По-существу, это опухоли, имеющие признаки клеток фолликулярных центров. Если внимательно изучить кривые выживаемости больных ДВКЛ в зависимости от экспрессии CD38 (также маркер клеток зародышевых центров), то обращают на себя внимание наиболее низкие показатели выживаемости у больных с мономорфной, наиболее высокой экспрессией антигена на опухолевых клетках. Следовательно, ДВКЛ с маркерами герминативных центров на опухолевых клетках не всегда представляют группу более благоприятного прогноза. Сам по себе факт того, что признаки фолликулярных лимфом при ДВКЛ могут свидетельствовать о неблагоприятном прогнозе не нов. Достаточно вспомнить, что BCL2 – маркер фолликулярных лимфом является признаком неблагоприятного прогноза ДВКЛ. Полученные нами данные ставят со всей определенностью вопрос о путях совершенствования иммунофенотипических диагностики данных подтипов первичной ДВКЛ опухоли, на состава основе клеток микроокружения и особенностей костномозгового кроветворения у больных. С одной стороны, полученные данные относительно факторов прогноза ДВКЛ позволяют более точно оценивать возможные результаты лечения при первичной диагностике. С другой – появляется реальная потребность в реализации критического подхода к существующим концепциям дифференциации ДВКЛ на GCB и АВС типы. Следует отметить, что приоритет в установлении подтипов диффузной В-крупноклеточной лимфомы принадлежит Alizadeh A.A. et al. (2000), которые изучили профили генной экспрессии при ДВКЛ. На основании профилей генной экспрессии или иммуногистохимически с использованием различных алгоритмов в качестве суррогатов большинство случаев диффузной В-крупноклеточной лимфомы могут быть отнесены к прогностически благоприятному GCB или неблагоприятному АВС субтипам (Muris J.J. et al., 2006; Visco C. et al., 2012). Однако иммунофенотипические алгоритмы не всегда хорошо коррелируют с профилями генной экспрессии и могут иметь низкое прогностическое значение (Ott G. et al., 2010; Thieblemont C. et al., 2011; Gu K. et al., 2012). Вопрос о том, насколько молекулярно-генетический подход к установлению подтипов ДВКЛ может быть заменен «суррогатными» иммуногистохимическими маркерами всегда оставался предметом дискуссии. Хотя стратификация в соответствие с нормальным аналогом опухолевой клетки (cell of origin) на основании сигнатур генной экспрессии способна дать общую перспективу клинического исхода, в настоящее время проведение GEP не входит в рутинную практику клинической диагностики (Hu S. et al., 2013). Более того, каждый из 2 субтипов ДВКЛ является гетерогенным и содержит дополнительные подгруппы, которые имеют различные прогнозы и могут нуждаться в различных терапевтических подходах. Например, GCB-подтип обычно имеет благоприятный прогноз, но он также включает MYC/BCL2 лимфомы с двойными транслокациями, которые имеют крайне агрессивное клиническое течение (Lin P. et al., 2007; Aukema S.M. et al., 2011). Таким образом, очень важной является дальнейшая стратификация случаев ДВКЛ на биологически сходные и клинически значимые подгруппы, которые будут помогать не только в оценке прогноза и улучшении терапевтических решений, но также стимулировать научные исследования для понимания патогенеза и разработки потенциально новых лечебных подходов. Наши данные указывают на то, что целесообразность выделения GCB и АВС типов ДВКЛ иммуногистохимическими методами является, по меньшей мере, спорной. Мы изучили 4 маркера ДВКЛ, которые в нормальных лимфатических узлах ассоциированы преимущественно с клетками светлых центров фолликулов (CD10, CD38, CD23), либо локализованы на клетках вне фолликулов (CD30). Исследование проведено с целью дальнейшего анализа возможностей разграничения GCB и ABC-типов ДВКЛ иммуногистохимическими методами. Рестриктированность того или иного маркера клетками светлых центров фолликулов или отсутствие таковой в нормальных лимфатических узлах, возможно, позволяет выделить GCB-вариант ДВКЛ, но не всегда соотносится с представлением о благоприятном течении ДВКЛ с экспрессией антигенов, свойственных клеткам светлых центров. Наиболее типичный вариант – это антиген CD10. Данный антиген используется для диагностики GCB-варианта ДВКЛ. Однако в нашем исследовании все больные CD10-позитивной группы погибли в очень ранние сроки. Это соответствует данным Uherova P. et al. (2001) и Xu I. et al. (2001), которые соотнесли экспрессию CD10 с группой высокого риска ДВКЛ. Интересно отметить, что экспрессия bcl-2 по данным этих авторов также свидетельствовала о плохом прогнозе. В целом ряде исследований не отмечено разницы в выживаемости больных в зависимости от экспрессии CD10 на клетках ДВКЛ (Сolomo L. et al., 2003; Linderoth J. et al., 2003; McClure R.F. et al., 2003). В работе Colomo L. et al. (2003) экспрессия CD10 наблюдалась в основном при поздних стадиях ДВКЛ, что могло быть причиной плохого прогноза у этих больных. Наряду с этим существует ряд работ о благоприятной роли экспрессии CD10 при ДВКЛ (Takeshita M. et al., 2000; Ohshima K. et al., 2001; Go J.H. et al., 2002; McClintock S. et al., 2003). Учитывая такую вариабельность ответов, автор иммуногистохимического алгоритма диагностики GCB и ABC-типов ДВКЛ Hams C.P. считает сомнительным, что на основе CD10 может диагностироваться GCBтип (Hans C.P. et al., 2004). По нашему мнению, комбинации CD10 с другими маркерами не смогут перекрыть неблагоприятное прогностическое значение данного маркера. Реаранжировка bcl-2, с которой обычно связывают гиперэкспрессию соответствующего белка при фолликулярной лимфоме, наблюдается в группе GCB-типа ДВКЛ. Разумеется, экспрессия белка BCL-2 при ДВКЛ – это не то же самое, что его гиперэкспрессия при фолликулярной лимфоме. Тем не менее, BCL2-позитивные ДВКЛ характеризовались неблагоприятным прогнозом, что было преодолено только в эру ритуксимаба (Mounier N. et al., 2003). Аналогичная ситуация с маркером CD23. В нормальных лимфатических узлах он представлен почти исключительно на клетках светлых центров и фолликулярных дендритических клетках. Вместе с тем, в ходе активации Влимфоцитов периферической крови данный антиген также экспрессируется. Нами описана группа ДВКЛ с экспрессией на опухолевых клетках рецептора CD23. Частота встречаемости CD23+ ДВКЛ составляет 12% (39 из 326 больных). С клинических позиций интересно то, что CD23-позитивная группа больных характеризовалась достоверно худшим прогнозом, снижением показателей общей выживаемости, преобладанием лиц молодого возраста, крайне редкой встречаемостью двух и более экстранодальных локализаций опухоли в сравнении с CD23-негативной группой пациентов. В литературе есть лишь единичные указания о возможной благоприятной прогностической роли данного антигена при агрессивных лимфомах, однако, группа лимфом была разнородна (Linderoth J. et al., 2003) и не сопоставима с анализируемой нами ДВКЛ, неспецифицированной. К тому же, как мы уже отметили, вряд ли, маркер CD23 может быть использован для разграничения GCB и ABC-типов ДВКЛ в силу его достаточно широкой экспрессии на периферических В-клетках как активационного антигена. Подобное заключение можно сделать и относительно антигена CD38, который имеет широкий диапазон экспрессии, но по нашим данным не имел прогностического значения. Совершенно иная ситуация с активационным антигеном CD30, который отражает более поздние этапы активации периферических В-лимфоцитов. Маркер CD30 ранее не применялся для разграничения GCB и ABC-типов ДВКЛ. Это не удивительно, так как в описанном в 2013 году CD30-позитивном варианте ДВКЛ были представлены в достаточно высокой пропорции оба эти типа ДВКЛ. Установленная благоприятная роль такого иммуногистохимического маркера как CD30 (Hu S. et al., 2013) представляется весьма убедительной, хотя и ранее было сделано множество попыток для того, чтобы найти биомаркеры, способные предсказывать исход ДВКЛ помимо IPI. И в литературе описано множество таких прогностических маркеров, дополнительные исследования которых не подтвердили их прогностической ценности. Сложность оценки прогноза может быть обусловлена различной прогностической ролью тех или иных маркеров (например, экспрессией BCL2) при GCB и ABC-подтипах ДВКЛ. В эру до применения ритуксимаба BCL2 предсказывал плохой прогноз при АВС-типе, но не при GCB-типе, а при внедрении ритуксимаба ситуация изменилась на противоположную (Iqbal J.et al., 2011). Часто исследование единичных маркеров является недостаточным, так, доказано, что экспрессию MYC и BCL2 необходимо проводить одновременно (Johnson N.A. et al., 2012). Важную роль в прогнозе ДВКЛ играют профили генной экспрессии микроокружения (Lenz G. et al., 2008). В работе по оценке прогностической роли CD30 (Hu S. et al., 2013) учитываются многие из этих факторов, обусловливающих комплексность прогноза ДВКЛ, что делает ее очень весомой для предстоящих исследований клиники. Разумеется, ограничиваться чисто механистическим подходом в разделении ДВКЛ на 2 группы на основании экспрессии CD30 недостаточно (Chan W.C. et al., 2013). Роль экспрессии CD30 при ДВКЛ на сегодняшний день остается неясной. Необходим поиск маркеров, которые являются не только пригодными и информативными для предсказания исхода заболевания, но также дают информацию о механизмах, лежащих в основе неблагоприятного прогноза, а также существующих возможностях его улучшения. В настоящее время доступны новые методические возможности для расшифровки подобных механизмов – изучение профилей экспрессии генов и микро-РНК, новые подходы к секвенированию и т.д. Наши данные, представленные в этой работе, свидетельствуют о том, что новые молекулярные подходы к исследованиям на клеточном уровне необходимо сочетать с исследованиями на организменном уровне. Нами не только подтверждена благоприятная прогностическая роль экспрессии CD30 при ДВКЛ, но также впервые убедительно доказано, что экспрессия CD30 отражается на гемопоэзе (эритропоэзе) больных. CD30позитивные ДВКЛ формируют уникальную группу, которая отличается от остальных случаев ДВКЛ отсутствием возрастания процента оксифильных нормобластов и соответствующим характером эритробластограммы. Интересен тот факт, что увеличение уровня оксифильных нормобластов является впервые установленным нами фактором неблагоприятного прогноза при ДВКЛ. При CD30позитивных случаях подобной динамики оксифильных нормобластов не наблюдается. Обусловлена ли благоприятная прогностическая роль экспрессии CD30 при ДВКЛ собственно биологическими особенностями опухоли или ее особым взаимоотношением с гемопоэзом на сегодняшний день не ясно. Полученные нами данные открывают широкое поле для исследований в данной области. Вместе с тем, однозначной точки зрения относительно прогностической роли даже такого широко изучаемого и наиболее точного маркера клеток светлых центров как CD10, используемого для диагностики GCB-варианта ДВКЛ, нет. Наши данные и результаты исследований целого ряда зарубежных авторов свидетельствуют о неблагоприятной роли этого антигена при ДВКЛ. Напротив, маркер CD30 идентифицировал группу больных ДВКЛ с хорошим прогнозом. Наши данные ставят под сомнение саму необходимость идентификации GCB и ABC вариантов, ведь первоначальная привлекательная диагностическая идея заключалась в возможности установления вариантов ДВКЛ с различным клиническим течением и ответом на терапию. «Суррогатные» маркеры не дают однозначной информации для выбора тактики лечения больного, именно по этим причинам иммуногистохимическое разграничение GCB и ABC типов ДВКЛ не рекомендовано к внедрению в клинику как малодоказательное (Ghelmini M. et al., 2013). Таким образом, комплексный иммунологический, гематологический и клинический подход к проблеме ДВКЛ позволил при проведении исследований у большого числа больных (338) вскрыть патогенетические связи с гемопоэзом и микроокружением опухоли, а также установить новые факторы прогноза диффузной В-крупноклеточной лимфомы. ВЫВОДЫ 1. На основании проведеннных углубленных исследований у 338 больных неспецифицированной установлена важная диффузной роль В-крупноклеточной оценки показателей лимфомой гемопоэза, иммунофенотипа первичной опухоли и субпопуляционного состава интратуморальных лимфоцитов неопухолевого микроокружения в диагностике, патогенезе, клиническом течении и прогнозе ДВКЛ. 2. Важнейшим неблагоприятным признаком международного прогностического индекса (IPI) в выделении групп риска ДВКЛ является распространенность опухолевого процесса при диагностике (наличие III, IV стадий). Наличие двух или более экстранодальных локализаций опухоли и показатель ECOG (>=2), как правило, соотносятся с III, IV стадиями ДВКЛ, а прогностическая роль пожилого возраста больных и повышенных уровней ЛДГ утратили свое значение. Поэтому главной задачей улучшения прогноза при ДВКЛ являются совершенствование ранней диагностики заболевания и достижение большей частоты ремиссий при проведении специфического лечения. 3. Включение препарата ритуксимаб (моноклональные антитела к антигену CD20) повышает частоту достижения полных ремиссий у больных ДВКЛ и достоверно увеличивает общую выживаемость больных при сроке наблюдения 8 лет (р=0,047). 4. В-линейная природа ДВКЛ в 100% случаев подтверждается обнаружением цитоплазматической детерминанты антигена CD20 (L26). Экспрессия CD19 и мембранных CD20 может быть слабой и в редких случаях отрицательной, что высоко коррелирует (p<0,001) с утратой экспрессии общелейкоцитарного антигена CD45. Отсутствие мембранной экспрессии CD20 по нашим наблюдениям встречается в 1,5% случаев ДВКЛ (4 из 272 больных) и должно учитываться при назначении препарата Ритуксимаб (моноклональные антитела к мембранной детерминанте антигена CD20). 5. Характерными особенностями гемопоэза у больных ДВКЛ являются увеличение процента бластов в миелограмме и изменения эритробластограммы (снижение базофильных и полихроматофильных нормобластов, повышение оксифильных форм с повышением индекса созревания эритрокариоцитов в 86% случаев). 6. Нарушения гемопоэза у больных ДВКЛ имеют прогностическое значение: повышение бластных клеток (>=1%) ухудшает общую выживаемость больных (р=0,048); задержка созревания увеличением клеток числа гранулоцитарного нейтрофильных ряда миелоцитов с или снижением процента сегментоядерных нейтрофилов также ухудшают прогноз (р=0,011 и р= 0,013); нарушение дифференцировки эритрокариоцитов с повышением уровня оксифильных нормобластов ухудшает прогноз ДВКЛ (р=0,041). 7. Иммунофенотипирование (криостатных) срезах клеток ДВКЛ опухолевой ткани на свежезамороженных существенно расширяет возможности рутинной иммуногистохимии за счет изучения маркеров активации (HLA-DR, CD38), пан-В-клеточных антигенов (CD19, мембранные CD20), пан-Т-клеточных (CD7) в дополнение к стандартно используемым CD45, CD20 (L26), CD163, CD30, CD3, CD5, CD10, CD23, CD21. Это позволяет диагностировать редкие варианты лимфом, оценивать особенности иммунофенотипа во взаимосвязи с клетками микроокружения опухоли. 8. HLA-DR-негативный вариант ДВКЛ составляет 9,3% случаев (32 из 331), характеризуется благоприятным прогнозом, крайней редкостью (2,8%) двух и более экстранодальных локализаций. Опухоль не имела иных специфических иммунофенотипических признаков, характеризовалась сниженной Т-клеточной инфильтрацией, достоверно более редким снижением нейтрофильных метамиелоцитов. 9. Экспрессия CD38 наблюдается в 55,9% (184 из 329) и не влияет на прогноз ДВКЛ. Иммунобиологические особенности CD38+ ДВКЛ состоят в более выраженной интратуморальной инфильтрации клетками опухолевого микроокружения (макрофагами, плазмоцитами, зрелыми Тлимфоцитами), чаще присутствуют ФДК. CD23+ Опухоль характеризуется спецификой иммунофенотипа (CD21, CD23), связью с гемопоэзом (сегментоядерные нейтрофилы, плазмоциты), более низкими уровнями ЛДГ. 10. К редким вариантам относится CD45-негативная ДВКЛ – 3,9% (13 из 332). Опухоль наблюдается при III, IV стадиях и характеризуется чертами иммунологической анаплазии: снижением CD19, CD20 (p<0,001), экспрессией в 55,6% случаев антигена Ki-1 CD30. 11. Экспрессия рецепторов CD21 и CD23 высоко коррелирует между собой и наблюдается в 12,4% (33 из 266) и 12,0% (39 из 326) ДВКЛ, соответственно. Эти две группы ДВКЛ различны: CD21-позитивные лимфомы в сравнении с CD21-негативными чаще наблюдались у женщин (р=0,046) и характеризовались частым отсутствием признаков неблагоприятного прогноза. Отмечена достоверная связь с уровнями промиелоцитов и лимфоцитов в костном мозге. В CD21+ группе ДВКЛ не наблюдали CD30-позитивных случаев. CD23+ ДВКЛ характеризовались неблагоприятным прогнозом (р=0,029), преобладали больные более молодого возраста (р=0,002). В этой группе вдвое чаще были повышены уровни сегментоядерных нейтрофилов в костном мозге. Отмечена корреляция экспрессии CD23 и CD38 на опухолевых клетках, а также высокая частота выраженных интратуморальных Т- клеточных реакций при CD23+ иммунофенотипе. 12. Особую группу ДВКЛ представляют CD30-позитивные случаи (23,9% 21 из 88), характеризующиеся хорошим прогнозом (все больные живы, срок наблюдения до 110 мес), р=0,02. Характерна связь с эритропоэзом и отсутствие выраженных реакций плазмоцитов в опухолевом микроокружении. 13. Из числа клеток микроокружения (макрофагов – CD163+, плазмоцитов – CD38++, фолликулярных дендритных клеток двух субпопуляций – CD21+, CD23+ и Т-лимфоцитов – CD3, CD5, CD7) наиболее клинически важными являются Т-лимфоциты. Наличие Т-клеточной интратуморальной иммунной реакции (CD7) характеризует группу ДВКЛ с благоприятным прогнозом (р=0,021) по выживаемости и отсутствию двух и более экстранодадьных локализаций. Т-клеточная инфильтрация связана с активационными маркерами опухоли, наличием фолликулярных дендритных клеток и макрофагов микроокружения. 14. Полученные данные дают основание для более точного назначения иммунопрепаратов (ритуксимаб). Интенсификация лечения не показана у больных с HLA-DR+, CD30+ ДВКЛ, а также при наличии Т-клеточной инфильтрации опухоли. Результаты лечения больных CD10+ и CD23+ ДВКЛ, а также пациентов с повышением бластов в костном мозге, нарушением гранулоцитарной дифференцировки, повышением оксифильных нормобластов являются менее удовлетворительными – целесообразно совершенствование программ терапии. СПИСОК ЛИТЕРАТУРЫ 1. Адылов М.А., Хамзалиев Б.Х. Изменение эритрона при длительных геморрагиях. //Лабораторное дело. -1990. -№5. –С.24-26 2. Валиев Т.Т., Крвригина А.М., Серебрякова И.Н. и др. Диффузная Вкрупноклеточная лимфома с поражением яичка в детском возрасте.//Клиническая окогематология. -2013. –Т.6, №1. –С.74-77 3. Владимирская Е.Б. Основы кроветворения. В кн. Гератрическая гематология (ред. Л.Д. Гриншпун, А.В.Пивник). –Москва, Медиум. -2011. –С.21-44. 4. Воробьев А.И. Руководство по гематологии. // М.: Ньюдиамед., — 2002. — 3-е изд., том 3 —С.313—322. 5. Долгих Т.Ю., Домникова Н.П., Петрусенко Е.Е. и др. Морфологическая характеристика центрального звена эритрона при агрессивных и индолентных неходжкинских лимфомах. //Бюллетень экспериментальной биологии и медицины. -2011. –Т.151, №2. –С.224-228. 6. Кондратьева Н.Е. Антиген СD38 (обзор).//Иммунология гемопоэза. -2005. – Выпуск 2. –С.145-153 7. Ланг Г.Ф.//Клиническая медицина. -1939. –Т.17,№6. –С.3. 8. Мазурок Л.А. Клинико-иммунологические особенности неходжкинских лимфом с первичным поражением средостения. Дис…канд.мед.наук. Москва. -2006. -157 С. 9. Перминова О.А. Состояние эритрона у крыс в отдаленные сроки после острой лучевой травмы. //Радиобиология. -1985. –Т.XXV, выпуск 4. –С.539544. 10. Поддубная И.В., Савченко В.Г. (Руководители) и коллектив авторов. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. М.: Медиа Медика, 2013. -104 с.: ил. 11. Рябов С.И. Основы физиологии и патологии эритропоэза. –Л., 1971. 12. Сарычева Т.Г., Козинеци Г.И. Морфофункциональная характеристика эритрона в норме (обзор литературы). //Клиническая лабораторная диагностика. -2001. –Т.5. –С.3-8. 13. Соколов В.В., Грибова И.А. Гематологические показатели здорового человека. — М., 1972. — 102 с. 14. Тимонина Е.Г., Френкель М.А., Колбацкая О.П., Подвязников С.О. Характеристика гемопоэза у больных плоскоклеточным раком головы и шеи. //Вестник РОНЦ им. Н.Н.Блохина РАМН. -2009. –Т.20, №3. –С.75-81 15. Ткачева Т.В., Шардаков В.И. К вопросу о номенклатуре и количественной характеристике клеток эритрона у здоровых людей. //Проблемы гематологии и переливания крови. -1978. -№1. –С.31-34 16. Тумян Г.С., Османов Е.А., Кравченко С.К. и др. Российские клинические рекомендации по диагностике и лечению диффузной В-крупноклеточной лимфомы (версия 2012 г). //Клиническая онкогематология. -2013. –Т.6,№4. – С.465-469 17. Тумян Г.С., Сорокин Е.Н., Ковригина А.М. и др. Диффузная Вкрупноклеточная лимфома с первичной локализацией в яичке.//Клиническая онкогематология. -2008. –Т.1,№3. –С.206-210 18. Френкель М.А. Исследование костного мозга в онкологии. //Иммунология гемопоэза. -2014. –Т.12. -№1-2. –С.18-41 19. Чернова Е.Н, Гольдберг Е.Д., Новицкий В.Д. Состояние эритрона в процессе роста индуцированных опухолей. //Патологическая физиология и экспериментальная терапия. -1992. -№2. –С.52-54 20. A predictive model for aggressive non-Hodgkin’s lymphoma. The international non-Hodgkin’s lymphoma prognostic factors project. //N. Engl. J. Med. -1993. – V.329,№14. –P.987-994 21. Adams H.J., Kwee T.C., de Keizer B. et al. FDG PET/CT for the detection of bone marrow involvement in diffuse large B-cell lymphoma: Systematic review and meta-analysis. Eur J. Nucl. Med. Mol. Imaging. -2014. –V.41. –P.565-574 22. Adams H.J.A., de Klerk J.M.H., Fijnheer R. et al. Bone marrow biopsy in diffuse large B-cell lymphoma: useful or redundant test? //Acta oncol. -2014. –Sept. 29, 1-6 [Epub. Ahead of print]. 23. Adida C., Haioun C., Gaulard P. et al. Prognostic significance of surviving expression in diffuse large B-cell lymphomas.//Blood. -2000. –V.96. –P.19211925 24. Advani R.H., Chen H., Habermann T.M. et al. Comparison of conventional prognostic indices in patients older than 60 years with diffuse large B-cell lymphoma treated with R-CHOP in the US intergroup study (ECOG 4494, CALGB 9793): consideration of age greater than 70 years in an elderly prognostic index (E-IPI).//Br. J.Haematol. -2010. –V.151. –P.143-151 25. Ahearne MJ, Bhuller K, Hew R, Ibrahim H, Naresh K, Wagner SD. Expression of PD-1 (CD279) and FoxP3 in diffuse large B-cell lymphoma //Virchows Arch. 2014. –V.465, №3. P.351-358 26. Alizadeh A.A., Eisen M.B., Davis R.E. et al. Distinct types of large B-cell lymphoma identified by gene expression profiling.//Nature. -2000. –V.403, №6769. –P.503-511 27. Amen F., Horncastle D., Elderfield K. et al. Absence of cyclin-D2 and Bcl-2 expression within the germinal center type of diffuse large B-cell lymphoma identifies a avery good prognostic subgroup of patients //Histopathology. -2007. – V.51. –P.70-79 28. Andre-Schwartz J. et al. In: Hematology (Second Edition). Basic principles and practice. (Eds. Hoffman R. et al.), 1995, pp. 86-108. Churchill Livingstone, N.-Y. 29. Armitage J.O., Weisenburger D.D. New approach to classifying non-Hodgkin’s lymphomas: clinical features of the major histologic subtypes. Non-Hodgkin’s lymphoma classification project.//J. Clin. Oncol. -1998. –V.16. –P.2780-2795 30. Aukema S.M., Siebert R., Schuuring E. et al. Double-hit B-cell lymphomas .//Blood. -2011. –V.117. –P.2319-2331 31. Barrans S.L., Felton J.A., Banham A. et al. Strong expression of FOXP1 identifies a distinct subset of diffuse large B-cell lymphoma (DLBCL) patients with poor outcome // Blood. -2004. –V.104. –P.2933-2935 32. Bea S., Zetti A., Wright G. et al. Diffuse large B-cell lymphoma subgroups have distinct genetic profiles that influences tumor biologyand improve geneexpression-based survival prediction //Blood. -2005. –V.106. –P.3183-3190 33. Berglund M., Thunberg U., Amini R.M. et al. Evaluation of immunophenotype in diffuse large B-cell lymphoma and its impact on prognosis //Mod. Pathol. -2005. – V.18. –P.1113-1120 34. Berndt H.-W., Ziepert M., Thorns C. et al. Loss of HLA-DR expression and immunoblastic morphology predict adverse outcome in diffuse large B-cell lymphoma – analyses of cases from two prospective randomized clinical trials. //Haematologica. -2009. –V.94, №11. –P.1569-1580 35. Berthet L., Cochet A., Kanoun S. et al. In newly diagnosed diffuse large B-cell lymphoma, determination of bone marrow involvement with 18F-FDG PET/CT provides better diagnostic performance and prognostic stratification than does biopsy. /J. Nucl. Med. -2013. –V.54. –P.1244-1250 36. Bertram H.C., Check I.J., Milano A.M. Immunophenotyping large B-cell lymphomas. Flow cytometric pitfalls and pathologic correlations. //Am.J.Clin.Pathol. -2001. –V.116. –P.191-203 37. Bonzheim I., Geissinger E., Roth S. et al. Anaplastic large cell lymphomas lack the expression of T-cell receptor molecules or molecules of proximal T-cell receptor signaling. //Blood. -2004. –V.104, №10. –P.3358-3360 38. Cai QC, Liao H, Lin SX, Xia Y, Wang XX, Gao Y, Lin ZX, Lu JB, Huang HQ High expression of tumor-infiltrating macrophages correlates with poor prognosis in patients with diffuse large B-cell lymphoma// Med Oncol. 2012. –V.29, №4. – P.2317-2322 39. Campbell J., Seymour J.F., Matthews J. et al. The prognostic impact of bone marrow involvement in patients with diffuse large cell lymphoma varies according to the degree of infiltration and presence of discordant marrow involvement. //Eur. J. Haematol. -2006. –V.76. –P.473-480 40. Carbone P.P., Kaplan H.S., Musshoff K. et al. Report of the committee on Hodgkin Lymphoma staging classification. //Cancer Research. -1971. –V.31. – P.1860-1861 41. Carli P.M., Heudes D., Bailly F. et al. //Blut. -1988. –Vol.56. –P.4. 42. Carr R., Barrington S.F., Madan B. et al. Detection of lymphoma in bone marrow by whole-body positron emission tomography.//Blood. -1998. –V.91. –P.33403346 43. Chan W.C. CD30, another useful predictor of survival in DLBCL?// Blood. -2013. –V.121,№14. –Р.2582-2583. 44. Chen R., Palmer J.M., Thomas S.H. et al. Brentuximab vedotin enables successful reduced-intensity allogeneic hematopoietic cell transplantation in patients with relapsed or refractory Hodgkin lymphoma. //Blood. -2012. –V.119, №26. – P.6379-6381 45. Cheson B. The case against heavy PETing. //Journal of clinical oncology. -2009. – V.27. №11. –P.1742-1743 46. Cheson B.D., Fisher R.I., Barrington S.F. et al. Recommendation for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: The Lugano Classification. //J. Clin. Oncol. -2014. –V. 32. –P.30593067. 47. Chigrinova E.V., Pavlovskaya A.I., Tupitsyn N.N. The role of immunophenotyping in the diagnosis of bone-marrow involvement in patients with peripheral B-cell non-Hodgkin’s lymphoma. //Haematopoiesis immunology. -2006. –V.3, №2. –Р.22-45 48. Choi W.W., Weissenburger D.D., Greiner T.C. et al. A new immunostain algorithm classifies diffuse large B-cell lymphoma into molecular subtypes with high accuracy. //Clin. Cancer. Res. -2009. –V.15, №17. –P.5494-5502 49. Coiffer B. Rituximab therapy in malignant lymphoma //Oncogene. -2007. –V.26. – P.3603-3613 50. Coiffier B., Gisselbrecht C., Herbrecht R. et al. LNH-84 regimen: a multicenter study of intensive chemotherapy in 737 patients with aggressive malignant lymphoma.//J.Clin.Oncol. -1989. –V.7. –P.1018-1026 51. Colomo L, Lopez-Guillermo A, Perales M, et al. дClinical impact of the differentiation profile assessed by immunophenotyping in patients with diffuse large B-cell lymphoma. Blood. 2003;101: 78-84. 52. Cools J., Wlodarska I., Somers R. et al. Identification of novel fusion partners of ALK, the anplastic lymphoma kinase, in anaplastic large cell lymphoma and inflammatory myofibroblastic tumor //Genes chromosomes cancer. -2002. –V.34. –P.354-362 53. Cunningham D., Smith P., Mouncey P. et al. R-CHOP14 versus R-CHOP21: result of a randomized phase III trial for the treatment of patients with newly diagnosed diffuse large B-cell lymphoma.//J.Clin.Oncol. -2011. –V.29. –P.504S (abstr.8000). 54. Dave S.S., Wright G., Tan B. et al. // Prediction of survival in follicular lymphoma based on molecular features of tumor-infiltrating immune cells. // N. Engl. J. Med. -2004, V.351. –P. 2159-2169. 55. De Jong D., Rosenwald A., Chhanabhai M. et al. Immunohistochemical prognostic markers in diffuse large B-cell lymphoma: validation of tissue microarray as a prerequisite for broad clinical applications – a study from the Lunenburg Lymphoma Biomarker Consortium. //J. Clin. Oncol. -2007. –V.25. –P.805-812 56. De Leval L., Gaulard P. CD30+ Lymphoproliferative disorders. //Haematologica. 2010. –V.95, №10. –P.1627-1630 57. De Leval L., Rickman D.S., Thielen C. et al. The gene expression profile of nodal peripheral T-cell lymphoma demonstrates a molecular link between angioimmunoblastic T-cell lymphoma (AITL) and follicular helper (TFH) cells. //Blood. -2007. –V.109,№11. –P.4952-4963 58. De Paepe P., Achten R., Verhoef G. et al. Large cleaved and immunoblastic lymphoma may represent two distinct clinicopathologic entities within the group of diffuse large B-cell lymphomas.//J. Clin. Oncol. -2005. –V.23. –P.7060-7068 59. De Weers M., Tai Y.-T., van der Veer M.S. et al. Daratumumab, a novel therapeutic Human CD38 monoclonal antibody, induces killing of multiple myeloma and other haematological tumors. //J.Immunol. -2011. –V.186. –P.18401848 60. Donner L.R., Mott F.E., Tafur I. Cytokeratin-positive, Cd45-negative primary centroblastic lymphoma of the adrenal gland. A potential for the diagnostic pitfall.//Arch. Pathol. Lab. Med. -2001. –V.125. –P.1104-1106 61. Duman BB, Sahin B, Ergin M, Guvenc B. Loss of CD20 antigen expression after rituximab therapy of CD20 positive B cell lymphoma (diffuse large B cell extranodal marginal zone lymphoma combination): a case report and review of the literature //Med Oncol. 2012 Jun;29(2):1223-6. 62. Dunleavy K., Pittaluga S., Czuczman M.S. et al. Differential efficacy of bortezomib plus chemotherapy within molecular subtypes of diffuse large B-cell lymphoma. //Blood. -2009. –V.113,№24. –P.6069-6076 63. Durkop H., Latza U., Hummel M. et al. Molecular cloning and expression of a new member of the nerve qroeth factor receptor family that is characteristic for Hodgkin’s disease. //Cell. -1992. V.68, №3. –P.421-427 64. Dykewicz C.A. Summary of the guidelines for preventing opportunistic infections among hematopoietic stem cell transplant recipients. //Clin. Infect. Dis. -2001. – V.33. –P.139-144 65. Fallini B., Pileri S., Zinzani P.L. et al. ALK+ lymphoma: clinic-pathological findings and outcome.//Blood. -1999. –V.93, №8. -2697-2706 66. Fanale M.A., Forero-Torres A., Rosenblatt J.D. et al. A phase I weekly dosing study of brentuximab vedotin in patients with relapsed/refractory CD30-positive hematologic malignancies. //Clin. Cancer Res. -2012. –V.18.№1. –P.248-255 67. Farinha P., Masoudi H., Skinnider B.F. et al. // Analysis of multiple biomarkers shows that lymphoma-associated macrophage (LAM) content is an independent predictor of survival in follicular lymphoma (FL). // Blood, 2005. –V. 106, №6, P.2169-2174. 68. Ferdinand P.M., Lobue J., Lutton J. et al. //Exp. Hematol. -1985. –Vol.13, #8. – P.719-721 69. Ferreri A.J. How I treat primary CNS lymphoma. //Blood. -2011. –V.118, №3. – P.510-522 70. Ferreri A.J., Montalban C. Primary diffuse large B-cell lymphoma of the stomach. //Critical reviews in oncology/hematology. -2007a. –V.63. –P.65-71 71. Ferreri A.J., Reni M. Primary central nervous system lymphoma. //Critical reviews in oncology/hematology. -2007. –V.63, №3. –P.257-268 72. Ferreri AJ, Dognini GP, Verona C, Patriarca C, Doglioni C, Ponzoni M. Reoccurrence of the CD20 molecule expression subsequent to CD20-negative relapse in diffuse large B-cell lymphoma //Haematologica. 2007 Jan;92(1):e1-2. 73. Fontenot J.D., Rasmussen J.P., Williams L.M. et al. Regulatory T-cell lineage specification by the forkhead transcription factor foxp3. //Immunity. -2005. –V.22. –P.329-341 74. Galand С., Donnou S., Molina T.J., Fridman W.H., Fisson S., Sautès-Fridman C. Influence of tumor location on the composition of immune infiltrate and its impact on patient survival. Lessons from DCBCL and animal models//Frontiers in immunology. –2012. -V.3. –Article 98. 75. Gaskoyne R.D., Adomat S.A., Krajewski S. et al. Prognostic significance of Bcl-2 protein expression and Bcl-2 gene rearrangement in diffuse aggressive nonHodgkin’s lymphoma //Blood. -1997. –V.90. –P.244-251 76. Geissinger E., Sadler P., Roth S. et al. Disturbed expression of the T-cell receptor/CD3 complex and associated signaling molecules in CD30+ T-cell lymphopreliferations. //Haematologica. -2010. –V.95, №10. –P.1697-1704 77. Ghelmini M., Vitolo U., Kimby E et al. ESMO guideline consensus conference on malignant lymphoma 2011 part 1: diffuse large B-cell lymphoma (DLBCL), follicular lymphoma (FL) and chronic lymphocytic leukemia (CLL).// Annals of oncology. -2013. –V.24. –P.561-576 78. Go JH, Yang WI, Ree HJ. CD10 expression in primary intestinal large B-cell lymphomas: its clinical significance. Arch Pathol Lab Med. 2002; 126:956-960. 79. Gopal A.K., Ramchandren R., O’Connor O.A. et al. Safety and efficacy of brentuximab vedotin for Hodgkin lymphoma recurring after allogeneic stem cell transplantation. //Blood. -2012. –V.120, №3. –P560-568 80. Greb A., Bohlius J., Schiefer D. et al. High dose chemotherapy with autologous stem cell transplantation in the first line treatment of aggressive non-Hodgkin’s lymphoma (NHL) in adults // Cochrane database syst Rev. -2008. –V.1. – CD004024 81. Gruss H.J., Boiani N., Williams D.E. et al. Pleiotropic effects of the CD30-ligand on Cd30-expressing cells and lymphoma cell lines.//Blood. -1994. –V.83, №8. – P.2045-2056. 82. Gu K., Weisenburger D.D., Fu K. et al. Cell of origin fails to predict survival in patients with diffuse large B-cell lymphoma treated with autologous hematopoietic stem cell transplantation. //Hematol. Oncol. -2012. –V.30, №3. –P.143-149 83. Gregorini A., Tomasetti M., Cinti C. et al. CD38 expression enhances sensitivity of lymphoma T- and B-cell lines to biochemical and receptor-mediated apoptosis.//Cell Biology International. -2006. –V.30. –P.727-732 84. Gutierrez-Garcia G., Cardesa-Salzmann T., Climent F. et al. Gene-expression profiling and not immunophenotypic algorithms predicts prognosis in patiens with diffuse large B-cell lymphoma treated with immunochemotherapy. //Blood. -2011. –V.117. –P.4836-4843 85. Hans C.P., Weisenburger D.D., Greiner T. et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray.//Blood. -2004. –V.103. –P.275-282 86. Hans C.P., Weisenburger D.D., Greiner T.C. et al. Expression of PKC-beta or cyclin D2 predicts for inferior survival in diffuse large B-cell lymphoma //Mod. Pathol. -2005. –V.18. –P.1377-1384 87. Hermine O., Haioun C., Lepage E. et al. Prognostic significance of bcl-2 protein expression in aggressive non-Hodgkin’s lymphoma. Group d’Etude des lymphomes de l’adulle (GELA)// Blood. -1996. –V.87. –P.265-272 88. Hernandez-Ilizaliturri F.J., Deeb G., Zinzani P.L. et al. Higher response to lenalidomide in relapsed/refractory diffuse large B-cell lymphoma in nongerminal center B-cell-like than in germinal center B-cell-like phenotype.//Cancer. -2011. – V.117,№22. –P.5058-5066 89. Hiraga J, Tomita A, Sugimoto T, Shimada K, Ito M, Nakamura S, Kiyoi H, Kinoshita T, Naoe T. Down-regulation of CD20 expression in B-cell lymphoma cells after treatment with rituximab-containing combination chemotherapies: its prevalence and clinical significance //Blood. 2009 May 14;113(20):4885-93 90. Hoeller S, Tzankov A, Feichter G, Obermann E, Dirnhofer S. Analysis of CD20 alone could be misleading in lineage determination of B-cell lymphomas: a case of CD20 negative diffuse large B-cell lymphoma in abdominal effusion //Cytopathology. 2009 Aug;20(4):273-4 91. Hori S., Nomura T., Sakaguchi S. Control of regulatory T-cell development transkription factor Foxp3. //Science. -2003. –V.299, №5609. –P.1057-1061 92. Hu S., Xu-Monette Z.Y., Balasubramanyam A. et al. CD30 expression defines a novel subgroup of diffuse large B-cell lymphoma with favorable prognosis and distinct gene expression signature: a report from the International DLBC Rituximab-CHOP consortium program study.//Blood. -2013. –V.121, №14. – Р.2715-2724. 93. Huang J.Z., Sanger W.G., Greiner T.C. et al. The t(14;18) defines a unique subset of of diffuse large B-cell lymphoma with a germinal center B-cellgene expression profile.// Blood. -2002. –V.99. –P.2285-2290 94. Hus I., Podhorecka M., Bojarska-Junak A. et al. The clinical significance of ZAP70 and CD38 expression in B-cell chronic lymphocytic leukemia.//Annals of oncology. -2006. –V.17. –P.683-690 95. Iguchi T, Miyazawa K, Okabe S, Kawakubo K, Shimamoto T, Kuriyama Y, Ito Y, Kimura Y, Ohyashiki K, Serizawa H, Iwaya K, Mukai K. Relapse of diffuse large B cell lymphoma to CD20-negative multiple cutaneous tumors immediately after anti-CD20 monoclonal antibody (rituximab) therapy //Rinsho Ketsueki. 2004 Oct;45(10):1129-34. 96. Inaba T., Nishimura H., Saito J. et al. A case of CD45-negative diffuse large Bcell lymphoman in thyroid gland. //Lab. Hem. -2008. –V.14. –P.12-14 97. Inghirami G., Pileri S.A. European T-cell lymphoma study group. Anaplastic large-cell lymphoma.// Semin.Diagn. Pathol. -2011. –V.28, №3. –P.190-201 98. Iqbal J., Neppalli V.T., Wright G. et al. BCL2 expression is a prognostic marker for the activated B-cell like type of diffuse large B-cell lymphoma //J.Clin. Oncol. -2006. –V.24. –P.961-968 99. Iqbal J., Meyer P.N., Smith L.M. et al. BCL2 predicts survival in germinal center B-cell lie diffuse large B-cell lymphoma treated with CHOP-like therapy and rituximab. //Clin. Cancer res. -2011. -. –V.17, №24. –P.7785-7795 100. Johnson N.A., Slack G.W., Savage K.J. et al. Concurrent expression of MYC and BCL2 in diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone. //J. Clin. Oncol. 2012. –V.30, №28. –P.3452-3459 101. Juweid M.E., Stroobants S., Hoekstra O.S. et al. Use of positron emission tomography for response assessment of lymphoma: consensus of the imaging subcommittee of international harmonization project in lymphoma. //Journal of Clinical Oncology. -2007. –V.25, №5. –P.571-578 102. Kaplan E., Meyer P. Nonparametric estimation from incomplete observations.//J. Am. Stat. Assoc. -1958. –V.53. –P.457-481 103. Keane C, Gill D, Vari F, Cross D, Griffiths L, Gandhi M. CD4(+) tumor infiltrating lymphocytes are prognostic and independent of R-IPI in patients with DLBCL receiving R-CHOP chemo-immunotherapy// Am J Hematol. 2013. –V.88, №4. –P.273-276 104. Khan A.B., Barrington S.F., Mikhael L.G. et al. PET-CT staging of DLBCL accurately identifies and provides new insight into the clinical significance of bone marrow involvement.// Blood. -2013. –V.122. –P.61-67 105. Lasota J., Hyjek E., Koo S.H. et al. Cytokeratin-positive large-cell lymphomas of B-cell lineage. A study of five phenotypically unusual cases verified by polymerase chain reaction.//Am.J.Surg. Pathol. -1996. –V.20. –P.346354 106. Le Gouill S., Talmant P., Touzeau C. et al. The clinical presentation and prognosis of diffuse large B-cell lymphoma with t(14;18) and 8q24/cMYC rearrangement.//Haematologica. -2007. –V.92. –P.1335-1342 107. Lenz G., Wright G., Dave S.S. et al., Stromal gene signatures in large B- cekk lymphomas.//New England Journal of Medicine. -2008. –V.359, №22. – P.2313-2323 108. Li YJ, Li ZM, Rao HL, Xia Y, Huang HQ, Xia ZJ, Li S, Li WY, Jiang WQ. CD20-negative de novo diffuse large B-cell lymphoma in HIV-negative patients: a matched case-control analysis in a single institution //J Transl Med. 2012 May 3;10:84 109. Lin P., Medeiros L.J., High grade B-cell lymphoma/leukemia associated with t(14;18) and 8q24/MYC rearrangement: a nejplasm jf germinal center immunophenotype with poor prognosis. //Hematologica. -2007. –V.92, №10. – P.1297-1301. 110. Linderoth J, Jerkeman M, Cavallin-Stahl E, Kvaloy S, Torlakovic E. Immunohistochemical expression of CD23 and CD40 may identify prognostically favorable subgroups of diffuse large B-cell lymphoma: a Nordic Lymphoma Group Study. Clin Cancer Res. 2003;9:722-728. 111. Lister T.A., Crowther D., Sutcliffe S.B. et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: cotswolds meeting. //J. Clin. Oncology. -1989. –V.7, №11. -1630-1636 112. Lossos I.S., Morgensztern D. Prognostic biomarkers in diffuse large B-cell lymphoma //J. Clin. Oncol. -2006. –V.24. –P.995-1007 113. Lund F., Solvason N., Grimaldi J. et al. //Immunol. Today. -1999. –V.16. – P.499 114. Maes B., Anastasopoulou A., Kluin-Nelemans J.C. et al. EORTC lymphoma group. Among diffuse large B-cell lymphomas, T-cell rich/histiocyterich BCL and CD30+ anaplastic B-cell subtypes exhibit distinct clinical features. //Ann. Oncol. -2001. –V.12, №6. –P.853-858 115. Maeshima AM, Taniguchi H, Fukuhara S, Morikawa N, Munakata W, Maruyama D, Kim SW, Watanabe T, Kobayashi Y, Tobinai K, Tsuda H. Followup data of 10 patients with B-cell non-Hodgkin lymphoma with a CD20-negative phenotypic change after rituximab-containing therapy //Am J Surg Pathol. 2013 Apr;37(4):563-70. 116. Malavasi F., Deaglio S., Damle R. et al. CD38 and chronic lymphocytic leukemia: a decade later. //Blood. -2011. –V.118. –P.3470-3478 117. Mantei K., Wood B. Flow cytometric evaluation of CD38 expression assists in distinguishing follicular hyperplasia from follicular lymphoma.//Cytometry Part B (Clinical Cytometry). -2009. –V.76B. –P.315-320 118. Marinaccio C., Ingravallo G., Gaudio F., Perrone T., Nico B., Maoirano E., Specchia G., Ribatti D. Microvascular density, CD68 and tryptase expression in human Diffuse Large B-Cell Lymphoma //Leuk Res. 2014 Sep 22. pii: S01452126(14)00284-7. doi: 10.1016/j.leukres.2014.09.007. [Epub ahead of print]. 119. Martelli M., Ferreri A.J.M., Agostinelli C. et al. Diffuse large B-cell lymphoma.//Critical reviews in oncology/hematology. -2013. –V.87. –P.146-171 120. McClintock S, Perkins SL, Cleveland RP, et al. Immunohistochemical expression pattern of germinal center and activation B-cell markers correlates with prognosis in diffuse large B-cell lymphoma [abstract]. Mod Pathol. 2003;16:244a 121. McClure RF, Macon MR, Remstein ED, Dewald GW, Habermann TM, Kurtin PJ. Prognostic markers in adult, de novo, diffuse large B-cell lymphoma; CD10, bcl-6, bcl-2, and BCL2/IGH [abstract]. Mod Pathol. 2003;16:244a. 122. Medeiros L.J., Elenitoba-Johnson K.S. Anaplastic lymphoma.//Am. J. Clin. Pathol. -2007. –V.127, №5. –P.707-722 large cell 123. Meyer P.N., Fu K., Greiner T.C. et al. Immunohistochemical methods for predictive cell of origin and survival in patients with diffuse large B-cell lymphoma treated with rituximab.//J. Clin. Oncol. -2011. –V.29, №2. –P.200-207 124. Miller T.P., Lippman S.M., Spier C.M. et al. HLA-DR (Ia) immune phenotype predicts outcome for patients with diffuse large cell lymphoma.//J.Clin. Invest. -1988. –V.82. –P.370-372 125. Miller T.P., Grogan T.M., Dahlberg S. et al. Prognostic significance of the Ki-67 associated proliferative antigen in aggressive non-Hodgkin’s lymohomas: a prospective Southwest Oncology Group trial.//Blood. -1994. –V.83. –P. 14601466 126. Mir S.S., Richter B.W., Duckett C.S. Differential effects of CD30 activation in anaplastic large cell lymphoma and Hodgkin disease cells.//Blood. 2000. –V.96, №13. –P.4307-4312. 127. Moscowitz C.H., Zelenetz A.D., Kewalramani T. et al. Cell origin, germanal center versus nongerminal center, determinate by immunohistochemistry on tissue microarray , does not correlates with outcome in patients with relapsed and refractory DLBCL //Blood. -2005. –V. 106. –P.3383-3385 128. Mounier N., Briere J., Gisselbrecht C. et al. Rituximab plus CHOP (R- CHOP) overcomes bcl-2-associated resistance to chemotherapy in elderly patients with diffuse large B-cell lymphoma (DLBCL) //Blood. -2003. –V.101. –P.42794284 129. Mounier N., Briere J., Gisselbrecht C. et al. Estimating the impact of rituximab on bcl-2-associated resistance to CHOP in elderly patients with diffuse large B-cell lymphoma //Hematologica. -2006. –V.91. –P.715-716 130. Muris J.J., Cillessen S.A., Vos W. et al. Immunohistochemical profiling of caspase signaling pathways predicts clinical response to chemotherapy in primary nodal diffuse lagre B-cell lymphomas //Blood. -2005. –V.105. –P.2916-2923 131. Muris J.J., Meijer C.J., Vos W. et al. Immunohistochemical profiling based Bcl-2, CD10 and MUM1 expression improves risk stratifcation in patients with primary nodal diffuse large B-cell lymphoma.//J.Pathol. -2006. –V.208, №5. – P.714-723 132. Nakamaki T, Fukuchi K, Nakashima H, Ariizumi H, Maeda T, Saito B, Yanagisawa K, Tomoyasu S, Homma M, Shiozawa E, Yamochi-Onizuka T, Ota H. //Eur J Haematol. 2012 Oct;89(4):350-5 133. Nam SJ, Go H, Paik JH, Kim TM, Heo DS, Kim CW, Jeon YK. An increase of M2 macrophages predicts poor prognosis in patients with diffuse large B-cell lymphoma treated with rituximab, cyclophosphamide, doxorubicin, vincristine and prednisone// Leuk Lymphoma. -2014. –V.55, №11. –P.2466-2476. 134. Nath P., Bhattacharya S., Bharadwaj R. ALK-positive diffuse large B-cell lymphoma – unusual subtype of diffuse large B-cell lymphoma (DLBCL).//Lymphoma Chronic lymphocytic leuk. -2010. –V.2. –P.1-5 135. Natkunam Y., Farinha P., His E.D. et al. Lmo2 protein expression predicts survival in patients with diffuse large B-cell lymphoma treated with antracyclinebased chemotherapy with and without rituximab// J.Clin. Oncol. -2008. –V.26. – P.447-454 136. Noorduyn L.A., de Bruin P.C., van Heerde P. et al. Relation of CD30 expression to survival and morphology in large cell B-cell lymphomas.// J.Clin. Pathol. -1994. –V.47,№1. –P.33-37 137. Nyman H., Adde M., Kajalainen-Lindsberg M.L. et al. Prognostic impact of immunohistochemically defined germinal center phenotype in diffuse large Bcell lymphoma patients treated with immunochemotherapy. //Blood. -2007. – V.109. –P.4930-4935 138. Ohshima K, Kawasaki C, Muta H, et al. CD10 and Bcl10 expression in diffuse large B-cell lymphoma: CD10 is a marker of improved prognosis.Histopathology. 2001;39:156-162. 139. Ott G., Ziepert M., Klapper W. et al. Immunoblastic morphology but not the immunohistochemical GCB/nonGCB classifier predicts outcome in diffuse large B-cell lymphoma in the RICOVER-60 trial of the DSHNHL. //Blood. -2010. –V.116, №23. –P.4916-4925 140. Paone G., Itti E., Haioun C. et al. Bone marrow involvement in diffuse large B-cell lymphoma: correlation between FDG-PET uptake and type of cellular infiltrate. //Eur. J. Nucl. Med. Mol. Imaging. -2009. –V.36. –P.745-750. 141. Patten P.E.M., Buggins A.G.S., Richards J. et al. CD38 expression in chronic lymphocytic leukemia is regulated by the tumor microenvironment.//Blood. –V.111. –P.5173-5181 142. Pelosi E., Penna D., Douroukas A. et al. Bone marrow disease detection with FDG-PET/CT and bone marrow biopsy during the staging of malignant lymphoma: results from a large multicentre study.// Q. J. Nucl. Med. Mol. Imaging. -2011. –V.55. –P.469-475 143. Perry A.M., Mitrowic Z., Chan W.C. Biological prognostic markers in diffuse large B-cell lymphoma. //Cancer contr. -2012. –V.19, №3. –P.214-226 144. Pfister M., Ogilvie A., Silva C. et al. //Eur. J.Biochem. -2001. –V.268. – P.5601-5608 145. Pfreundschuh M., Trumper L., Osterborg A. et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patientswith good prognosis diffuse large B-cell lymphoma: a randomized controlled trial by the MabThera International trial (MInT) Group. // lancet Oncol. -2006. –V.7. –P.379-391 146. Pro B., Advani R., Brice P. et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large B-cell lymphoma: results of a phase II study. //J. Clin. Oncol. -2012. –V. 30,№18. –P.2190-2196 147. Rajnai H, Heyning FH, Koens L, Sebestyén A, Andrikovics H, Hogendoorn PC, Matolcsy A, Szepesi Á. The density of CD8+ T-cell infiltration and expression of BCL2 predicts outcome of primary diffuse large B-cell lymphoma of bone// Virchows Arch. -2014. –V. 464, №2. –P.229-239 148. Recher C., Coiffier B., Haioun C. et al. Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP for the treatment of diffuse large B-cell lymphoma (LNH03-2B): an open randomized phase 3 trial.//Lancet. -2011. –V.378, №9806. –P.1858-1867 149. Riemersma S.A., Jordanova E.S., Schop R.F. et al. Extensive genetic alterations of HLA region including homozygous deletions of of HLA class II genes in B-cell lymphomas arising in immunepriviliged sites. //Blood. -2000. – V.96. –P.3569-3577 150. Rimsza L.M., Farinha P., Fuchs D.A. et al. HLA-DR protein status predicts survival in patients with diffuse large B-cell lymphoma treated on the MACOP-B chemotherapy regimen. //Leuk. Lymphoma. -2007. –V.48. -542-546 151. Rimsza L.M., Roberts R.A., Miller T.P. et al. Loss of MHC class II gene and protein expression in diffuse large B-cell lymphoma is related to decreased tumor immunosurveillance and poor patient survival regardless of other prognostic factors: a follow-up study from the Leukemia and Lymphoma Molecular Profiling Project.//Blood. -2004. –V.103. –P.4251-4258 152. Robertson .E., Redman J.R., Butler J.J. et al. Discordant bone marrow involvement in diffuse large cell lymphoma: a distinct clinical-pathologic entity associated with a continuous risk of relapse.//J.clin.Oncol. -1991. –V.9. –P.236242 153. Rosenwald A., Wright G., Chan W.C. et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large B-cell lymphoma. //New England Journa of medicine. -2002. –V.346. –P.1937-1947 154. Rybski J.A., Spier C.M., Miller T.P. et al. Prediction of outcome in diffuse large cell lymphoma by the mayor histocompatibility complex class I (HLA-A,-B, -C) and class II (HLA-DR, -DP, -DQ) phenotype. Leuk. Lymphoma. -1991. –V.6. –P.31-38 155. Saez A.I., Saez A.J., Artiga M.j. et al. Building an outcome predictor model for diffuse large B-cell lymphoma.// am. J. Pathol. -2002. –V.164. –P.12211226 156. Salles G., de Jong D., Xie W. et al. Prognostic significance of immunohistochemical biomarkers in diffuse large B-cell lymphoma; a study from the Lunenburg lymphoma biomarker consortium. //Blood. -2011. –V.117. – P.7070-7078 157. Sandoval-Montes C., Santos-Argumedo L. CD38 is expressed selectively during the activation of a subset of mature T-cells with reduced proliferation but improved potential to produce cytokines.//J.Leukocyte Biology. -2005. –V.77. – P.513-521 158. Savage K.J., Harris N.L., Vose J.M. et al. International peripheral T-cell lymphoma project. ALK- anaplastic large cell lymphoma is clinically and immunophenotylically different from both ALK+ ALCL and peripheral T-cell lymphoma not otherwise specified: report from the international peripheral T-cell lymphoma project.//Blood. -2008. –V.111,№12. –P.5496-5504. 159. Savage K.J., Al-Raihi N., Voss N. et al. Favorable outcome of primary mediastinal large B-cell lymphoma in a single institution: The British Columbia experience. //Ann. Oncol. -2006. –V.17, №1. -123-130 160. Schuurman H.J., Huppes W., Verdonck L.F. et al. Immunophenotyping of non-Hodgkin’s lymphoma. Correlation with relapse-free survival.//Am.J.Pathol. 1988. –V.131. –P.102-111 161. Seam P., Juweid M.E., Cheson B.D. The role of FDG-PET scans in patients with lymphoma. //Blood. – 2007. –V.110, №10. –P.3507-3516 162. Sehn L.H., Berry B., Chanabhai M. et al. The revised international prognostic index (R-IPI) is better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. //Blood. -2007. –V.109, №5. –P.1857-1861 163. Shipp M.A., Harrington D.P., Anderson J.R. et al. A predictive model for aggressive non-Hodgkin’s lymphoma. // New Engl. J. Med. -1993. –V.329. – P.987-994 164. Shipp M.A., Ross K.N., Tamayo P. et al. Diffuse large B-cell lymphoma outcome prediction by gene-expression profiling and supervised machine learning.//Nature Medicine. -2002. –V.8, №1. –P.68-74 165. Slack J.W., Steidl C., Sehn L.N., Gascone R.D. CD30 expression in de novo diffuse large B-cell lymphoma: a population based study from British Columbia. //Br. J. Haematol. – 2014, Aug. 19. Doi:10.1111/bjh.13085 166. Spier C.M., Grogan T.M., Lippman S.M. et al. The Aberrancy ofImmunophenotype and Immunoglobulin Status as Indicators ofPrognosis in B Cell Diffuse Large Cell Lymphoma//American Journal of Pathology. -1988. -Vol. 133, No. 1. –P.118-126 167. Stein H., Warnke R.A., Chan W.C. et al. Diffuse large B-cell lymphoma not otherwise specified. In: WHO classification of tumours of haematopoietic and lymphoid tissues (Swerdlow S.H., Campo E. Harris N.L. et al. –Eds). –WHO Press. -2008. –P.233-237 168. Suzuki Y, Yoshida T, Wang G, Togano T, Miyamoto S, Miyazaki K, Iwabuchi K, Nakayama M, Horie R, Niitsu N, Sato Y, Nakamura N. Association of CD20 levels with clinicopathological parameters and its prognostic significance for patients with DLBCL //Ann Hematol. 2012 Jul;91(7):997-1005. 169. Tagawa H., Suguro M., Tsuzuki S. et al. Comparison of genome profiles for identification of distinct subgroups of diffuse large B-cell lymphoma. //Blood. 2005. –V.106. –P.17170-1777 170. Takeshita M, Iwashita A, Kurihara K, et al. Histologic and immunohistologic findings and prognosis of 40 cases of gastric large B-cell lymphoma. Am J Surg athol. 2000;24:1641-1649. 171. Teruya-Feldstein J, Chiao E, Filippa DA, Lin O, Comenzo R, Coleman M, Portlock C, Noy A. CD20-negative large-cell lymphoma with plasmablastic features: a clinically heterogenous spectrum in both HIV-positive and -negative patients //Ann Oncol. 2004 Nov;15(11):1673-9. 172. Thieblemont C., Briere J., Mounier N. et al. The germinal center/activated B-cell subclassification has a prognostic impact for response to salvage therapy in relapsed/refractory diffuse large B-cell lymphoma: a bio-CORAL study. //J.Clin.oncol. -2011. –V.29, №31. –P.4079-4087 173. Trumper L., Renner C., Nahler M. et al. Intensification of CHOEP regimen for high grade non-Hodgkin’s lymphoma by G-CSF – Feasibility of a 14-day regimen. //Oncologie. -1994. –V.17. –P.69-71 174. Tzankov A, Meier C, Hirschmann P et al. Correlation of high numbers of intratumoral FOXP3+ regulatory T cells with improved survival in germinal center-like diffuse large B-cell lymphoma, follicular lymphoma and classical Hodgkin’s lymphoma. Haematologica. 2008;93(2):193-200. 175. Uherova P, Ross CW, Schnitzer B, Singleton TP, Finn WG. The clinical significance of CD10 antigen expression in diffuse large B-cell lymphoma Am J Clin Pathol. 2001;115:582-588. 176. Van Dongen J.J.M., Lhermitte L., Bottcher S. et al. EuroFlow antibody panels for standardized n-dimentional flow cytometric immunophenotyping of normal, reactive and malignant leykocytes. /Leukemia. -2012. –V.26. –P.19081975 177. Van Imhoff G.W., Boerma E.J., van der H.B. et al. Prognostic impact of germinal center-associated proteins and chromosomal breakpoints in poor-risk large B-cell lymphoma.//J. Clin. Oncol. -2006. –V.24. –P.4135-4142 178. Veelken H., Vik D.S., Schulte M.J. et al. Immunophenotype as prognostic factor for diffuse large B-cell lymphoma in patients undergoing clinical riskadpated therapy. //Ann. Oncol. -2007. –V.18. –P.931-939 179. Venugopal P, Leslie WT, O'Brien T, Gregory SA. CD20-negative relapse after (131)I-anti-CD20 therapy //J Clin Oncol. 1999 Nov;17(11):3692-3 180. Visco C., Li Y., Xu-Monette Z.Y. et al. Comprehensive gene expression profiling and immunohistochemical studies support application of immunophenotyping algorithm for molrcular subtype classification in diffuse large B-cell lymphoma: a report from the international DLBCL Rituximab-CHOP Consortium program study.//Leukemia. -2012. –V.26, №9. –P.2103-2113 181. Winter J.N., Weller E.A., Horning S.J. et al. Prognostic significance of Bcl- 6 protein expression in DLBCL treated with CHOP or R-CHOP: a prospective correlative study. //Blood. -2006. –V.107. –P.4207-4213 182. Wright C.W., Rumble J.M., Duckett C.S. Cd30 activates both the canonical and alternative NF-kappaB pathways in anaplastic large cell lymphoma cells. //J. Biol. Chem. -2007. –V.282, №14. –P.10252-10262 183. Xu Y, McKenna RW, Molberg KH, Kroft SH. Clinicopathologic analysis of CD10_ and CD10_ diffuse large B-cell lymphoma: identification of a high-risk subset with coexpression of CD10 and bcl-2. Am J Clin Pathol. 2001;116:183190. 184. Younes A., Barlett N.L., Leonard J.P. et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. //N.Engl. J. Med. -2010. –V.363, №19. – P.1812-1821. 185. Zhang A., Ohshima K., Sato K. et al. Prognostic clinicopathologic factors , including immunologic expression in diffuse large B-cell lymphomas. //Pathol. Int. -1999. –V.49. –P.1043-1052 186. Ziepert M., Hasenclever D., Kuhnt E. et al. Standard international prognostic index remains a valid predictor of outcome for patients with aggressive CD20+ B-cell lymphoma in the rituximab era. //Journal of clinical oncology. - 2010. –V.28. –P.2373-2380. [Erratum in Journal of clinical oncology . -2011. – V.29(6). –P.779] 187. Ziepert M., Hasenclever D., Kuhnt E. et al. Standard international prognostic index remains a valid predictor of outcome for patients with aggressive CD20+ B-cel lymphoma in rituximab era. //J.Clin. Oncol. -2010. –V.28. –P.23732380 188. Zu Y., Steinberg S.M., Campo E. et al. Validation of tissue microarray immunohistochemistry staining and interpretation in diffuse large B-cell lymphoma. //Leuk. Lymphoma. -2005. -.V.46. –P.693-701 189. Zucca E., Conconi A., Mughal T.I. et al. Patterns of outcome and prognostic factors in primary large cell lymphoma of testis in a survey by the International Extranodal Lymphoma Study Group. //Journal of Clinical Oncology. -2003. –V.21, №1. –P.20-27


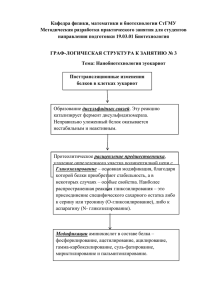


![УДК 616.155.392.2-036.12]-07 ДИНАМИКА ИЗМЕНЕНИЙ](http://s1.studylib.ru/store/data/002674618_1-eee889dfcdf364de84706837a80716db-300x300.png)