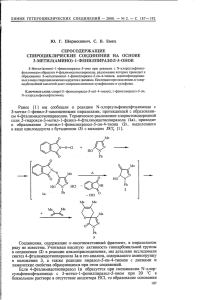
Сдвиг этого сигнала зависит от того, какая из аминогрупп
advertisement

ХИМИЯ ГЕТЕРОЦИСЛИЧЕСКИХ СОЕДИНЕНИЙ . - 1999. - N4 5. - C. 696-700
А . И . Гypиовский, Н. Н. Тонких, M. S. Петрова, А. Я. Страков
3 -АЦИЛ- I, 5-БЕНЗОДУiАЗЕПИНЫ B РЕАКЦИЯХ
5,5-ДИMETИЛ-2- ФОРМИЛДИКЛОГЕКСАН-I,3- ДИОНА
C HEKOTOPbIMH 1,2-ДИАМИНОБЕНЗОЛАМИ
В реакциях 5,5-димeтил-2-формилциклогексан -1, 3-диoнa c 4-мeтил -, 4-бeнзoил- и 4-нитро-1,2-диaминoбeнзoлaми получены соответственно замещенные 2-(2аминo-4-метилфениламинометилен )-, 2- (2- аиино -5- бензоилфениламино -
метилен)- и 2- (2-амино-5-иитрофеяиламинометилен )-5,5-диметилциклогексан1,3-дионы , к о т орые при действии соляной кислоты циклизуются в гидрохлориды
7 метил , 8 бeнзo ил , 8 нитpo З ,3 дим eтил 2,3,4,5 т e тpa гидpo l Н - ди бензо [Ь, е][1,4] диазепинонов . в гидролитических условиях соли 3,3,7- тpи-
-
-
-
-
-
-
-
-
метил 2,3,4,5 тетрагидро l Н дибензо [Ь, е] [1,4] диазегi инона и 3,3 - диметил 3,4,5 -тетpaгидpо-l Н-дибензо [Ь, е] [1,4] диазепинона расщепляются по связи2,
C(n)-N(io) c образованием ранее не известньпс N (2 аминофенил)- и N (2 aминo
-
-
-
-
-
-
-
-
-
5 метилфенил) замещенных 5,5-димeтил-3-aминo-2-фopмилциклoгeкc-2-eнoнoв.
Расщеплениегидрохлоридов 8-бекзоил-,8-нитpo-3,3-димeтил-2,3,4,5-тeтpaгидpo-
1 H-дибензо [Ь, е] [1,4] диaзепинонов происходит по связи C-N(5) и ведет к исходным
енаминонам.
Продолжая исследования по синтезу 3-aцил -l,5- циазепинов в реакциях
2-ацилциклан -1,3-диoнoв c 1 ,2 -диаминами [1, 2], мы изучили взаимодейст -
вие 5,5-димeтил-2-формилциклогексан -1,3- диона (I) c 4-метил- (II6),
4-бeнзoил (IIв) и 4-нитpo-1,2- диаминобензолами (IIг). Как было показано в
[2], формилцикландион I c o-фехилендиамином IIa реагирует в мольном
отношении 1 : 1 c образованием енаминона IIIa. Наличие в исходных
диаминах II6- г двух неэквивалентных аминогрупп предполагает возможность образования в реакциях двух изомеров .
B условиях обычного для подобных реакций эксперимента (сметпивание
исходных веществ c последующей
горячих этанольных растворов
перекристaллизацией полученного продукта) только реакция c диамином IIr
завершается образованием одного изомера - 2- (2 -амино -5 -зшТрофени7iаминометилен) -5,5-диметилдиклогексан -1 , З-диона IIIr. Реакции c диаминами
II6, в ведут к смесям, состоящим из основного продукта - енаминонов III б
или IIIв , a
также
продуктам
реакции
по
второй
аминогруппе
-
2-(2-амино-5-метилфениламинометилен)-5,5-диметилциклогексан-1,3-диону и 2-(2-aминo-4-бензоилфениламинометилен )-5,5-диметилциклогексан 1,3- диону соответственно. Индивидуальные изомеры III6, в удалось получить
проводя реакции I c диаминами II6,r при -20 ' С и осаждением продуктов
водным раствором хлорида калия.
Строение полученных индивидуальных соединений установлено на
основе анализа спектральных данных. Как было показано в [1], y
соединений вида III наиболее информативным в спектрах ПМР является
химический сдвиг сигнала , принадлежащего ароматическому протонy,
находящемуся в мeта-положeнии по отношению к заместителю (R или R 1 ).
Сдвиг этого сигнала зависит от того, какая из аминогрупп диамина II
вступила в реакцию c I. Если прореагировала аминогруппа , находящаяся в
мета-положении по отношению к заместителю (R или R 1 ), то сигнал этого
протона смещен в сторону сильного поля по отношению к сигналам других
ароматических протонов и наблюдается в районе б ,84... б ,86 м. д. В
противном случае сигнал смещается в сторону слабого поля (7,27 м . д .) и
существенно
не
отличается
от
сдвигов
сигналов
остальных
протонов
ароматического кольца. Наблюдаемые сдвиги сигналов y соединений IIIв ,r
696
6, 79 и 6, 80 м. д. однозначно указывают , что реакция I c диаминобензолами
IIв ,r прошла по 3-аминогруппе . B случае енаминона III6 в реакцию c I
вступила 4-aминoгpyппa диaмина 116 (характерный сигнал появляется при
7,10 м . д .) . Такой ход реакций хорошо согласуется c приближенной оценкой
реакционной способности аминогрупп y соединений 116— г .
0,
*
'н
3
R
ц
NH2
i
—►
+
1
о
R1
in
R
НС1
I
н20
IVB, Г
IIaR=H,6R= Ме, HR=COPh,rR=NO 2;
Iц ,IVaR= R1 = Н ,6R= Н , R1 = Me, в R=COPh,R1 =H, г R= NO2,R1
У , VIa
Н
R1 = Н, 6R= Н,
Ме, в R= Ме,
=H;
ИК спектры енаминохов III6— г информативны , в первую очередь ,
благодаря наличию в молекулах свободной аминогруппы (две интенсивные
полосы поглощения в районе 3428...3348 см 1 ) и хелатизированного NH...O=
протона (3256...3180 см 1
).
Обработка енаминонов III6— г соляной кислотой ведет к образованию
темно-синих циазепиновых солей IV6—r. B спектре ПМР помимо сигналов
ароматических протонов и протонов диметипттикпогексанонового кольца
появляются сигналы двух протонов N+H. B ИК спектрах солей IV6— г
пропадают макcимумы поглощения , обусловленные наличием свободной
аминогруппы и хелатизированного пpотона , a вместо них наблюдается
широкий максимум в районе 2728...2688 см 1 , характерный для аммониевых
солей . B УФ спектре появляется максимум абсорбциии 513,0...517,3 нм ,
положение которого слабо зависит от структуры IV.
Как было установлено нами ранее [1], диазепиновы е соли, подобные ГУ ,
но имеющие метильную группу в 11 положении, легко гидролизуются по
связи С (11) N(1 р) c образовaнием N-зaмeщeнныx З-амино-2-ацетил-5,5-диметилциклогекс-2- енонов . B то же время y описываемых здесь солей VIв—г,
—
697
имеющих в бензольном кольце электроноакцепторный заместитель ,
гидрглитическое расщепление диазепикового цикла происходит и по связи
C-N(5) и ведет к исходным циаминам IIIв ,r. Гидролиз проходит легко уже
при непродолжительном кипячении в водных растворителях.
Гидрохлорид VI6 и известная [3] соль VIa оказались в этих условиях
устойчивыми , но расщеплялись под действием NаНС03 c раскрытием цикла
по связи C <ii> -N (10). Выделить соединения Va,6 не удалось . Полученные в
реакциях в разных температурных условиях (20 ' С и -20 ° С) продукты не
являлись индивидуальными веществами. Полагаем , что соединения V
существуют в виде смеси изомерных форм . При этом возможны как
циклические , так и полимерные структуры , образующиеся при взаимодействии свободных формильной и aминогрyпп.
Если на V подействовать эквимолярным количеством 2- формилин пан
, -
1,3-диона, то можно получить производные по свободной aминогруппе 5,5-диметил-3-оксо-2-формилциклогексениламино -2- (1, 3- диоксоиндан-2илиденметиламино ) бензол (VIa) и 3 (5,5 диметил 3 оксо 2 - формялдиклогексенил) амино -4- (1, 3- диоксоиндан-2-илиденметиламино) толуол
(VI6) .
-
-
-
-
-
Получить VIa,6 можно и не выделяя промежуточные соединения V, a
последовательно обработав диазепиновые соли IVa,6 растворами гидрокарбо -
ната натрия и 2-формил-l,3- индандиона . В спектрах ПМР соединений VIa,6
отчетливо видны сигналы двух различных типов протонов ТН. Сигналы
первого типа (11,22 и 10,97 м. д .) появляются как дублет (J = 13 Гц) и
принадлежат
транс-фиксированному
фрагменту
=CH-NH-.
Сигналы
второго типа появляются как синглет (13,08, 12,83 м. д.) и принадлежат
хелатизированным NH...0= протонам . Сигналы протонов формильной
группы имеют характерный сдвиг 10,22, 10,11 м. д. Связи N-H в
соединениях VIa,6 не вызывают в ИК спектрах заметного поглощения в
районе 3600...3200 см .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК спектры зарегистрированы на приборе Specord-75 для суспензий в вазелиновом масле и
гексахлорбутадиене . частоты валентных колебаний связей С-Н в районе 3050...2800 см 1 не
приведены . Спектры ПMP полученных соединений в ДМСО - Д 6, СДС1з или в смеси этих растворителей записаны на спектрометрах Вгикег WH-90/DS и Bruker АМ-360 на частотах 90 и 360 МГц
при 303К. Химические сдвиги приведены в шкале по отношению к ТМС. УФ спектры сняты на
спектрофотометpе 5ресогд М -40 для 10-5 М концентраций.
B работе иcпользовaны диаминобензольт фирм F1uka (4- бензоил- и 4 -метил -1 ,2 -диамхнобензолы) и Асгов (1 ,2-диамино -4-нитробензол).
2- (2 -Амино-4- метилфеяиламивометилен ) 5,5-диметилци iсюгексав-1,3 - дион (шб). Смешивают охлажденные до -20 °C этанольные растворы 0,72 г (20 мл) 3,4-диаминотолуола IIa и
1,00 г (6,00 ммоль) 5,5-диметил-2- формилциклогександиона I, выдерживают при этой температуре 1,5 ч. Затем добавляют 80 мл 5% водного раствора КС1. Выпaвший осадок отфильтровывают ,
промывают на фильтре водой (2 х 15 мл) , 15% водным раствором этанола (2 Х 10 мл) и сушат 4 ч
при 80 °C, a затем 24 ч в вакуумном эксикаторе над P205. Выход 1,10 г (68%). Тпп 148...150 °C.
ИК спектp: 1661, 1613, 1583, 1575, 1560, 1513, 3400, 3348, 3256 см 1. Спектр ПМР (СДС1 з): 1,08
-
(6Н, c, 2СНз); 2,26 (3Н, c, СНз); 2,39 (2Н, c, СНг);2,45 (2H, c, СНг); 3,.63 (2Н, уш. c, NНг); 6,62
(1 Н, д, J =1,3 Гц, 3'-H) ; 6,66 (1 Н, д. д, Т = 8,4,. и 1,3 Гц , 5'-H) ; 7,10. (1 Н, д, Т = 8,4 Гц, 6' -Н) ; 8,49
(1 Н, д, J=13,6 Гц, =СН-); 12,85 м. д. (1 Н, д, Т =13,6 Гц , NН). Найдено , : С 70,89; Н 7,20;
СиНгоNгОг. Вычислено, %: С 70,56; Н 7,40; N 10,28.
N10,67.
2-(2-Амино-5- бензоилфениламикометилеи )-5,5-диметилциклогексан-1,3- дион (IIYж ).
Смешивают охлажденные до -20 ° С этанольнь е растворы 1,25 г (5,90 ммоль) 3,4-диаминобензофенона Пв (15 мл) и 0,99 г (5,90 ммоль) 5,5-диметил-2- формилциклогександиона I (20 мл),
выдерживают при этой температуре 1,5 ч. Затем добавляют 35 мл 5%о водного раствора КС1 и
оставляют при -20 ° С до вьшадения маcляниcтом осадка, который co временем затвердевает .
Осадок отделяют , промьшают водой (2 Х 15 мл), 15 водным раствором этанола (2 х 10 мл) и
сушат сначала 4 ч.при 80 ° С , a затем 24 ч в вакуумном эксикаторе над, Рг 05. Выход 1,84 г (86%).
698
Тпл 167...170 ° С . ИК спектр : 1662, 1649, 1600, 1578, 1570, 1524, 3408, 3324, 3225 c м1 . Спектр
ПМР ( СДС1з ):1,01 (6 Н , c, 2 СНз ); 2,32 (2H, c, СН2); 2,41 (2 Н , c, СН2); 6.15 (2 Н, уш . c, NH2); 6,89
(1H, д , J= 8,5 Гц , 3'- Н); 7,48 (1 Н , д . д , J= 8,5 и 2,1 Гц , 4'-H); 7,50...7,90 (6 Н , м , СЬН5+ 6'-H);
8,25 (1 Н , д , J=13,2 Гц , = СН-); 12,39 м . д . (1 Н , д , 3=13,2 Гц , NH) _ Найдено , %_ C 73,00; H 6,52;
N 7,43. С22 Н22N20 з. Вычислено , %: C 72,91; H 6,12; N 7,73.
2 - (2 -Амиио-5- нитрофениламинометилен) -5,5- диметилцинлогексан .-1,3 -дион (ПIг). Сливают подогpетые до 78 ° С спиртовые растворы 1,00 г (6,00 ммоль ) 5,5-диметил-2-формилциклогексан-1,3-диона I (10 мл ) и 0,91 г (6,00 ммоль) 1,2-диaмино-4-нитробензола . Реакционнyю
смесь выдерживают 24 ч при 20 °С . Выпавший осадок (1,40 г) отфильтровьпаают и перекристал-
лизовьпаают из водного диоксана. Выход 1,10 г (61%). Тпл 176...178 ° С. Спектр JLMP ( СДС1з +
ДМСО -D6): 1,01 (6Н , c, 2СНз); 2,44 (2Н , c, СН2); 2,49 (2Н, c, СН2); 4,50 (2Н , уш. c, NH2); 6,82
(1 Н, д , J= 9,1 Гц , 3'-H); 8 ,02 (1H, д . д , J= 9,1 и 2,6 Гц , 4'-H); 8,14 (1H, д , Т =2,6 Гц , 6'- Н); 8,50
(1 Н, д , Т =12,3 Гц, =СН-); 12,83 м. д . (1 Н , д, Т =12,3 Гц , NH). Найдено , %: C 59,80; H 5,65;
N 13,29. С 15Н 17N304. Вычислено , %: C 59,40; H 5,63; N 13,85.
Гидрохлорид 3,3,7-триметил -2,3,4,5-тетрагидро -l Н-дибензо [Ь, е][1,4] диазепин-1-она
(IV6). К 1,00 г (3,67 ммоль) мелко измельченного 2-(2- амино-4-метилфениламинометилен )-5,5диметилциклогексаи-1,3-диона Ш6 приливают смесь 5 мл этaнола и 5 мл концентрироваиной
соляной кислоты . Нагревают до кипения и оставпвпот на 48 ч при +5...+8° С . Выпаикпий осадок
отфильтровывaют , промывают на фильтре хлороформом . Фильтрат отгoняют в вакууме до трети
объема . Полученные продукты объединяют и сушат сначала при 80°C, затем 24 ч в вакуyмном
эксикаторе над Р 205• Общий выход 0,50 г (47%). Ton 280...281 ,5 ° С. ИК спектр : 1676, 1654, 1610,
1588, 1560, 2728 см 1 . Спектр ПМР (ДМСO-D6): 1,00 (6 Н , c, 2СНз); 2,10 ( ЗН, c, СНз); 2,17 (2Н,
c, СН 2); 2,38 (2 Н , c, СН2); 6,51...7,18 (4H, м, аром .+- СН=); 10,7 (1H, NH); 11,9 м _ д . (1H, NH).
УФ спектр (этанол + НС1, рН 1), )nuх (1g s): 279,8 (4,60), 344,7 (3,31), 513,0 ни (2,80). Найдено ,
%: C 66,36; H 6,29; N 9,28; Cl 12,20. СIьН 1в N г
НС1. Вычислено , % C 66,40; H 6,59; N 9,63;
Cl 12,19.
Гидрохлорид 8-беизоил -3,3-диметил -2,3,4,5-тетрaгидpо -l Н-дибензо [Ь, е ] [1,4] диазепин1-она ('Ув ) и гидрохлорид 3,3- диметил-8-нитpо -2,3,4,5- тетрагидро -l Н-дибензо [Ь, е] [1,4] ди-
азепин-1-она ('Уг). Мелко измельчают 1,00 г исходного енaминона IIIs,r и суспендируют в смеси
15 мл зтанола и 10 мл концентpиpовaнной соляной кислоты. Реaкционнyю смесь нагревают до
кипения и оставляют на 48 ч при +5...+8 ° С . Выпaвший осадок отфильтровывают , промьпзают на
фильтре холодным этанолом и сушат сначала при 80 ° С , затем 24 ч в вакуумном эксикаторе над
Р 205.
Р/в . Выход 1,05 г (100%). Т 230...234 ° С . ИК спектр : 1680, 1660, 1640, 1624, 1596, 1560,
1522, 2772 см1. Спектр ПМР (ДMСО- D0): 1,04 (6Н, c, 2СНз); 2,17 (2Н, c, СН2); 2,50 (2Н, c, СН2);
6, 75...8, 39 (11 Н, м, аром . + - СН=+ NH) ; 10,92 м . д . (1 Н, уш . c, NH) . УФ спектр (этанол + НС1,
рН 1), ) шах (1g Е ): 292,2 (4,66), 517,3 ни (2,90). Найдено , %: C 66,85; H 6,22; N 9,31; Cl 12,78.
С22Н 2о N202 • НС1. Вычиcлено ,
%: C 66,40; H 6,59; N 9,63; Cl 12,19.
' Уг . Выход 0,90 г (87%). Тпл 230...234 °C. ИК спектр : 1678, 1648, 1635, 1620, 1590, 1534,
1.
1520, 2688 см Спектр lIMP (ДMСО - D6): 0,92 ( ЗН , c, СНз ); 1,08 ( ЗН , c, СНз ); 2,14 (2 Н , c, СН2);
2,25 (2 Н , c, СН2); 6,72...7,92 (4 Н , м , аром. + - СН=); 9,03 (1 Н , c, NH); 10,28 м . д . (1 Н , д , J= 8 Гц ,
NH). УФ спектр (этанол + НС1, рН 1), iimax (Ig Е ): 231,8 (4,36), 276,4 (4,23), 515,3 ни (2,63).
Найдено , %: С 56,20; Н 5,21; N 13,20; С111,00. СиН15NзОз НС1. Вычиcлено , %: С 55,99; Н 5,01;
N 13,06; Cl 11,02.
Гидролиз гидрохлорида 8- беизоил -3,3- диметил -2,3,4,5- тетрагидро - АН - дибен-
зо [Ь, е] [1,4] диазепин-1-она (Рв
Кипятят 3 мин 0,30 г (0,79 ммоль) гидрохлорида IVs в 10 мл
50% водного зтанола . K остывшемy раствору добавляют 5 мл воды , выпавший осадок отфильтро вывают и перекристаллизовьпзают из толуола. Получают 0,15 г (52%) 2-(2- амино-5-бензоил).
фениламинометилен) - 5, 5-диметклцяклогексан-1 , 3-диона Шн. Тпл 162...165 ° С .
Гидролиз гидрохлорида 3,3-диметил-8-нитро-2,3,4,5-тетpагидро -l Н-дибензо [Ь, е ] [1,4] диазепин-1-она (' Уг). Нагревают до кипения 0,30 г (0,76 ммоль) гидрохлорида УVв в 10 мл 50%
водного диоксaна, после остывания добавляют еще 5 мл воды .
Вьшадает смолистый осадок
(0,17 г), который co временем затвердевает . Отфильтровывают и перекристаллизовыватот из
диоксана . Выход 0,09 г (32%) 2- (2 -аимно -5 -нитрофекиламииометилен) -5,5-диметилциклогексан- 1,3-диона IIr. Тпл 178...180 ° С .
1- (5,5-диметил-З- оксо -2 -формиJщикзюгексен -1 -илатчино) -2- (1, 3-диоксоиндан -2- или денметиламино) бензол (У I а ). Растворяют при нагревании 0,50 г (1,81 ммоль ) гидро -
699
хлорида З , З-димeтил-2,3,4,5- тетрагидро -l Н-дибензо [Ь, е] [1,4] диазепинона IVa в 10 Mn этанола . K остывшемy раствору добавляют раствор 0,20 г гидрокарбоната натрия в 5 мл воды . По
окончании выделения газа к реакционной смеси добавляют раствор 0,32 г (1,81 ммоль ) 2- фopмилиндан -1,3- диона в 5 мл этанола . Смесь нагревают до кипения и оставляют на 24 ч при 20 °C.
Получают 0,50 г технического продукта . Для очистки кипятят c углем в хлороформе , фильтруют
и осаждают из фильтрата VIa легким петролейньпк эфиром. Выход 0,31 г (41%). Т,лI 214...215 ° C.
ИКспектр :1717,1662,1650,1618,1598,1590,1558 см 1. СпектрПМР ( СДС1з): 0,99 (6Н, c, 2СНз );
2,23 (2Н, c, СН2); 2,36 (2H, c, СН2); 7,83...7,25 (8 Н, м, аром_); 8.22 (1 Н , д , J=13 Гц , =СН-); 10,22
(1 Н, c, СНО ); 11,22 (1 Н, д, J=1 З Гц, -NН); 13,08 м. д. (1 Н, c, NH). Найдено , %: С 72,65; Н 5,20;
N 6,80. С25Н22N2Ол . Вычислено , %: C 72,45; H 5,35; N 6,76.
З - (5,5-Диметил-3- оксо -2-формилциклогексенил ) амино -4- (1,3- диоксоиндан-2-илиденметиламино) толуол (V16). Растворяют 0,53 г (1,81 ммоль) гидрохлорида 3,3,7-тpимeтил-2,3,4,5тетрагидро-1 Н-дибензо [6, е] [1 , 4] диазепинона 'Ув в 20 мл этанола, затем добавляют раствор 0,20 г
NаНСОз в 5 мл моды . По окончании выделения газа к реакционной смеси добавляют раствор 0,32 г
(1,807 ммоль) 2-фopмилиндaн-1,3-ди oнa. Смесь нагревают до кипения и оставляют на 24 ч при
20 °C. Вьптанший осадок отфильтpовывaют. Получают 0,45 г технического продукта , который
перекристаллизовывают из этанола . Выход 0,32 г (42%). Тпл 203...206 °C. ИК спектр : 1706, 1656,
1628, 1608, 1570, 1558 см 1. Спектр ПМР ( СДС1з): 0,99 (6 Н , c, 2СНз); 2,17 (2Н, с , СН2); 2,28 (2Н,
c, СН2); 2,42 ( ЗН , c, СНз); 6,94...7,72 (7Н, м, аром .); 8,11 (1H, д, J=13 Гц, =СН-); 10,11 (1 Н , c,
СНО ); 10,97 (1 Н, д, Т =13 Гц , -NН); 12,83 м. д. (1 Н, c, NH). Нaйдено, %: С 73,01; H 5,96; N 6,32.
С26 Н 24N2Од. Вычиcлено ,
С 72,88; Н 5,65; N 6,54.
СПИСОК ЛИТЕРАТУРЫ
1. Страхов А Я., Петро в а М В Тонких П. Н Турковский А И., Попелис Ю ., Крейщман Г. П., Беляков C. В // ХГС
N4 3.
1997.
C. 379.
2. Страков А . Я., Петрова М В., Дишс А ., Стракова И. А ., Пахвич O. Ф. // ХГС . - 1995. Ne 3_ - C. 336.
3. Шульца М. Т., Страков А. Я. // Изв . АH ЛатвССР . Cep. хим_ -1971. -N 3.- C. 329_
.
.
.
.,
.
.,
-
-
.
-
.
Рижский технический университет,
Рига LV--1658, Латвия
e-mail: пгаггпа@osLlanet.ly
Поступило в редакцию 11.05.98