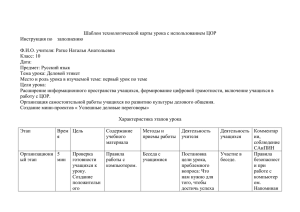
НАБОР ЦИФРОВЫХ ОБРАЗОВАТЕЛЬНЫХ РЕСУРСОВ
advertisement

ЗАКРЫТОЕ АКЦИОНЕРНОЕ ОБЩЕСТВО «ПРОСВЕЩЕНИЕ-МЕДИА» НАЦИОНАЛЬНЫЙ ФОНД ПОДГОТОВКИ КАДРОВ НАБОР ЦИФРОВЫХ ОБРАЗОВАТЕЛЬНЫХ РЕСУРСОВ к учебнику «Химия. 8-9» Иванова Р.Г для 8 класса МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ по использованию набора ЦОР на уроках Москва 2007 СОДЕРЖАНИЕ Методические поурочные рекомендации Пояснения к применению ЦОРов на уроках химии Глава 1: Общие сведения о веществах Урок № 1. Предмет химии Атомы и молекулы Урок № 2. Вещества Свойства веществ Урок № 3. Чистые вещества и смеси. Способы разделения смесей Урок № 4. Ознакомление с лабораторным оборудованием и правилами работы в химической лаборатории. Практическая работа Урок № 5. Очистка загрязнённой поваренной соли. Практическая работа 2 Урок № 6. Химические элементы Урок № 7. Простые и сложные вещества Урок № 8. Знаки химических элементов Урок № 9. Химические формулы Урок № 10. Кислород как простое вещество Урок № 11. Химические свойства кислорода: взаимодействие с простыми веществами Урок № 12. Получение кислорода и изучение его свойств. Практическая работа 3 Урок № 13. Оксиды Урок № 14. Вода как сложное вещество. Распространение в природе. Физические свойства Урок № 15. Вода как растворитель. Растворы Урок № 16. Массовая доля вещества в растворе Урок № 17. Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа 4 Урок № 18. Что нам известно о веществах Урок № 19. Состав, строение и свойства веществ: физические и химические Урок № 20. Валентность. Определение валентности по формулам веществ из двух химических элементов Урок № 21. Составление формул веществ по валентности химических элементов Урок № 22. Атомная и молекулярная массы Урок № 23. Массовая доля химического элемента в веществе Урок № 24. Количество вещества. Моль. Молярная масса Урок № 25. Решение задач Урок № 26. Металлы Физические свойства металлов значение металлов: меди, железа, алюминия Урок № 27. Особенности строения атомов металлов на примере натрия Урок № 28. Неметаллы. Особенности строения атомов неметаллов на 2 5 6 7 10 12 14 14 15 17 19 20 23 25 26 27 29 30 32 33 34 36 38 40 42 44 45 47 47 49 50 примере хлора Урок № 29. Ионная химическая связь на примере хлорида натрия Урок № 30. Образование молекул простых веществ - неметаллов Урок № 31. Водород. Получение водорода, его физические и химические свойства Урок № 32. Как образуются сложные вещества из неметаллов. Полярная ковалентная химическая связь Урок № 33. Кристаллические решетки. Зависимость физических свойств веществ от строения кристаллических решеток Урок № 34. Электролиты и неэлектролиты Урок № 35. Диссоциация электролитов в воде Урок № 36. Катионы и анионы Урок № 37. Кислоты как электролиты Урок № 38. Основания как электролиты Урок № 39. Обобщение сведений о веществах Урок № 40. Контрольная работа по теме. Общие сведения о веществах Глава 2: Химические реакции Урок № 41. Признаки химических реакций Урок № 42. Закон сохранения массы веществ при химических реакциях Урок № 43. Химические уравнения Урок № 44. Расчеты по химическим уравнениям Урок № 45. Реакции, подтверждающие генетическую связь металлов и их соединений Урок № 46. Реакции, подтверждающие генетическую связь неметаллов и их соединений Урок № 47. Окислительно-восстановительные реакции Урок № 48. Урок №-упражнение. Составление окислительновосстановительных реакций Урок № 49. Реакция нейтрализации Урок № 50. Практическая работа. Реакция нейтрализации. Реакции ионного обмена Урок № 51. Обратимые и необратимые реакции Урок № 52. Скорость химической реакции Урок № 53. Влияние концентрации реагирующих веществ на скорость химической реакции Урок № 54. Влияние температуры на скорость химической реакции Урок № 55. Катализаторы и их влияние на скорость химической реакции Урок № 56. Влияние различных факторов на изменение скорости химических реакций. Урок № 57. Классификация химических реакций 3 52 53 55 57 59 61 62 64 66 68 70 71 71 72 74 75 77 79 80 82 82 84 84 87 88 89 91 92 93 Урок № 58. Химические реакции, характерные для оксидов и оснований Урок № 59. Химические реакции, характерные для кислот Урок № 60. Химические свойства сложных веществ. Практическая работа Урок № 61. Обобщение сведений о химических реакциях Урок № 62–63. Контрольная работа по теме. «Химические реакции» и её анализ Урок № 64. Круговорот кислорода, углерода, азота в природе Урок № 65–68. Повторение изученного материала 4 95 98 99 99 101 101 102 Методические поурочные рекомендации Введение Поурочное планирование основано на планировании уроков химии методического пособия Р.Г.Ивановой (Уроки химии в 8 – 9 классах; Москва «Просвещение», 2001 г.). Однако автор позволил себе внести некоторые изменения и дополнения, показавшиеся ему более рациональными с точки зрения основательной подготовки учащихся в 8 классе. Это не нарушает основную идею содержания материала учебного пособия. Например, уроки 28 – 29 (указанные в методическом пособии Р.Г.Ивановой) можно объединить вследствие легкости усвоения данных тем. Кроме того, экономия времени полезна для использования его при отработке знаний в дальнейшем. Лабораторные опыты по исследованию электропроводимости веществ и их растворов, предлагаемые авторами учебника (Урок 31 методического пособия Р.Г.Ивановой), не всегда возможны из-за различного оснащения кабинетов химии. Если же оборудование кабинета позволяет провести данные опыты в виде лабораторных, то целесообразнее превратить уроки 3031 в урок-исследование, используя 4 ЦОРа. Требуется раздельное рассмотрение таких вопросов, как «Кислоты как электролиты» и «Основания как электролиты» в целях более осознанного подхода учащимися к изучению в дальнейшем реакций ионного обмена. Автор считает, что отдельно необходимо рассматривать вопрос о признаках химических реакций, так как он развивает у учащихся наблюдательность, что очень важно в изучении предмета. В разделе «Скорость химической реакции» допустимо более подробное рассмотрение законов, определяющих зависимость скорости от концентрации реагирующих веществ и температуры. Автор пособия не указывает на правила техники безопасности в поурочных конспектах, так как эта часть работы учителя обязательно должна присутствовать и, хочется думать, не требует напоминания. Автор методического пособия определяет в основном содержательные цели уроков. Задача работающего учителя расширить деятельностные и воспитательные цели уроков, которые во многом определяются методикой, применяемой разными учителями. 5 Пояснения к применению ЦОРов на уроках химии. 1. Как работать с озвученным определением? Сначала учащиеся прослушивают определение, данное в ЦОР. Затем записывают по памяти в тетрадь. После этого следует самопроверка (вновь слушают определение). 2. Как работать с компьютерными тестами? Если в кабинете отсутствует сетевая версия, то учитель в процессе индивидуальной самостоятельной (проверочной) работы, выполняемой учениками, может последовательно вызывать учащихся к компьютеру для выполнения теста, после чего они могут продолжать работать далее по своим индивидуальным заданиям. 6 8 класс Тема 1. Общие сведения о веществах Урок № 1. «Предмет химии. Атомы и молекулы» Задачи урока: сформировать представление о предмете химии, дать первоначальные понятия о веществе как объекте изучения химии, познакомить с техникой безопасности при работе в химическом кабинете. Оборудование: ЦОР № 1 – 4, 77, лабораторное оборудование (на усмотрение учителя), образцы физических тел из одних и тех же химических веществ и (например, линейка деревянная и пластмассовая, коллекции алюминиевых и стеклянных изделий), реактивы для проведения демонстрационных опытов (по усмотрению учителя). Название этапа урока 1. Актуализация знаний учащихся Содержание этапа 1) Учитель познакомит учащихся с кабинетом химии, принадлежностями, необходимыми при изучении предмета, а также правилами работы с учебным материалом. (т.е. с требованиями к каждому уроку). 2) Беседа о науках, изучающих природу (география, физика, биология). Примечание: уместно также на этом этапе помочь учащимся вспомнить, что является объектом (объектами) изучения той или иной науки. 3) 4) Вывод, к которому должны прийти школьники: все перечисленные науки – это науки о природе. Учитель уточняет: химия – наука о природе и кратко знакомит учащихся с историей этой науки. Примечание: здесь уместно обратить внимание на то, что химия – достаточно древняя наука, а также познакомить с именами некоторых ученых. Для этого он может воспользоваться дополнительным материалом учебника (Приложение для любознательных) и организовать работу в группах по своему усмотрению. 7 Используемые средства обучения 2. Усвоение новых знаний Для того, чтобы учащиеся усвоили предмет химии, учитель вместе с ними может составить следующую схему, иллюстрирующую уровни организации материи: природа ↓ физические тела (и явления) (обладают формой, размерами, массой, объемом) ↓ вещества (обладают свойствами: агрегатное состояние, цвет, запах, растворимость в воде, температуры кип. и плавл. и т.д.) Демонстрация предметов из разных веществ, ЦОР № 77 ↓ ↓ ↓ молекулы атомы ионы Вывод учащихся: вещества бывают атомного, молекулярного или ионного состава. Свойства физических тел определяются свойствами веществ, из которых они состоят. Организация учебного затруднения Вопрос: почему, например, скрепляющие детали (гвозди) не делают из стекла? Гипотезы, приводимые учениками, должны быть связаны с требованиями к данным деталям. Учитель обратит внимание на то, что сегодня крепёжные детали делаются не только из металла, но и других материалов (веществ). Почему? Вывод учащихся: для грамотного применения различных веществ необходимо учитывать их свойства. (в данном случае скорее технические характеристики). Для организации проблемы дальнейшего рассмотрения предмета химии, связанной с химическими превращениями, учителю следует опереться на химический эксперимент. Примечание: с целью повышения мотивации и интереса к предмету учителю необходима интрига в виде химического эксперимента, который был бы запоминающимся. Это могут быть опыты «вулкан», «дым без огня» и др. на усмотрение учителя и в связи с возможностями кабинета химии. 8 Реактивы и оборудования для проведения демонстрационного эксперимента. Разрешение учебного затруднения Учитель должен дать возможность ученикам рассмотреть предъявляемое им вещество, и после эксперимента – его результат, т.е. новое вещество или вещества. Учитель уточнит, что свойства веществ – это и возможности их превращения, которые также являются предметом изучения химии. Далее учитель демонстрирует материалы (слайды), учащиеся должны определить направления деятельности человека, которые невозможны без знаний основ химической науки. ЦОР № 1,4 Примечание: здесь уместно процитировать слова М.В.Ломоносова: «Широко распростирает химия руки свои в дела человеческие. Куда ни посмотрим, везде обращаются перед очами нашими успехи ея прилежания». Учащиеся вспомнят области применения химических веществ, показанные на слайдах (ЦОР №4) и запишут в конспект. Учитель задаст вопрос: какова цель изучения веществ и их превращений? Вывод, который должны сделать учащиеся: грамотное применение химических веществ. В завершении этапа учитель знакомит учащихся с образцами некоторых химических веществ (в т.ч. и едких) и с лабораторным оборудованием. ЦОР № 2,3 Примечание: демонстрацию ЦОРов №2,3 можно сопроводить вопросами: - для каких веществ предназначено данное оборудование, - для каких работ предназначено то или иное оборудование? 3. Закрепление изученного материала 4. Домашнее задание В качестве экспресс-закрепления учитель может предложить учащимся небольшой устный диктант на определение «вещество – тело». В конце урока необходимо записать основные правила работы с веществами и химическим оборудованием. Для этого можно воспользоваться учебным материалом, данным в практической работе №1. Прочитать «Введение», § 1, статьи из истории химии в Приложении «Для любознательных», Устно: найти вещества, используемые в быту. 9 Предметы лабораторного оборудования, принадлежностей к уроку. Урок № 2. «Вещества. Свойства веществ» Задачи урока: сформировать представление о веществе, его составе, умение описывать вещество, начать формирование понятий простых и сложных веществ. Оборудование: ЦОР № 4 – 9, 33, модели атомов, молекул, кристаллов, стакан с водой, концентрированный раствор KMnO4 (или кристаллы), лабораторное оборудование (на усмотрение учителя), образцы химических веществ. Название этапа урока Содержание этапа 1. Активизация знаний учащихся Учитель проведет беседу о важности химических веществ, их широком использовании и о важности химических знаний. С этой целью учитель может использовать слайды, которые учащиеся уже видели на предыдущем уроке, но теперь без текстового сопровождения. Можно попросить учащихся прокомментировать тот или иной слайд. Затем необходимо вспомнить о том, от чего зависит применение разных химических веществ. Посредством беседы ребята могут вывести следующую схему: Используемые средства обучения ЦОР № 4 Состав веществ Свойства веществ Применение веществ Примечание: здесь учитель может сделать акцент, что в данном триединстве они и будут постигать знания о химических веществах. Для того, чтобы учащиеся усвоили новую тему, 2. Усвоение новых знаний учитель вместе с ними вспомнит схему, иллюстрирующую уровни организации материи: природа ↓ физические тела (обладают формой, размерами, массой, объемом) ↓ вещества (обладают свойствами: агрегатное состояние, цвет, запах, растворимость в воде, температуры кип. и плавл. и т.д.) ↓ молекулы ↓ ↓ атомы ионы На данном этапе необходимо остановиться на составе веществ. Учитель познакомит учеников с атомом и молекулой (этимологией названия) с помощью ЦОР и продемонстрирует молекулы простых веществ и сложных веществ с помощью моделей. Примечание: на этом этапе учитель может продемонстрировать 10 Демонстрация моделей атомов, молекул, кристаллов. ЦОР № 7,8 эксперимент, иллюстрирующий прерывистое строение веществ: растворение перманганата калия в воде (диффузию), а также выпаривание раствора сахара как доказательства того, что вещество состоит из мельчайших частиц. Учитель знакомит ребят с положениями атомистической теории Демокрита. ЦОР № 6 ЦОР № 9, ЦОР № 33 дополнительно вода сера Уксусна кислота цинк медь железо уголь сахар соль Свойства веществ Свойства веществ Разрешение учебного затруднения Вещества Организация учебного затруднения Вывод учащихся: вещества бывают атомного, молекулярного или ионного состава. Свойства веществ определяются их составом и строением. Вывод учащихся: для грамотного применения различных веществ необходимо учитывать их свойства. Далее необходимо остановиться на описании свойств веществ. С этой целью можно организовать виртуальную лабораторную работу по определению понятия и свойств чистого вещества с заполнением учащимися следующей таблицы: ЦОР № 5 1.агрегатное состояние 2.цвет 3.растворимость 4.плотность 5.электропроводность 6.теплопроводность 3. Закрепление изученного материала Ребята делают вывод, что вещества отличаются друг от друга свойствами, которые неизменны независимо от способа получения веществ. В качестве экспресс-закрепления учитель может предложить учащимся небольшой устный диктант на определение «вещество – тело». Учитель может воспользоваться также упр. 4 ЦОР № 34, причем проверить правильность рассуждений ребят можно таким образом: покажите пальцами руки номер строки верного ответа. В конце урока можно организовать короткую лабораторную работу по характеристике свойств веществ. 4. Домашнее задание Повторить § 1, статьи в Приложении «Для любознательных» о строении и превращении веществ. 11 ЦОР № 34, Образцы веществ из раздаточных материалов «Металлы», «каучук», «пластмассы» и др. Урок № 3. «Чистые вещества и смеси. Способы разделения смесей» Задачи урока: дать понятие о чистом веществе и смеси, типах смесей. Раскрыть значение смесей в природе и жизни человека. Познакомить со способами разделения смесей. Оборудование: ЦОР № 9 – 18, 28,29, вода, 3 стакана, сахар, деревянная стружка, песок, фильтровальная бумага, воронка, стеклянная палочка. Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа В начале урока учитель проведёт беседу по вопросам домашнего задания: - что изучает химия? - что такое вещество? - чем одно вещество отличается от другого? - какими опытами можно доказать, что вещество состоит из мельчайших частиц? Используемые средства обучения ЦОР № 9 Учитель повторяет понятие «чистое вещество». Примечание: следует сделать запись в тетрадь о том, что чистым веществом является такое вещество, свойства которого неизменны независимо от способа получения (в чём учащиеся убедились при выполнении лабораторной работы). Далее учитель акцентирует внимание учащихся, что в природе чистые вещества практически не встречаются. В подтверждение своих слов учитель демонстрирует вещества: сахар, воду, песок, деревянную стружку и просит ребят вспомнить, где встречаются данные вещества. Учащиеся делают гипотезы, доказывающие, что в природе вещества встречаются в виде смесей. Учитель смешивает: а) воду с сахаром; б) воду с песком; в) песок со стружкой. Вопрос учителя: чем отличаются эти смеси? Учащиеся легко приходят к выводу о типах смесей (однородные и неоднородные, твердые, жидкие, газообразные). Если учитель сочтёт необходимым, то может обозначить однородные и неоднородные смеси как гомогенные и гетерогенные. Учитель далее пояснит, что часто очень важным является получение чистых веществ, а, значит, есть необходимость отделения их от смеси. После записи учащимися подтемы урока: «Способы разделения смесей» учитель вновь приглашает ребят в виртуальную лабораторию, где они знакомятся со способами разделения смесей. Примечание: К ЦОР № 13 можно задать вопрос: «какой 12 ЦОР № 10,11,12 Чтобы заполнить нижнюю строку таблицы, можно применить ЦОР № 18. Демонстрация веществ. Демонстрация смесей. ЦОР № 12,13,14,15,16, 28,29 способ разделения смеси использует лаборант?» ЦОР № 16 (хроматографию) необходимо пояснить. С помощью беседы учащиеся приходят к ЦОР № 17 выводу, что разделение смесей основано, прежде всего, на разных физических свойствах веществ- Демонстрация компонентов смеси. фильтрования Примечание: с помощью ЦОР учитель может напомнить, смеси воды и что свойства веществ, составляющих смесь, сохраняются. песка. Учитель дополняет и поясняет другие способы 3. Закрепление изученного материала разделения смесей (фильтрование, дистилляция). Закрепление можно организовать как групповую работу по заполнению схемы способов разделения смесей, которая может выглядеть следующим образом: Смеси неоднородные 1) отстаивание 2) фильтрование 3) действие магнита однородные 1) выпаривание 2) дистилляция 3) хроматография 4) кристаллизация Задание группам: определить методы разделения смесей (однородных и неоднородных) и краткую суть методов. Уточнение содержаний методов можно провести в виде устной беседы или взаимопроверки групп и коррекции с выставлением оценки за работу, как группам, так и индивидуальной. Учитель добавит, что существуют химические способы ЦОР № 81 разделения смесей, основанные на выведении компонентов в осадок или газ. 2) Ребятам группами можно предложить компьютерную самостоятельную работу с последующей проверкой и оценкой. Примечание: второй пункт закрепления проводим в случае, если есть время на уроке. В противном случае это закрепление может служить проверкой домашнего задания в уроке «Практическая работа 2». Учитель может разбить задания упражнений и провести их фронтально, индивидуально (при наличии достаточного количества компьютеров в классе), оптимальный же вариант – групповая работа «под секретом». 4. Домашнее задание § 2, изучить методы разделения смесей, записанные в тетрадях, упр. 4,5,6,7 (устно), в качестве подготовки к практической работе 1 познакомиться с содержанием работы в учебнике. 13 Урок № 4. «Ознакомление с лабораторным оборудованием и правилами работы в химической лаборатории» Практическая работа 1 Задачи урока: начать формирование навыков работы с лабораторным оборудованием, повторить и на практике закрепить знания правил техники безопасности при работе с химическими реактивами. Оборудование: ЦОР № 2,3, лабораторные принадлежности к уроку по усмотрению учителя. Примечание: работу проводим так, как позволяет оборудование кабинета химии, наличие реактивов и методика, используемая учителем. Так как данная работа не очень сложна и выполняется учениками достаточно быстро, то можно организовать групповую проверочную работу по ЦОР № 2,3, которые уже знакомы ребятам, а также групповую работу при выполнении задания практической работы 1 учебника. Задания при этом можно разделить, а выполнение не обязательно должно быть письменным: учащиеся могут «говорить без слов», изображать рисунками предметы лабораторного оборудования или приемы работы с ними и т.д. Другие команды «угадывают» изображенное, или команда показывает какой-либо приём работы с лабораторным оборудованием, но должна показать его, сделав ровно одну ошибку, которую и ищут другие команды. Домашнее задание: повторить методы очистки смесей, а также с содержанием практической работы 2 учебника. Урок № 5. «Очистка загрязнённой поваренной соли». Практическая работа 2 Задачи урока: продолжить формирование навыков работы с лабораторным оборудованием, повторить и на практике закрепить знания физических методов разделения смесей. Оборудование: ЦОР № 70,76,81, оборудование согласно практической работе учебника. Примечание: Данная работа занимает немного времени и не составляет особого труда для ребят. Поэтому в начале урока учитель должен проверить уровень усвоения данной темы, а также повторить правила техники безопасности при работе с лабораторной посудой и химическими веществами. Это можно сделать с помощью ЦОР № 81 (если он не использовался на соответствующем уроке в виде закрепления) или устно с помощью фронтального опроса. Далее учитель продемонстрирует ЦОР № 70, к которому задаст следующие вопросы: - какой метод разделения смеси использовал лаборант? - в каких случаях этот метод эффективен? После выполнения учащимися практической работы в качестве закрепления изученного и подтверждения важности полученных знаний учитель продемонстрирует видеоролик «Очистка воды» (ЦОР № 76), к которому задаст вопросы: • какие физические методы используются при очистке воды? • к какому методу можно отнести хлорирование и озонирование воды? 14 Урок № 6. «Химические элементы» Задачи урока: раскрыть понятие «химический элемент», показать единство природы, как единство химических элементов и их круговорота. Оборудование: ЦОР № 7,8,19–26, пробирки с собранными газами: водородом и кислородом, лучинка, коллекции металлов и неметаллов в качестве примеров веществ, состоящих из одного химического элемента. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения Опираясь на знания ребят из курса физики, а также на первоначальные химические знания, учитель вспомнит с учащимися состав веществ (молекулы, атомы), а также уточнит: веществ, которые состоят из свободных атомов, в природе не так уж много. Гораздо больше веществ, состоящих из молекул. Вопрос учителя: что такое молекула? не должен вызвать затруднения у учащихся. Если ребята затрудняются, то учитель может в качестве повторения опорных знаний предложить определения ЦОРов №7,8. ЦОР № 7,8 Здесь же нужно уточнить: 1) атом химическими методами разделить нельзя, это мельчайшая частица вещества; 2) молекула – частица, отвечающая за свойства вещества. Вопрос, который может задать учитель для продолжения диалога, может быть следующим: почему вещества обладают разными свойствами? Ответ учащихся может быть таким: вещества состоят из разных молекул, а те, в свою очередь, из разных атомов. Следующий вопрос учителя провокационный: сколько веществ на Земле? Ученики могут строить гипотезы, учитель уточняет примерное количество известных веществ. Далее учитель может спросить: сколько слов в русском языке? Этот вопрос не вызывает затруднений. Ответ: много. Учитель поддерживает диалог: а сколько букв в русском языке? В качестве доказательства того, что одни и те же буквы могут образовать разные по смыслу слова, учитель может воспользоваться такими простыми словами как «нос» и «сон». Этот простой пример легко подведёт ребят к выводу о том, что из небольшого количества разных видов атомов по определенным природным законам 15 образуются миллиарды различных химических веществ. 2. Усвоение новых знаний Учитель подытоживает первый этап урока: 1) сегодня известно 110 видов атомов; 2) они отличаются друг от друга массой, размерами, свойствами; 3) как определенное сочетание звуков в языке обозначает букву, так и определенный вид атомов обозначает химический элемент; 4) на химическом языке различные виды атомов обозначаются (как буквы) символами. Далее учитель с помощью ЦОРа познакомит с этимологией символов и названий разных химических элементов. ЦОР № 21 ЦОР № 22 Примечание: в данном случае учитель может опираться на периодическую таблицу Д.И.Менделеева, чтобы ребята начали привыкать к подобной работе. Однако не следует навязывать запоминание отдельных химических символов и названий химических элементов, так как этому будет посвящен отдельный урок. Для демонстрации и подтверждения того, что разные химические вещества могут состоять из одних и тех же элементов учитель продемонстрирует виртуальный опыт разложения воды. Заметим, что ребята не могут идентифицировать водород и кислород. Поэтому советуем кроме анимационного ролика воспользоваться пробирками с собранными заранее газами и показать идентификацию. Тогда учащиеся смогут ответить на вопросы учителя к данному видеоролику, а именно: 1) что произошло с водой под действием электрического тока? 2) Какие газы были собраны в пробирки? 3) Сделайте вывод о составе воды. 4) Почему водорода собралось в два раза больше, чем кислорода? Примечание: здесь не лишним будет акцентировать внимание ребят на то, кислород лишь поддерживает горение, а водород сгорел, так как в воздухе есть кислород, с которым он снова соединился. Что могло образоваться? Результатом работы может служить схема, записанная в тетрадях, и показывающая круговорот химических элементов, а также пути круговорота (химические превращения): 16 ЦОР № 20 атомы водорода и кислорода электр.ток молекулы водорода вода и кислорода горение Вывод учащихся: один и тот же химический элемент встречается в разных химических веществах, а также в атомарном состоянии. В качестве закрепления изученного учитель демонстрирует ЦОР № 23, 24,25, 26, которые сопровождает вопросами: 1) какой химический элемент является самым распространенным? 3. Закрепление изученного материала ЦОР № 23,24,25 ЦОР № 25 лучше продемонстрировать и поработать с ним после вопроса 1. 2) приведите примеры веществ, в которые входят атомы химического элемента кислорода. 3) приведите примеры веществ, в которые входят атомы химического элемента кремния. При работе с ЦОР № 26 обязательно нужно сделать акцент на единство всей природы. 4. Домашнее задание § 3, упр. 1–4. Урок № 7. «Простые и сложные вещества» Задачи урока: дать первоначальные понятия о простых и сложных веществах, начать формирование умения находить различия в понятиях «вещество» и «химический элемент». Оборудование: ЦОР № 27,28,29,30,31,32,33,34, образцы, иллюстрирующие примеры простых и сложных веществ, порошок оксида меди(II), цинк и раствор соляной кислоты для получения водорода, пробирки, газоотводная трубка, медная пластинка, спиртовка, зажим пробирочный. Название этапа урока 1. Активизация знаний учащихся Содержание этапа В начале урока следует проверить домашнее задание. Примечание: учитель может по своему усмотрению провести данный этап работы. Далее вспоминаем вместе с ребятами: что такое вещество, из чего состоят вещества, что такое химический элемент, из каких химических элементов состоят такие вещества, как кислород, водород, сера, вода (учитель может предложить 17 Используемые средства обучения и другие вещества). 2. Усвоение новых знаний Данный этап желательно начать с проблемного эксперимента, предложенного авторами УМК: окисление меди в пламени горелки: для этого можно прокалить медную пластинку в пламени, а затем восстановление оксида меди водородом. Для этого на внутренние стенки влажной пробирки нанести порошок оксида меди(II), нагреть пробирку и пропустить по газоотводной трубке водород, который образуется при взаимодействии цинка и соляной кислоты в другой пробирке. Газоотводная трубка должна доставать до дна пробирки с оксидом. Эксперимент необходимо сопровождать комментариями и вопросами, например: - Из атомов какого химического элемента состоит медь? - Какие свойства меди изменились после прокаливания пластинки? (здесь учителю необходимо дать комментарий). - что доказывает второй опыт? (в оксид меди входят атомы меди). Далее учитель напомнит ребятам о смесях и продолжит демонстрацию – нагревание смеси железа и серы виртуально. Для продолжения диалога учитель продемонстрирует дополнительную информацию о железе и сере и попросит сделать вывод о составе веществ, в которые входят химические элементы железо и сера. ЦОР № 28,29,30. ЦОР № 31,32. Примечание: после подобной подготовки, как показывает опыт, учащиеся довольно легко самостоятельно делают вывод о том, что вещества бывают простыми, т.е. состоят из атомов одного химического элемента, и сложными, состоящими из атомов разных химических элементов. 3. Закрепление изученного материала 4. Домашнее задание После демонстрации образцов различных веществ учитель предложит обобщающую таблицу, а также попросит записать выводы в тетрадь. ЦОР № 27 Этот этап урока можно провести частично в виде устного диктанта на распознавание простых и сложных веществ, а затем организовать групповую работу с помощью ЦОРа (упр.4, 1, 2, 3 ,5, 7). § 4, упр. 1 – 4 (устно), 5 (письменно по образцу: а) простое и т.д.) ЦОР № 34. 18 Урок № 8. «Знаки химических элементов» Задачи урока: дать понятие о знаках химических элементов, познакомить с названиями элементов, понятием «коэффициент». Оборудование: ЦОР № 22,35,36,37,38, Периодическая таблица, шариковые модели атомов. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения Проверка домашнего задания, которую учитель проводит согласно применяемой им методике. Примечание: будет не лишним провести здесь краткую письменную проверочную работу на различение понятий «вещество» - «тело» и «простое вещество» «сложное вещество». 2. Усвоение новых Для реализации задач урока целесообразно ввести в него проблему: знаний Что изучает химия? Как записать на бумаге исследуемое вещество или явление? Учитель предлагает учащимся записать названия (при этом диктует быстро, отводит мало времени. Учащиеся не успевают. Создается учебная проблема: как успеть?) Целесообразно при пояснении провести Организация аналогию с русским языком: учебного затруднения буквы → слова → предложения Разрешение учебного затруднения знаки химическ ихэлемент ов химическ ие формулы уравнения химическ их реакций Учитель напомнит учащимся символы, которые присваивали веществам, и обсудит невозможность использования подобных символов в науке. Далее учитель познакомит ребят с «отцом» химической письменности Й. Я. Берцелиусом, который предложил использовать для обозначения разных химических элементов начальные буквы их латинских названий. В качестве примера можно использовать слайд. Далее учитель обращается к таблице химических символов и продолжает работать с ней (учитель поясняет этимологию некоторых названий, а ученики запишут их в тетрадь). 19 ЦОР № 22 ЦОР № 37 ЦОР № 35 Периодическая таблица 3. Закрепление изученного материала 4. Домашнее задание Происхождение названий химических элементов связано с: 1. свойствами простых веществ, образуемых ими (водород, кислород, фтор и т.д.); 2. мифами древних греков (тантал); 3. географическими названиями государств, городов, частей света (рутений – Россия, полоний – Польша, европий – Европа, лютеций – Париж); 4. астрономическими (селен – Луна, теллур – Земля и т.д.); 5. именами великих ученых (менделевий, кюрий, эйнштейний). Будет правильным уже на данном этапе познания дать ребятам первоначальную классификацию химических элементов на металлы и неметаллы. Учитель пояснит, заучивать латинские названия необязательно, необходимо знать, как символы произносятся. Заключением данного этапа может стать решение проблемы: как обозначить несколько атомов химического элемента. Для решения этой проблемы вводится понятие «коэффициент». Учитель может воспользоваться моделями атомов, чтобы разъяснить данное понятие. Закрепление проводим в группе или ЦОР № 36,38 индивидуально с помощью интерактивных упражнений. § 5, выучить химические символы. Урок № 9. «Химические формулы» Задачи урока: дать понятие об индексах, коэффициентах, научить записывать состав химического вещества в виде химической формулы, читать их, понимать символьную запись. Примечание: в данном уроке закрепление лучше проводить во время основного этапа урока, в течение всего урока. Оборудование: ЦОР № 39,40,41,42,91,95,97, шаростержневые модели. 20 Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения Урок начинается с проверки домашнего задания, которое можно провести в виде устного или письменного диктанта, а также соревнования «Как мы знаем химический язык» с помощью подготовленных учениками заранее карточек с символами и названиями химических элементов. Учитель ещё раз вспомнит с ребятами, что обозначают символами (химический элемент), а также то, что вещества состоят из химических элементов, а, следовательно, также могут быть записаны в виде символов. 2. Усвоение новых В начале урока учитель напомнит ребятам, что одноатомных молекул в природе не так много знаний (инертные газы), их состав записать легко – символом соответствующего химического элемента. Однако простые вещества твердого агрегатного состояния, кристалла, в котором миллиарды одинаковых атомов, принято записывать также, как и инертные газы – символом, отражающим их состав. Например: железо. Из каких атомов состоит это вещество? Сколько атомов железа в Организация данном образце? (ответ неопределенный). Как учебного передать эту информацию молча? затруднения Учитель может записать формулу простого вещества железа и по аналогии попросить Разрешение учебного передать информацию соседу сзади без слов, затруднения показав (по секрету) одному из учеников такие вещества, как цинк, алюминий, медь, серу, уголь. Примечание: Опыт показывает, что подобная работа нравится школьникам, так как в ней присутствует интрига. Первый вывод учащихся: символьная запись отражает состав вещества.(записываем в тетрадь). Здесь же учитель попросит учащихся записать напротив уже имеющихся у них символов ещё несколько (один, два, три) таких же, а затем прочитать записи. Учащиеся станут создавать гипотезы, например, феррум, феррум или феррум + феррум. Учитель подхватит: как в математике записать кратко Х + Х? Ответ: 2Х. Таким образом, учащиеся повторяют уже известное им понятие на другом уровне. При этом они легко усваивают понятие «коэффициент» и его содержание, а также 21 Образцы веществметаллов и неметаллов Организация учебного затруднения Разрешение учебного затруднения легко догадываются, что коэффициент «1» записывать не надо. Учитель, воспользовавшись шаростержневыми Шаростержневые моделями, может провести краткую модели лабораторную работу на отработку этого понятия (в данном случае вариантов масса). Далее можно переходить к молекулам простых веществ, образованным несколькими атомами. Для этого учитель создает проблему, попросив ребят соединить атомы, например имитирующие кислород (водород и т.д.) по два. Как записать состав молекулы, состоящей из атомов одного химического элемента? На этом этапе урока учитель сам ввести понятие «индекс», пояснив, что маленькая цифра, записанная справа внизу от символа, обозначает число атомов в одной молекуле, т.е. ЦОР № 42 связанных атомов. Кроме того, можно познакомить ребят с именем химика, впервые применявшим химические формулы – Д.Дальтоном. Снова короткое закрепление: учитель просит записать (собрать модели) нескольких молекул простых веществ. Примечание: в данном случае будет логично сразу предоставить ребятам два вида подобной работы: запись химических формул и их прочитывание. 3. Домашнее задание Второй вывод учащихся: символьная запись показывает число атомов химического элемента в одной молекуле. Учитель просит прослушать и воспроизвести полное определение химической формулы. После краткого закрепления этой части нового материала учитель переходит к химическим формулам сложных веществ. С этой целью он может продемонстрировать модели сложных веществ и попросить записать их состав. Затем можно предложить ребятам записи формул и попросить составить записи нескольких молекул демонстрируемых веществ. В конце урока проводим индивидуальное (или групповое) закрепление материала темы общими упражнениями 2 (§ 6) и ЦОР. § 6, упр. 1 (и 2, если оно не выполнялось на уроке). 22 ЦОР № 40 ЦОР № 39, шаростержневые модели ЦОР № 91,95,97 ЦОР № 41 Урок № 10. «Кислород как простое вещество» Задачи урока: познакомить учащихся с составом воздуха, , получением и применением кислорода. Оборудование: ЦОР № 43 – 48,50,51,52,56,57,перманганат калия, газоотводная трубка, спиртовка, зажим, лучинка. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения После проверки домашнего задания учитель обращается к ученикам с просьбой: дать определение чистого вещества и смеси. Следующий вопрос учителя: к чему относится воздух? Примечание: важно, чтобы отвечающий(ие) дали полную характеристику этой смеси. Таким образом, учитель сможет выявить пробелы в ранее полученных знаниях. Учитель продолжает: сейчас этот вопрос показался вам простым, однако до 18 века все человечество считало, что воздух – это единственный газ. Впервые в этом усомнились ученые Дж. Пристли, А Лавуазье и К. Шееле. Учитель демонстрирует эксперимент и предлагает дополнительную информацию: «Красный порошок, который вы наблюдали, называется оксидом ртути(II). Это чистое вещество и задает вопрос: «Где вы могли наблюдать темную блестящую жидкость, которая получилась в результате эксперимента? Как она называется?». ЦОР № 44,45 ЦОР № 48,43 Примечание: в качестве дополнительной информации, если позволяет время урока, учитель расскажет о том, как грамотно убрать разлившуюся ртуть. Затем он просит ребят сделать выводы о составе воздуха. Затем учитель кратко познакомит учащихся с биографиями Дж. Пристли и А. Лавуазье. Возможные вопросы учителя: 1) Кто из этих ученых предложил название «кислород» и почему? 2) Как получил кислород Дж. Пристли? 3) Каково основное свойство этого газа? 4) Как используется это свойство кислорода? Учитель продемонстрирует области применения двух важных составляющих воздуха и попросит учащихся воспроизвести увиденное по пунктам в тетрадях с последующими дополнениями и обсуждениями. 23 ЦОР № 46,47 2. Усвоение новых знаний С помощью видеоролика учитель определит проблему: - из каких веществ, и какими превращениями можно получить кислород в лабораторных условиях? - Можно ли этот способ использовать для получения кислорода в больших количествах? Почему? - как можно получить кислород в больших объемах для хозяйственных нужд? Примечание: учащиеся должны назвать два способа: - разложение оксида ртути (опыт Дж. Пристли); - разложение перманганата калия. Учитель же обобщит: один из способов получения кислорода – разложение сложных веществ. Здесь же можно кратко охарактеризовать способ получения кислорода в промышленности. Далее следует определить следующую проблему: как собрать выделяющийся кислород? После обсуждения учащиеся запишут два способа собирания газа: вытеснение воздуха и вытеснение воды. ЦОР № 50 ЦОР № 51 ЦОР № 52 Примечание: метод собирания кислорода вытеснением воздуха может продемонстрировать на уроке учитель. Далее учитель обсуждает состав молекулы кислорода (из химического элемента кислорода), а также состав аллотропной модификации, в виде которой встречается этот химический ЦОР № 57 элемент (озон). Ребята могут записать определение аллотропии, а также превращение кислорода в озон в атмосфере в виде схемы: кислород (О2) 3. Закрепление изученного материала электрический разряд ультрафиолет. лучи озон (О3) Итогом этого этапа будет обобщение: в виде чего встречается химический элемент кислород, которое учитель обсудит с учащимися. Этот этап урока учитель может провести посредством беседы по вопросам: 1) что вы узнали о воздухе? 2) Как образуется кислород в природе и как можно получить его в лабораторных условиях? 3) Что такое озон, как он образуется? 4) Что произошло бы на Земле, если бы весь кислород превратился в озон? 5) Назовите самое главное свойство кислорода, определяющее его применение. Кроме того, учитель может воспользоваться упражнениями, данными в ЦОР № 56. 24 ЦОР № 56, упр. 1,2,3,5,6 4. Домашнее задание § 8 (до слов «В кислороде хорошо горят многие вещества …»), упр.1, 3. Урок № 11. «Химические свойства кислорода: взаимодействие с простыми веществами» Задачи урока: познакомить учащихся с химическими свойствами кислорода, дать представление об оксидах, первоначальные представления о признаках химической реакции на примере реакции горения, уточнить знания ребят о распространении кислорода в природе. Оборудование: ЦОР № 49, 53,54,55,56,58,59,60. Название этапа урока Содержание этапа 1. Активизация знаний учащихся В начале урока с целью повторения и закрепления ранее полученных знаний можно провести короткий химический диктант. Задания могут быть следующие: 1) написать химические формулы (учитель проговаривает: 2 атома магния, одна молекула водорода, 3 атома серы, 2 молекулы озона и т.д.); 2) расставить в 2 столбика (химический элемент, вещество) номера диктуемых учителем предложений, например: - рыбы дышат кислородом; - кислород входит в состав перманганата калия и т.д. Этап начинаем с характеристики кислорода (физические свойства), которую учащиеся расскажут устно в беседе с учителем. Учитель уточнит, что это физические свойства вещества. На сегодняшнем уроке ребята познакомятся с химическими свойствами вещества кислорода, т.е. возможностями его превращения. Для более осознанного осмысления темы урока необходимо поставить конкретные задачи перед учениками: - наблюдать внешние проявления (признаки) превращений; - определить главное свойство кислорода. После этого учитель может обратиться к ЦОР № 49,53 опытам: горение различных простых веществ в кислороде. 2. Усвоение новых знаний Используемые средства обучения Примечание: результатом просмотра опытов должен стать вывод о том, что кислород не горит, а поддерживает горение. При этом явлении образуются новые вещества, 25 следовательно, это химическое явление. Учащиеся прослушают и воспроизведут определение реакции горения. С целью определения состава образовавшихся веществ учащиеся вместе с учителем сделают запись схем данных превращений. Учитель может задать вопрос: что общего в образующихся при горении веществах? После этого вводим понятие «оксиды». Учитель пояснит, что названия (оксид) подчёркивают, что в состав данного вещества входят атомы кислорода (Oxygenium), а также то, что оксиды образуют как металлы, так и неметаллы. 3. Закрепление изученного материала 4. Домашнее задание Закрепление можно провести в виде асс повой работы. Задание группам будет одинаковым: собрать полную характеристику вещества кислорода. Затем можно попросить ребят выполнить (устно) упражнение. С этой целью можно воспользоваться ЦОР. ЦОР № 55 ЦОР № 54 ЦОР № 60 ЦОР № 59 ЦОР № 58,56, упр. № 4,7 § 8 (до слов: «Оксиды – вещества, широко распространенные на Земле…»), упр.2, § 9, упр. после параграфа. Урок № 12. «Получение кислорода и изучение его свойств. Практическая работа 3» Задачи урока: продолжать формировать навыки работы с лабораторным оборудованием, умения получать газ, собирать его методом вытеснения воздуха и воды и доказывать наличие газа, а также проводить наблюдения, делать выводы. Оборудование: ЦОР № 49,50,51, оборудование и реактивы для получения кислорода из перманганата калия и пероксида водорода. Название этапа урока 1. Актуализация знаний учащихся Содержание этапа Ответственный этап. Необходимо не только провести проверку домашнего задания, в которую включим такую работу, как прочитать формулу оксида и назвать вещество, но и повторить свойства кислорода, признаки обнаружения реакции горения, правила работы в химической лаборатории (особенно пункты 3,4,5,6 см. практическую работу 1 учебника). 26 Используемые средства обучения 2. Практическая часть урока. После конкретизации задач практической работы (получить кислород разложением перманганата калия и пероксида водорода и собирание его методом вытеснения воды и воздуха – в 2 пробирки) повторяем способ определения кислорода по его свойствам. Для подтверждения свойств кислорода можно предложить ребятам не только лучинку, но и кусочек угля. ЦОР № 49,50,51. Примечание: очень хорошо, если учитель попросит учащихся определить условия разложения веществ в каждом случае («определите различия при протекании реакций разложения перманганата калия и пероксида водорода»), так как при этом формируются навыки наблюдения за реакцией. Советуем написать схемы разложения веществ (не обязательно с помощью химических формул). После работы учитель обсудит выводы, сделанные ребятами. 3. Домашнее задание Повторить определение оксидов. Урок № 13. «Оксиды» Задачи урока: расширить представления учащихся об оксидах, познакомив с важнейшими представителями. Оборудование: ЦОР № 59,60,62,63,64,65,66, образцы природных оксидов (красный, бурый, магнитный железняки, глина, минерал пиролюзит и т.д.). Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения После анализа практической работы учитель предложит учащимся следующее задание: из написанных химических формул выберите формулы оксидов и назовите их. Примечание: учитель может организовать индивидуальную работу или групповую (например, в виде соревнования за определенный промежуток времени кто найдет больше формул оксидов). Также в виде групповой работы можно организовать повторение определения оксидов (какая команда четче проговорит определение), а затем сравнить их определения с определением, данным в ЦОР. Можно предложить вспомнить и различные исторические названия оксидов. 27 ЦОР № 60 ЦОР № 59 2. Усвоение новых знаний Учитель продолжает демонстрировать оксиды в виде природных соединений, одновременно, давая им названия. С помощью беседы учитель подведет учащихся к выводу о способах получения оксидов (реакция разложения сложных веществ и горения простых – реакция синтеза). Необходимо также акцентировать внимание на то, что простые вещества могут соединяться не ЦОР № 62,63 только с кислородом, но и с другими веществами, но только соединения с кислородом называются оксидами, а реакция синтеза оксидов из простых веществ – реакцией окисления. Примечание: в зависимости от уровня подготовленности класса учитель на данном уроке может начать формировать умения называть бинарные соединения по аналогии с оксидами, таким образом, расширяя понятие сложное вещество, состоящее из двух химических элементов (сульфиды, хлориды и т.д.). Далее учитель расскажет ученикам о наиболее распространенных оксидах (углекислый газ, угарный газ, кремнезем, воде). Обратим внимание, что на данном уроке нет необходимости подробно останавливать на воде, так как ей посвящены следующие уроки. Учитель, продолжая рассказ, задаст вопрос: «Какова роль реакции окисления в природе?» (с одной стороны она является причиной разрушения металлов, с другой – защищает металл). Выслушав гипотезы учащихся, учитель резюмирует: реакция является неотъемлемой частью процесса круговорота химических элементов. Здесь же можно предложить ребятам классифицировать оксиды (они уже знают об оксидах металлов и неметаллов) по физическим свойствам: агрегатному состоянию, растворимости в воде. Такой прием позволит прививать навыки анализа у детей. В свете представляемых учащимися гипотез учитель задаст провокационный вопрос, к какой группе оксидов можно отнести воду? Учащиеся сами придут к выводу об универсальности данного соединения, а учитель объявит, что об этом оксиде они поговорят на следующем уроке. (таким образом создастся интрига). 28 ЦОР № 64,65 3. Закрепление изученного материала После краткого подведения итогов учитель может предложить закрепляющие задания из ЦОР. 4. Домашнее задание § 8 (до конца), упр. 5,6. ЦОР № 66 Урок № 14. «Вода как сложное вещество. Распространение в природе. Физические свойства» Задачи урока: расширить знания учащихся о воде как представителя сложных веществ – оксидов, её распространении в природе и значении в жизни всего живого на Земле, формировать грамотное отношение к воде. Оборудование: ЦОР № 67,20,61,71,18,91 (слайд 1) Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа После проверки домашнего задания учитель повторит с учащимися первоначальную классификацию веществ и попросит определить место воды в данной классификации. Уместен вопрос учителя: «как доказать, что вода является сложным веществом?» После приведения учащимися гипотез учитель демонстрирует эксперимент разложения воды электрическим током. В начале данного этапа учитель, опираясь на знания ребят и их жизненный опыт, просит составить характеристику вещества – воды. Затем необходимо уточнить данные о воде как одном из самых распространенных веществ на Земле, а именно: Почти ¾ поверхности Земли покрыто водой. Большая часть воды сосредоточена в морях и океанах, но она есть и под землей, а также составляет ледники. Общепринято, что жизнь возникла из воды. Доказательствами этому служит то, что любая клетка организмов содержит воду, мозг человека содержит 81% воды, кости – 30%, печень – 70%, мышцы – 50 – 75%, почки – 83%, а из 5 л крови – 4 л – вода. Без пищи человек может обходиться 30 дней, а без воды – не более 3 дней. Примечание: по усмотрению учителя эти данные ученики могут записать. 29 Используемые средства обучения ЦОР № 67 ЦОР № 20 Подытоживая уточнения, учитель с помощью видеоролика просит учащихся записать физические свойства воды в тетрадь. Примечание: кроме агрегатного состояния необходимо записать плотность воды, температуру кипения и замерзания, а также важный факт: вода – универсальный растворитель. С целью напоминания можно использовать информацию по плотности веществ. Далее следует рассмотреть строение молекулы воды. 3. Закрепление изученного материала 4. Домашнее задание ЦОР № 71 ЦОР № 18 ЦОР № 91 На данном этапе можно провести обобщение ЦОР № 61 полученной информации и подвести итог: круговорот воды в природе – необходимый процесс для жизни на Земле. Учитель моет расширить представления учащихся о круговороте, уточнив, что вода в природе совершает два круговорота. Большой круговорот: его ребята могли наблюдать с помощью анимационного видеоролика, и малый, который связан непосредственно с живыми организмами: растения получают воду из почвы и атмосферы, она попадает в организм животных, откуда снова возвращается в почву и воздух с выделениями животных. Подготовить рассказ о физических свойствах, её распространении в природе. Урок № 15. «Вода как растворитель. Растворы» Задачи урока: расширить знания учащихся о смесях на примере растворов, начать формирование понятий «доля», «насыщенный раствор». Оборудование: ЦОР № 11,72,73,74,75,76, два стакана, мерные цилиндры, сахар, вода, стеклянная палочка, образец природных растворов (минеральная вода), Название этапа урока 1. Актуализация знаний учащихся Содержание этапа После проверки домашнего задания, которое можно организовать, как соревнование на лучший рассказ о воде учитель просит ребят вспомнить, что такое смеси и какие смеси им известны (по агрегатному состоянию и величине частиц компонентов смеси). Примечание: соревнование можно провести по рядам или по командам. Для этого можно пустить лист, в котором ребята каждой парты (или команды) последовательно должны вписать не более одной фразы о воде за ограниченное количество минут, которое установит учитель. Оценивают сами ребята. Только необходимо 30 Используемые средства обучения выстроить перед ними критерии оценки. Например, больше всего неповторяющихся фраз, дополнительные сведения, о которых не шла речь на предыдущем уроке, стиль изложения и т.д. Учитель должен творчески подойти к данной форме работы. 2. Усвоение новых знаний Организация учебного затруднения Разрешение учебного затруднения В начале этапа учитель напомнит, что одной из важнейших характеристик вещества является его растворимость в воде. С этой целью он повторит показ эксперимента растворимости ЦОР № 11 веществ в воде, но без звука, и попросит прокомментировать его. Теперь учитель задаст провокационный вопрос: можно ли на Земле встретить воду как чистое вещество? После озвучивания гипотез учитель обратится к ЦОР № 72,73 ЦОР. Видеоролик на ЦОР № 72 можно попросить прокомментировать учащихся. Учащиеся придут к выводу о том, что большая часть воды встречается в виде гомогенной смеси, которую мы назвали раствором. Учитель продолжит: «из каких компонентов состоит раствор?» Учащиеся легко приходят к выводам: 1) растворы состоят из воды и растворенного в ней вещества; 2) масса раствора состоит из суммы масс компонентов раствора (воды и растворенного вещества). Учитель запишет последний вывод с помощью математических символов: mр-ра = mв-ва + m (Н2О). На этом этапе можно ввести первоначальное представление о концентрации. С этой целью учитель проведет эксперимент: В два стакана с одинаковым количеством воды насыплет разное количество сахара и размешает. Вопрос к учащимся: «чем отличаются эти два раствора?» Для полной картины представляемого явления учитель перельёт растворы в мерные цилиндры, чтобы ученики увидели разный объем в них. Примечание: опыт показывает, что наряду с такими ответами, как «один раствор более сладкий», обязательно будет и такой: «один раствор более концентрированный». Это и может послужить поводом для раскрытия понятия «массовая доля вещества в растворе, концентрация». Учитель с помощью шариков разных цветов (от шаростержневых моделей) или других объектов вводит понятие «доля». При переходе к применению данного понятия к растворам учащиеся в диалоге с учителем довольно легко смогут определить долю 31 вещества в растворе как долю от целого числа. Примечание: будет уместным провести небольшую устную работу по расчету доли вещества в растворах. Например: раствор, масса которого 100 г содержит 10 г соли. Какова массовая доля соли в растворе? Или: в воде массой 100 г растворили 5 г вещества. Какова доля растворенного вещества? 3. Закрепление изученного материала 4. Домашнее задание Этап можно закончить демонстрацией опыта по дальнейшему растворению сахара в одном из растворов, которые демонстрировались ранее. Сколько сахара можно растворить в данном объеме воды? В диалоге с учащимися учитель вводит понятие «насыщенный раствор». Ученики могут записать, как классификацию растворов: насыщенные и ненасыщенные с определениями содержаний данных понятий. Для закрепления темы урока учитель может поработать над понятием «доля», а также остановиться на том, что природная вода, как смесь, в которую могут входить не только Образец природной воды твердые растворимые вещества, но и газы. Итогом урока должна стать беседа о загрязнении воды (учитель предложит видеоролик ЦОР № 74 и задаст вопрос: «от чего ещё может ЦОР № 74,75,76 загрязняться природная вода?»). После беседы можно продолжить демонстрацию видеоролика ЦОР № 75, дополнив его своими пояснениями. Способы очистки воды учитель попросит вспомнить самих учеников или, показав видеоролик ЦОР № 76, попросит прокомментировать, какие методы были использованы? прочитать о минеральной воде в Приложении для любознательных. Выполнить задачу: рассчитать массу воды и соли для приготовления 120 г раствора, в котором доля вещества составляла бы ¼ часть. Урок № 16. «Массовая доля вещества в растворе» Задачи урока: расширить знания учащихся о смесях на примере растворов, продолжить формирование понятий «доля», «массовая концентрация», научить производить математические расчеты для приготовления растворов заданной концентрации. Оборудование: ЦОР № 81, оборудование и реактивы для приготовления растворов разной концентрации. 32 Название этапа урока Содержание этапа 1. Актуализация и усвоение новых знаний учащихся После проверки и коррекции домашнего задания учитель расширит понятие концентрации, пояснив, что доля вещества в растворе может быть выражена в процентах. Учитель демонстрирует опыт: приготовление раствора и определение доли вещества в нём. Учащиеся должны записать формулу выражения концентрации: ω= Используемые средства обучения Оборудование и реактивы для приготовления раствора mв-ва * 100% mр-ра а также следствия из данной формулы. Примечание: процесс пояснений учитель может применить согласно применяемой им методике и формам работы. Учащиеся могут записать: масса вещества в определенной массе раствора, выраженная в долях от единицы или в процентах, называется массовой концентрацией. Учитель подытоживает, что существуют и другие способы выражения концентрации растворов. 2. Закрепление изученного материала Для закрепления учитель использует сборники задач, применяемые учителем, а также упр. 9 ЦОР № 81. Данную задачу можно решить, распределив учащихся у компьютеров группами с последующей проверкой. Учитель может дополнить и расширить познания учащихся следующим заданием: Как изменится масса раствора и массовая доля вещества в нём, если к полученному раствору добавить 10 г воды (или 5 г вещества), выпарить раствор так, чтобы его масса уменьшилась на 10 г и т.д. Таким образом, учащиеся получают первоначальные навыки работы с растворами. 3. Домашнее задание Решение задач, данных учителем, на вычисление массовой доли веществ в растворах, а также вычисления массы компонентов растворов для приготовления раствора данной концентрации (2 – 3 задачи). 33 ЦОР № 81, упр. 9 Урок № 17. «Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа 4» Задачи урока: продолжать формировать навыки работы с лабораторным оборудованием, познакомить с понятием «массовая концентрация», научить производить математические расчеты для приготовления растворов заданной концентрации. Оборудование: ЦОР № 2, оборудование и реактивы согласно практической работе учебника. Название этапа урока 1. Актуализация знаний учащихся Содержание этапа Сначала вместе с учащимися повторяем правила работы в химической лаборатории. Просим ребят подумать и ответить на вопрос, какое оборудование необходимо для приготовления раствора? С этой целью демонстрируем ЦОР №2, а учащиеся должны выбрать и предложить необходимое. 2. Практическая часть урока. На данном этапе учитель осуществит проверку и коррекцию домашнего задания (решение задачи). Практическая часть осуществляется согласно тексту учебной практической работы 3. 3. Домашнее задание § 10, упр. 3,4. Используемые средства обучения ЦОР №2 Урок № 18. «Что нам известно о веществах» Задачи урока: обобщить и систематизировать знания учащихся о веществах, смесях, провести текущий контроль знаний учащихся. Оборудование: ЦОР № 67,68,69,70,71, тексты контрольной (проверочной) работы. Название этапа урока 1. Обобщение знаний учащихся Содержание этапа Этот этап учитель может организовать с помощью ЦОР в виде групповой работы. Задания группам: 1) за 1 мин приведите как можно больше примеров веществ, относящихся к простым или сложным веществам; 34 Используемые средства обучения ЦОР № 67 Примечание: сначала учитель покажет слайд с классификацией, а ребята прокомментируют его. Затем выполнят задание. 2) За 1 мин приведите по одному примеру гомогенной и гетерогенной смеси, состоящее из двух компонентов, и передайте свои примеры в соседнюю группу. ЦОР № 68,69 Примечание: задание даём, как и первое, после просмотра и комментариев ЦОР. Для чего примеры передаются в другую группу? За 1 мин соседняя группа должна определить метод разделения данного примера смеси и отдать обратно. Группа, передавшая задание, оценивает представленный метод. 3) После просмотра видеоролика учитель спросит учащихся: «что ещё им известно о растворах?» и повторит с ними понятие массовая доля вещества в растворе. ЦОР № 70 Примечание: задание организуем также в группах: определите массовую долю вещества, если в 80 г воды растворили 5 г соли. 4) Приведите примеры (по одному) веществ, находящихся в разных агрегатных состояниях. Время ограничиваем – 1 мин. ЦОР № 71 К данному видеоролику задание может быть и таким: за 30 сек вспомните, что ещё вам известно о воде, запишите и передайте соседней группе для оценивания. Примечание: 1) учитель должен постоянно определять количество отведенного времени на задания и оценивание. На всю работу нужно отвести не более половины урока. 2) Оценки заданий каждой из групп необходимо фиксировать. Тогда в конце такой работы все члены групп получат общую групповую оценку, которую учитель вправе поставить в журнал или считать её добавочным баллом при оценивании индивидуальной проверочной работы. 3) Чтобы ребятам было проще оценивать своих ровесников, советуем предоставить им выбор из 10-бальной шкалы. 2. Систематизация и контроль знаний На этом этапе учитель может провести индивидуальную проверочную работу по изученным темам в соответствии со своим планом и дидактическим материалом. 3. Домашнее задание Повторить содержание определений «химическая формула», «коэффициент», «индекс». 35 Урок № 19. «Состав, строение и свойства веществ: физические и химические» Задачи урока: продолжить формирование понятия о предмете химии, химических явлениях как важнейшей составляющей предмета, расширить знания учащихся о составе и строении веществ, показать зависимость химических свойств от состава и строения веществ. Оборудование: ЦОР № 20,77,78,79,80,84,85,86,87,91,93, кристаллические решетки поваренной соли, алмаза, углекислого газа, прокаленный сульфат меди (II), стакан с водой, натрий, оксид кальция, кислотно-основный индикатор (универсальный), стеклянная палочка. Название этапа урока 1. Актуализация знаний учащихся 2. Усвоение новых знаний Содержание этапа Учитель вспомнит с ребятами, что изучает химия и что они знают о веществах, а также классификацию веществ (простые и сложные). С этой целью он попросит выполнить упр. ЦОР. Далее следует разобрать, каким образом учащиеся «догадались», какие вещества являются простыми и какую информацию несет химическая формула. Здесь же учитель может ввести определение структурной формулы, которая показывает не только качественный и количественный состав реальных или представляемых молекул, но и последовательность соединения атомов в них. В качестве примера можно использовать структурную формулу воды (это вещество хорошо знакомо). Самый ответственный этап. Учитель демонстрирует ЦОР № 77 и задает вопрос: - о чём свидетельствует эксперимент? (ответ: является одним из доказательств дискретности веществ). Следующие вопросы диалога: - из каких частиц состоят вещества? После ответов учащихся учитель выводит определение молекулы, атома, и дополняет информацию – ионы. Вывод, к которому необходимо подвести учащихся: вещества бывают молекулярного и немолекулярного состава (атомные и ионные). Учителю необходимо привести примеры, когда атомы одного и того же химического элемента могут быть в составе простого и сложного веществ (например: атомы водорода в составе молекулы простого вещества водорода и молекулы сложного вещества – воды, атомы 36 Используемые средства обучения ЦОР № 84 ЦОР № 93, 91 ЦОР № 77 ЦОР № 85,86,87 химического элемента хлора в составе простого вещества – хлора и сложного – поваренной соли). Учитель может продемонстрировать состав некоторых веществ с помощью моделей кристаллических решеток, с помощью которых ребята должны уяснить, что химические формулы ионных или атомных веществ отражают лишь состав кристаллов этих веществ, так как имеют атомный или ионный состав. Затем учитель задает следующие вопросы: «чем отличается одно вещество от другого?» и «что такое свойства веществ?» Учащиеся уже знакомы с физическими свойствами веществ. Поэтому учитель может попросить их вспомнить и записать физические признаки, по которым одно вещество отличается от других. (например, за ограниченный промежуток времени вспомнить как можно больше физических свойств и записать). Проверкой степени усвоения данного аспекта темы может служить ЦОР № 78. Кристаллические решетки поваренной соли, алмаза, углекислого газа ЦОР № 78 Примечание: эту часть работы можно оценить в виде накопительного балла за работу на уроке. Те, кто перечислил все названные в ЦОР свойства, ставят себе 1 балл. Далее учитель демонстрирует: 1) растворение сульфата меди (II) в воде (о чем говорит изменение окраски раствора? К каким свойствам воды можно отнести это свойство?) 2) реакцию разложения воды; 3) реакцию воды с металлом; 4) реакцию воды с оксидом металла. Учащиеся наблюдают изменение свойств воды, то есть образование новых веществ, и делают вывод, что вещества обладают также химическими свойствами. Учитель может уточнить, что изучение химические свойств – предмет химии, и попросить учащихся определить, что же можно называть химическими свойствами? После приведения гипотез учитель предоставит примеры химических свойств как способности веществ превращаться в результате взаимодействия с другими веществами. Учащиеся должны помнить, что в процессе химической реакции атомы не разрушаются, а перегруппировываются. В этом – суть химического превращения. Превращения веществ называют химической реакцией. 37 Сульфат меди и вода ЦОР № 20. Натрий, оксид кальция, вода ЦОР № 79 Уместен вопрос учителя: «можно ли отличить химическое превращение от физического свойства вещества?», а также запись признаков, по которым химическая реакция отличается от физического явления: изменение цвета, выпадение осадка, выделение газа, изменение температуры. 3. Закрепление изученного материала 4. Домашнее задание На данном этапе урока учителю необходимо поработать с ЦОР №80, к которому можно дать следующее задание: Какие из приведенных веществ обладают горючестью, токсичностью, способностью к ржавлению? Можно также поработать с упр.2 § 12. § 11, 12, подготовить ответы на вопросы после параграфов. ЦОР № 80 Урок № 20. «Валентность. Определение валентности по формулам веществ из двух химических элементов» Задачи урока: дать представление о составе атома, раскрыть понятие «валентность», научить определять валентность химических элементов в бинарных соединениях. Оборудование: ЦОР № 21,82,88,89,90,91,92,93,94,95,96,97, периодическая таблица химических элементов Д.И.Менделеева. Название этапа урока 1. Актуализация знаний учащихся 2. Усвоение новых знаний Содержание этапа Используемые средства обучения ЦОР № 21 В начале урока учитель вспомнит с учащимися содержание понятия «химический элемент». Посредством беседы необходимо повторить отличия состава простых веществ от сложных. А также суть химической реакции. Данный этап следует начать с более подробного ЦОР № 82 рассмотрения состава атома. Примечание: на данном этапе познания химии нет необходимости приводить доказательства делимости атома, нужно лишь дать пояснения о том, каким образом могут возникать химические связи (взаимодействие атомов внешними электронными слоями). При рассмотрении теории Дж. Дальтона необходимо обратить внимание учащихся на тот факт, атомы химических элементов присоединяют разное количество атомов других химических элементов. Учитель пояснит, а учащиеся запишут, состав атомов с помощью таблицы ЦОР. Акцент внимания учеников должен быть на следующем: 38 ЦОР № 88 1) атом – электронейтральная частица; 2) взаимодействие атомов возможно только с помощью электронов, наиболее удаленных от центра атома – ядра; 3) взаимодействие атомов приводит к образованию связей между ними; 4) каждый атом может образовать строго определенное количество связей; 5) электроны, которые участвуют во взаимодействии с другими атомами, называют валентными электронами. ЦОР № 89 Примечание: привлечение внимания к ЦОР 89 должно привести к выводу о том, что валентность - свойство каждого атома. Таким образом, учитель подведет учащихся к понятию «валентность». Учитель пояснит, что за единицу валентности принята валентность самого простого атома – атома водорода, но существуют и другие химические элементы, имеющие такую же валентность. Здесь желательно обратиться к периодической таблице Д.И.Менделеева, с помощью которой показать, что максимальная валентность, Периодическая проявляемая атомами, не может быть больше 8. таблица Также можно пояснить, что атомы могут проявлять разную валентность по отношению к атомам других химических элементов, а с помощью таблицы (номера группы) можно определить высшую валентность атома любого химического элемента. Желательно провести небольшую тренировку по определению высшей валентности некоторых химических элементов с помощью периодической таблицы. Такую работу можно расценить как пропедевтический прием. Далее ребята запишут в тетрадь валентности некоторых химических элементов, а учитель укажет на вид записи валентностей атомов – при помощи римских цифр. Учитель уточнит, что сумма всех валентностей одного атома должна быть равна сумме всех валентностей другого атома в соединении, состоящем из двух химических элементов. ЦОР № 92 Примечание: учитель при пояснении воспользуется приёмом, применяемым в своей методике работы. На примере молекулы воды поясняем данное положение: атом водорода имеет одну валентность, а атом кислорода может иметь две валентности. Следовательно, для реализации своих возможностей атом кислорода присоединит два атома водорода, что подтверждает молекулярная формула, а структурная – показывает порядок соединения атомов этих двух химических элементов в молекуле. 39 ЦОР № 90,91 Сумма валентностей данных атомов выглядит следующим образом: I * 2атома = II * 1атом. Или в общем виде, как предлагается авторами данного УМК. 3. Закрепление изученного материала 4. Домашнее задание Закрепление проводим в виде групповой или фронтальной работы по определению валентностей химических элементов по формулам бинарных соединений. При использовании ЦОР учитель задаст вопросы к слайдам: - какую валентность проявляет каждый из атомов, образующих данное соединение? - какова сумма валентностей каждого из атомов? § 13, ответить устно на вопросы после параграфа, § 14, упр. 1,2. ЦОР № 93 ЦОР № 94,95,96,97 Урок № 21. «Составление формул веществ по валентности химических элементов» Задачи урока: научить составлять химические формулы веществ по валентности, начать формирование умений называть бинарные соединения. Оборудование: ЦОР № 98,99,100,101,102. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения С целью коррекции умений и навыков учащихся урок необходимо начать с проверки домашнего задания. Учитель может организовать фронтальную или групповую работу по теме предыдущего урока. 2. Усвоение новых знаний Данный этап учитель может провести дифференцированно: часть ребят учится составлять формулы по валентности с помощью ЦОР, а часть – с учителем. Примечание: 1) ребятам, работающим с компьютером, следует пояснить, что в алгоритме компьтера применяется понятие «степень окисления», с которым они будут знакомиться позднее. Алгоритм идентичен определению формулы по валентности, так как часто степень окисления и валентность атома численно совпадают. Следует заметить, что можно предложить несколько способов определения индексов в химической формуле и записать алгоритмы в виде схем, которые могут выглядеть следующим образом: 40 ЦОР № 98 1 способ. Надпишите над знаками значения валентности атомов. Определите наименьшее общее кратное этих валентностей. 6 ЦОР № 99 III II Fe O Разделите последовательно кратное на каждую валентность. Значения запишите рядом со знаками элементов (справа): Fe 2O 3 6:3=2 6:2= 3 ЦОР № 100 Внимание: индексы «1» не записываются. 2 способ. Значение валентности одного элемента нацело делится на значение валентности другого элемента Поделив степени окисления, запишите индекс рядом со знаком элемента с меньшей валентностью. IV II Si О (4 : 2 = 2 ) = > SiО2 3 способ. Значения валентностей элементов не делятся друг на друга: Индексы записывают крест-накрест. III II Fe2 O3 Учитель может попросить учащихся предложить ЦОР № 101 гипотезы для решения следующей проблемы, какие индексы необходимо поставить, если атомы имеют одинаковую валентность? В ходе обсуждения учитель может предоставить ЦОР для самостоятельного изучения, после чего предложит подобные задания в качестве закрепления данного аспекта (хлорид водорода, оксид углерода (II), фосфид алюминия и т.д.). Обратим внимание: при написании химических формул необходимо проговаривать названия веществ. В конце этапа учитель задаст вопрос: «Что общего в названии рассмотренных веществ?» Если ребята затрудняются, то учитель должен пояснить, что названия (номенклатура) бинарных соединений имеют определенные правила: латинское название второго химического элемента с суффиксом «ид» и русское название первого в родительном падеже. Следует тут же привести несколько примеров или повторить написанные ранее формулы, называя вещества. Также следует оговорить, как называют бинарные соединения с химическим элементом, имеющим переменную валентность. 41 3. Закрепление изученного материала Закрепление данной темы лучше провести фронтально с помощью упр. 1 § 15, а также в виде индивидуальной работы с компьютерными тестами. 4. Домашнее задание § 15, упр. 2 (и 1, если оно не выполнялось на уроке). ЦОР № 102 Урок № 22. «Атомная и молекулярная массы» Задачи урока: сформировать представление об относительных атомной и молекулярной массах, научить рассчитывать относительную молекулярную массу. Оборудование: ЦОР № (102),82,103,104,106,107,109,110, периодическая таблица Д.И.Менделеева, шаростержневые модели. Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа Используемые средства обучения ЦОР № 102 Первый этап необходимо отвести для проверки домашнего задания. При этом учитель может использовать ЦОР №102 (если он не был использован) или дидактические материалы. В начале этапа учитель вспомнит с ребятами ЦОР № 82 положения атомной теории Дж. Дальтона. Обсудив вопрос отличий атомов разных химических элементов, учитель акцентирует внимание учащихся на отличие массы разных атомов. Как измерить массу атома? Учащиеся приведут гипотезы, после чего учитель может продемонстрировать записи ЦОР № 103 атомных масс водорода, кислорода и др., выраженных в граммах. Вывод учащихся: подобное выражение атомных масс весьма неудобно. Тогда учитель пояснит, что была принята особая единица атомной массы – масса самого маленького атома водорода. 1 а.е.м. < 1 г в 6,02 * 1023 раз. Массы других атомов сравнили с этой массой и получили (можно записать): mат.(O) :mат.(H) = 2.67 * 10-23 :1.66 * 10-24=16 на вопрос учителя: «Что означает эта цифра?», ученики легко ответят, а учитель уточнит: масса атома водорода равна 1 а.е.м., следовательно масса атома кислорода – 16 а.е.м. После этого учитель пояснит, что массы всех других атомов также сравнили с массой водорода и получили целые числа, отражающие 42 массу соответствующего атома относительно массы самого маленького атома. Эту массу назвали относительной атомной массой. Учащиеся запишут её обозначение – Аr. Примечание: для того, чтобы ученики понимали истинный смысл относительной атомной массы, учитель может провести краткую работу над этим понятием: рассчитайте абсолютную массу атома, если известно, что относительная атомная масса равна 14 и т.д. кроме того можно оговорить, что 1 а.е.м. равна массе 1/12 массы атома углерода. Можно провести здесь такую работу (с помощью ЦОР 103): какова относительная атомная масса элементов, представленных в ЦОР № 104 таблице. Подобная работа поможет учащимся сориентироваться в периодической таблице Д.И. ЦОР № 103 Менделеева. Периодическая Учащиеся могут обратить внимание на то, что в таблица периодической таблице массы атомов – десятичные дроби. Учитель пояснит, что принято округлять их до целых чисел, кроме атомной массы хлора (35,5), а причину данного явления они рассмотрят чуть дальше. В контексте с этой частью урока учитель прояснит значение относительной молекулярной массы (Мr). Хорошо, если для этого учитель воспользуется шаростержневыми ЦОР № 106 Шаростержневые моделями молекул некоторых веществ. модели молекул Осуществление практического расчета относительной молекулярной массы учитель проводит с помощью самостоятельной работы учащихся с алгоритмом и конкретных примеров. Примечание: будет правильным постоянно акцентировать ЦОР № 107 внимание: на что указывает относительная молекулярная ЦОР № 110 (атомная) масса? 3. Закрепление изученного материала 4. Домашнее задание Закрепление материала урока проводим в виде групповой работы (кто быстрее) по заданию ЦОР. (учитель должен подсказать формулы оговариваемых веществ). Если есть время, то можно предложить сравнить плотности данных в ЦОР газов. § 16, упр. 3 (устно ответить), §17, упр. 1,2. 43 ЦОР № 109 Урок № 23. «Массовая доля химического элемента в веществе» Задачи урока: расширить знания учащихся о химической формуле с точки зрения массовых отношений химических элементов, научить определять химическую формулу вещества по массовым долям входящих в её состав химических элементов. Оборудование: ЦОР № 111,112,113,114,115, шаростержневые модели молекул метана, углекислого газа и т.д.. Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа В целях проверки уровня усвоения материала на предыдущем уроке желательно провести проверку домашнего задания (фронтально), и краткую проверочную работу (индивидуально) на вычисление относительной молекулярной массы различных веществ. Этап можно начать с повторения характеристики вещества посредством химической формулы (какую информацию несёт химическая формула). С понятием «массовая доля» учащиеся уже знакомы, поэтому доля химического элемента в веществе усваивается ребятами довольно легко. Учитель может пояснить содержание этого понятия с помощью всё тех же шаростержневых моделей молекул. При этом логический переход к данному понятию может быть следующим: соотношения атомов в молекуле → отношения масс атомов → массовая доля элемента. Например: для вещества формула которого Cu2S отношения атомов Cu : S = 2 : 1, Отношения масс? (самостоятельное решение + ЦОР в качестве проверки и коррекции). После отработки и пояснений смысла понятия «массовые отношения» учитель задает провокационный вопрос: изменятся ли массовые отношения элементов, если взять другую массу? После просмотра видеоролика опыта взаимодействия меди с серой учащиеся с помощью учителя определят массу соединившейся с медью серы и вычислят простейшие массовые отношения в каждом случае. Вывод им поможет сделать ЦОР. Кроме того, учитель может раскрыть содержание закона постоянства состава вещества Ж.Л.Пруста, гласящего: Вещества молекулярного строения имеют постоянный состав независимо от способа их получения. 44 Используемые средства обучения ЦОР № 112 ЦОР № 113 ЦОР № 111 Теперь можно акцентировать внимание учеников на следующем: если массовые отношения элементов – постоянные величины, то можно ли с их помощью представить химическую формулу вещества? Учитель покажет на примере формулы бинарного соединения переход: массовые отношения → химическая формула. Примечание: учитель пояснит данный аспект в соответствии с применяемой им методикой. В конце данного этапа следует рассмотреть ЦОР № 114 вопрос о массовой доле элемента в веществе (по аналогии с массовой долей вещества в растворе). Учитель в зависимости от контингента класса использует ЦОР в качестве наглядного пособия или организует самостоятельную работу с данным алгоритмом. ЦОР № 115 Логично завершить данный этап формированием навыка составлять химическую формулу по массовой доле химических элементов и пояснить значение подобных вычислений в практической деятельности человека. 3. Закрепление изученного материала 4. Домашнее задание На этом этапе можно предложить решение задач по теме. С этой целью можно использовать задания 1,2 после параграфа 18. § 18, упр.3. Следующие уроки, посвященные количеству вещества и молярной массе, считаем возможным объединить, так как эти два понятия неразделимы. Урок № 24. «Количество вещества. Моль. Молярная масса» Задачи урока: сформировать понятие о количестве вещества и единицах его измерения, показать связь физико-химических величин: массы, количества вещества, числа частиц. Оборудование: ЦОР № 90,116,117,118,119,120,121,122,123,124,125. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Проверка домашнего задания должна быть краткой, так как тема данного урока довольно сложна. Поэтому можно предложить учащимся краткую (на 5 мин) задачу на вычисление массовой доли элементов в молекуле. Примечание: учитель может и вовсе отказаться от проверки домашнего задания на этом уроке и включить элементы 45 Используемые средства обучения проверки в урок-обобщение материала позже. 2. Усвоение новых знаний Данная тема – одна из самых сложных для объяснения, так как понятие «моль» - весьма абстрактно. Учитель вправе воспользоваться той методикой объяснения, которая ему ближе. Мы предлагаем один из вариантов. Атомы в веществах соединяются в строго определенных количественных соотношениях. Например, в 1 молекуле воды (Н2О) на 2 атома водорода приходится 1 атом кислорода. Значит, для образования этой молекулы необходимо взять такие порции веществ, чтобы на каждые два атома водорода приходился бы один атом кислорода. Как отмерить количество атомов, если они невероятно малы? В химии используется понятие «порция вещества», в которой 6,02 * 1023 атомов или молекул - 1 моль. Массу этой порции определить очень легко: 1г = 1 а.е.м.* 6,02*1023 частиц (атомов, молекул ит.д.). Следовательно, если относительная молекулярная масса (Mr) воды 18 (2*1+16а.е.м. ), то 6,02*1023 молекул воды весят 18 г, т.е. масса одного моля – молярная масса (т.е. масса 6,02*1023 молекул) будет равна 18 г или M = 18 г/моль. Учитель задает вопрос: «А сколько весит масса 2 моль воды?» (запишем это выражение: 2 Н2О). После ответа ребят необходимо обратить внимание на запись (что означает коэффициент?) и расширить представление о коэффициенте как цифре, указывающей на число молей вещества. Таким образом, можно оперировать не только граммами (миллиграммами, килограммами), но и числом частиц. Зная молярную массу, можно рассчитать массу любого количества частиц, например массу 0,5 моль (3,01*1023 частиц): m = M * n. Количество вещества обозначается буквой n, порция, в которой 6,02*1023 частиц (число Авогадро) - NA. Тогда N = NA * n. Предлагаем записать и запомнить взаимосвязь массы, молярной массы, количества вещества и числа частиц. Как видно, количество вещества – центральная 46 Просмотр ЦОР №90 ЦОР № 116 ЦОР №121,122 ЦОР № 117 ЦОР № 118,119 ЦОР № 123 3. Закрепление изученного материала 4. Домашнее задание составляющая этих вычислений. Здесь же можно показать алгоритм вычисления молярной массы и поупражняться устно. Первичное закрепление лучше проводить в группах, воспользовавшись упр. 1,2 ЦОР №120 и ЦОР № 125. ЦОР № 124 ЦОР № 120, 125 § 19, упр.2,3, § 20, упр.2. Урок № 25. «Решение задач» Задачи урока: отрабатывать навыки химических вычислений массы, числа частиц по известному количеству вещества и обратные расчеты. Оборудование: ЦОР № 116,117,118,121,124,123. Название этапа урока 1. Активизация знаний 2. Тренировочные упражнения. 3. Домашнее задание Содержание этапа В качестве опорных знаний учитель может при повторении материала прошедшего урока воспользоваться ЦОРами: - самопроверка опорных определений при выполнении диктанта или фронтальной работы. Данный урок учитель проводит с помощью дидактических материалов, отрабатывая взаимосвязь понятий «количество вещества», «молярная масса», «число частиц», а также применяя дифференцированный подход: 1) решение задач с применением алгоритма. 2) решение задач с применением в виде опорной схемы. В конце этапа учитель может предложить ученикам проверочную работу. Используемые средства обучения ЦОР № 116,117,118,121 ЦОР № 124 ЦОР № 123 Повторить классификацию веществ, свойства, по которым можно различать вещества. Урок № 26. «Металлы. Физические свойства металлов. значение металлов: меди, железа, алюминия» Задачи урока: повторить особенности простых веществ – металлов, показать относительность деления веществ на металлы и неметаллы. 47 Оборудование: ЦОР № 126,127,128,129,130,136,137,138,139,140,141,143,144, коллекции «редкие металлы» и «металлы и сплавы». Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа Используемые средства обучения На этом этапе учитель может провести анализ проверочной работы и в качестве активизации знаний может предложить задачу из упр. 6,7 § 21, добавив задание: Где атомов больше: в 3 моль железа или 3 моль алюминия? Что тяжелее: 0,5 моль меди или 0,5 моль серебра? Таким образом, учителю станет ясным уровень прочности полученных знаний по предыдущей теме и возникнет положительная установка на новую тему. В начале этапа учитель повторит с учащимися классификацию веществ и предложит просмотр ЦОР, а также коллекций. Задание к ЦОР: определите общее и отличное в представленных веществах. Далее учащиеся самостоятельно могут определить основные физические свойства металлов. Учителю необходимо уточнить два понятия: «ковкость» и «пластичность» и пояснить эти понятия с помощью модели кристаллической решетки, например, железа. Для большей наглядности учитель использует ЦОР 127, к которому учитель может задать вопрос: - Что такое ковкость? Затем учитель акцентирует внимание учащихся на то, что металлы отличаются тем, что имеют высокие температуры плавления. Так ли это? Используя ЦОР, учитель докажет ребятам, что есть металлы, которые имеют относительно низкие температуры плавления. Однако, это не есть общее свойство металлов. Данный вопрос будет рассмотрен далее при более подробном изучении строения атома и его свойств. Задание к ЦОР может быть следующим: - укажите самый легкоплавкий и тугоплавкий металл из представленных в видеоролике. Уточняя такое свойство, как теплопроводность, учитель может сначала дать просмотреть видеоролик, а затем провести беседу по вопросам: - какое свойство металлов демонстрировалось? - одинаковая ли теплопроводность у представленных металлов? - с чем это может быть связано? 48 ЦОР № 126 Коллекция «редкие металлы» ЦОР № 127 ЦОР № 128 ЦОР № 129 В результате беседы учащиеся придут к выводу: теплопроводность зависит от строения (кристаллической решетки) металлов. Следует обратить внимание на твердость металлов, как общее свойство этих веществ, зависящее от строения атома и кристаллической решетки, а также на различия металлов по этому признаку. Задание к ЦОР №136 следующее: Какой из представленных металлов является самым твердым? (подтверждение правильных выводов покажет выполнение упр. ЦОРа № 138.) В конце этапа учитель предлагает групповую работу по § 23 (в течение 5 мин представить медь (первая группа), железо (вторая группа), алюминий (третья группа)) и может оценить вклад ребят в состоявшийся диалог. С этой целью организуем самостоятельную работу с ЦОРами и текстом учебника. 3. Закрепление изученного материала 4. Домашнее задание В качестве закрепления предлагаем работу с 3,4,5 к § 23 и ЦОР. ЦОР № 139,140 ЦОР № 136,138 ЦОР № 137, 141,143,144 ЦОР № 130 § 21, устно ответить на вопросы упр. 1,3,5, § 23, упр. 2,3, приготовить рассказ о жидком металле с помощью Приложения для любознательных. Урок № 27. «Особенности строения атомов металлов на примере натрия» Задачи урока: дать понятие о металлических свойствах атома, вскрыть зависимость свойств вещества от свойства атомов, из которых оно состоит. Оборудование: ЦОР № 88,131,132,133,134,135, периодическая таблица химических элементов. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Беседа об общих свойствах металлов, а также об особенностях и применении таких металлов, как медь, железо, алюминий поможет перейти к теме настоящего урока. Примечание: можно предложить провести проверку домашнего задания в виде мини-семинара, когда ребята в группах выберут (методом, например, считалочки) металл и расскажут о нем. Остальные задают вопросы. Оценку получат все. В качестве поддержки своих представлений можно предложить учащимся слайды, использующиеся на предыдущем уроке (ЦОР № 137,139,140,141,143,144). 49 Используемые средства обучения 2. Усвоение новых знаний Чтобы начать разговор об особенностях атомов металлов, учитель вспомнит с ребятами строение атома, особенно обратить внимание надо на расположение электронов вокруг ядра, отметив, что внешние (валентные) электроны наименее всех связаны с ядром. Рассказ о строении атомов металлов необходимо связать с расположением этих химических элементов в периодической таблице (левый нижний угол). С помощью моделей атомов учитель обратит внимание учащихся на сравнительно большой радиус атомов и возможность внешних электронов делокализовываться. Учитель продемонстрирует лекцию о металлической связи и дополнит её беседой, а также вопросом: - какое ещё свойство простого вещества – металла обеспечивается наличием свободных электронов в нём? На уроке следует записать следующие понятия: «электронный газ», металлическая связь, металлическая кристаллическая решетка. ЦОР № 88, периодическая таблица химических элементов ЦОР № 131,133,134 ЦОР № 132 Примечание: учитель может на данном уроке дополнить знания учащихся: атом – электронейтральная частица. Во что превращается атом, который «потерял» внешние электроны? Можно записать схему: Ме0 – n*е = Ме+n. Тогда у учеников будет более полное представление о частицах, лежащих в узлах металлической кристаллической решётки. 3. Закрепление изученного материала Выполнение упражнений ЦОР (индивидуально) может являться закреплением на уроке. Кроме того учитель может обсудить ещё раз зависимость свойств металлов от строения их атомов, а также в диалоге предложить подумать над вопросом: почему металлы обладают металлическим блеском? 4. Домашнее задание § 22, упр. 1,2,3. ЦОР № 135 Урок № 28. «Неметаллы. Особенности строения атомов неметаллов на примере хлора» Задачи урока: рассмотреть физические свойства неметаллов в связи со строением их атомов, познакомить с явлением аллотропии на примере соединений углерода и фосфора. Оборудование: ЦОР № 145,146,147,148,149, периодическая таблица химических элементов, образцы кристаллических решеток графита, алмаза, прибор для демонстрации 50 электропроводности веществ, колба, наполненная хлором, вода, универсальный индикатор. Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа Используемые средства обучения Проверяя домашнее задание, учитель уточнит отличительные признаки атомов металлов (малое количество внешних электронов), а также расположение их в периодической системе. Исследование отличительных признаков атомов неметаллов следует начать с физических свойств простых веществ, образованных ими. С этой целью учитель продемонстрирует образцы ЦОР № 145,146,11 некоторых неметаллов и попросит дать краткую характеристику по следующему плану: 1) агрегатное состояние; 2) цвет; 3) блеск; 4) растворимость в воде (с помощью учителя и ЦОРа). О растворимости в воде кислорода ученики знают, а растворимость хлора в воде можно продемонстрировать, если приготовить заранее колбу, наполненную хлором. С помощью данного опыта познания учащихся расширятся: они узнают, что растворение может сопровождаться не только диффузией молекул, но и химическим взаимодействием вещества с водой. Учитель с помощью прибора по определению электропроводности веществ может продемонстрировать исследование электропроводности неметаллов (кислород, сера, графит). Стоит задать вопрос: «можно ли считать электропроводность графита общим свойством неметаллов?» диалог учителя с учащимися подведет к ознакомлению явления аллотропии (алмаз, состоящий также из атомов углерода, не имеет электропроводности). Желательно записать определение данного явления, а также привести ещё несколько примеров (кислород и озон, красный, белый и чёрный фосфор). Вывод, к которому необходимо подвести учащихся: неметаллы имеют прямо противоположные свойства относительно металлов. Примечание: думаем, что следует оговориться, что, как и среди металлов, среди неметаллов есть исключение: бром, агрегатное состояние которого также жидкое, как у ртути. Знакомство с атомами неметаллов лучше начать с определения их положения в периодической таблице (верхний правый угол). Вопрос о причинах подобных физических свойств неметаллов учитель рассмотрит на примере строения атома брома (можно хлора и 51 брома) и укажет на внешний электронный уровень данного атома. ЦОР № 147 Примечание: будет нелишним показать, как определяется число внешних (валентных) электронов у атомов неметаллов (номер вертикального столбика). Учащиеся сделают вывод, что именно в разнице внешних электронных слоёв атомов металлов и неметаллов и состоит причина разных физических свойств этих веществ. С помощью учителя школьники узнают, что данные атомы «не теряют своих электронов». 3. Закрепление изученного материала На данном этапе проводим сравнительную характеристику физических свойств металлов и неметаллов (учащиеся могут проанализировать самостоятельно). Для прочного усвоения знаний можно провести самостоятельную работу с помощью ЦОР. ЦОР № 148 ЦОР № 149 4. Домашнее задание § 24, упр.1,2,5 (в качестве повторения). Урок № 29. «Ионная химическая связь на примере хлорида натрия» Задачи урока: познакомить учащихся с ионами и ионной химической связью, научить записывать образование ионной химической связи. Оборудование: ЦОР № 150,151,152,153,154 Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа На этом этапе учитель может провести проверку домашнего задания, а также ещё раз проанализировать вместе с учащимися строение атомов металлов и неметаллов (можно это сделать на примерах атома магния и кислорода). Учитель начнет объяснение с того, что рассматриваемые атомы имеют столько электронов, сколько положительных зарядов (протонов) в ядре, а во внешнем слое - разное количество электронов. Однако, у атомов металлов и атомов неметаллов внешний электронный слой незавершен. Завершенным считается электронный слой, имеющий 8 электронов. Далее учитель предлагает учащимся подумать, как достичь атомам металлов и неметаллов такого «совершенства»? После гипотез учащихся можно обратиться к ЦОР и пояснить образование ионов. 52 Используемые средства обучения ЦОР № 151,152 Учитель уточнит названия положительных и отрицательных ионов, а учащиеся запишут. ЦОР № 154 Практическое осуществление данных изменений атомов желательно продемонстрировать с ЦОР № 150 помощью эксперимента. Затем учитель резюмирует: «При передаче электронов каждый атом получает завершенный электронный слой, но цена этого – потеря свободы: положительные ионы притягиваются к отрицательным». Взаимодействие атомов, приводящее к образованию системы, называется химической связью. Как назвать такую связь? Учащиеся легко «догадаются» - ионная. Определение необходимо ЦОР № 153 записать. Учитель дополнит: ионная связь образуется при взаимодействии атомов металлов и неметаллов. Примечание: на данном этапе познания важно, чтобы ученики усвоили, что ионная связь – это связь атомов металлов и неметаллов. ЦОР № 152 Схему образования связи учащиеся запишут в тетрадь. Учитель уточнит некоторые физические свойства веществ с ионной связью. 3. Закрепление изученного материала В качестве закрепления материала урока нужно потренировать ребят в написании схем образования ионной связи, например, в «молекуле» CaBr2, MgO. 4. Домашнее задание § 25, упр.1,2. Урок № 30. «Образование молекул простых веществ - неметаллов» Задачи урока: продолжить формирование понятия о химической связи, познакомить учащихся с образованием химической связи в молекулах, образованных атомами неметаллов, научить записывать схемы образования ковалентной связи. Оборудование: ЦОР № 155,156,157,158,159. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Данный этап можно посвятить проверке домашнего задания и отработке понятий предыдущего урока. С этой цель можно провести устный или письменный диктант, а также выполнить задание: из веществ, представленных формулами, выпишите вещества с ионной 53 Используемые средства обучения химической связью, запишите схему образования одного из них. Учитель самостоятельно подберёт соответствующие формулы. 2. Усвоение новых знаний На этом этапе учитель рассмотрит образование химической связи между атомами неметаллов. Для этого необходимо обратиться к учащимся с вопросами: 1) чем отличаются атомы неметаллов от атомов металлов? 2) Каким образом возможно завершение внешнего электронного слоя у атомов неметаллов? Учитель пояснит, что в случае, когда ядра взаимодействующих атомов сильно притягивают внешние (валентные) электроны, завершение происходит другим путём: через объединение валентных электронов в пары. Демонстрация образования электронной пары в молекулах разных неметаллов должна привести к выводу о возможности образования таких пар только неспаренными электронами. Поэтому учитель уточнит, что электронные пары образуют лишь неспаренные электроны, минимальное число которых у атомов неметаллов можно определить, если из 8 (максимальное число внешних электронов) вычесть № группы, в которой находится элемент. Итак, атомы неметаллов, взаимодействуя между собой, образуют ковалентную химическую связь посредством общих электронных пар. Она может быть одинарной, двойной или тройной. Количество химических связей, которое данный атом может образовать, называют валентностью. С помощью ЦОР учитель может организовать самостоятельную работу по записи схем образования ковалентной связи. Следует акцентировать внимание на то, что в рассматриваемых случаях взаимодействуют атомы одного и того же химического элемента. такая связь называется неполярной, так как передачи электронов (смещения электронной плотности) не происходит и атом остается электронейтральным. В конце этапа подводим итог: 1) условия возникновение ковалентной связи – сближение атомов на расстояние взаимодействия электронных слоев с ядрами соседнего атома; - наличие во внешнем электронном слое неспаренных электронов; 54 ЦОР № 155,158 ЦОР № 157 ЦОР № 156 ЦОР № 159 2) единица ковалентной связи – одна электронная пара; 3) число возникающих ковалентных связей равно валентности атома. 3. Закрепление изученного материала В заключении урока учитель может пояснить такое понятие, как «длина связи», а также потренировать ребят в умении записывать схемы образования ковалентной химической связи. 4. Домашнее задание § 26, ответить на вопросы в конце параграфа. Урок № 31. «Водород. Получение водорода, его физические и химические свойства» Задачи урока: познакомить учащихся с представителем неметаллов – водородом, его свойствами, способами получения, начать формирование понятия «восстановитель». Оборудование: ЦОР № 160 – 172, пробирки с газами: кислород, углекислый газ, хлор, водород, лучинка, прибор для получения газов, пробирка с порошком оксида меди (II), раствор соляной кислоты, цинк. Название этапа урока 1. Актуализация знаний учащихся 2. Усвоение новых знаний Содержание этапа Урок следует начать с повторения отличий атомов металлов от атомов неметаллов. Учитель предложит определить место атома водорода (металл или неметалл). После предоставления учащимися гипотез учитель подтвердить двойственность свойств данного атома и перейдет к простому веществу, которое образует данный атом. После просмотра модели учитель может задать вопрос: «Какой химической связью образована молекула водорода?» Учащиеся придут к выводу: вещество водород – типичный представитель простых веществ, относящихся к неметаллам. Здесь же можно обсудить распространение водорода в природе. Учитель укажет основные источники водорода на Земле. Данную работу можно провести в группах. Учитель объявляет тему и задачи урока. Данный этап можно построить следующим образом: 1) получение водорода (в лаборатории и в промышленности). 55 Используемые средства обучения ЦОР № 160 ЦОР № 163 ЦОР № 162 а) демонстрация опыта и обсуждение его. Учитель задаст следующие вопросы: - как собрать водород? (методы и положение пробирки); - каково отношение водорода к воде? - из каких веществ в лабораторных условиях можно получить водород? б) запись и обсуждение схемы реакции получения водорода лабораторным способом. Учитель введёт понятие «реакция замещения». в) предоставление информации об открытии водорода (самостоятельная работа учащихся с информацией). В связи с этим можно задать вопросы: - Как назвал водород его первооткрыватель? - что получил Кавендиш, сжигая водород? - Свяжите этот факт с этимологией названия газа. 2) физические свойства водорода. Ребята могут предложить гипотезы, которые обсуждаются классом или в группах и учитель дополнит недостающие факты. Необходимо акцентировать внимание учащихся на то, что свойства (в том числе и физические) этого вещества во много обуславливают его применение. 3) химические свойства водорода. Учитель продемонстрирует реакцию горения, предварительно обратив внимание на то, что водород необходимо проверять на чистоту. При этом, чтобы ребята самостоятельно записали схему реакции, можно сначала вывести для просмотра ЦОР № 167 и попросить определить продукт(ы) реакции горения водорода.Затем учащиеся запишут схему данной реакции. Можно здесь обратить внимание учащихся на то, что Кавендиш назвал его «горючим воздухом». Почему? Как идентифицировать водород среди других газов? Примечание: учитель может (если позволяет время урока) продемонстрировать три пробирки с собранными в них заранее газами: углекислым, кислородом и водородом. Ребята удостоверятся, что с помощью лучинки можно определить, какой газ находится в пробирке. Следует обратить внимание на причину «гремучести» водорода при горении и пояснить, что в данном случае реакция протекает так стремительно, что сопровождается взрывом (вывод о правилах безопасности при работе с водородом ученикам поможет сделать ЦОР). Учитель может расширить представление о реакциях соединения водорода: соединение с хлором, которое также можно 56 ЦОР № 165 ЦОР № 161 ЦОР № 166,164 ЦОР № 167 ЦОР № 168 продемонстрировать. Примечание: хотим напомнить, что при получении хлороводорода необходимо идентифицировать его (например, прилив в пробирку с образовавшимся хлороводородом воды и проверив раствор кислотноосновным индикатором). Свойство водорода как восстановителя также желательно продемонстрировать. (описание методики проведения данной реакции учитель найдет в любых методических пособиях). 3. Закрепление изученного материала 4. Домашнее задание Следует пояснить эту реакцию, найти общее с реакцией получения водорода из кислоты действием металла, и обобщить понятие «реакция замещения». Понятие «восстановитель» рассматриваем только с точки зрения вещества, восстанавливающего другое вещество. Обобщаем новые сведения о водороде. учитель может попросить учащихся предложить области применения водорода в связи с тем, что они узнали нового на уроке, а затем уточнить и расширить их представления. Выполнение теста поможет ребятам осмыслить вновь полученные данные. ЦОР № 169 ЦОР № 170 (определение 2) ЦОР № 171 ЦОР № 172 § 27, упр. 3,4,5,6, прочитать дополнительный материал о водороде в Приложении «Для любознательных». Урок № 32. «Как образуютя сложные вещества из неметаллов. Полярная ковалентная химическая связь» Задачи урока: повторить способ взаимодействия атомов металлов с атомами неметаллов, познакомить учащихся со способами взаимодействия атомов неметаллов, тренировать умения составлять схемы образования ковалентной химической связи. Оборудование: образец хлорида меди(II), стакан с водой, ложка для сыпучих веществ, ЦОР № 1-5, раствор соляной кислоты, лакмусовая бумага. Название этапа урока Содержание этапа 1. Активизация знаний учащихся (проверка домашнего задания) Учитель вместе с учащимися повторяет понятия: «химическая связь», «ковалентная связь», «ионная связь». С этой целью можно организовать работу учащихся по составлению схем образования химической связи в молекулах водорода и хлора (необходимо сделать акцент на том, что в образовании химической связи участвуют неспаренные электроны атомов). Затем можно предложить учащимся проведение 57 Используемые средства обучения Оборудование и лабораторного опыта: описать хлорид меди (II), пронаблюдать его растворимость в воде и составить схему образования химической связи в данной «молекуле». Очень полезно на данном этапе акцентировать внимание учащихся на понятии «электроотрицательность». Например, задав вопрос: почему при образовании ионной связи в хлориде меди (II) электроны переходят к атому хлора? 2. Усвоение новых знаний а) организация учебного затруднения Для этого можно задать вопрос: может ли образоваться химическая связь в молекуле, образованной атомами разных неметаллов (в молекуле хлороводорода) и если может, то каким образом? С целью разрешения учебного затруднения учитель демонстрирует получение хлороводорода, проверяет его раствор индикатором. Вместе с учащимися учитель составляет схему образования химической ковалентной связи, указав на спаривание только неспаренных электронов атомов водорода и хлора и образования частичного отрицательного заряда на атоме более электроотрицательного атома хлора, и записывает графическую формулу вещества. Таким образом, учащиеся подходят к выводу о поляризации молекулы и существовании полярной ковалентной связи между атомами разных неметаллов. Учащиеся слушают и записывают определение в тетрадь. 3. Закрепление изученного материала ЦОР № 1 Учитель объявляет тему урока и задачи. Учащиеся строят гипотезы и приходят к выводу, что связь между атомами неметаллов может быть только ковалентной (напоминаем еще раз определение ковалентной связи с помощью цор). б) разрешение учебного затруднения реактивы для постановки лабораторного опыта. 1) В качестве закрепления материала урока учитель предлагает учащимся составить схемы образования молекул HBr, H2O, NH3, CO2. При составлении схем учащиеся должны показать смещение электронных пар. 2) Завершить урок можно систематизацией сведений о видах химической связи, которая может выглядеть следующим образом: 58 ЦОР № 2 ЦОР № 5 ЦОР № 4 ЦОР № 3 Химическая связь: Взаимодействие атомов, приводящее к образованию молекулы Условие образования связи: Наличие неспаренных электронов Виды химической связи Металлич. (металл) 4. Домашнее задание Ионная (Ме + Неме) Ковалентная Неполяр. Поляр. (Неметалл: (Неметалл: А+А=А2) А + В= АВ эоА <эоВ § 28, упр. 1 (составить схемы образования связи в молекулах KCl, H2S, I2),2 (подготовить ответ), повторить § 25, 26. Урок № 33. «Кристаллические решетки. Зависимость физических свойств веществ от строения кристаллических решеток» Задачи урока: познакомить учащихся со строением веществ, выявить причины различий физических свойств веществ, образованных разными видами химической связи, развивать умение строить и объяснять гипотезы. Оборудование: кристаллические решетки СО2, алмаза, образцы веществ с разными кристаллическими решетками, ЦОР № 6,7,8,9,10,11. Название этапа урока Содержание этапа 1. Активизация знаний учащихся (проверка домашнего задания) В качестве проверки домашнего задания предлагаем провести промежуточный контроль, состоящий из химического диктанта и самопроверки. Задания: 1) раскрыть содержание понятий: - электроотрицательность - химическая связь - ионная связь - ковалентная связь - ион - металлическая связь. 2) определите вид химической связи в веществах: СаCl2, O3, C2H4, Na, Fe(NO3)2, CS2. Самопроверку осуществляем, раскрывая понятия устно. Диктант можно проводить и по вариантам. 2. Усвоение новых знаний Учитель объявляет тему урока и задачи. Объяснение материала урока можно провести в 59 Используемые средства обучения виде беседы с учащимися по вопросам: - опишите физические свойства веществ (например: поваренная соль, углекислый газ, Кристал.решетки железо, алмаз); алмаза, железа, - может ли углекислый газ быть твердым; углекислого газа - чем отличается твердое состояние вещества от жидкого и газообразного? Далее учитель поясняет, что а) вещество есть совокупность частиц, расположенных строго определенным образом в пространстве; б) частицами могут быть атомы, ионы или молекулы; в) если соединить частицы твердого вещества, то образуется каркас, который называют кристаллической решеткой; г) частицы кристалла называют узлами решетки. Следует подчеркнуть, что частицы находятся в постоянном движении, усиливающемся при увеличении температуры, свойства веществ кроются не столько в различном строении частиц, сколько в разном взаимодействии всей совокупности частиц, образующих кристалл. Пользуясь слайдами (ЦОР), учитель расскажет о молекулярных, ионных, атомных и металлических кристаллах. Полезно уточнить некоторые физические характеристики рассматриваемых веществ с помощью справочных данных. Если позволяет время урока, то полезно отдельно пояснить учащимся, почему водородное соединение кислорода (вода) в отличие от других подобных соединений является жидкостью. 3. Закрепление изученного материала В качестве закрепления и систематизации материала урока на данном этапе необходимо составить сравнительную таблицу по теме, которая может выглядеть следующим образом: Сравнительные признаки Виды химической связи Ионная Ков.пол. Ков.непол. Метал. Природа хим.элементов Вид частиц в узлах кристал. реш. Тип кристал. решетки Физические свойства Примеры веществ Данную работу учащиеся проводят самостоятельно, лучше в группах по 4 человека. 4. Домашнее задание § 29, упр. 4,5 (устно подготовить ответы на вопросы). 60 ЦОР № 6,7,8,9,10 ЦОР № 11 Урок № 34. «Электролиты и неэлектролиты» Задачи урока: познакомить учащихся с важной характеристикой веществ электропроводностью, а также с классификацией веществ по данному свойству, развивать умение наблюдать и анализировать явления. Оборудование: прибор для проверки электропроводности веществ, кристаллические NaCl, NaOH, сахар, растворы NaCl, NaOH, Al, ЦОР № 12,13,14,15,16 (4,5). Название этапа урока 1. Актуализация знаний учащихся 2. Усвоение новых знаний а) организация учебного затруднения б) разрешение учебного затруднения Содержание этапа Используемые средства обучения В качестве актуализации знаний учитель проводит небольшой фронтальный опрос по домашнему заданию. Таким образом, учащиеся вспоминают, что электропроводность веществ обусловлена наличием свободных заряженных частиц. Данный этап можно начать с постановки проблемы, какие вещества могут проводить электрический ток, т.е. имеют свободные заряженные частицы? Надо заметить, что учащиеся чаще всего приводят гипотезы о наличии свободных заряженных частиц в веществах с ионной связью. Надо лишь напомнить им, что в кристаллах эти частицы (ионы) не свободны. Для пояснения этой части проблемы учитель проводит демонстрационный эксперимент по определению электропроводности в твердых веществах с ионной химической связью. Здесь имеет смысл обсудить, какие ещё вещества не смогут проводить электрический ток и провести с помощью эксперимента наблюдения за веществами с атомной и молекулярной кристаллической решеткой (твердые и растворы, например сахара). Прибор для определения электропроводности веществ. Для подобного опыта можно взять кристаллическую серу, углекислый газ, дистиллированную воду. Этот эксперимент лучше сделать лабораторным опытом в соответствии с инструкцией, данной в учебном пособии (Приложение 1, опыт 3), что будет более эффективно. Учащиеся легко приходят к выводу о том, что вещества с атомной и молекулярной, а также с ионной кристаллической решеткой (в твердом агрегатном состоянии) неэлектропроводны. в) организация учебного затруднения Учитель демонстрирует проблемный эксперимент (опускает электроды в раствор поваренной соли) или учащиеся проводят его самостоятельно (при условии, что опыты проводятся лабораторной работой) и предлагает пояснить, почему раствор соли является 61 Оборудование для проведения опыта электропроводным. Учащиеся строят гипотезы. На этом этапе важно подвести учеников к выводу о роли молекул воды в растворении кристалла и высвобождении ионов. г) разрешение учебного затруднения 3. Закрепление изученного материала Далее учитель демонстрирует, что и другие ЦОР № 12 сложные вещества, в том числе и с ковалентной связью, в растворах ведут себя аналогично. Здесь логично задать вопрос (по в/ролику): как можно классифицировать сложные вещества по данному признаку? В процессе беседы учитель подводит учащихся к ЦОР № 13 определению «электролит» и «неэлектролит». На данном этапе выполняются упражнения по распознаванию электролитов с обязательной проверкой и коррекцией. ЦОР № 14, 15, 16 (5) Закреплением также служит работа с таблицей растворимости сложных веществ, по которой отрабатывается умение распознавать электролиты по формуле. Например, можно предложить учащимся определить соединения какого-либо металла, кислоты или основания, являющимися электролитами. Эту работу можно провести и в виде эстафеты по рядам и обязательно оценить. Итогом этапа является составление таблицышпаргалки: электролиты щелочи Растворимые соли Растворимые кислоты 4. Домашнее задание неэлектролиты Нерастворимые соли, кислоты, основания Органические вещества Простые вещества Нерастворимые оксиды, вода § 30, упр. 1,2. упражнения 3,4 – по выбору. Урок № 35. «Диссоциация электролитов в воде» Задачи урока: раскрыть механизм электролитической диссоциации, роль молекул воды в диссоциации электролитов в растворах, расширить представления о веществах и химических реакциях в растворах, формировать способности к выявлению теоретической основы гипотезы. Оборудование: таблица растворимости сложных веществ в воде, ЦОР № 17,18,19,20,21,22,23,24,25,26. Название этапа урока 1. Активизация знаний учащихся Содержание этапа На этом этапе учитель повторит с учащимися основные понятия темы, а также выполнит упражнение: определите ионы и их заряды, которые образуются при растворении 62 Используемые средства обучения Таблица растворимости 2. Усвоение новых знаний Ba(OH)2, H2SO4, AlCl3 и т.д. (ребята работают с таблицей растворимости, называя ионы). Этап логично начать с решения проблемного вопроса: почему вода, молекулы которой образованы ковалентной полярной связью, не является электролитом? Учащиеся должны предложить свои гипотезы и в ходе их обсуждения учитель пояснит, что: а) вода может распадаться на ионы, но только две молекулы из миллиарда, поэтому не может обеспечить заметной электропроводности, т.е. вода – очень слабый электролит; б) расположение ковалентных связей под углом 104,50 приводит к смещению электронной плотности к одному полюсу молекул, т.е. молекулы воды становятся диполями (молекулы воды полярны), и при хаотичном движении могут притягиваться противоположно заряженными полюсами. Далее учитель может попросить учащихся выдвинуть свои предположения о том, что происходит при попадании ионного кристалла в воду и пояснить процесс растворения как процесс гидратации, ослабления связей между ионами в кристаллической решетке (в 81 раз) и диссоциации (распада) ионного соединения на ионы. Учащиеся должны записать процесс диссоциации NaCl. Обратим внимание на сумму зарядов в растворе (число минусов равно числу плюсов). Раствор электронейтральный. Учитель констатирует, что условная запись распада электролита на ионы с помощью химических символов и коэффициентов, обозначающих число ионов, называют уравнением электролитической диссоциации. Обязательно нужно записать определения оснований (щелочей) и солей с точки зрения электролитической диссоциации в тетрадь, а также схематично отразить процесс диссоциации (см. схему в учебнике, рис.51). Учитель объявляет, что термин «диссоциация», т.е. «распад» впервые был введен шведским ученым С.Аррениусом, и кратко знакомит их с его последователями, одним из которых был Д.И.Менделеев. После этого учащиеся запишут определение электролитической диссоциации. Учащиеся убедились, что вещества с ковалентной полярной связью являются электролитами только в растворах. Поэтому учитель может поставить следующий проблемный вопрос: 63 ЦОР № 19, 20,22 ЦОР № 21 ЦОР № 17 ЦОР № 18 итогом электролитической диссоциации является образование свободных ионов. Почему вещества, в которых изначально нет ионов (с ковалентной полярной связью) тоже электролиты? После обсуждений учитель поясняет этапы диссоциации электролита с ковалентной полярной связью. Итогом данного этапа станет обобщение и систематизация полученных знаний. 3. Закрепление изученного материала ЦОР № 23,24 Этапы диссоциации веществ с ионной и ковалентной полярной связью необходимо записать. ЦОР № 25,26 На этом этапе ребята должны научиться записывать уравнения диссоциации электролитов. Таблица растворимости Уточним, на что необходимо обратить внимание учащихся при выполнении тренировочных упражнений: а) верная запись коэффициентов, стоящих перед ионами в правой части уравнения (часто пишут так: KNO3 → K+ + 3 NO- ); б) какой знак писать между левой и правой частями уравнения? Если электролит сильный, то записывают одну стрелку вправо (процесс необратимый), если электролит слабый, то пишется две стрелки навстречу (процесс обратимый). Будет правильным, если учитель сразу укажет на запись этих процессов. 4. Домашнее задание § 31, упр. 2,3. Урок № 36. «Катионы и анионы» Задачи урока: пояснить причину классификации ионов, вскрыть количественную сторону электролитической диссоциации, углубив представление о сильных и слабых электролитах, продолжать закреплять навыки по написанию уравнений диссоциации сложных веществ. Оборудование: ЦОР № 27,28,29,30,31, прибор для проведения опытов с электрическим током, полоски фильтровальной бумаги, медный купорос, раствор гидроксида натрия. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Урок необходимо начать с проверки домашнего задания, которую учитель построит в соответствии с уровнем класса (фронтальная, групповая, индивидуальная работа, организация самопроверки). Для промежуточного контроля знаний можно использовать ЦОР, а также провести небольшую самостоятельную работу, например: а) найдите ошибку и исправьте (учащимся дают уравнения диссоциации различных веществ, в 64 Используемые средства обучения ЦОР № 31 (2) которых допущены ошибки); б) задание: в растворе обнаружены ионы SO42-, K+, Al3+, H+, Cl-. Напишите формулы веществ, которые образовали эти ионы, и уравнения их диссоциации. 2. Усвоение новых знаний Этап можно начать с демонстрации эксперимента (ЦОР). Работая с ним, учитель задает учащимся следующие вопросы: а) почему растворы соляной и уксусной кислот пропускают электрический ток? б) что произошло с ионами, когда в раствор опустили электроды? Движение ионов к электродам необходимо отразить схемой: Кат.Ионы Ан.+ + H , Cl Учитель по возможности предлагает провести лабораторный опыт в контексте с учебным пособием (Приложение 1, опыт 4). Учащиеся сами сделают вывод о том, как различают ионы по названию (катионы и анионы). Далее учитель продолжит работу с видеороликом, попросив ребят ответить на вопрос, заданный в нём. Вместе с учителем ребята делают вывод, что в растворе уксусной кислоты не все молекулы продиссоциировали на ионы, следовательно, не все сложные вещества сильные электролиты. Учитель обсуждает количественную сторону электролитической диссоциации. На этом этапе полезно провести устное тренировочное упражнение по определению силы электролита с таблицей растворимости. Поскольку в дальнейшем количественная характеристика диссоциации не используется, то можно не тренировать учащихся в выполнении задач, связанных с определением степени диссоциации, а ограничиться определением знака (обратимости или необратимости) между левой и правой частями в уравнениях диссоциации электролитов. 65 ЦОР № 27 (кроме вопроса) ЦОР № 27(включая вопрос) ЦОР № 28,29,30 3. Закрепление изученного материала В качестве закрепления материала урока учитель ЦОР № 31 (1) предлагает выполнить упражнение (ЦОР) и составить обобщающую схему данной темы: Сильные электролиты α → 100% Молекулы электролита полностью диссоциируют на ионы Примеры: щелочи (LiOH – CsOH, Ca(OH)2 – Ba(OH)2), Кислоты (HCl – HI, H2SO4, HNO3, HClO4) Слабые электролиты α→0 В растворах содержатся как ионы, так и молекулы электролита Примеры: плохо растворимые основания (Cu(OH)2, Mg(OH)2, щелочь NH4OH), Слабые кислоты (H2CO3, H2S, H2SO3, HNO2, H3PO4, HF, уксусная кислота), вода Работу желательно провести самостоятельно в парах. 4. Домашнее задание § 32, упр. 2,3 Урок № 37. «Кислоты как электролиты» Поскольку тема важна с точки зрения дальнейшего изучения материала предмета, постольку необходимо выделить на неё 2 часа учебного времени. Задачи урока: дать представление о составе кислот как типичных представителях электролитов, пояснить причины общих свойств этих классов соединений, тренировать умение называть вещества по химической формуле, определять класс веществ. Оборудование: образцы сильных и слабых электролитов (кислот неорганических и органических), кислотно-основный индикатор, фильтровальная бумага для демонстрации едких свойств кислот, ЦОР № 32,33,34,35,36,37. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения Урок следует начать с проверки домашнего задания, повторить названия положительных и отрицательных ионов, правила определения их зарядов. Поскольку материал урока насыщен, не следует отводить много учебного времени на этот этап. 2. Усвоение новых знаний В начале данного этапа учитель объявляет тему и задачи урока. Затем он предлагает учащимся выполнить лабораторный опыт: Проведите пробы выданных Вам растворов на индикатор и сделайте вывод. После вывода о том, что во всех пробирках была кислота, учитель показывает ребятам, какие кислоты они проверяли индикатором. Учитель демонстрирует слабые кислоты (уксусную, лимонную, угольную) и рассказывает о распространении и значении кислот в природе. 66 Оборудование для проведения опыта: (растворы серной, азотной, соляной кислот в пробирках) Учебное затруднение Здесь же можно продемонстрировать едкие свойства концентрированных серной и азотной кислот и акцентировать внимание учащихся на правилах обращения с кислотами и растворения концентрированной серной кислоты. Ребята записывают формулы кислот. Проблемный вопрос: почему растворы разных кислот проявляют одинаковые свойства? Учащиеся предлагают гипотезы. Важно, чтобы ученики сами определили наличие одинаковых ионов в растворах кислот и сделали вывод: какой ион определяет кислотность раствора. Разрешение учебного затруднения После проделанной работы учащиеся довольно легко придут к определению класса кислот. Учитель корректирует с помощью ЦОР. Учитель предлагает поработать с ЦОР, и вместе записать уравнения диссоциации кислот и общую схему диссоциации. ЦОР № 34 ЦОР № 32,33,35 Обратим внимание учащихся на отличии уравнений диссоциации и реакций разложения, которым подвержены некоторые слабые кислоты (сернистая, угольная). Полезно также записать уравнения разложения слабых кислот: ЦОР № 36 Н2СО3 → СО2 + Н2О Н2SO3 → SO2 + H2O Здесь же можно потренировать ребят в написании ступенчатой диссоциации многоосновных кислот, например: Н3РО4, Н2S т.д. Необходимо обратить внимание учащихся на названии кислотных остатков, записать с ними наиболее часто используемые, а также на определение заряда кислотных остатков по количеству протонов водорода. В конце данного этапа учитель обращается к таблице 7 (§33) учебного пособия и организует работу с ним. Будет правильным сразу проговорить о генетической связи разных классов веществ, образованных атомами неметаллов (в целях опережающего обучения), сделать вывод о том, что кислоты – это гидроксиды неметаллов, перевести данную в учебнике таблицу в тетрадь в виде схемы: S → SO2 → H2SO3, в которой над стрелками указать метод превращения веществ. 3. Закрепление материала урока 4. Домашнее задание Учитель предлагает самостоятельную работу с текстом параграфа в целях ответа на вопрос: какие меры необходимо предпринять при попадании кислоты на кожу. Учащиеся также должны выполнить упражнения ЦОР № 37 (1,2) теста. § 33 (до оснований), знать названия и формулы кислотных остатков и кислот, найти кислоты среди предметов бытовой химии. 67 Урок № 38. «Основания как электролиты» Задачи урока: дать представление о составе оснований как типичных представителях электролитов, пояснить причины общих свойств этих классов соединений, тренировать умение называть вещества по химической формуле, определять класс веществ. Оборудование: образцы сильных и слабых электролитов (щелочей и нерастворимых оснований, раствор аммиака), кислотно-основный индикатор, сульфат меди (II), раствор гидроксида натрия, спиртовка, ЦОР № 37,38,39,40,41. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Данный этап можно начать с повторения материала прошлого урока. С этой целью учитель может провести химический диктант, а также выполнить упражнение 3 (ЦОР) или упражнение по написанию уравнений диссоциации различных кислот. Используемые средства обучения ЦОР № 37 (3) Заметим, что данный урок проходит по аналогии с предыдущим. Поэтому есть смысл решить с учащимися несколько задач по определению молярной массы, массы по известному количеству вещества или количество вещества по известной массе некоторых кислот, что является повторением ранее пройденного материала, и потребуется в решении задач. 2. Усвоение новых знаний Учебное затруднение В начале данного этапа учитель объявляет тему и задачи урока. Затем он предлагает учащимся выполнить лабораторный опыт: Проведите пробы выданных Вам растворов на индикатор и сделайте вывод. После вывода о том, что во всех пробирках была щелочь, учитель показывает ребятам, какие щелочи они проверяли индикатором. Учитель демонстрирует слабые основания (гидроксид железа (III), раствор аммиака) и рассказывает о распространении и значении оснований в природе и жизни человека. Здесь же акцентировать внимание учащихся на правилах обращения со щелочами. Ребята записывают формулы оснований. Проблемный вопрос: почему растворы разных оснований проявляют одинаковые свойства? Учащиеся предлагают гипотезы. Важно, чтобы ученики сами определили наличие одинаковых ионов в растворах щелочей и сделали вывод: какой ион определяет основность раствора. Разрешение учебного После проделанной работы учащиеся довольно легко придут к определению класса оснований. Учитель корректирует с помощью ЦОР. Учитель предлагает поработать с ЦОР, и вместе записать уравнения диссоциации кислот и общую схему диссоциации. Обратим внимание учащихся на отличии уравнений 68 ЦОР № 40 ЦОР № 38,39 затруднения диссоциации и реакций разложения, которым подвержены некоторые слабые основания (гидроксид железа (II, III), гидроксид меди (II) и др.) По аналогии с реакциями разложения слабых кислот можно попросить учащихся записать уравнения реакций разложения слабых оснований: Cu(OH)2 → CuO + H2O и др. Акцентируем внимание учеников на том, что валентность атома металла в оксиде равна заряду его иона в гидроксиде. Реактивы для опыта разложения слабого основания Здесь же можно потренировать ребят в написании ступенчатой диссоциации многоосновных оснований, например: Ba(OH)2. Необходимо обратить внимание учащихся на названии оснований, а также на определение заряда иона металла по количеству гидроксогрупп. В конце данного этапа учитель обращается к таблице 8 (§33) учебного пособия и организует работу с ним. Будет правильным сразу проговорить о генетической связи разных классов веществ, образованных атомами металлов (в целях опережающего обучения), сделать вывод о том, что основания – это гидроксиды металлов, которые можно получить из оксидов, а также о том, что растворимость оксида металла можно определить по растворимости соответствующего основания, для чего воспользоваться таблицей растворимости. Затем перевести данную в учебнике таблицу в тетрадь в виде схемы: Са → СаО → Са(ОН)2, в которой над стрелками указать метод превращения веществ. 3. Закрепление материала урока На данном этапе учитель расскажет о применении оснований в технике, а также попросит выполнить задания теста. Хочется обратить внимание, что необходимо сразу приучать учащихся к названиям веществ по разным номенклатурам (систематической и тривиальной), и в данном уроке следует записывать несколько названий отдельных оснований. Например: гидроксид натрия - едкий натр; гидроксид кальция – известковая вода, гашеная известь; гидроксид бария – баритовая вода и т.д. 4. Домашнее задание Учащиеся должны выполнить упражнения по написанию уравнений диссоциации веществ с ионной химической связью (оснований и солей). § 33, упр. 1, 4. 69 ЦОР № 41 Урок № 39. «Обобщение сведений о веществах» Задачи урока: систематизировать и обобщить знания учащихся по теме, развивать навыки химического языка, подготовить к контрольной работе. Оборудование: растворы кислоты, щелочи и вода на столах для проведения опыта, кислотно-основный индикатор, ЦОР № 42,43,44,45,46. Название этапа урока 1. Проверка домашнего задания 2. Активизация знаний учащихся Содержание этапа Используемые средства обучения После фронтальной проверки домашних упражнений можно провести химический диктант с проверкой с тем, чтобы повторить основные понятия темы. Затем можно выполнить индивидуальную самостоятельную работу (можно на 2 варианта). Задание может быть таким: Определите электролиты и запишите их диссоциацию в растворах. (1 вариант – HCl, H2O, Ca(OH)2, P2O5, Al2(SO4)3; 2 вариант – NaOH, CuO, K2CO3, N2, H3PO4). В конце этапа обязательно следует взаимопроверка и коррекция. Этап очень важный с точки зрения сбора основных понятий темы в целостную систему. Поэтому провести его лучше через самостоятельную деятельность учащихся в группах. Учитель волен самостоятельно подобрать приемы и методы работы. Обратим внимание на то, что логически грамотно будет построить работу на постепенном усложнении заданий. Например, характеристика атомов металлов и неметаллов, химических связей в образуемых ими соединениях, наконец, характеристика веществ с точки зрения состава, строения и электролитической диссоциации. Учащиеся должны не только дать характеристику атома, но и записать схему образования химической связи в простом и бинарном веществе. Причем это должно касаться конкретных веществ. Учитель еще раз акцентирует внимание на растворении солей, и проводит сопутствующие закрепляющие упражнения с помощью ЦОР. ЦОР № 43,44,45 В качестве повторения материала можно добавить задание на расчет молярной массы и массы по определенному количеству вещества. 3. Обобщение и систематизация На данном этапе учитель помогает ребятам собрать все сведения, полученные в процессе изучения темы, собрать в единую систему. Для этого обязательно необходимо создать схему, отражающую классификацию веществ. Учитель может воспользоваться схемой учебного пособия (рис.51, §34) или предложить ребятам создать свою. В конце этапа нужно провести тренировочные 70 ЦОР № 42 (слайд 1) упражнения, направленные на подготовку к контрольной работе. Подбор заданий может быть таким как в методическом пособии автора учебника. 4. Домашнее задание ЦОР № 46 Повторить § 17,18,19,20,25,26,28. § 34, упр. 3. Урок № 40. «Контрольная работа по теме «Общие сведения о веществах»» Задачи урока: проконтролировать уровень усвоения материала о веществах, зависимости свойств от строения атомов и кристаллических решеток, видах химической связи, электролитической диссоциации сложных веществ-электролитов. Оборудование: методическое пособие к учебнику под ред. Р.Г.Ивановой, другие дидактические материалы. Урок проводится в виде индивидуальной текстовой или тестовой контрольной работы в соответствии с приемами и методами, применяемыми учителем. Глава 2. «Химические реакции» Урок № 41. «Признаки химических реакций» Задачи урока: расширить представления учащихся о различных явлениях природы, пояснить признаки и условия химических явлений. Оборудование: ЦОР № 47,48,49,50,51, парафин, колба, ложка для сжигания вещества, известковая вода, растворы медного купороса, гидроксида натрия, соляной кислоты, карбоната натрия, пробирки, инструктивные карты. Название этапа урока 1. Активизация знаний учащихся Содержание этапа В начале этапа учитель задаст вопросы о том, что изучает химия, из чего состоят вещества? Учитель проводит проблемный демонстрационный эксперимент: нагревает парафин в одном случае, и поджигает парафин в другом. Подожженный парафин учитель опускает в колбу, в которой на дне известковая вода, и плотно закрывает её. После сгорания парафина встряхиваем колбу, известковая вода мутнеет. Проблемный вопрос учителя: чем отличаются продемонстрированные явления? Учащиеся высказывают гипотезы, а учитель уточняет: по каким признакам ребята отличали эти два явления? Учащиеся повторяют и записывают определение химической реакции. Таким образом, учащиеся сами предполагают 71 Используемые средства обучения 2. Усвоение новых знаний. тему урока и его задачи. На этом этапе важно, чтобы учащиеся понимали признаки химических реакций и условия их проведения. Учитель просит учащихся записать в три колонки: Реакция Признаки Условия Учитель демонстрирует ряд превращений веществ, учащиеся заполняют колонки. Далее ребята самостоятельно проведут несколько опытов с помощью инструктивных карт, и продолжат работу. В целях экономии времени урока можно провести данную работу по вариантам. В ходе беседы уточняются проведенные реакции, а также их условия и признаки. Учитель может задать вопросы и по уточнению состава реагирующих веществ. Стоит обратить внимание учащихся на то, что не всегда в реакциях участвуют несколько веществ (они уже встретились с подобными реакциями – это реакции разложения) и рассказать о реакции синтеза на примере превращения кислорода в озон. В конце этапа проводится первичное закрепление знаний в ходе фронтальной работы. ЦОР № 47,48,49,50 Пример инструктивной карты: 1)к 2 мл гидроксида натрия прилейте 1 мл раствора медного купороса. Запишите наблюдения; 2)нагрейте пробирку с полученным содержимым. Запишите наблюдения; 3)к 1 мл карбоната натрия прилейте 1 мл соляной кислоты. запишите наблюдения. ЦОР № 51 Учитель по своему усмотрению может предложить ещё несколько демонстраций и побеседовать с учащимися о признаках и условиях реакций. 3. Домашнее задание. § 35, упр. 1,2. Урок № 42. «Закон сохранения массы веществ при химических реакциях» Задачи урока: продолжить формирование понятий о классификации химических реакций, признаках химических реакций, объяснить химическую реакцию с точки зрения атомномолекулярного учения. Оборудование: на столах учащихся весы с разновесами, раствор соляной кислоты, цинк, реактивы для проведения опыта к 1 этапу, на столе учителя прибор для подтверждения закона сохранения массы веществ (сосуд Лантдольта), реактивы по выбору учителя, ЦОР № 47,52,53,54,55,56. Название этапа урока 1. Активизация знаний учащихся Содержание этапа В начале этапа учитель проверит домашнее задание, и побеседует о признаках и условиях химических реакций на конкретных примерах. Здесь же можно предложить небольшой лабораторный опыт по вариантам с целью отработки навыков 72 Используемые средства обучения наблюдения и умения грамотно отражать свои наблюдения в записях с последующей беседой и коррекцией. Например: 1 вариант – из имеющихся у Вас реактивов получите соль; опишите признаки химической реакции и т.д. 2. Усвоение новых знаний. Этап можно начать с проблемного вопроса: Что изменяется в веществах при их взаимодействии друг с другом? Учащиеся строят предположения об изменении химических связей в молекулах, строения веществ. Далее учитель задает следующий вопрос: как изменяется масса в процессе реакций? Учащиеся могут построить свои гипотезы. Учитель демонстрирует опыт с помощью сосуда Лантдольта (реактивы он выберет по своему усмотрению) и вместе с ребятами делает первое «открытие»: в процессе реакции ни один атом (так как он является носителем массы) не исчез. Затем учитель возвращается к уже известному учащимся опыту (прокаливание меди в колбе) и делает следующее «открытие»: масса веществ, вступающих в реакцию, не изменяется. Эта характеристика реакции свойственна всем типам реакций. Учитель расскажет о том, что это открытие принадлежит русскому ученому М.В.Ломоносову, и предложит его краткую биографию. Вопрос, который можно задать учащимся после ознакомления с биографией: обладателем каких специальностей мог бы считаться Ломоносов сегодня? Можно кратко упомянуть о работах Лавуазье в этом же направлении. 3. Закрепление материала урока 4. Домашнее задание. ЦОР № 47 ЦОР № 52,53 Далее можно предложить учащимся самим сформулировать закон сохранения массы и, ЦОР № 54 скорректировав его с помощью ЦОРа, записать в тетрадь. Учитель поясняет закон с точки зрения атомномолекулярного учения. ЦОР № 55 В конце данного этапа учитель закрепляет материал урока с помощью тестов ЦОР. ЦОР № 56 На этом этапе необходимо поупражняться в решении простых задач в контексте с учебником, выполнив упражнения 1,2 после § 36. § 36, упр. 3. 73 Урок № 43. «Химические уравнения» Задачи урока: познакомить учащихся с практическим применением закона сохранения массы, с записью химической реакции, тренировать навыки написания химического уравнения. Оборудование: ЦОР № 57,58,59,60,61, простые вещества для демонстрации реакции горения, оксид меди (II), раствор соляной кислоты, пробирки, спиртовка, ложка для сжигания веществ. Примечание: учитель вправе самостоятельно подобрать необходимые реактивы к уроку. Название этапа урока 1. Актуализация знаний учащихся 2. Усвоение новых знаний. Содержание этапа Используемые средства обучения Учитель напоминает учащимся, что на предыдущих уроках они научились записывать состав вещества в знаковой форме, а сегодня они будут рассматривать химическую реакцию и учиться её записывать. Далее он предлагает сформулировать определение химической реакции и вспомнить основные типы химических реакций. Этап можно начать с демонстрации химических реакций соединения, обмена. ЦОР № 58 В процессе беседы необходимо просить учащихся называть признаки реакций и образующиеся вещества. Организация учебного затруднения. Разрешение учебного затруднения. Учитель предлагает записать данную химическую реакцию с помощью слов и даёт 10 секунд, после чего просит объяснить причину неудобства такой записи. Теперь он просит записать данные реакции с помощью химических формул. Учитель выводит на экран запись реакции разложения оксида ртути (II) и обращает внимание на знак равенства в записи: что бы это значило? Для ответа на вопрос учитель просит сформулировать этот же закон с применением понятия «атомы» и вводит понятие «коэффициента». Учитель просит сделать вывод о том, как совместить закон сохранения массы веществ с условной записью химической реакции. Следует пояснить применение закона сохранения массы веществ в записи химической реакции: число атомов химических элементов уравнивается посредством стехиометрических коэффициентов. Для этого индекс элемента умножается на коэффициент, стоящий перед формулой вещества С целью более прочного понимания правил уравнивания атомов в химических уравнениях можно предложить уравнять ранее продемонстрированные реакции. Тут же необходима рефлексия – проверка . 74 ЦОР № 59 (словесная запись реакции) ЦОР № 59 (символьная запись реакции) ЦОР № 57 Учитель просит записать определение химического уравнения: это условная запись химической реакции посредством химических символов и коэффициентов. С помощью ЦОР он поясняет, что в химических реакциях участвуют вещества, т.е. порции атомов или молекул. С этой позиции коэффициенты указывают на порции веществ. Т.к. единицей количества вещества является моль, то коэффициенты указывают число моль веществ. Учитель просит подписать количества веществ в химических уравнениях под формулами и прочитать, используя данное понятие. 3. Закрепление материала урока Этап можно начать с того, что учитель предлагает одному ученику выполнить упражнения у доски, одному на компьютере, а остальным в тетрадях. ЦОР № 60 ЦОР № 61 Проверка осуществляется путём чтения уравнений учащимися с места. Если позволяет время урока, то можно провести фронтальную (или парную) работу по выполнению упражнений из параграфа учебника. Например: упр. 1, 6. 4. Домашнее задание § 37, упр. 1,2,3,4. Урок № 44. «Расчеты по химическим уравнениям» Задачи урока: расширить представление о химической реакции, научить производить расчеты на основе закона сохранения массы и химического уравнения, продолжать формирование способности к организации наблюдения. Оборудование: ЦОР № 60,62,63,64,65, реактивы на демонстрационном столе для проведения некоторых экспериментальных задач (по выбору учителя). Название этапа урока 1. Актуализация знаний учащихся Содержание этапа В начале урока следует немного потренировать учащихся в составлении уравнений химических реакций и постановке коэффициентов согласно закону сохранения массы. Учитель может провести такую работу фронтально или индивидуально, но с обязательной коррекцией. Заметим, что данный урок очень насыщен и не нужно затягивать этот этап проверки усвоения материала прошлого урока. Необходимо обратить внимание на комментарии к уравнениям, прочитывая их. Например: 2Al + 6HCl = 2AlCl3 + 3H2 75 Используемые средства обучения Работая с этим уравнением, можно потренировать не только в комментировании химического уравнения (алюминий взаимодействует с соляной кислотой с образованием хлорида алюминия и водорода), что очень важно, но и простых устных подсчетах: сколько молей алюминия и соляной кислоты потребуется для выделения 1,5 молей водорода? И т.д. Учитель, вспомнив с учащимися, как связаны ЦОР № 60,63 моль и масса веществ, подведет учащихся к проблеме текущего урока. Учащиеся на данном этапе должны усвоить прямую пропорциональную количественную зависимость между веществами, участвующими в реакции: меньше взято одного вещества, значит, во столько же раз меньше будет получено других веществ; чем больше получено, тем больше израсходовано. 2. Усвоение новых знаний. Объяснение задач по химическим уравнениям можно начать с простых задач, в которых указаны количества веществ, а найти необходимо массу. Например: какая масса оксида кальция получится при термическом разложении 0,75 моль карбоната кальция? Учитель совместно с учащимися определит количественную пропорциональную зависимость стехиометрических коэффициентов, и вычислит количество вещества оксида кальция, а затем и массу по известной учащимся формуле. Далее усложняем задачу: вычисление массы веществ продуктов реакции по известной массе ЦОР № 62 одного из реагентов. Обратим внимание на следующее: 1) на этом уроке необходимо разобрать два варианта задач (вычисление продукта реакции по одному из реагентов и вычисление массы реагента по известной массе продукта); 2) в зависимости от уровня подготовки учащихся можно здесь же ввести задачи по химическим уравнениям, в которых известна техническая масса вещества (масса известняка, масса раствора), в которой указана массовая доля реагирующего вещества, т.к. учащиеся уже знакомы с понятием «массовая доля». 3. Закрепление материала урока На этом этапе необходимо потренировать учащихся в решении подобных задач по известному алгоритму с обязательной рефлексией. Эту работу лучше сначала провести фронтально, а затем в парах. Учитель сам определяет приемы согласно применяемой им методике. Напомним лишь, что прочное усвоение навыков решения подобных задач наступит не сразу. Поэтому хорошо, если некоторое время перед глазами учащихся находится алгоритм решения задач. 76 ЦОР № 64,65 4. Домашнее задание § 38, упр. 1 (устно), 2,3 (письменно). Урок № 45. «Реакции, подтверждающие генетическую связь металлов и их соединений» Задачи урока: на примерах превращения металлов пояснить смысл понятий «генетическая связь», «степень окисления», «основные оксиды», выявить отличие генетической связи металлов В подгрупп, продолжить формирование навыков наблюдения. Оборудование: ЦОР № 67,68,69,70, магний (или кальций), кислотно-основный индикатор, растворы медного купороса и гидроксида натрия, фарфоровая чашка, стакан с водой, спиртовка. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Используемые средства обучения В начале урока следует провести проверку домашнего задания, и вспомнит с учащимися основные классы сложных веществ. Учитель проведет её согласно приемам и методам, используемым им в работе. Цель проверки: не только уточнить пробелы в понимании способов решения химических задач по уравнениям, но и подвести к выводу о том, что химическая реакция показывает взаимосвязь всех веществ между собой. 2. Усвоение новых знаний. Учитель объявляет тему и задачи урока. Этап целесообразно начать с демонстрации эксперимента горения магния (или кальция). Методика проведения опыта отражена в методическом пособии УМК Р.Г.Ивановой. После анализа прошедшей реакции учитель попросит записать её уравнение. С помощью рисунка учебника в §39 учитель пояснит понятие «степень окисления» и учащиеся запишут определение в тетрадь. Здесь же можно уточнить понятие «оксид» как бинарное соединение атомов химического элемента с кислородом, степень окисления которого -2. ЦОР № 68 Необходимо сопоставить степень окисления с валентностью атомов и зарядом иона, указав, что простые ионы чаще всего имеют заряд, который численно равен степени окисления атома, а валентность – число ковалентных связей, которые мог бы образовать атом данного химического элемента. Учитель вводит понятие «генетическая связь» и продолжает формирование понятия с помощью дальнейших превращений металла. Для этого учитель использует реакции соединения оксидов металлов с водой. В данном случае уместно задать вопросы: 77 ЦОР № 67 1) к какому типу относятся продемонстрированные реакции? 2) какие оксиды металлов соединяются с водой? 3) к какому классу относятся полученные гидроксиды? Учащиеся запишут общую схему подобных реакций оксида металла с водой. Далее учитель продемонстрирует реакции щелочных металлов с водой с обязательной записью уравнений химических реакций. ЦОР № 69 Заметим, что с помощью данных уравнений можно потренировать учащихся в определении степени окисления атомов и понятия «окислитель», ведь в данном случае окислителем выступает не кислород, а протон водорода. Затем он попросит отразить с помощью схемы данное превращение. Итак, у учащихся должна появиться первая генетическая цепочка, характерная для превращений металлов А подгрупп: Ме → Ме2Оn → Ме(ОН)n ме I, II группы, А подгр. Над стрелками переходов можно указать способ. Учебное затруднение Учитель создает проблемой: запишите генетическую цепочку для металла меди, если известно, что в оксиде степень окисления меди +2. Учащиеся сталкиваются с вопросом, как из оксида меди (II) получить гидроксид. Они построят гипотезы. Разрешение учебного затруднения С этой целью учитель должен воспользоваться демонстрационным экспериментом, а учащиеся записывают новую генетическую цепочку. Таким образом, у них появится ещё одна генетическая цепочка для металлов В подгрупп: Ме → Ме2Оn → соль → Ме(ОН)n Учитель акцентирует внимание учеников на том, что так можно получать нерастворимые основания и поработает с определением оснований и основных оксидов. ЦОР № 70 3. Закрепление материала урока 4. Домашнее задание В качестве закрепления материала урока учитель может предложить тренировочные упражнения по составлению уравнений химических реакций к изученным цепочкам, отражающим генетическую связь металлов, подобных упражнению 2 § 39 и для металлов побочных подгрупп. § 39, упр. 1,2,3. 78 Урок № 46. «Реакции, подтверждающие генетическую связь неметаллов и их соединений» Задачи урока: познакомить учащихся с генетической связью неметаллов, кислотными оксидами, закрепить понятия «окисление», «степень окисления», выявить сходства и различия в генетической цепочке металла и неметалла. Оборудование: красный фосфор, вода, индикатор метиловый оранжевый, спиртовка, ложка для сжигания вещества, колба, заполненная кислородом, ЦОР № 71,72,73,74,75. Название этапа урока 1. Актуализация знаний учащихся Содержание этапа Используемые средства обучения В начале урока учитель проверит домашнее задание. Задача данного этапа состоит в том, чтобы укрепить понимание учащимися следующего: а) генетическая связь неорганических веществ основана на том, что в составе веществ одной генетической цепочки присутствует один и тот же химический элемент, а не простое вещество; б) основный оксид – это оксид металла, которому соответствует основание (даже если оно не образуется непосредственным растворением оксида в воде). 2. Усвоение новых знаний. Работу можно провести фронтально и индивидуально с обязательной самопроверкой. В конце этапа учитель выведет на доску обобщающую схему: Ме → Ме2Оn→ Ме(ОН)n. Этап учитель начинает с постановки задач текущего урока и демонстрации горения серы и растворения оксида серы (IV) в воде. Необходимо поэтапно проанализировать опыт, попросив учащихся сделать следующее: 1) постройте гипотезы относительно того, что произошло с атомами серы в ходе реакции? 2) Запишите уравнение реакции, определите степени окисления атомов в веществах. 3) Что образовалось в результате растворения оксида серы (IV) в воде? 4) К какому типу относят данную реакцию? 5) Почему раствор изменил цвет индикатора на красный? Ученики должны сделать выводы: а) превращения неметалла похожи на таковые металла; б) растворение оксида неметалла в воде приводит к образованию гидроксида, имеющего кислотные свойства. Они проведут самопроверку записанных уравнений реакций, и сделают вывод о превращениях атомов неметалла в виде схемы генетической связи: Неме → Неме2Оn → Hm Rm- или 79 ЦОР № 71 В ходе обсуждения гипотез: ЦОР № 72 ЦОР № 73 Неметалл →оксид → гидроксид (кислота). Далее отрабатывается понятие «кислотный оксид». С этой целью учитель проводит демонстрационный эксперимент: горение фосфора (или серы) и растворение его оксида в воде, и просит составить уравнения реакций превращения фосфора. ЦОР № 74 Выводы, которые должны сделать учащиеся: 1) генетическая связь неметаллов основана на тех же химических превращениях, что и у металлов; 2) кислотный остаток в кислотном гидроксиде – не есть оксид неметалла (Р2О5→РО43-); 3) оксид является кислотным, если степень химического элемента, образующего его, больше +3 (исключение: В2О3) 3. Закрепление материала урока На данном этапе учитель проведет тренировочные упражнения по заданиям: 1) составьте генетическую цепочку углерода (азота); записывать уравнения реакций к ним в данном случае нет необходимости. 4. Домашнее задание 2) запишите уравнения реакций согласно генетической цепочке ЦОР. Необходимо провести самопроверку. В конце урока, если позволяет время, можно обратить внимание учащихся на исключение в мире неметаллов: оксид кремния (IV) не растворяется в воде, и поработать над решением вопроса о том, как получить кремниевую кислоту. § 40, упр. 1,2,3,4. ЦОР № 75 Урок № 47. «Окислительно-восстановительные реакции». (ОВР) Задачи урока: разобрать суть окислительно-восстановительного процесса, дать представление об окислителе, восстановителе, научить уравниванию окислительновосстановительных реакций посредством электронного баланса. Оборудование: медная проволока, железная пластинка, раствор медного купороса, или натрий и вода в стакане для демонстрации ОВР, ЦОР № 76,77,78,79,80. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Урок начинаем с проверки домашнего задания. Можно использовать упражнение № 6 ЦОР № 76, если оно не использовалось на предыдущем уроке. После проверки генетических цепочек (упр. 1) и уточнения понятия «степень окисления» учителю целесообразно задать вопрос: В чем отличие химической реакции соединения простых веществ от реакции соединения оксида 80 Используемые средства обучения 2. Усвоение новых знаний с водой? Учитель сообщит тему и задачи текущего урока: разобрать суть реакций, в которых атомы химических элементов меняют степень окисления. Этап можно начать с проведения демонстрационного эксперимента окисления медной проволоки в пламени спиртовки. Учитель попросит учащихся записать уравнение реакции и определить степени окисления атомов. Он задаст вопрос: почему изменилась степень окисления атомов? Затем уточнит: степень окисления атома меди повысилась, а атомов кислорода - понизилась. Учащиеся самостоятельно сделают вывод о перемещении валентных электронов атомов. Далее учитель демонстрирует схему реакции соединения натрия с хлором и, разбирая её суть, укажет, что «окислитель» - это общее понятие атома, понижающего степень окисления в процессе химической реакции. Учащиеся запишут определение. ЦОР № 78,76,77 Можно уточнить, что в реакциях с участием сложных веществ, в составе которых элементы – окислители и элементы – восстановители, всему веществу присваивается название «окислитель» или «восстановитель». Затем учитель перейдет к практическому значению применения знаний об ОВР учащимися. Для этого он демонстрирует взаимодействие натрия с водой, и просит составить уравнение химической реакции. Учебное затруднение Учащиеся сталкиваются с трудностями в уравнивании левой и правой частей уравнения. Разрешение учебного затруднения Если позволяет время урока, учитель потренирует учащихся в составлении электронного баланса на примере реакций окисления железа раствором медного купороса, и укажет, что процесс разрушеия металла агрессивной средой (кислородом воздуха, окислителями – кислотами и т.д.) называют коррозией. Учитель может по своему усмотрению разобрать суть коррозии железа и его сплавов или перенести данный вопрос на следующий урок. Хорошо, если учащиеся самостоятельно подготовят ответ на вопрос: как защитить металл от коррозии? 3. Закрепление материала урока В качестве закрепления учитель проводит тренировочные упражнения с самопроверкой. Для этого он может использовать упр. 3 в § 41 или ЦОР. § 41, упр. 1,2,3 (если не выполнялось на уроке). 4. Домашнее задание С целью разрешения затруднения учитель покажет пошаговый алгоритм уравнивания схем ОВР с помощью электронного баланса. 81 ЦОР № 79 ЦОР № 80 Урок № 48. «Урок-упражнение. Составление окислительновосстановительных реакций». (ОВР) Задачи урока: отработать навыки составления и уравнивания ОВР с помощью электронного баланса, продолжить формирование умений составлять химические формулы и уравнения химических реакций Оборудование: ЦОР № 80, дидактический материал по усмотрению учителя. Данный урок необходимо начать с проверки домашнего задания, после чего учитель решит поставленные задачи согласно приемам и методам, используемым им. На этом уроке учащиеся познакомятся с основными окислителями и восстановителями. Можно использовать ЦОР № 81 (упражнение 2), усложнив его заданием: предложите химические реакции, в которых степень окисления химического элемента изменялась бы так, как показано в данных схемах. Формы работы: групповая, индивидуальная в виде проверочной работы по вариантам в конце урока в качестве текущего контроля знаний и умений. Для домашнего задания можно предложить цепочку превращений с указанием типов химических реакций, а также расчетов согласно упр. 5 § 41. цепочка может быть такой: H2S ← S → SO2 → SO3 → H2SO4 Урок № 49. «Реакция нейтрализации» Задачи урока: повторить сущность ОВР, разобрать суть реакции нейтрализации как типичной реакции ионного обмена, продолжить формирование навыков написания уравнений химических реакций в ионном виде. Оборудование: растворы серной кислоты, гидроксида калия, гидроксида натрия, соляной кислоты, медного купороса, индикатор универсальный и метиловый оранжевый, ЦОР № 81,82,83,84. Название этапа урока 1. Активизация знаний учащихся Содержание этапа Для перехода к рассмотрению реакции нейтрализации полезно сначала проверить домашнее задание. Во-первых, таким образом можно устранить пробелы в знаниях учащихся по окислительновосстановительным реакциям. Во-вторых, начать знакомство с реакцией нейтрализации, основываясь на серной кислоте. Примечание: имеется в виду домашнее задание, данное на прошлом уроке – это цепочка превращений серы. 2. Усвоение новых знаний В начале этапа учитель демонстрирует два раствора: серной кислоты и гидроксида калия, проверяет их индикатором, и просит учащихся объяснить причину изменения цвета индикатора. Таким образом, учащиеся вспомнят диссоциацию электролитов. Затем учитель, подкрасив раствор серной 82 Используемые средства обучения кислоты метиловым оранжевым, прильет к нему раствор гидроксида калия до изменения окраски индикатора на оранжевый и попросит учащихся прокомментировать произошедшее изменение цвета индикатора. Ребята приходят к выводу, что в растворе отсутствуют свободные ионы Н+ и ОН.Учитель вместе с учащимися запишет и пояснит данную реакцию с точки зрения электролитической диссоциации. ЦОР № 81 Заметим, что необходимо записать сокращенное ионное уравнение реакции и пояснить, что именно оно указывает суть химической реакции - образование малодиссоциирующего вещества: 2Н+ + 2ОН- →2 Н2О (коэффициент укажет на то, что в реакции взаимодействовала двухосновная кислота). Далее учитель демонстрирует (или ученики самостоятельно проводят лабораторный опыт) реакцию нейтрализации между соляной кислотой и гидроксидом натрия и просит учащихся составить уравнение реакции в молекулярном и ионном виде. Необходимо, чтобы учащиеся прокомментировали записи и ответили на вопрос: что общего и в чем отличие данной реакции и предыдущей? Теперь ребята сами сформулируют понятие реакции нейтрализации, а учитель поможет. Следующая демонстрация должна расширить представление учащихся о реакции нейтрализации. Для этого можно поставить вопрос: будет ли следующая реакция относиться к реакции нейтрализации? Учитель, предварительно получив нерастворимое основание (например, гидроксид меди (II)), по каплям прильет к нему кислоту. Затем предложит классу указать признаки реакции и записать уравнение в молекулярном и ионном виде. Таким образом, учащиеся придут к выводу, что все основания взаимодействую с кислотами с образованием малодиссоциирующего вещества – воды. В конце данного этапа можно потренировать учащихся в написании молекулярных уравнений по приведенным ионным сокращенным уравнениям. ЦОР № 82,83 Например: 2Н+ + 2ОН- →2 Н2О Fe(OH)2 + 2H+ → Fe2+ + 2H2O. 3. Закрепление материала урока В качестве закрепления можно устно ответить на вопросы упражнений 3,4,5 после § 42 (работу лучше провести в парах или группах) и выполнить упражнение ЦОРа, к которому 83 ЦОР № 84 4. Домашнее задание добавить задание: отметьте реакции нейтрализации или дополните цепочку превращений, получив ещё одну соль той же кислоты. § 42, упр. 1,2. Урок № 50. Практическая работа. «Реакция нейтрализации. Реакции ионного обмена» Работа выполняется по инструкции учебника. Учитель может дополнить работу выполнением расчетной задачи на основе проведенных учащимися экспериментов или разнообразить её разными вариантами, например, предложив разные реагенты. Урок № 51. «Обратимые и необратимые реакции» Задачи урока: расширить представления о химической реакции, выяснив условия, при которых они необратимы, продолжить формирование навыков написания уравнений химических реакций в ионном виде. Оборудование: растворы хлорида бария, серной кислоты, карбонат кальция, ЦОР № 85,86,87,88. Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа В начале урока необходимо повторить с учащимися известные им классификации химических реакций и попросить привести по одному примеру. Внимание уделяется реакциям обмена и их частной разновидности – реакции нейтрализации. Учитель проанализирует выполнение практической работы, и задаст вопрос: возможно ли протекание реакции нейтрализации в обратном направлении (для этого он правую часть уравнения запишет слева). Ученики сделают вывод о необратимости процесса. Учитель предложит учащимся в группах по 2 – 4 человека провести несколько лабораторных опытов, и записать наблюдения и выводы (без уравнений химических реакций). Для этого необходимо, чтобы работа выполнялась по инструктивным картам. Пример инструктивных карт: 1 вариант: 1) в 2 пробирки налейте по 1 мл 84 Используемые средства обучения раствора BaCl2; 2) в одну из них прилейте немного (0,5 мл) раствора серной кислоты; 3) во вторую прилейте 0,5 мл раствора азотной кислоты; 4) наблюдения запишите. 2 вариант: 1) в 2 пробирки насыпьте твердые NaCl и Na2CO3 так, чтобы закрыть дно пробирок; 2) в одну и вторую пробирки прилейте по 1 мл соляной кислоты; 3) наблюдения запишите. Учитель вправе предложить другие опыты согласно имеющимся в кабинете реактивам. Учебное затруднение Разрешение учебного затруднения Учащиеся сделают вывод, что признаки химической реакции наблюдались в одной из пробирок, на что учитель продемонстрирует (или напомнит) учащимся о реакции нейтрализации щелочи и кислоты. Признаков реакции (без участия индикатора) нет, но реакция прошла. После этого учитель задаст провокационный вопрос: как проверить, была ли реакция во второй пробирке? Ребята должны построить гипотезы. Вместе с учащимися учитель рассмотрит данные ЦОР № 85,86 процессы в свете теории электролитической диссоциации, и запишет уравнения в молекулярном и ионном виде. Если число ионов осталось прежним, то реакция не прошла. Учащиеся самостоятельно сделают вывод об условиях необратимости реакций: если часть ионов уходит из сферы реакции в виде осадка или газа, то реакция необратима. Закрепить это понимание поможет ЦОР. ЦОР № 87 Далее учитель пояснит, что с позиции направления протекания химических процессов все реакции можно разделить на необратимые (к таким реакциям относят реакции, протекающие в одном направлении, когда один из продуктов уходит из сферы реакции) и обратимые (протекающие в двух направлениях: прямом и обратном). Необходимо на этом этапе разъяснить значение стрелок между левой и правой частями записанных уравнений химических реакций. Нужно акцентировать внимание учащихся на том, что обратимыми и необратимыми могут быть не только реакции обмена, но и реакции соединения, разложения или замещения и привести примеры подобных реакций. 3. Закрепление материала урока В качестве закрепления темы учитель проводит тренировочные упражнения, в том числе 85 ЦОР № 88 разберет упр. 1 § 43 и ответит на вопросы № 3,4,5,6 этого параграфа. 4. Домашнее задание § 43, упр. 7,8. Урок № 52. «Скорость химической реакции» Задачи урока: расширить представления учащихся о химической реакции, раскрыв понятие «скорость реакции», выявить зависимость скорости химической реакции от природы реагирующих веществ, продолжить формирование навыков наблюдения. Оборудование: ЦОР № 89,90,91,96,93, 2 пробирки с молоком, раствор азотной кислоты, шаростержневые модели (набор шариков трёх цветов), сода кристаллическая и раствор соды. Название этапа урока 1. Актуализация знаний учащихся Содержание этапа В начале урока полезно вспомнить, что называют химической реакцией, попросить учащихся привести примеры различных химических реакций и собственных жизненных наблюдений. Затем учитель задаст вопрос: сколько времени продолжается химическая реакция? Учащиеся предлагают гипотезы. Учитель может дополнить, что существуют реакции, которые длятся несколько секунд (часто сопровождаются взрывом), несколько минут (например: синтез белковой молекулы в клетке) и дольше (например, ржавление железа). 2. Усвоение новых знаний Используемые средства обучения Учитель объявит тему и задачи текущего урока. Сразу необходимо обратить внимание учащихся на значение знаний о скорости химических реакций и задать вопрос: как измерить скорость химической реакции? Если учащиеся затрудняются ответить, то после наводящих вопросов о том, что такое скорость в физическом смысле, можно предложить небольшой демонстрационный эксперимент: С этой целью пригласить двух учеников, перед которыми разложить в коробке шарики от набора шаростержневых моделей атомов двух цветов (одни шарики одинаковые, а вторые разного цвета). По команде они должны соединить шарики попарно. Таким образом, вносится элемент игры, которую учитель может сам разнообразить в соответствии с контингентом учащихся. Так же по команде они останавливаются, и учитель задаст вопрос:1) у кого скорость сбора 86 ЦОР № 90 модели была выше? 2)как ученики определили скорость? Ребята объясняют чаще всего с точки зрения изменения количества шариков. Далее в процессе беседы учитель подведет учащихся к определению скорости химической реакции как изменению количества вещества в единицу времени в единице объема. Путем простых математических действий учащиеся самостоятельно сделают вывод о скорости химической реакции и единицах её измерения. Следующий вопрос, который должны решить на данном уроке учащиеся: от чего зависит скорость химической реакции? Учебное затруднение Разрешение учебного затруднения Ученики самостоятельно начнут строить предположения и это очень хорошо. Учитель снова предложит собрать из шариков модели на время, но теперь один ученик собирает попарно, а второму нужно к шарику одного цвета присоединить 2 шарика другого цвета. Этот игровой эксперимент можно разнообразить. Важно, чтобы суть была такова, что учащиеся пришли бы к выводу о том, что скорость химической реакции зависит от природы реагирующих веществ. Вывод, сделанный учениками, следует записать в тетрадь. Можно попросить их привести примеры, в которых скорость идентичных химических реакций различается в зависимости от того, какие вещества в них участвуют, и дополнить с помощью ЦОРа. Примечание: к ЦОР № 94 можно задать вопрос: в чем различие приведенных реакций? 3. Закрепление материала урока 4. Домашнее задание ЦОР № 89 ЦОР № 92,96,93 В качестве закрепления необходимо поработать с формулой, определяющей скорость химической реакции, решить задачи, подобные упр. 2,4 § 44, а также такие, как: Определите начальную концентрацию вещества А, участвующего в реакции А + В =АВ, если средняя скорость реакции составляет 0,1 моль/л*с, а через 20 секунд после начала реакции концентрация вещества А стала 0,02 моль/л. Упражнение ЦОРа учащиеся выполняют с самопроверкой. ЦОР № 91 § 44, упр. 2,4, § 45 (раздел: зависимость скорости от природы реагирующих веществ). 87 Урок № 53. «Влияние концентрации реагирующих веществ на скорость химической реакции» Задачи урока: выявить зависимость скорости химической реакции от концентрации реагирующих веществ, познакомить учащихся с законом действующих масс, определить причину изменения скорости в гетерогенных реакциях. Оборудование: одинаковые порции серы (в кусочке и порошке), колба, заполненная кислородом, реактивы для лабораторного опыта 7 (в,а), ЦОР № 97,101. Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа В начале урока учитель проверит домашнее задание, а также выполнит тренировочные упражнения на определение скорости химической реакции. Этап начинается с постановки проблемного опыта и вопроса: В ложке для сжигания вещества учитель сжигает кусочек серы, и просит учащихся зафиксировать время, потребовавшееся для сжигания. Вопрос: как увеличить скорость реакции? Ученики строят гипотезы. Главное, проследить, чтобы они могли не только их построить, но и обосновать. На основании гипотез учитель проведет ещё 2 эксперимента с серой: 1) такой же кусочек серы сожжет в колбе, заполненной кислородом; 2) порошок серы той же массы может в воздухе. Примечание: время можно не фиксировать, так как отличие составляет несколько секунд. Учащиеся сделают выводы, которые подведут к решению вопроса, поставленного учителем. Таким образом, ученики самостоятельно выведут зависимость скорости химической реакции от концентрации реагирующих веществ в гомогенных системах и от площади соприкосновения в гетерогенных системах. Будет правильно, если учитель даст определение гомогенных и гетерогенных реакций, а учащиеся попробуют привести примеры. Далее учитель пояснит прямую пропорциональную зависимость скорости химической реакции от концентрации с помощью закона действующих масс, который применим к несложным реакциям. Учащиеся запишут содержание закона и его математическое выражение в общем виде для реакции aA + bB = сС: Vср.= k[A]a *[B]b. Здесь же полезно потренировать учащихся с целью выявления понимания закона на конкретных примерах. 88 Используемые средства обучения Следующий вопрос, который задаст учитель: как повысить концентрацию веществ? Учащиеся сделают предположения. Задача учителя на этом этапе: подвести к решению этого вопроса, связав концентрацию и объем, а, значит, давление (концентрация изменяется во столько же раз, во сколько изменяется давление). Можно предложить здесь устную тренировку. 3. Закрепление материала урока 4. Домашнее задание В качестве закрепления материала урока учитель организует самостоятельную деятельность учащихся с помощью лабораторного опыта 7 (в, а) приложения учебника. Затем проведет устное обобщение материла с использованием ЦОРа. ЦОР № 97, 101 (выборочно) § 45 (раздел: зависимость скорости реакции от концентрации), упр. 1,4. Урок № 54. «Влияние температуры на скорость химической реакции» Задачи урока: выявить зависимость скорости химической реакции от температуры, познакомить учащихся с законом Вант-Гоффа, продолжить формирование навыков наблюдения и обращения с лабораторным оборудованием. Оборудование: ЦОР № 98,96,97 Название этапа урока 1. Активизация знаний учащихся Содержание этапа Вначале урока учитель проверит домашнее задание, и проведет небольшое промежуточное обобщение материала темы с помощью ЦОР. Урок можно начать с определения темы и задач и постановки проблемного лабораторного опыта 7 (б) приложения учебника. Используемые средства обучения ЦОР № 96,97 Учащиеся могут проводить эксперимент в парах, затем обсудить его результаты и уравнение реакции. 2. Усвоение новых знаний После проведенной работы учащиеся уже готовы к более подробному рассмотрению проблемы урока, которую ставит учитель: Как изменяется скорость реакции при повышении температуры? Вопрос не вызывает у учащихся трудностей, так как они убедились на опыте, что скорость повышается при увеличении температуры. Задача учителя: добиться понимания зависимости скорости реакции от небольшого увеличения температуры. Далее учитель обсуждает проблему вычисления изменения скорости реакции при повышении 89 ЦОР № 98 температуры, т.е. закон Вант-Гоффа. Рекомендуется тут же провести закрепление данного аспекта темы, потренировав учащихся в применении данного закона к химическим расчетам. Задание может быть таким: 1) как изменится скорость реакции при увеличении температуры от 200С до 500С, если температурный коэффициент данной реакции равен 2; 2) вычислите конечную скорость реакции при повышении температуры от 00С до 200С, если скорость реакции при 00С составляет 0,002 моль/л*с, а температурный коэффициент равен 3. 3. Закрепление материала урока Обсуждение вопроса о том, почему повышается скорость химической реакции при увеличении температуры, даст возможность рассмотреть классификацию химических реакций с точки зрения теплового эффекта. Заметим, что в 8 классе можно не углубляться в понимание энтальпии, а обсудить лишь внешнюю сторону химического процесса: выделение или поглощение теплоты. Поэтому на данном уроке учащиеся должны усвоить три понятия: а) тепловой эффект; б) экзотермическая реакция; в) эндотермическая реакция. Учитель напомнит, что некоторые реакции не идут при нормальных условиях. Учащиеся самостоятельно вспомнят примеры химических реакций с поглощением или выделением теплоты (или учитель укажет на них). А учитель покажет, как обозначается экзотермическая или эндотермическая реакции в уравнении (+Q или - Q). Закрепление материала проводится по ЦОР № 98 обобщающей схеме ЦОРа в виде вопросов и ответов, которые учащиеся должны составить сами (сначала одна группа задаст вопросы другой, затем они меняются ролями). Если есть время, то можно решить задачу на определение теплового эффекта реакции по уравнению и составление термохимического уравнения реакции. Учитель всегда подберет соответствующие задачи из дидактического материала, используемого им в работе. 4. Домашнее задание § 45 (раздел: зависимость скорости от температуры), повторить разделы 1,2, упр. 3 к § 46 (к данному упражнению можно дать творческое задание: придумайте задачу по одному из приведенных уравнений реакций). Эту задачу учитель может использовать на обобщающем уроке в качестве проверки домашнего задания, когда учащиеся выступят в роли учителя. 90 Урок № 55. «Катализаторы и их влияние на скорость химической реакции» Задачи урока: раскрыть понятие «катализатор», его участие в химических реакциях, классификацию химических реакций с точки зрения участия катализатора. Оборудование: перекись водорода, оксид марганца (IV), спиртовка, ЦОР № 95,96,100,101,102. Название этапа урока 1. Активизация знаний учащихся 2. Усвоение новых знаний Содержание этапа В начале урока учитель вспомнит с учащимися факторы, влияющие на скорость химической реакции, а также потренирует их в решении задач с применением законов, изученных на предыдущих уроках. Этап начинается с проблемного эксперимента с перекисью водорода. Учитель пояснит, что такое перекись водорода, её применение в медицине и обратит внимание учащихся на ограниченный срок хранения. Почему? Если учащиеся затрудняются ответить, то учитель расскажет о разложении этого вещества, запишет уравнение реакции. После этого он демонстрирует перекись водорода. Для эксперимента он наливает в пробирку 3-4 мл перекиси и задает вопрос: как увеличить скорость реакции разложения? Учащиеся без труда предлагают нагревание. Учитель проводит опыт. Следующий вопрос учителя: как определить выделившийся газ (кислород)? С помощью учащихся определяется кислород посредством тлеющей лучинки. Примечание: эту часть опыта можно поручить ребятам. Заметим, что скорость реакции разложения с помощью нагревания настолько мала, что кислород не определяется. Следующую часть опыта учитель проводит сам. Он всыпает в пробирку с перекисью немного оксида марганца (IV). Перекись «вскипает», а внесенная тлеющая лучинка вспыхивает. Снова вопрос учителя: почему увеличилась скорость реакции? Учащиеся построят гипотезы, а учитель пояснит, что оксид марганца (IV) не израсходовался, так как кроме кислорода ничего не образовалось. Учитель поясняет, что подобные вещества называются катализаторами, и просит определить, что же такое катализатор? Ребята записывают определение, которое составят сами. В данном случае важно не передавать ученикам само определение, а дать возможность делать вывод 91 Используемые средства обучения самостоятельно. С помощью ЦОР ребята знакомятся с катализаторами и сверят свое определение с научным. Далее учитель познакомит учащихся с каталитическими реакциями, а также с биологическими катализаторами – ферментами. Можно продемонстрировать все тот опыт разложения перекиси водорода каталазой сырого картофеля, доказав таким образом эффективность биокатализаторов (нет необходимости нагревать). 3. Закрепление материала урока 4. Домашнее задание Учитель перечислит особенности ферментов: 1) избирательность; 2) действие в строго определенной среде; 3) действие в строго определенных интервалах температур. Вывод, который должны сделать учащиеся – это ещё одна классификация химических реакций с точки зрения участия катализатора: каталитические и некаталитические. Учитель объяснит упрощенную схему действия катализатора (через активированный комплекс) и учащиеся запишут схему. Закрепление проводится через вопросы и ответы, подготовленные учащимися по обобщающей схеме. § 45, упр. 3 (повторить все разделы). ЦОР № 94 ЦОР № 95 ЦОР № 99 Урок № 56. «Влияние различных факторов на изменение скорости химических реакций. Урок - обобщение» Задачи урока: обобщить и систематизировать знания учащихся по данной теме, проверить уровень усвоения материала. Оборудование: ЦОР № 100,101, дидактический материал по теме. Примечание: если учитель не предлагал учащимся лабораторные опыты (Приложение 1, опыты 7 - 9), то урок проводится в виде практической работы по инструкции, данной в учебнике. Название этапа урока 1. Проверка домашнего задания Содержание этапа На данном этапе достаточно провести химический диктант по основным понятиям темы с обязательной самопроверкой. Затем учитель предложит ребятам выбрать 5 основных понятий и продолжит работу по обобщению и систематизации знаний. Для выделения пяти основных понятий учитель может воспользоваться игровым моментом: сначала они 92 Используемые средства обучения выделяются индивидуально, затем в паре, затем в группе из четырех человек и, наконец, по рядам. Однако на подобную игру уйдет достаточно времени урока, поэтому рекомендуется провести такую работу в классе с достаточно сильным потенциалом учащихся. 2. Обобщение материала темы Учитель делит класс на группы, каждая из которых готовит ответ на отдельный вопрос данной темы (иначе говоря, работает с определенной группой понятий), который затем докладывает. Задача группы: не только верно донести содержание, но сделать это быстро (иначе учитель увязнет в обобщении) и предложить задание по своему вопросу другим группам. Например: группа готовит вопрос о влиянии температуры на скорость реакции. Она может предложить несложную задачу на закон Вант-Гоффа. Учителю необходимо ограничить время подготовки группы и проследить (а также помочь), какие задания предлагает группа. 3. Систематизация и контроль знаний 4. Домашнее задание Как при подготовке групп, так и в процессе их выступления учитель использует обобщающую схему по данной теме (ЦОР). После сбора понятий в единую систему, т.е. определения выводов, учитель проведет индивидуальную самостоятельную работу с помощью теста или дидактического материала. Повторите § 27,39,40,41,42,43. ЦОР № 100 ЦОР № 101 Урок № 57. «Классификация химических реакций» Задачи урока: обобщить представление о химических реакциях как процессе превращения исходных веществ в отличающиеся от них по составу продукты, продолжить формирование умения предсказывать продукты реакций и записывать уравнения, рассмотреть некоторые из классификаций химических реакций, раскрыть их относительный характер. Оборудование: ЦОР № 102,104,105,106,107,109,108,110,111,112,113,114, реактивы для демонстрационных опытов по усмотрению учителя с целью характеристики демонстрируемой реакции. Примечание: обобщение в 8 классе допустимо проводить в виде фронтальной беседы, поэтому учитель при оценивании работы учащихся может использовать, например, накопительную оценку. Название этапа урока 1. Активизация знаний учащихся Содержание этапа В начале урока учитель напомнит учащимся некоторые реакции, уже известные им. С этой целью он повторит некоторые 93 Используемые средства обучения Реактивы для демонстрационные опыты. Важно подобрать такие реакции, чтобы их можно было рассмотреть с разных позиций. Это может быть: 1) горение серы с последующим растворением оксида в воде; 2) разложение перекиси водорода с помощью оксида марганца (IV); 3) разложение гидроксида меди (II); 4) взаимодействие сульфата натрия с хлоридом бария. Учитель вправе подобрать и другие опыты согласно реактивам, имеющимся в кабинете. 2. Усвоение новых знаний После того, как учащиеся вместе с учителем запишут уравнения реакций, учитель задаст вопросы: 1) что объединяет данные явления? (это химические реакции); 3) чем отличаются данные химические реакции? Учащиеся сделают несколько выводов. Учитель уточнит позиции оценивания химических реакций учениками, и запишет на доске признаки классификаций реакций: 1) по составу исходных веществ и продуктов реакции; 2) по изменению степени окисления химических элементов; 3) по участию катализатора; 4) по обратимости процесса; 5) по поглощению или выделению энергии (теплоты). Далее следует рассмотреть отдельно разные классификации. Учитель в беседе с учащимися может использовать ЦОР в следующей последовательности: 1) Какие реакции подразумевает первая классификация? (вопрос учителя); 2) Приведите примеры реакций соединения. 3) Сформулируйте понятие реакции, обратной реакции соединения (р. разложения), приведите примеры; 4) К какому типу можно отнести следующую реакцию? Дайте определение р. замещения; 5) Запишите уравнение реакции и определите её тип; 6) К какому типу можно отнести ионные реакции? 7) Выполните упражнение; Примечание: можно повторить правила составления ионных уравнений с помощью ЦОР. 8) Сделайте вывод: чем отличается химическое явление от физического? 9) Выполните упражнение (ЦОР) и 94 демонстрационных экспериментов ЦОР № 106 ЦОР № 105 Проверка с помощью ЦОР № 102 ЦОР № 107 ЦОР № 108 ЦОР № 112 ЦОР № 109 ЦОР № 113 ЦОР № 111 10) 11) 12) 13) 4. Домашнее задание подумайте: чем отличается данная реакция соединения от ранее рассмотренных? Какие из продемонстрированных на уроке реакций относятся к таким же реакциям? Вспомните типы химических реакций с точки зрения теплового эффекта. Как обозначить поглощение теплоты? Какие из продемонстрированных на уроке реакций относятся к эндотермическим? Что называют обратимой реакцией? Дайте определение катализатора. Итогом этой беседы должна стать характеристика одной из реакций, предложенной учителем. В конце обобщения учитель предлагает сформулировать понятие «химическая реакция» с позиции знаний о ней (это сложный процесс перекомбинации атомов, который сопровождается разрывом старых химических связей и образованием новых), а также выполнить проверочные упражнения. § 46, упр. 1,2, повторите § 39, 40. ЦОР № 104 ЦОР № 114 Урок № 58. «Химические реакции, характерные для оксидов и оснований» Задачи урока: обобщить сведения об оксидах и основаниях, познакомить учащихся с рядом Н.Н.Бекетова, расширить представление о генетическом ряде. Оборудование: ЦОР № 115,116,117,118,119, оксиды кальция и меди (II), вода, раствор соляной кислоты, стеклянная трубка, цинк, медь. Название этапа урока 1. Актуализация знаний учащихся Содержание этапа На этом этапе учитель попросит учащихся вспомнить классы изученных веществ и состав генетических рядов металлов и неметаллов, а также уравнения реакций, характеризующих эту генетическую связь. На доске необходимо поместить схему генетических рядов и напомнить ребятам названия оксидов металлов и неметаллов (основные и кислотные). Хорошо, если учитель отобразит ряд металла, имеющего растворимый гидроксид и нерастворимый гидроксид. Необходимо также обратить внимание на то, что неметаллы тоже могут иметь нерастворимые гидроксиды 95 Используемые средства обучения ЦОР № 117 и обратить внимание на сходство соответствующих рядов металла и неметалла. Здесь же можно пояснить учащимся, что такое несолеобразующие оксиды. Учащиеся определят общие и отличительные черты данных рядов. Схемы учащиеся отражают в своих тетрадях. 2. Усвоение новых знаний Учитель акцентирует внимание учеников на том, что конечным веществом в превращениях генетических рядов являются соли. Вопрос учителя: как получить соль? Учащиеся уже не раз наблюдали химические превращения, и должны достаточно легко справиться с поставленным вопросом. Если вопрос вызовет затруднение, то можно обратиться к строению атомов металлов и неметаллов и возможности образования химической связи. В ходе беседы с учащимися заполняются пробелы между генетическими рядами, изображенными на доске. Учащиеся устно делают выводы: 1) металлы взаимодействуют с неметаллами с образованием солей бескислородных кислот; 2) оксиды металлов – с оксидами неметаллов с образованием солей кислородсодержащих кислот; 3) основания – с кислотами с образованием солей кислородсодержащих кислот. Учитель может показать некоторые из реакций, которые уже знакомы учащимся или предложить их выполнить в лабораторных опытов. Учитель поясняет, что взаимодействия веществ, относящихся к разным генетическим рядам, называется генетической связью. Необходимо различать генетическую связь и генетический ряд. Первое понятие шире, так как отражает превращения, в которых связаны разные формы существования химических элементов. Второе понятие - более узкое, так как отражает превращения разных веществ, образованных одним химическим элементом. Для закрепления данного аспекта учитель предложит поработать (прокомментировать) ЦОР № 118 генетические ряды и записать уравнения химических реакций, отражающих генетическую связь между ними. Учащиеся могут самостоятельно или с помощью учителя вспомнить, что наблюдали и другие реакции, нежели описанные выше. Например: взаимодействие металлов с кислотами при изучении водорода. Учитель проведет (или предложит провести 96 учащимся) эксперимент: в две пробирки нальет немного раствора соляной кислоты, и опустит в них цинк и медь. Выводы ребята сделают самостоятельно. Учитель расширит их представления, ЦОР № 115 познакомив с вытеснительным рядом Н.Н.Бекетова. Далее учитель предложит продолжить рассуждения о взаимодействии веществ разных генетических рядов между собой. Для этого проводятся опыты : взаимодействие гидроксида кальция с углекислым газом (ученик продувает раствор известковой воды через стеклянную трубку) и взаимодействие оксида меди (II) с соляной кислотой. Учащиеся обнаруживают получение соли (с этой целью можно выпарить полученные растворы) и ставят соответствующие стрелки в схеме. Они запишут уравнения реакций и могут составит отдельные схемы, иллюстрирующие химические свойства оксидов и оснований. Учитель может предложить составление таких схем в виде домашнего задания. Таким образом, учащиеся приходят к выводу о том, что взаимодействие веществ разных генетических рядов приводит к обязательному образованию солей, и учитель систематизирует полученные сведения. ЦОР № 116 Если позволяет время урока, то необходимо поговорить о возможностях взаимодействия солей друг с другом. Если времени не хватает, то обратиться к данному вопросу на следующем уроке. 3. Закрепление материала урока Учитель может воспользоваться упр. 1 § 47 или выполнение теста. 4. Домашнее задание § 47, упр. 2 (нужно пояснить: в записанных на уроке уравнениях химических реакций надо определить реакции ионного обмена и составить ионные уравнения и окислительновосстановительные реакции и составить электронный баланс). 97 ЦОР № 119 (упр.1,2,3). К упражнениям можно предложить вопросы, например к упр.1: определите типы химических реакций; Свойства какого класса веществ характеризуют данные реакции? Урок № 59. «Химические реакции, характерные для кислот» Задачи урока: обобщить сведения о кислотах, научить пользоваться таблицей растворимости для прогнозирования возможных химических реакций кислот. Оборудование: ЦОР № 115, 116, 103, 119, таблица растворимости, реактивы, необходимые для демонстрации характерных свойств кислот. Название этапа урока 1. Актуализация знаний учащихся Содержание этапа Используемые средства обучения В начале урока учитель проверит домашнее задание, и проведет фронтальную работу с классом по вопросам: 1) назовите известные классы веществ; 2) назовите вещества, относящиеся к генетическому ряду металлов; 3) назовите вещества, относящиеся к генетическому ряду неметаллов; составьте генетический ряд фосфора; Здесь же имеет смысл вспомнить о несолеобразующих оксидах. 4) какие из веществ генетического рада неметаллов взаимодействуют с веществами противоположного ряда; 5) что называют генетической связью? 2. Усвоение новых знаний Для более прочного усвоения знаний учитель может воспользоваться уже известной ребятам генетической цепочкой фосфора (провести реакции превращения фосфора и попросить записать уравнения реакций). После уточнения принадлежности веществ к определенным классам учитель просит вспомнить, с какими из веществ генетического ряда металлов могут взаимодействовать кислоты и записать схематично это взаимодействие. Запись может выглядеть таким образом: Ме, стоящие до водорода в вытесн.ряду Кислоты основные оксиды Основания Теперь можно уточнить, с какими металлами взаимодействуют кислоты и, проведя демонстрационный эксперимент, дополнить: при условии, если образующаяся соль является растворимой. ЦОР № 115 Для эксперимента можно взять фосфорную кислоту и цинк. Наблюдения покажут, что гранула цинка покрывается налетом соли, и реакция постепенно уменьшается. Для иллюстрирования взаимодействия кислот с 98 ЦОР № 103 металлами учитель может предложить в качестве повторения ЦОР. Если есть время, то можно рассмотреть реакции кислот с солями (учитель подберет необходимые реактивы) и записать некоторые уравнения, прокомментировав условия протекания реакций ионного обмена до конца. Закончить этап можно обобщающей схемой способов получения солей. На данном этапе учитель ещё раз поговорит о классах веществ. Затем учащиеся выполнят индивидуальную проверочную работу. 3. Закрепление материала урока 4. Домашнее задание ЦОР № 116 ЦОР № 117 ЦОР № 119 (упр. 4) В целях экономии времени урока можно предложить 4 варианта с последующей коррекцией. § 47, упр. 1 (а, г) (если оно не было выполнено ранее). Урок № 60. «Химические свойства сложных веществ. Практическая работа» Работа выполняется по инструкции, данной в учебнике (Практическая работа 5 приложения 1 учебника). Домашнее задание: повторить генетическую связь сложных веществ (§ 46, 47). Урок № 61. «Обобщение сведений о химических реакциях» Задачи урока: обобщить и систематизировать знания учащихся о химических реакциях, генетической связи неорганических веществ, подготовить к выполнению контрольной работы по теме. Оборудование: ЦОР № 116,117,118. Тип урока: учебный семинар. Название этапа урока 1. Активизация знаний учащихся Содержание этапа С целью активизации знаний учитель вместе с учениками анализирует практическую работу. Для коррекционного анализа можно предложить следующее: Учитель выписывает на доске наиболее распространенные ошибки и просит учащихся определить и исправить их. Подобная работа называется «найди ошибку» и очень нравится ребятам. 2. Обобщение и систематизация знаний Данный этап следует разделить на три ключевых момента: 1) классификация неорганических веществ; 99 Используемые средства обучения 2) генетическая связь между ними; 3) способы получения солей как отражение генетической связи. С целью вовлечения всех учащихся в работу учитель предложит им разделиться на группы, каждая из которых рассматривает один из предложенных моментов. Очень хорошо в данном случае использовать элементы социо-игровой технологии (если учителю они знакомы, то он самостоятельно решит, какие элементы возможны в данном уроке). Учитель предложит учащимся группы определенную схему (ЦОР) и вопросы к ней, которые они должны отразить в своем представлении данной схемы. Группа 1: а) назовите основные признаки, по которым классифицируют неорганические вещества; б) перечислите вещества одного генетического ряда; в) дайте определение веществам в генетическом ряду; г) напишите пути перехода (уравнения химических реакций) от одного вещества генетического ряда к другому. Группа 2: а) дайте определение генетической связи; б) определите генетическую связь оксидов; в) определите генетическую связь оснований; г) определите генетическую связь кислот. Группа 3: а) назовите способы получения солей бескислородных кислот, определите тип химической реакции; б) приведите примеры реакций соединения в результате которых образуются соли; в) приведите примеры реакций обмена, в результате которых образуются соли; г) сделайте вывод о типах реакций, в результате которых образуются соли. 3. Контроль и самопроверка знаний учащихся 4. Домашнее задание На этом этапе ученики выполняют краткую проверочную работу, предложенную учителем. Работа не должна содержать много вариантов (можно и один вариант) и должна быть обязательно проверена в классе с целью коррекции и рефлексии. Должно включать задания, подобные тем, что будут предложены в контрольной работе. 100 ЦОР № 117 ЦОР № 118 ЦОР № 116 Урок № 62-63. Контрольная работа по теме «Химические реакции» и её анализ Задачи урока: проконтролировать уровень усвоения знаний по данной теме. Оборудование: учитель использует дидактический материал авторов данного учебного пособия. Урок № 64. «Круговорот кислорода, углерода, азота в природе» Задачи урока: расширить знания учащихся о явлениях, происходящих в природе, объединив сведения, полученные из биологии и химии в целое, показать значение круговорота для человека, развивать самостоятельность учащихся в работе с учебным материалом, продолжить формирование наблюдать, сравнивать, делать выводы. Оборудование: ЦОР № 120,121,122,123, схемы круговорота, данные в учебнике (§ 48). Урок можно построить в виде конференции с серией докладов и работой с учебными схемами, данными в § 48. Учитель также может построить урок, используя методику семинара и элементы технологии коллективной творческой деятельности учащихся, т.е. групповую работу. С этой целью класс делится на группы, которые станут выполнять одинаковое задание. Начинает отвечать (защищать свой творческий отчет) группа, выполнившая задание первой. Остальные группы выступают оппонентами, и могут получить накопительный балл за дополнения к ответам выступающих других групп. Вопросы для обсуждения записаны на доске: 1) Охарактеризуйте превращения атомов кислорода в природе, значение круговорота. Приведите примеры реакций (генетическую цепочку), доказывающую круговорот кислорода. 2) Охарактеризуйте превращения атомов углерода в природе, значение круговорота. Приведите примеры реакций (генетическую цепочку), доказывающую круговорот углерода. 3) Охарактеризуйте превращения атомов азота в природе, значение круговорота. Приведите примеры реакций (генетическую цепочку), доказывающую круговорот азота. К каждому вопросу учитель прилагает соответствующий ЦОР (ЦОР № 120, 121, 122). Примечание: сразу отметим, что, используя подобный метод работы с этим материалом, учителю потребуется 2-3 часа учебного времени, что обосновано и допустимо в данном случае, так как учитель может разнообразить тему решением генетических цепочек и задач. Завершением данной работы станет отражение схем круговоротов с простейшими уравнениями химических реакций в тетрадях учащихся. Учитель поработает фронтально с классом по вопросам, данным в конце § 48, а также предложит тест ЦОРа (ЦОР № 123) и подобные в нем задачи для индивидуальной работы учащихся. 101 Урок 65 – 68 «Повторение изученного материала». Это цикл обобщающих и контрольных уроков, которые являются заключительными в 8 классе. Здесь учитель проводит годовую контрольную работу (смотр знаний), экскурсии и т.д. 102