Лекция 2. Химическая связь Лектор: асс. каф. ОНХ Абрамова Полина
advertisement

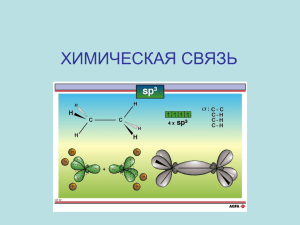
Лекция 2. Химическая связь Лектор: асс. каф. ОНХ Абрамова Полина Владимировна еmail: bozhkopv@tpu.ru «Вопрос о природе химической связи - сердце всей химии» Брайк Кроунфорд – мл. ПЛАН ЛЕКЦИИ I. Химическая связь и её характеристики II. Ковалентная связь. Метод ВС III. Теория гибридизации АО IV. Ионная связь V. Металлическая связь VI. Водородная связь VII. Межмолекулярные взаимодействия 2 I. Химическая связь Химическая связь – это различные виды взаимодействий, обусловливающих существование многоатомных соединений (молекул, ионов, радикалов, кристаллов) Отличительные признаки химической связи: 1) Понижение энергии системы по сравнению с суммой энергий несвязанных атомов 2) Перераспределение электронной плотности в области образования химической связи 3 Характеристики химической связи 1. Длина химической связи (lсв) – расстояние между ядрами соседних атомов в молекуле или кристалле [нм] Чем больше радиус атома, тем длиннее связь: HF – HCl – HBr – HI lсв, нм 0,092 0,128 0,142 0,162 2. Энергия химической связи (Есв) – энергия, которую необходимо затратить для разрыва химической связи [кДж/моль] Чем больше длина связи, тем меньше её энергия: HF – HCl – HBr – HI Есв, кДж/моль 536 432 360 299 4 Виды химической связи 1. Ковалентная связь 2. Ионная связь 3. Металлическая связь 4. Водородная связь 5. Межмолекулярные взаимодействия (силы Ван-дер-Ваальса) 5 II. Ковалентная связь. Метод ВС Ковалентная связь – химическая связь, образованная путем обобществления пары электронов двумя атомами Метод ВС позволяет описать сложную молекулу 6 Положения метода ВС 1. Химическая связь образуется между двумя атомами как результат перекрывания атомных орбиталей (АО) (обобществление электронов) 2. В соответствии с принципом Паули химическая связь образуется неспаренными электронами с антипараллельными спинами 3. Характеристики химической связи (энергия, длина, кратность и др.) определяются типом перекрывания АО 7 Типы перекрывания АО 1. σ-связь – перекрывание АО вдоль линии связи. Пример: s-s, s-p, p-p, d-d перекрывание 8 Типы перекрывания АО 2. π-связь – перекрывание АО с двух сторон от линии связи Пример: p-p, d-p, d-d перекрывание 9 Схемы метода ВС Пример: О2 КС = 2 Кратность связи (КС) – это число общих электронных пар между взаимодействующими атомами 10 Механизмы образования ковалентной связи 1. Обменный механизм – каждый атом отдает на образование общей электронной пары по одному неспаренному электрону Пример: H2 КС = 1 11 2. Донорно-акцепторный механизм – один атом отдает пару электронов (донор), а второй предоставляет свободную орбиталь (акцептор электронной пары) Пример: NH4+ N 2s22p3 N – донор электронной пары Н+ – акцептор электронной пары 3H 1s1 H+ 1s0 КС = 1 Все четыре связи равноценны 12 Свойства ковалентной связи 1. Полярность – смещение электронной плотности к более электроотрицательному атому. - Ковалентная неполярная связь – образована атомами с одинаковыми значениями ЭО: Н-Н, О=О. (ΔЭО = 0) - Ковалентная полярная связь – образуется между атомами с разными значениями ЭО: H2O, NH3 13 Свойства ковалентной связи 2. Насыщаемость – определенное число химических связей атома, вызванное ограниченным числом валентных связей и АО Пример: молекула H2 H 1s1 Насыщаемость = 1 3. Направленность – ковалентными связями геометрическое строение молекулы и ионы с имеют определённое - Геометрическое строение молекул и объясняется гибридизацией атомных орбиталей ионов 14 III. Теория гибридизации АО Гибридизация - это выравнивание АО по форме и энергии Основные положения теории гибридизации: 1) Гибридизуются атомные орбитали только центрального атома 2) Гибридные атомные орбитали (ГАО) участвуют только в сигма (σ) связывании 3) Число АО = числу ГАО 15 sp гибридизация (на примере BeCl2) Алгоритм определения типа гибридизации в молекулах: 1) Записать электронно-графическую формулу для валентных электронов (участвуют в образовании химической связи) 16 2) Записать электронно-графическую формулу центрального атома в возбужденном состоянии (если необходимо) 17 3) По числу АО построить ГАО 18 4) Определить тип гибридизации по числу атомных орбиталей, участвующих в гибридизации Тип гибридизации sp, 180о, форма – линейная 19 sp2 гибридизация (на примере BCl3) 20 4) Тип гибридизации sp2, 120о форма – плоский треугольник 21 sp3 гибридизация (на примере СH4) 22 4) Тип гибридизации sp3, 109.28º форма – тетраэдр sp3d, sp3d2 изучить самостоятельно 23 IV. Ионная связь Ионная химическая связь – (В. Коссель, 1916г.) – электростатическое взаимодействие ионов в химическом соединении ΔЭО ˃ 1,9 - между катионами s-металлов I и II группы п. с. и анионами неметаллов VI и VII группы Пример: NaCl, LiF, K2O, MgO 24 Свойства ионной связи В отличие от ковалентной связи ионная связь: ненаправлена, т.к. электростатическое поле иона обладает сферической симметрией и способно притягивать ионы противоположного знака в любом направлении ненасыщаема – ионы данного знака притягивать к себе переменное ионов противоположного знака способны количество 25 Свойства ионной связи Эти свойства приводят к тому, что соединения с ионной связью имеют трёхмерные кристаллические решетки, в узлах которых находятся ионы Весь кристалл можно рассматривать как гигантскую молекулу, состоящую из огромного числа ионов: NaCl CsCl 26 V. Металлическая связь Металлическая связь – также, как и ковалентная связь возникает за счет обобществления валентных электронов, только в металле обобществленные электроны обслуживают весь кристалл (электронный газ) 27 VI. Водородная связь Водородная связь – связь между атомом водорода и наиболее ЭО атомами O, N или F Пример: NH3, H2O, HF - Внутримолекулярная – водородная связь между двумя группами одной и той же молекулы Пример: салициловый альдегид - Межмолекулярная – водородная связь между разными молекулами Пример: фтороводород 28 VII. Силы Ван-дер-Ваальса Силы Ван-дер-Ваальса – связи между молекулами, обусловленные электростатическим взаимодействием Типы сил: 1) Ориентационное взаимодействие – между полярными молекулами Пример: НCl – HCl 29 2) Индукционное взаимодействие – между полярными и неполярными молекулами Пример: H2 – HCl 3) Дисперсионное взаимодействие – между неполярными молекулами Пример: Н2 – Н2 30 Спасибо за внимание!