Лекция 14. Химия аренов. Получение и свойства.
advertisement

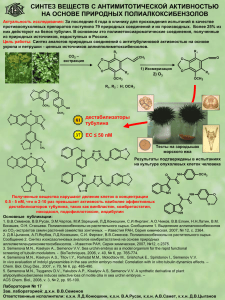
Лекция 14 Химия аренов. Doctoribus atque poetis omnia licent Ученым и поэтам все дозволено Свойства аренов. Реакции бензола, нафталина, антрацена и фенантрена, сопровождающиеся нарушением ароматической системы: гидрирование, хлорирование, окисление, озонолиз. Реакции циклоприсоединения. Восстановление аренов по Берчу. Реакции замещения водорода в боковой цепи алкилбензолов на галоген. Окисление алкилбензолов до альдегидов и карбоновых кислот. Канцерогенность полиароматических соединений. Классификация реакций ароматического электрофильного замещения. Общие представления о механизме реакций, кинетический изотопный эффект в реакциях электрофильного замещения водорода в бензольном кольце. Представление о πи σ-комплексах. Аренониевые ионы в реакциях электрофильного замещения. Влияние природы заместителя на ориентацию и скорость реакции электрофильного замещения. Электронодонорные и электроноакцепторные заместители. Согласованная и несогласованная ориентация двух или нескольких заместителей в в бензольном и нафталиновом рядах. Ориентанты первого и второго рода. Функционализация боковой цепи. Бензильное положение активировано CHCl2 CH2Cl CH3 CCl3 Cl2, hν Cl2, hν Cl2, hν - HCl - HCl - HCl бензилхлорид CH3 + Cl бензальхлорид HCl + бензотрихлорид CH2 + ∆H0 ∆H0 = -18 ккал / моль CH2 + Cl2 CH2Cl + Cl + ∆H0 ∆H0 = -12 ккал / моль Cl Cl hν + Cl2 + (56 %) + 40 °C (80 %) + Br2 Cl Cl (C6H5COO)2 + SO2Cl2 (44 %) hν (20 %) Br + 2 Br2 CH2Br hν 125 °C (50 %) CH2Br + 2 Br2 CH2Br hν 175 °C NBS CH2Br CHBr2 CHBr2 (75 - 80 %) Br Фториды не получают фторированием PhCH2Br + KF Ar 18-краун-6 CH3CN; 20 - 40 °C CHO + SF4 R COOH + 2 SF4 O2N PhCH2F + KBr 100 - 130 °C (100 %) Ar CF2H + SOF2 (70 - 90 %) 100 - 130 °C R CF3 + 2 SOF2 + HF COOH + 2 (C2H5)2NSF3 100 °C DAST O2N CF3 + 2 (C2H5)2NH2F + 2 SOF2 Окисление боковой цепи O2N CH2=CH2 CrO3 / Al2O3 H3PO4 600 °C CH3 Na2Cr2O7, H2SO4 O2N 100 °C COOH (82 - 86 %) CH3 KMnO4, KOH COOK 100 °C, H2O (80 %) O KMnO4, KOH COOK + 100 °C, H2O (46 %) KMnO4, t O OH HO KMnO4 COOH 18-краун-6 бензол CrO3, H2SO4 (78 %) (AcO)2HC (CH3CO)2O H2O, H EtOH CH(OAc)2 + OHC CAN или CrO2Cl2 CHO (52 %) CHO (78 %) - HO / H2O CHCl2 Cl - HCl CHO OH CCl3 NaOH H2O CH2OH KMnO4 CO2H CHO NaOH [O] CN CO2H CH3 O2 CO2H Co(OAc)2 (Промышленный метод) O2 / Co 2+ AcOH п-Ксилол O2 / Co CO2H Терефталевая кислота CO2H 3+ AcOH о-Ксилол HO2C CO2H Фталевая кислота ∆ O2 / V2O5 350 - 400 °C Нафталин O O O Фталевый ангидрид O Na2Cr2O7 / H2SO4 90 °C O антрахинон KMnO4 KOH тетрацен CO2H HO2C CO2H HO2C CO2H + CO2H Фталевая кислота Пиромеллитовая кислота Канцерогенность бензо[a]пирен 7,12-диметилбенз[a]антрацен O O2 энзимы HO OH OH OH O2 O энзимы NH2 N алкилирует ДНК и вызывет ошибки при считывании генетического кода HO O P O N O N N O O фрагмент ДНК Гидрирование + H2 CH3 H Rh / C 100 °C; 30 атм. H CH3 CH3 H + CH3 H 1 9 PtO2 Тетралин AcOH 50 °C; 4 атм. H H + 5 H2 Ni; 160 °C + EtOH; 150 атм. H H Восстановление по Берчу Na / NH3 жидк. EtOH, -33 °C Li быстро + Li - e медленно [NH3]n NH2- беcцветный раствор синий раствор H Li+ e- [NH3]n H Li+ - анион-радикал H H H e- EtOH H H + 1/2 H2 LiOEt H H H H H H EtOH H Li H Li LiOEt CO2H Na / NH3 (жидк.) H OMe OMe CO2H CO2Na Na / NH3 (жидк.) + Et2O, EtOH EtOH основной продукт (89 - 95 %) CO2Na CO2Na CO2Na CO2H - e- Na H CO2H EtOH - . H H e- H OMe OMe OMe H H H H CO2H H - EtOH H H H OMe H H OMe H H H H Na / NH3 (жидк.) (50 %) EtOH, - 33 °C OMe NMe2 H+ Na / NH3 (жидк.) EtOH, Et2O OMe NMe2 1) Na / NH3 (жидк.) 2) EtOH 1,4-дигидронафталин Na / NH3 (жидк.) EtOH (80 %) 1,4,5,8-тетрагидронафталин OH Na; NH3 C2H5OH O Реакция электрофильного замещения H H + E+ H E E + H+ + E H H E E δ+ δ+ δ+ H E H E H E Первая стадия – образование π-комплекса Br Ag Br Ag Упрощенный энергетический профиль электрофильного замещения Кинетический изотопный эффект КИЕ=kH/kD в случае участия разрыва связи CH (CD) в скорость определяющей стадии наблюдается КИЕ=5-7 Скорость определяющая стадия – образование σ-комплекса (карбокатиона) X X X X H E E H E орто- мета- E H пара- ипсо- Различная региоселективность электрофильного замещения OMe OMe OMe OMe Br Br2 + CH3COOH + Br Br (96 %) пара-броманизол (4 %) орто-броманизол NO2 NO2 (0 %) мета-броманизол NO2 NO2 NO2 98 % HNO3 / H2SO4 + + 100 °C O2 N (1 %) NO2 (6 %) (93 %) Ипсо-замещение X X X E E H +E ~E + ипсо-σ-комплекс E -X -H+ орто-σ-комплекс ~X + H E E X X H -H+ орто-продукт орто-σ-комплекс SiMe3 H HCl H SiMe3 Cl - - Me3SiCl Устойчивость сигма-комплексов – определяет региоселективность OCH3 OCH3 E OCH3 E E H H OCH3 H OCH3 H OCH3 OCH3 E H E H OCH3 ХОРОШО H E E E E H E H OCH3 OCH3 OCH3 E H H O O O O O N N N E E O O O H E O O N H O E O N O N E H O E O N H ПЛОХО N N H O E H H O O E H E H Cl Cl Cl E E E H H Cl H E H H Cl E H Cl E H E Cl Cl Cl E H Cl E E E H Cl H H Ориентанты 1 рода (орто-, пара-) OH, OR, OCOR, SH, SR, NH2, NHR, NR2, NHCOR, -N=N-, CH3, CH2R, CHR2, CR3, CH2Cl, CH2OH, F, Cl, Br, I Ориентанты 2 рода (мета-) SO3H, NO2, COOH, COOR, CONH2, COCl, SO2R, NO, CHO, COR, CN, CCl3; CF3, NH3+, NR3+; +PR3, +SR2, POR2, B(OH)2 Промежуточные (плохая региоселективность) CH2F, CHCl2, CH2NO2, CH2CH2NO2, CH2CH2N+R3, CH2P+R3, CH2S+R2 + Br2 CCl4 Br 10 °C (80 - 82 %) HO NO2 HNO3 (CH3CO)2O HO NO2 O2N (43%) Согласованное и несогласованное влияние заместителей Соотношение продуктов при нитровании Cl CH3 Br (> 99 %) (4 %) (96 %) COOH (< 1 %) Cl (80 %) (20 %) NO2 OCH3 F (66 %) (9 %) (59 %) (87 %) (3 %) (31 %) CH3 COOH (13 %) Br (32%) Cl