ОСОБЕННОСТИ ПРОСТРАНСТВЕННОЙ ОРГАНИЗАЦИИ
advertisement

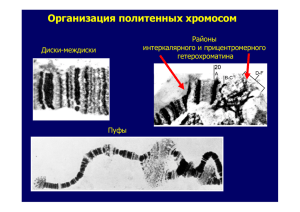
Таким образом, именно нервная система животных влияет на производство «положительных» и «негативных» химических сигналов, несущих социальнозначимую информацию об условиях окружающей среды. Центральная нервная система участвует также в восприятии и обработке ольфакторной информации, с помощью которой сообщества животных регулируют собственную приспособленность через стабилизацию/дестабилизацию генетического аппарата соматических и половых клеток. К настоящему времени у человека обнаружены эффекты влияния феромонов на изменение длительности и синхронизации эстральных циклов; на изменения в настроении и на предпочтения при выборе полового партнера, а также способность определять некоторые генетические дефекты по запаху. Все это позволяет предполагать, что описываемые нами закономерности влияния хемосигналов на реципиентные организмы у мышей действуют и у человека. Ключевые слова: плотность, модель на мышах, феромоны, плотность костной ткани, клетки костного мозга, зародышевые клетки, целостность генома. Key words: human health, density, mouse model, pheromones, stress, bone marrow cells, germ cells, genome integrity. УДК 575.21 Никитина Е.А., Медведева А.В., Долгая Ю.Ф., Журавлев А.В., Савватеева-Попова Е.В. ОСОБЕННОСТИ ПРОСТРАНСТВЕННОЙ ОРГАНИЗАЦИИ ХРОМАТИНА У ПОЛИМОРФНЫХ ВАРИАНТОВ ЛОКУСА agnostic ДРОЗОФИЛЫ - МОДЕЛИ ГЕНОМНЫХ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА 1 Институт физиологии им. И.П. Павлова РАН, Санкт-Петербург, 21074@mail.ru Актуальной проблемой современной нейрофизиологии и медицины является изучение предпосылок возникновения социально-значимых болезней - синдромов с разнообразными расстройствами высшей нервной деятельности и васкулярными патологиями. Эти синдромы возникают спонтанно и спорадически в результате протяженных делеций и дупликаций, генерируемых неравной рекомбинацией в районах хромосом со специфической архитектурой. Это синдромы: Уильямса в 7q11.23, Смит-Магениса в 17p11.2, ДиГеорги в 22q11.2, Прадер-Вилли-Ангельмана в 15q11-q13, дупликационный синдром 1 Nikitina E.A., Medvedeva A.V., Dolgaya Yu.F., Zuravlev A.V., Savvateeva-Popova E.V. Chromatin organization of Drosophila agnostic locus polymorphic variants – the models of human genomic diseases. 976 (17)(p11.2p11.2) и синдромы с делециями в Y-хромосоме. Высокая частота таких структурных перестроек генома, значительно превышающая частоты появления болезней из-за мутаций какого-либо одного гена, привлекла внимание клиницистов и привела к формированию концепции «геномных болезней» [1]. Если симптомы таких болезней описаны, то механизмы их возникновения еще мало изучены, что требует привлечения других модельных объектов. Такая модель была разработана нами у Drosophila melanogaster, политенные хромосомы слюнных желез которой дают уникальную возможность изучения пространственной организации интерфазного ядра, а становление различных форм обучения соотнесено с функциями определенных структур мозга. Мутация по гену agnostic, (AGNts3), нарушающая системы вторичных посредников, а также обучение и память при условно-рефлекторном подавлении ухаживания у самцов [2] была локализована в пределах района 11AB Х-хромосомы дрозофилы, который содержит ген CG1848 для LIM-киназы 1 (LIMK1), гомологичный у многих видов [3]. LIMK1 принимает участие в регуляции динамики актина, фосфорилируя фактор его деполимеризации - кофилин. Считается, что именно гемизиготность по этому гену в случае делеционного синдрома Уильямса (WilliamsBeuren Syndrome - WBS) обусловливает когнитивные нарушения у пациентов. Район 11АВ цитологической карты Х-хромосомы является районом интеркалярного гетерохроматина, обогащенного повторами, а сам ген фланкирован АТбогатыми повторами, что создает на нуклеотидном уровне ситуацию сходную с той, которая наблюдается у пациентов с делеционно-дупликационными синдромами. Поэтому неслучайно большинство нейродегенеративных болезней старения также возникают спорадически из-за нарушений интегральной целостности генетического аппарата и физиологических последствий его функционирования, предопределяемых, в частности, сигнальными каскадами ремоделирования актина. При секвенировании мутантной (AGNts3) и полиморфных аллелей гена agnostic, выделенных из природных популяций (CS, Or-R и Berlin), были обнаружены отдельные полиморфизмы в экзонах и особенно сильные изменения в 1-ом интроне линий AGNts3 и Or-R. Среди них несколько малых инсерций и делеций, а также АТ-богатая вставка 28 пар нуклеотидов. В предыдущих исследованиях было показано, что частота формирования негомологичных контактов в линии AGNts3 достоверно выше, чем в контрольной линии CS. При этом район локализации гена 11АВ у AGNts3 вступает в эктопические контакты в 3 раза чаще, чем у CS. В данном исследовании составлены матрицы контактов, сформированных районом 11АВ для всех 4 линий. Из литературных данных [4] известно, что для формирования негомологичного контакта необходимо наличие сайтов гомологии. АТ-богатая вставка 28 пар нуклеотидов препятствует формированию нуклеосомы, что характерно для промоторных районов. Поэтому изучая вклад свободных от нуклеосом районов гена для LIMK1 в пространственную организацию ядра косвенным образом оценивается совместная локализация транскрипционно активных генов. В программе 977 NCBI BLAST были определены гены, содержащие последовательности, гомологичные свободным от нуклеосом районам гена LIMK1. Далее локализация этих генов соотносилась с матрицей негомологичных контактов для каждой линии. Использовали стандартную методику приготовления давленых препаратов слюнных желез личинок дрозофилы III возраста и ацето-орсеинового окрашивания. Наибольшие межлинейные различия получены в районе 3256-3496, в котором по результатам секвенирования обнаружена вставка 28 нуклеотидов у AGNTs3 и Or-R. Мы предполагаем, что наличие вставки в 1-ом интроне у AGNts3 и Or-R и Sтранспозона в некодирующем 3’-конце гена LIMK1 у мутанта AGNts3 способствует появлению новых сайтов гомологии между отдаленными генами и их пространственному сближению. Изменение архитектуры ядра с необходимостью приведет к модификациям функционирования вовлеченных в контакты генов. Согласно полученным результатам, район 11АВ формирует контакты с рядом генов, определяющих структуру хроматина и влияющих на организацию как гетерохроматиновых, так и эухроматиновых районов. Для линии CS это lethal(3)neo38, участвующий в сайленсинге хроматина (FBgn0265276). У линий AGNts3, Berlin, Or-R - HP1D3csd гетерохроматиновый белок, содержащий хромодомен (FBgn0030994). Показано, что с генами, обрамленными повторами, HP1 связан на протяжении развития, вместе с тем с генами, свободными от повторов, HP1находится в динамическом взаимодействии. Этот белок локализуется по длине Х-хромосомы самцов дрозофилы, что свидетельствует о его участии в механизмах компенсации дозы гена [5]. Кроме того, для района 11АВ у Or-R характерно взаимодействие с геном 4.5SRNA, участвующем в регуляции сайленсинга хроматина (FBgn0265276) и polybromo (FBgn0039227). Ген polybromo содержит 6 тандемно расположенных бромодоменов и является фактором ремоделирования хромосом в составе BRG1-комплекса. Мишенью белка Pb1 являются ацетилированные гистоны [6]. Наличие вставки S-элемента в некодирующем 3’-конце гена LIMK1 у мутанта agnts приводит к появлению сайта гомологии с еще одним геном, влияющим на структуру хроматина, - JIL. Продукт гена JIL JIL-1-киназа специфически локализуется в междисках политенных хромосом и осуществляет фосфорилирование гистона H3 по серину в положении 10, что способствует поддержанию деконденсированного состояния междиска и препятствует распространению гетерохроматина и формированию негомологичных контактов [7]. В отсутствии JIL-1 происходит гетерохроматинизация хромосомы, укорочение, слияние дисков, уничтожение междисков и увеличение числа эктопических контактов. Согласно литературным данным, JIL-1-киназа взаимодействует с междисковыми белками Chriz (CHRO)- Chromator и белком Z4, образуя с другими междисковыми белками специфический комплекс, обеспечивающий поддержание структуры и транскрипционную активность района. Результаты исследования Uttama Rath с соавторами [8] свиде978 тельствуют о том, что JIL-1 и Chromator определяют распределение и активность других молекул, влияющих на организацию хромосомы и регулирующих формирование гетерохроматина и его распространение по хромосоме. По-видимому, все вышесказанное имеет отношение к таким междисковым белкам, как инсулятор BEAF-32, топоизомераза 1, факторы элонгации и инициации транскрипции РНК-полимераза II и др., факторы ремоделирования нуклеосом и модифицирования гистонов, что выражается в следующих модификациях: H2A2, H2AZ, H3K14ac, H3K9ac – K14Ac, H3K4me3 [9]. Таким образом, можно предположить, что изменение локализации упомянутых генов, участвующих в организации хроматина, может сказаться на свойствах как эухроматиновых, так и гетерохроматиновых районов хромосом исследуемых линий, что и выражается в увеличении частоты формирования негомологичных контактов по сравнению с контролем. Также результаты исследования позволяют предположить, что фенотипическое проявление гена, особенно локализующегося в гетерохроматине, зависит, в том числе и от того, с какими генами сформирован негомологичный контакт. Для линий agnts3 и Or-R характерен ряд аномалий в формировании памяти и обучения при условнорефлекторном подавлении ухаживания. Действительно, по сравнению с CS, изменена локализация генов, отвечающих за формирование памяти и обучение (sgg), развитие сенсорных органов (lz), восприятие вкусовых сигналов (Gr33a), песни (DCX-EMAP) и химических стимулов (dpr8), необходимых для полового поведения. Полученные данные свидетельствуют о том, что распространенные в популяции изменения в некодирующих последовательностях могут оказать существенное влияние на функционирование всего генома и являться дополнительным фактором геномных болезней. Литература 1. Shaw C.J., Lupski J.R. Implications of genome architecture for rearrangementbased disorders: the genomic basis of disease // Human Mol. Gen. - 2004. - V. 13. P. 57-64. 2. Медведева А.В., Молотков Д.А., Никитина Е.А., Попов А.А., Карагодин Д.А., Баричева Е.М., Савватеева-Попова Е.В. Системная регуляция генетических и цитогенетических процессов сигнальным каскадом ремоделирования актина: локус agnostic дрозофилы // Генетика. - 2008. - Т.44. № 6. - С. 669-681. 3. Савватеева-Попова Е.В., Переслени А. И., Шарагина Л. М., Медведева А. В., Корочкина С.Е., Григорьева И.В., Дюжикова Н.А., Попов А.В., Баричева Е. М., Карагодин Д., Хайзенберг М. Особенности архитектуры Х-хромосомы, экспрессии LIM - киназы 1 и рекомбинации у мутантов дрозофилы локуса agnostic: модель синдрома Уильямса человека // Генетика. - 2004. - Т.40. - № 6. - С. 749769. 4. Zhimulev I.F. Polytene chromosomes, heterochromatin, and position effect variegation // Advances in Genetics. - 1998. - V. 37. - 566 p. 5. de Wit E., Greil F., van Steensel B. Genome-wide HP1 binding in Drosophila: 979 Developmental plasticity and genomic targeting signals // Genome Res. – 2005. – V. 15. № 9. – Р. 1265-1273. 6. Chandrasekaran R., Thompson M. Polybromo-1-bromodomains bind histone H3 at specific acetyl-lysine positions // Biochem. Biophys. Res. Commun. – 2007. – V. 355. № 3. – Р. 661-666. 7. Ebert A., Schotta G., Lein S., Kubicek S., Krauss V., Jenuwein T., Reuter G. Su(var) genes regulate the balance between euchromatin and heterochromatin in Drosophila // Genes Dev. – 2004. – V. 18. № 23. – Р. 2973-2983. 8. Rath U., Ding Y., Deng H., Qi H., Bao X., Zhang W., Girton J., Johansen J., Johansen K.M. The chromodomain protein, Chromator, interacts with JIL-1 kinase and regulates the structure of Drosophila polytene chromosomes // Journal of Cell Science. – 2006. – V. 119. - Р. 2332-2341. 9. Vatolina T.Yu., Boldyreva L.V., Demakova O.V., Demakov S.A., Kokoza E.B., Semeshin V.F., Babenko V.N., Goncharov F.P., Belyaeva E.S., Zhimulev I.F. Identical Functional Organization of Nonpolytene and Polytene Chromosomes in Drosophila melanogaster // PLoS One. – 2011. – V. 6. № 10. e25960. Ключевые слова: гетерохроматин, геномные болезни, эктопическое спаривание. Key words: heterochromatin, genomic diseases, ectopic pairing. УДК 614.2 Т.А. Чернышенко, А.В. Ульянова, В.Э. Федоров ОСОБЕННОСТИ РАБОТЫ ВЕДОМСТВЕННЫХ СТАЦИОНАРОВ 1 ФГБУ «ЦКБ с поликлиникой УД президента РФ», Москва; Кафедра факультетской хирургии с онкологией Саратовский государственный медицинский университет, Саратов В настоящее время большинство лечебных учреждений подразделяется на государственные, ведомственные и частные. Деятельность государственных и частных стационаров широко освещается и обсуждается, в то время, как деятельность ведомственных учреждений здравоохранения менее известна. В данной работе решено проанализировать функционирование ведомственного стационара на примере гинекологического отделения Федерального государственного бюджетного учреждения «Центральная клиническая больница с поликлиникой Управления делами Президента Российской Федерации», которое является структурным подразделением хирургической службы. Основными задачами отделения являются: оказание высококвалифицированной стационарной помощи госпитализированным больным с использованием современных достижений медицинской науки и техники, а также использо1 T.A. Chernyshenko, A.V. Ulyanov, V.E. Fedorov Features of work of departmental hospitals. 980