2. Конденсированные пятичленные гетероциклы с одним гетероатомом 2.1. Индолы
advertisement
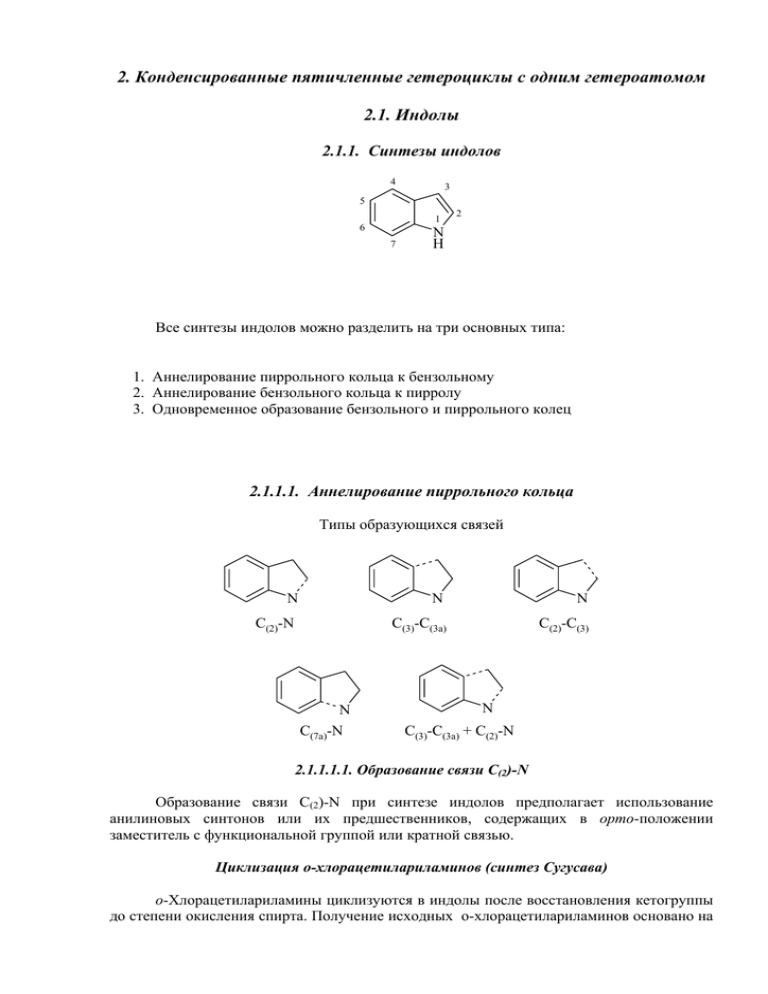
2. Конденсированные пятичленные гетероциклы с одним гетероатомом 2.1. Индолы 2.1.1. Синтезы индолов 4 3 5 1 6 7 2 N H Все синтезы индолов можно разделить на три основных типа: 1. Аннелирование пиррольного кольца к бензольному 2. Аннелирование бензольного кольца к пирролу 3. Одновременное образование бензольного и пиррольного колец 2.1.1.1. Аннелирование пиррольного кольца Типы образующихся связей N N N C(2)-N C(3)-C(3a) C(2)-C(3) N C(7a)-N N C(3)-C(3a) + C(2)-N 2.1.1.1.1. Образование связи С(2)-N Образование связи С(2)-N при синтезе индолов предполагает использование анилиновых синтонов или их предшественников, содержащих в орто-положении заместитель с функциональной группой или кратной связью. Циклизация о-хлорацетилариламинов (синтез Сугусава) о-Хлорацетилариламины циклизуются в индолы после восстановления кетогруппы до степени окисления спирта. Получение исходных о-хлорацетилариламинов основано на том, что ариламины, не имеющие защитной группы на атоме азота, селективно ацилируются в орто-положение по реакции Фриделя-Крафтса при использовании нитрилов (в нашем случае хлорацетонитрила) и трифторида бора. O ClCH2CN CH2Cl BF3, AlCl3 NH2 NH2 Cl NaBH4 диоксан, вода N H Cl Cl 63% 64% Synth. Commun., 18, 265 (1988) Синтез индолов по Рейсерту – восстановительная конденсация онитрофенилпировиноградной кислоты Исходный эфир о-нитрофенилпировиноградной кислоты получают конденсацией диэтилоксалата с активированной метильной группой о-нитротолуола. Последующий гидролиз и восстановительная циклизация приводят к замыканию пиррольного цикла и образованию соответствующего 2-карбоксииндола, термическое декарбоксилирование которого дает 2,3-незамещенный индол (Джоуль и Смит, стр. 315). CH3 NO2 (CO2Et)2 EtOK, 40oC O KOH CO2H H2O OMe NO2 OMe CO2H FeSO4 230oC O NH4OH 100oC NH2 N H OMe N H CO2H Существует более поздняя модификация метода, позволяющая сразу получать 2,3незамещенные индолы. Так, взаимодействие о-нитротолуолов с три(1пиперидино)метаном приводит к о-нитрофениленаминам, которые затем под действием TiCl3 претерпевают восстановительную циклизацию с элиминированием пиперидина [Tetrahedron Lett., 24, 4561 (1983); 25, 285 (1984)]. Me X N + NO2 CH N 3 TiCl3 X NO2 X N H N H Восстановительная конденсация 2,β-динитростиролов Модифицированная восстановительная конденсация 2,β-динитростиролов Fe/AcOH в присутствии силикагеля, по-видимому, также идет через енамины. Исходные 2,βдинитростиролы могут быть легко получены конденсацией о-нитротолуолов с нитроалканами в щелочной среде [J. Org. Chem., 48, 3347 (1983)]. R R 2 NO2 3 R R R 4 R 3 1 R NO2 R 2 R 5 4 5 1 N H R 1 2 3 4 R =H, Me; R =Me, H; R =OMe, OBz; R =H, OMe, OBz; R5=H, Me, OMe, OBz Синтез индолов по Леймгруберу-Бачо – восстановительная конденсация βдиметиламино-2-нитростиролов Этот метод синтеза очень похож на два предыдущих с той разницей, что енаминная группировка вводится с использованием диметилацеталя диметилформамида [Heterocycles, 22, 195 (1984)]. NMe2 Me Me2NCH(OMe)2 NO2 H2 NO2 Pd/C N H Циклизация о-алкиниланилинов. Другим перспективным строительным блоком для получения индолов служат анилины с о-алкинильным заместителем. Циклизацию о-алкиниланилинов можно проводить различными методами. NH N Метод катализируемых палладием сочетаний в настоящее время позволяет получать арены с алкинильным заместителем в орто-положении к атому азота из о-иод- и о-бромнитробензолов, о-иод- и о-бром-N-ацил (или N-сульфонил)ариламинов или даже сочетанием ацетиленов с самим о-йоданилином [cм., например, Tetrahedron Lett., 27, 1653 (1986), J. Org. Chem., 54, 5856 (1989), Tetrahedron Lett., 27, 6397 (1986)]. Примером использования самого о-иоданилина может служить кросс-сочетание с медной солью енина. В результате реакции образуется 2-аллилиндол [Chem. Ber., 104, 2027 (1971)]. (R1C X N C)3Al CR NaNH2 X OSiMe3 R 1 X R NH N R R 1 X=F, R=H, R1=Bu (95%); X=F, R= CH(Me)Ph, R1=H (96%) Существует также возможность нуклеофильного введения алкинильных заместителей в орто-положение бензольного кольца О-силилированных N-замещенных фенилгидроксиламинов с использованием алюминийорганических соединений [J. Am. Chem. Soc., 105, 7177 (1983)]. I + CuC CCH2CH=CH2 N H NH2 Прямая циклизация о-алкиниланилинов происходит просто при обработке фторидом тетрабутиламмония, альтернативно могут быть использованы соли палладия или меди. В катализируемых палладием циклизациях о-галогенанилинов можно использовать и дизамещенные ацетилены, при этом большая по размеру группа оказывается в положении 2 индола: Me I MeC SiMe3 Pd(OAc) (кат.), PPh NH2 Na CO , 2Bu NCl, 3 2 3 4 ДМФА, 100оС PdX SiMe3 NH2 N H PdX Me SiMe3 N H J. Org. Chem., 63, 7652 (1998) Превращения о-алкинилнитробензолов происходит под действием алкоксидов, которые присоединяются по тройной связи с образованием нитроацеталей, последующее восстановление нитрогруппы и гидролиз ацеталя приводит к цик лизации в индолы: CSiMe3 Br HC CSiMe3 F3C Pd(PPh3)2Cl2 Et3N F 3C NO2 CH(OMe)2 MeOH, KOH F 3C NO2 NO2 89% H2, Pd/C водн. HCl, EtOH F 3C N H 95% Heterocycles, 29, 1013 (1989) Циклизация о-виниланилинов, о-винилнитренов В зависимости от строения замещенных при двойной связи 2-винил-1пирролидинилбензолов их термическая перегруппировка протекает по-разному [Tetrahedron Lett., 25, 2025 (1984)]: CN CN CN R b aH N a R=OAlk b R=OAc, OTs, Cl + N R H + N YCN CN CH2R N N (CH2)4Y Наличие легко уходящей группы в β-положении винильного заместителя, а также возможность раскрытия спиранового кольца под действием нуклеофилов позволяет получить ароматическую индольную структуру (путь b). Винильный заместитель можно ввести в молекулу о-броманилинов с помощью кросс-сочетания с трибутилэтоксивинилоловом в присутствии палладиевого катализатора. Образующиеся при этом о-этоксивиниланилины циклизуются в 2,3-незамещенные индолы в присутствии п-толуолсульфокислоты [Tetrahedron, 47, 1876 (1991)]. H Br H Bu3Sn H OEt OEt PdCl2(PPh3)2 NHR 100oC, ДМФА, Et4N+Cl TsOH бензол NHR N R R=H (29%) R=Ac (70%) Вместо аминогруппы в орто-положении к винильному заместителю можно использовать нитрен [Tetrahedron Lett., 24, 5169 (1983)]. Исходным для получения овинилнитрена может служить о-бромбензилбромид. Последовательное использование реакции Виттига с ацетофеноном, а затем реактива Гриньяра с азидом натрия приводит к о-винилазиду. При его термолизе образуется 2,2-дизамещенный илид, миграция фенильной группы в котором в положение 3 приводит к ароматизации. Следует отметить, что выход 2-метил-3-фенилиндола невелик, и метод представляет скорее теоретический интерес. Me Me Me O CH2Br 1. Mg Ph Ph Ph реакция Виттига Br 2. NaN3 Br N3 Ph + N Ph ~ Ph Me Me N H Циклизация о-аллиланилинов с участием хлористого палладия о-Аллиланилины циклизуются в 2-алкилиндолы под действием стехиометрического количества хлористого палладия. Видимо процесс идет через циклопалладированный интермедиат: PdCl2(MeCN) Et3N NH2 NH2 PdCl2 NH2 H + NH2 Pd Cl Cl Et3N H - HCl - "PdH" PdCl2 ~ H+ N H + Pd(0) Me N H Tetrahedron Lett., 14, 1037 (1977); J. Am. Chem. Soc., 100, 5800 (1978); J. Am. Chem. Soc., 102, 3583 (1980); Helv. Chim. Acta, 62, 2581 (1979); J. Am. Chem. Soc., 106, 5759 (1984) Циклизация (о-аминофенил)алканолов в присутствии катализаторов платиновой группы на активированном угле Первым шагом этого процесса, по-видимому, является дегидрирование (окисление) спиртов в соответствующие кетоны, которые затем самопроизвольно циклизуются в индолы [Pat. 21508 Hung.; C. A., 97, 109833 (1982)]. R R X R 1 Pd/C R X OH NH2 1 N H X=F, Alk, NH2; R=H, Me, Et, CH2OH; R1=H, Ph Циклизация о-аминобензилкетонов. Методы получения исходных соединений о-Аминобензилкетоны спонтанно циклизуются в индолы по следующей схеме: H R H - H2O ~ H+ R O NH2 R N H N Существует множество оригинальных способов получения о-аминобензилкетонов, которые заслуживают отдельного рассмотрения. Взаимодействие о-галогенанилинов с енолятами кетонов при облучении R I R R 2 1 R 2 hν + NH2 2 O R 1 t-BuOK R O NH2 1 N H 40-100% Tetrahedron Lett., 37, 393 (1981) Доказательством тому, что реакция идет по механизму SRN1 служат следующие экспериментальные факты: • процесс не идет без облучения • процесс ингибируется кислородом • процесс региоселективен В случае реализации альтернативного дегидробензольного механизма образовывалась бы смесь региоизомеров, чего на практике не наблюдается O O NH2 NH2 Общая схема SRN1 механизма Баннета пригодна и в этом случае [J. Org. Chem., 45, 1547 1980); Tetrahedron, 37, 343 (1981)]. e. ArI IAr. . IArAr + I. Ar + -CHR2COR1 . ArCHR2COR1- + ArI . ArCHR2COR1. ArCHR2COR1 + ArI- Возможно химическое (CuI) и электрохимическое инициирование процесса [J. Chem. Soc., Chem. Commun., N 21, 950 (1979)]. Одним из таких методов служит перегруппировка типа Коупа производных Nфенилгидроксиламина. Так, взаимодействие производных фенилгидроксиламина с электронодефицитными алленами сопровождается сигматропной перегруппировкой, приводящей к получению индолов. Интермедиатами процесса служат оаминобензилкетоны [Tetrahedron Lett., 25, 1547 (1984)]. CHX R 1 + R X 1 N O CH2 NR OM M=Li, Na, K R X R 1 R O NHR X 1 N R R1 5-Me H R COMe CO2CH2Ph Выход, % 95 80 X SO2Ph SO2Ph Для получения N-незамещенных индолов используют N-фенилнитроны: CH2 R R + N CHPh O N H CHSOCCl3 SOCCl3 R=5-Me (60%), R=7-Me (50%) Для О-винилирования фенилгидроксиламинов винилкарбоксилаты в присутствии палладиевых катализаторов. можно использовать R LiPdCl4 3 + CH2 R R R 3 OH N 2 =OCOR4 R 1 N 2 R 1 ~ 80% Tetrahedron Lett., 25, 1547 (1984); Helv. Chim. Acta, 68, 1835 (1985); Helv. Chim. Acta, 67, 1647 (1984) Путь к получению 4-замещенных индолов (предшественников эргоалкалоидов) включает в себя аза-Кляйзеновскую перегруппировку мета-замещенных Nаллиланилинов с последующим озонолизом двойной связи [Tetrahedron Lett., 25, 3159 (1984)]. CN CN O3 CF3CO2H толуол, 80оС N NHR R H O CN CN CHO O N NHR R Арилирование по Мейервейну винилацетата или винилбромида солью онитрофенилдиазония приводит к эквиваленту о-нитробензилкетона, восстановление которого и внутримолекулярная циклизация дают замещенные индолы [J. Org. Chem., 48, 2066 (1983)]. R 2 2 R NH2 N2+ Cl- NaNO2 1 R NO2 R 2 R R3CH=CHR4Z HCl 1 R 3 2 R 4 R Cl Z R 1 NO2 R 2 R 3 R [H] NO2 Z=OCOMe, Br R 4 3 R R 1 O NH2 R 1 4 N H 50-90% Для получения 2-незамещенных индолов используют производные оаминофенилуксусного альдегида. Так, на основе о-нитростирола получают 3-метилиндол (скатол) с высоким выходом [J. Chem. Soc., Chem. Commun., N 3, 82 (1981)]. Me CHO CO, H NO2 [H] NO2 Me Me CHO N H 70% NH2 Приведенная схема является интересным примером применения двух различных родиевых катализаторов – гомогенного на стадии карбонилирования стирола и гетерогенного на стадии избирательного восстановления нитрогруппы. Применение гомогенного родиевого катализатора приводит к селективному получению разветвленных альдегидов. Оригинальным источником о-нитрофенилуксусного альдегида служит соль 5нитроизохинолиния, которая под действием водного раствора TiCl3 дает 4аминометилиндол через стадии восстановления нитрогруппы и гидролитического расщепления пиридиниевого ядра [Heterocycles, 14, 101 (1980)]. R + N CH2NH2 TiCl3, H2O NO2 CH2NH2 CHO NH2 N H 2.1.1.1.2. Образование связи С(3)-С(3а) Синтез Фишера – циклизация арилгидразонов под действием кислых агентов Синтез Фишера – один из самых распространенных и известных методов получения широкого круга производных индола. Этому синтезу уже более 100 лет, однако он не потерял своего препаративного значения и в наши дни. В настоящее время принят следующий механизм этой реакции: R 1 R H+ R 1 R H+ 2 R N N H 2 R N N H H H R R 2 R 1 R NH2+ N H NH 2 N NH2+ H 1 R 1 2 1 R -NH3 NH2 2 N H Катализаторами реакции Фишера служат многочисленные кислотные агенты различной природы. Так, известно применение протонных кислот (неорганических и птолуолсульфокислоты в толуоле), кислот Льюиса (ZnCl2, PCl3, ПФК), ионообменных смол Amberlist-15), спиртовых растворов HCl, SOCl2 и т.п. Известна методика, использующая взаимодействие гидрохлоридов арилгидразинов с кетонами в уксусной кислоте. В качестве карбонильной компоненты могут выступать альдегиды, кетоны, кетокислоты, кетоэфиры, дикетоны. При наличии в исходном кетоне двух метиленовых групп обычно образуется смесь изомерных индолов: R R N H R 2 1 2 R R 1 + H+ N R 1 N H N H 2 При использовании метилкетонов обычно образуются 2-метилиндолы, то есть циклизация идет по более замещенной алкильной группе. R CH2R N H N H+ Me N H Длительное время дискутировался вопрос о механизме реакции Фишера: считать ли ее сигматропным или электрофильным процессом. На этот вопрос дали ответ изящные работы И. И. Грандберга по индолизации и1,1-диарилгидразонов кетонов с заместителями различной электронной природы в фенильных ядрах. Me R D R N N R A R 2 2 2 A 1 R N D 1 R + 1 N A D 1 2 Если процесс электрофильный, то преимущественно должен образовываться индол 2. Поскольку экспериментально этого не наблюдается – образуется смесь индолов 1 и 2, то общепринятым сейчас считается [3,3]-сигматропный механизм. Ключевой стадией является разрыв связи N-N и образование прочной связи С-С. Оригинальное развитие получил синтез Фишера в нашей лаборатории (Г. А. Голубева, Л. А. Свиридова) – использование циклических аналогов фенилгидразина – 1фенилпиразолидинов [ХГС, № 3, 371 (1970)]: O N H N H+ + N N N (CH2)3NH2 Во-первых, циклическое строение гидразина предполагает при взаимодействии с кетонами образование енгидразина, который постулируется в качестве первого интермедиата в синтезе Фишера (важно подчеркнуть, что использование кислотных катализаторов в этой реакции диктуется необходимостью кислотно-катализируемой изомеризации гидразонов в енгидразины). Во-вторых, если в случае ациклических фенилгидразонов на последней стадии выделяется аммиак, то циклическое строение гидразина предполагает сохранение аминогруппы в молекуле образующегося индола (аминоалкильный заместитель при атоме азота). Другая модификация синтеза Фишера (И. И. Грандберг) относится к карбонильной компоненте процесса и сразу позволяет получать триптамины (биогенные амины, ответственные, в частности, за психическое здоровье человека). В данном случае в реакции используют γ-галоген- или γ-аминопропилкетоны. Эта реакция называется реакцией Грндберга. NH2 + RC (CH2)3X NHNH2 R O N H X=Hal, NH2 Использование вместо гидразонов кетонов гидразидов кислот привело к открытию нового метода синтеза 2-аминоиндолов – реакция Коста [А. Н. Кост, Ю. Н. Портнов, Г. А. Голубева, см. обзор ХГС, №9, 1153 (1985)]. R R 2 O POX3 NHR N N R R 2 1 N 1 R Процесс может быть представлен следующей схемой: R 2 R [3,3] OPOCl2 1 R R R 2 1 H H OPOCl2 +NHR R 1 NR R OPOCl2 + N NH N N + R R 2 a - HOPOCl2 2 NHR 2 OPOCl2 N NH R1 + 2 R 3 1 - R NH2 b R R 2 2 O 1 OPOCl2 N N N R R R Как и в синтезе индолов по Фишеру первоначальным актом является таутомерное превращение гидразидной формы в енгидразинную с последующей сигматропной перегруппировкой, приводящей к образованию связи С(3)-С(3а) (интермедиат 3). Ароматизация интермедиата 3 может происходить двумя путями: (а) элиминирование группы HOPOCl2 приводит к 2-аминоиндолам, тогда как путь (b) (элиминирование молекулы алкиламина) после гидролиза приводит к оксиндолам. Доказательством существования интермедиата 3 является образование дисульфидов, наряду с аминоиндолами, при использовании тиогидразидов кислот (в качестве катализаторов используют галогениды фосфора, фосген и т.п.): R S N Me R R NH POCl3 NH2 N Me + R S N Me S N Me Если в качестве циклизующего агента использовать реактив Вильсмайра-Хаака, то можно сразу получать 3-ацил-2-аминоиндолы. O R COMe N RCH=N N +Me 2 Cl- H N N Синтез индолов из анилинов и кетосульфидов Аналогичная фишеровской [3,3]-сигматропная перегруппировка с разрывом связи С-S и образованием связи С-С происходит под действием триэтиламина в сульфониевых солях, получаемых из N-хлоранилинов и β-кетосульфидов [J. Am. Chem. Soc., 96, 5495 (1974)]. COR X X + MeSCH2COR NHCl N H - X N H H COR S + Et3N + S Me SMe SMe O X R R Me N H NH Этот пример демонстрирует возможность индолизации не только в кислой, но и в основной среде. Синтез оксиндолов по Бруннеру Другим примером образования производных индола в щелочных средах служит синтез оксиндолов из гидразидов кислот под действием оксида кальция при высоких температурах: R H O N H NH R CaO 200oC O N H Синтез индолов по Неницеску – конденсация п-бензохинонов с βаминокротонатами Синтез Неницеску используют для получения 5-гидроксииндолов, некоторые из которых проявляют биологическую активность (например, биогенный амин серотонин – 5-гидрокситриптамин). Процесс включает сопряженное присоединение винилогов первичных или вторичных аминов к п-бензохинону с последующей циклизацией (Пакет, стр. 145). CO2Et EtO2C O + MeO H O Et O Et NHMe ацетон MeO NMe O CO2Et HO Et N MeO Me Синтез индолов по Бишлеру – кислотно-катализируемая циклизация α-(ариламино)кетонов Алкилирование анилинов α-галогенкетонами приводит к α-(ариламино)кетонам, кислотно-катализируемая циклизация которых осложняется тем, что в присутствии кислотных катализаторов ариламинокетоны могут изомеризоваться перед циклизацией. Это приводит к смеси изомерных индолов, если радикалы R1 и R2 различны. Механизм изомеризации приведен на схеме. 2 R1 Hal O R O N H NH2 R R 1 R PhNH2 2 - PhNH2 R N H PhNH2 2 - PhNH2 1 R R N H OH N H H+ R 1 2 O R N H R 2 H+ 2 R N H 1 1 Указанное равновесие (в зависимости от строения кетона) может быть сдвинуто в одну сторону, что обеспечивает региоселективность индольного синтеза. Примером этому может служить образование только 2-фенилиндола при нагревании (фениламино)ацетофенона в присутствии HBr: O Ph Ph OH N H H N H N H H H O N H Ph Ph N H Для того, чтобы сделать процесс региоселективным разработана модификация реакции Бишлера. Вместо фенацилбромидов, необходимых для получения (фениламино)ацетофенонов, в реакцию с анилином вводят бромиды (2-R-βоксоэтил)триметиламмония [Изв. АН СССР, Сер. Химия, №2, 509 (1991)]. + NMe3 NH2 Me3N+CH2COR Br- R N N H 60-90% R Вместо бромзамещенных кетонов в реакции с анилином можно использовать диазокетоны [J. Org. Chem., 21, 1013 (1956)]. CH Ph H+ + N N Ph O CH2 + N N - N2 O H2NPh Ph + NH2Ph CH2 + NH2Ph PhNH2 O N H Ph H H + - H+ Ph N Ph N H Циклизация α-(анилино)карбонильных соединений или их скрытых форм N-(Трифторацетил)-2-анилиноэтилацетали образуют с высокими выходами соответствующие N-(трифторацетил)индолы в трифторуксусной кислоте с избытком трифторуксусного ангидрида: EtO OEt (CF3CO)2O X Et3N N H EtO CF3CO2H X (CF3CO)2O N O KOH, MeOH X N O OEt CF3 X 25oC N H CF3 Этим способом можно получать 3-замещенные индолы, используя скрытую форму карбонильного соединения – 2,4-дихлорбут-1-ен – и катализ ПФК. Cl Cl Cl NH2 N H Cl (CF3CO)2O Et3N N O O H2SO4 Me N O CF3 1. ПФК 2. КОН, МеОН CF3 Me N H 64% J. Org. Chem., 46, 778 (1971) Циклизация о-галоген-N-аллиланилинов с использованием металлокомплексного катализа Циклизация о-галоген-N-аллиланилинов с использованием катализаторов Pd(0) или Ni(0) идет за счет внутримолекулярного арилирования двойной связи [Tetrahedron Lett., 21, 1803 (1976); J. Org. Chem., 45, 2709 (1980); Tetrahedron, 46, 1385 (1990)]. X R PdX 1 Pd(0) N 1 R N R R R 1 PdX R 1 - Pd(0) N N R R 70-97% Интересным вариантом использования о-галоген-N-аллиланилинов в синтезе индолов является путь, ключевой стадией которого служит использование цирконоценстабилизированных комплексов дегидробензола [J. Am. Chem. Soc., 116, 11797 (1994)]. ZrCp2 Br Cp2Zr CpZr(Me)Cl 2 t-BuLi, ТГФ 20oC - 78oC N N N R R I R I I I Nu Nu + 0oC N N N 65-70% R R R R=Bz, allyl Образующийся 3-метилениндол в реакциях с различными енофилами может вступать в еновую реакцию Альдера, образуя производные индолов: I B I B H A H N R A 85oC N R Например, I I + H N CO2Et N CO2Et H N CO Et 2 N N CO2Et N Bz Bz Для синтеза индолов можно использовать и о-галоген-N-виниланилины применением металлокомплексного катализа [Bull. Chem. Soc. Japan, 59, 927 (1986)]. O Br с O Pd(OAc)2/PTol3 R Et3N/MeCN R N H N H Окислительная каталитическая циклизация оснований Шиффа Циклизация оснований Шиффа идет в достаточно жестких условиях с использованием алюмосиликатных катализаторов [Пат. 211338, Франция; РЖХим, 14Н, 242 (1973)]. Al2O3, SiO2 300-800oC N N H Использование катализатора Кирби – ортофосфата алюминия – позволяет получать 3замещенные индолы конденсацией анилинов с низшими альдегидами (Bull. Soc. Chem. Belg., 92, 715 (1983)). R R + RCH2CHO NH2 AlPO4 N H N По многочисленным патентным данным аналогично идет каталитическая конденсация с вицинальными диолами. По-видимому, термическая дегидратация диолов приводит сначала к карбонильным соединениям. R соли Cu, Cd, Mg + NH2 HO OH 200-500oC R N H 80-90% Циклизация аринов Индолы можно синтезировать путем внутримолекулярного присоединения иминоатов [Tetrahedron, 50, 11903 (1994)] или виниллития [Tetrahedron Lett., 40, 1049 (1999)] к аринам. В последнем случае взаимодействие ариллитиевого интермедиата с электрофилами приводит к получению 4-замещенных индолов. Cl MeO NaNH2, t-BuONa ТГФ, N 0o C MeO - 20oC N MeO 75% N H Li F Br F Li Li 3.3 моль t-BuLi N ТГФ - 78oC 20oC Me N N Me Me Me Li N Me OH Me Me Me2CO N 71% Me 2.1.1.1.3. Образование связи С(2)-С(3) Синтез Маделунга – внутримолекулярная циклизация о-алкиланилидов Внутримолекулярная циклизация о-алкиланилидов идет в жестких условиях – в присутствии сильных оснований при высоких температурах [Gazz. chim. Ital., 93, 1392 (1963)]. R 1 R 2 NHCOR 3 R B200-400oC R 1 2 R 3 N H R2, R3 H, Alk, Ar Модификации синтеза Маделунга направлены на возможность проведения реакции в более мягких условиях. Одной из таких модификаций является литиирование оалкиланилидов. Предполагают, что ключевым в этом процессе является биметаллический интермедиат [J. Org. Chem., 46, 4511 (1981); J. Org. Chem., 38, 1668 (1973)]: Me CH2Li BuLi или (i-Pr)2NLi R N NHCOR Li O - H H H H R N OLi R N ~ H+ R N H Li R = t-Bu (87%), адамантил (59%) Особо следует обратить внимание на возможность получения индолов с объемными заместителями в положении 2 с хорошими выходами. Другая модификация реакции Маделунга заключается в использовании оациламинобензилфосфониевых солей. Активация о-алкильного заместителя осуществляется в этом случае за счет увеличения СН-кислотности и создания хорошей уходящей группы. Фактически процесс представляет собой внутримолекулярную реакцию Виттига [Synthesis, N 5, 364 (1989)]. + CH2PPh3 X- 1. Zn/HBr 2. RCOCl NO2 + CH2PPh3 XR CH2OH NH2 NHCOR 1. PPh3 HBr 2. RCOCl N H ~ 90% R=Me, CH=CHCH3 Для получения удобных субстратов для реакции Маделунга можно использовать викариозное нуклеофильное замещение (ВНЗ). Концепция ВНЗ заключается в том, что многие карбанионы, имеющие уходящие группы Х, такие как Сl-, Br-, PhO-, PhS-, при карбанионном центре, реагируют с нитроаренами, замещая водород в орто- и параположениях к нитрогруппе карбанионным остатком, но, в отличие от обычного нуклеофильного ароматического замещения, из промежуточного анионного σН-комплекса уходит не водород кольца, неспособный к элиминированию в виде аниона, а группа Х. [Acc. Chem. Res., 20, 282 (1987)]. То есть реакция проходит как инициируемое основанием β-элиминирование. Y H R z + - Y B- z X z - HX Y NO2 R X R NO2 - NO2 - CHRY H+ z NO2 Аналогичная схема реализуется и для орто-замещения по отношению к нитрогруппе с образованием очень удобного синтона для дальнейшей циклизации в индоы: z CHRY NO2 о-Алкильный заместитель в этом соединении обладает столь необходимой для синтеза Маделунга высокой СН-кислотностью за счет активации электроноакцепторным заместителем Y. Можно привести несколько примеров синтезов индолов с использованием на первой стадии процесса ВНЗ в нитроароматических субстратах [Tetrahedron, 42, 5053 (1986)]: R z R2O NO2 R1CHCN Cl ВНЗ 1 CN z NO2 R2O H2 z Pd/C R R2O N H 39-91% MeO MeO + ClCH2Tos CH2Tos t-BuOK NO2 NO2 MeO CH2Tos NH2 60% MeO RCOCl R N H Fe EtOH 1 Синтезы с использованием о-алкилфенилизонитрилов Вместо о-алкиланилидов в модифицированном синтезе Маделунга использовать о-алкилфенилизонитрилы [Bull. Soc. Chem. Japan, 57, 73 (1984)]. Li R R R H R 1 R 1 1 R Li NC можно N Li+ N A H R2 X R R1=H 2 R 1. MgX 2. R2X 1 R R N N H R 2 Попытки фиксации интермедиата А оказались безуспешными, т.к. при действии галоидных алкилов идет не 2-, а N-алкилирование. Для синтеза о-замещенных фенилизонирилов также можно использовать ВНЗ [Tetrahedron Lett., 25, 4743 (1984)]. NO2 X Cl + NC SO2Ph 1. NaOH/ДМСО или Na в жидк. NH3 2. H+ NO2 X O2N SO2Ph X NC NC NO2 SO2Ph X O2N SO2Ph + SO2Ph X N H N H Циклизация о-изоцианостиролов (синтез Фукуяма) о-Изоцианостиролы, легко получаемые дегидратацией соответствующих формамидов, в присутствии оловоорганических соединений подвергаются радикальной циклизации с образованием нестабильных 2-станнилиндолов, которые можно гидролизовать до соответствующих 2-незамещенных индолов, либо использовать без выделения для сочетания с арилгалогенидами, катализируемого нульвалентным палладием [J. Heterocycl. Chem., 35, 1043 (1998)]. CO2Me + N C CO2Me N . Bu3SnH AIBN, MeCN 100oC CO2Me CO2Me SnBu3 SnBu3 N H N SnBu3 PhBr, Pd(PPh3)4 Et3N, 100oC H+ H2O CO2Me CO2Me Ph N H 91% N H Электроциклическая циклизация азометинов с СН-кислотной группировкой в орто-положении [1,5]-Электроциклическое замыкание связи С(2)-С(3) происходит под действием оснований в азометинах, имеющих в орто-положении СН-кислотные группировки: CO2Et CO2Et CO2Et t-BuOK t-BuOH N Me CO2Et CO2Et H N Me H CO2Et + N H Me CO2Et Me N H Синтез индолов из о-ациланилидов (Синтез Фюрштера) Этот метод основан на восстановительной циклизации о-ациланилидов в присутствии низковалентного титана [Angew. Chem., Int. Ed. Eng., 35, 2443 (1996)] – в условиях, используемых для реакции МакМюррея сочетания кетонов. N COCl N O + NO2 S Bu3Sn N S CH2Cl2 20oC NO2 N S TiCl3, Zn N H 2. HCO2H, Ac2O N S O 1. H2, Pd O[Ti] O диметоксиэтан N H H В приведенном примере триметилстаннилтиазола. O[Ti] исходное соединение получают N H ацилированием S


