ДНК-диагностика
advertisement

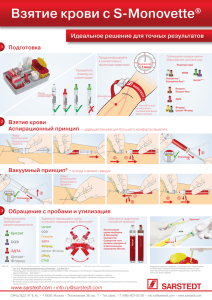
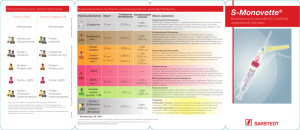
Основные требования к пробам, поступающим на ПЦР-исследование в Лабораторию ДНК-Диагностики 1. Для клинического материала Лаборатория предоставляет микропробирки объемом 1,5 мл со 100 мкл консервирующего Транспортного Буфера синего цвета. После забора материала пробирки хранят в морозильной камере. На холоду (лед, холодильник) можно хранить лишь несколько часов. 2. Нельзя присылать материал без Транспортного Буфера. 3. Нельзя использовать пробирки из других источников (лабораторий). 4. Нельзя оставлять в пробирке зонды, тампоны, шпатели. 5. Крышки пробирок закрывать плотно, двумя руками. 6. Недопустимо загрязнение клиническим материалом наружной поверхности пробирки. Пробирку можно обмыть дезсредством, этикетка не пострадает. 7. Нельзя заворачивать пробирки для диагностики в бланки направлений. Пробирку помещают в отдельный пакет, приколотый к направлению. 8. В бланк направления обязательно вписать номер (код) пробы, дату забора, материал, ФИО, пол, возраст пациента. Желательно указать диагноз. Рекомендации по взятию материала Общий объем материала – не более рисового зерна, в нем должно быть – как можно больше эпителиальных клеток; – как можно меньше крови и слизи, которые следует предварительно удалить ватным тампоном; – полностью отсутствовать посторонние химикаты – лекарственные и дезинфицирующие. Женщины не должны проводить спринцевания, врач не должен обрабатывать зеркало антисептиками. Инструментом для взятия соскобов и мазков для ПЦР-анализа является специальный зонд урогенитальный тип А универсальный из пластика с вискозным/целлюлозным ворсом. Использование щеток (зонд тип Д) нежелательно. Забирают материал вращательным движением, зонд переносят в пробирку с Транспортным Буфером, тщательно промывают, вращая в Буфере, и удаляют, отжав о внутреннюю стенку пробирки. Пробирку закрывают (как и открывают) двумя руками, плотно (до щелчка) и не повредив внутреннего ободка крышки. Полимеразная цепная реакция (ПЦР) требует высокой квалификации на всех этапах, включая забор проб. В Лаборатории ДНК-Диагностики все пробы проверяются на наличие ингибиторов и большинство на содержание общей ДНК, но исправить негодный материал нельзя. Пожалуйста, будьте внимательны! Правила взятия материала для ПЦР-исследований Минимум два дня до взятия материала нельзя проводить любые местные обработки (спринцевания, свечи, присыпки). Из влагалища: материал должен быть взят до проведения мануального исследования. Зеркало можно смочить горячей водой, применение антисептиков противопоказано. Избыток слизи или выделений удалить ватным тампоном. Соскоб берут с верхних бокового или заднего свода влагалища, у девочек – со слизистой оболочки преддверия влагалища. Из уретры: перед взятием биоматериала пациенту рекомендуется воздержаться от мочеиспускания в течение 1,5-2 часов. Наружное отверстие уретры обработать тампоном. Провести массаж уретры с помощью зонда для взятия биоматериала. В уретру у женщин зонд вводится на глубину 1-1,5 см, у детей материал для исследования берут только с наружного отверстия уретры. При наличии гнойных выделений соскоб рекомендуется брать через 15-20 минут после мочеиспускания. Из цервикального канала: перед взятием материала удалить ватным тампоном слизь и обработать шейку матки стерильным физиологическим раствором; зонд вводить в цервикальный канал на глубину 0,5-1,5 см; при извлечении зонда не касаться стенок влагалища. Секрет предстательной железы, сперма собирается в одноразовую посуду объемом 50—100 мл. В пробирку с синим Транспортным Буфером для ПЦР-диагностики необходимо перенести всего 20—50 мкл (каплю) материала. Достаточно количества, которое впитает урогенитальный зонд типа А. Можно использовать одноразовую пастеровскую пипетку. Конъюнктива, нос, зев: предварительно удалить гнойные выделения и слизь, затем собрать материал одноразовым (можно урогенитальным) зондом. В Лаборатории ДНК-Диагностики ПЦР-методом определяются хламидии, микоплазмы; ряд бактерий, колонизирующих поверхность эпителия; дрожжи; простейшие; герпес-, адено-, папиллома- вирусы. Репрезентативным материалом для этих исследования являются соскобы и мазки. (Исключение составляет только токсоплазма, которая не встречается в эпителии. В диагностике токсоплазмоза ПЦР и другие прямые методы редко дают положительные результаты даже при правильном выборе материала (спинномозговая жидкость, пунктат лимфоузлов, кусочки органов трупа, плацента и околоплодная жидкость). Рекомендуется серологическое исследование.) Пробу перенести в пробирку с Транспортным Буфером, инструмент тщательно прополоскать в Буфере и выбросить. Оставлять инструмент в пробирке нельзя. Материал из разных мест можно (и рекомендуется) комбинировать. После Транспортного Буфера нельзя повторно касаться зондом слизистой пациента. Обязательно вписать материал в бланк направления. Биоптаты, аспираты из полости матки, кровь и ее компоненты должны исследоваться лишь в редких клинических случаях и требуют особой обработки и других сред для хранения и транспортировки.