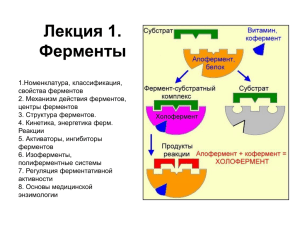
1. Биологическая роль белков и пептидов. Глутатион, строение и роль в организме. Синтезируется из З аминокислот без участия рибосомы (ферментативный синтез) В образовании пептидной связи участвует гаммакарбоксильная группа гаммаглутаминовой кислоты - принимает участие в окислительно-восстановительных реакциях - антиоксидант - тиоловый протектор 2. Первичная структура белка, ее определение, связи, ее образующие. Характеристика пептидной связи. Биологическая роль первичной структуры. Написать пример пептида (задает преподаватель, дать его характеристику) 3. Вторичная структура белка (Модель Поллинга-Кори). Виды вторичной структуры: альфа-спираль и складчатый слой, причины возникновения неупорядоченных участков. Роль неупорядоченных участков вторичной структуры. 4. Третичная структура белков, определение понятия, виды, связи, ее стабилизирующие третичную структуру. Биологическая роль третичной структуры. 5. Четвертичная структура белков, определение понятия, связи, ее стабилизирующие. Биологическая роль четвертичной структуры. 6. Характеристика растворов белков, условия, способствующие растворению белковых частиц. Белковые растворы проявляют свойства как истинных так и коллоидных растворов. Общие свойства истинных растворов: 1. Хорошо растворяются в воде без нагревания и внесения стабилизатора 2. Белковый раствор устойчивый, в осадок не выпадает Общие свойства коллоидных растворов: (Так как белки обладают большой молекулярной массой) 1. Белковые растворы вязкие 2. Как большие частицы обладают светорассеивающими и преломляющими свойствами (эффект Тиндаля) определение белка в приборах нефелометра 3. Белки не способны проходить через полупроницаемую мембрану (принцип диализа) Растворению белков способствует: 1. Наличие и количество полярных групп на поверхности белка 2. Оптимальная температура 36-37°С 3. Изменение рН среды (по соотношению основных и кислотных групп – кислые, основные, нейтральные) Общепринятой оптимальной рН для белков считается слабощелочная среда, но есть исключения (9% NaCl – обеспечивает хорошую растворимость в плазме крови) В сильнокислой и сильнощелочной средах белки также имеют заряд, но растворимость отсутствует, так как они денатурируют. 7. Механизм обратимого осаждения белков (высаливания), прирмеры высаливающих агентов. Практическое использование метода высаливания в медицине. Для обратимого высаливания белков используют соли щелочных металлов (KCl, NaCl), (NH4)SO4; этиловый спирт 70%, ацетон… Механизм обратимого осаждения: водоотнимающие агенты разрушают гидратную оболочку белка, когда агенты оттянут на себя воду, то оставшиеся на поверхности белка заряженные радикалы начинают взаимодействовать друг с другом, образуя конгломераты, выпадают в осадок. Затем осадок высушивают при помощи лиофильной сушки и получают лиофилизат. При этом белок остается функционально активным, так как его структурные уровни не разрушены. В практическом применении этот метод используют для разделения белков с различной гидратной оболочкой, например, глобулины имеют большой размер молекулы и тонкую гидратную оболочку, альбумины, наоборот, имеют меньший размер молекулы и больший слой гидратной оболочки. А также этот метод используют для создания лекарств – ферментов. 8. Денатурация белков. Определение понятия. Факторы, вызывающие денатурацию, механизмы их действия. Практическое использование феномена денатурации в гигиене и медицине. Денатурация белков – это разрушение 2, 4, 3 структур белка, имеющих слабые внутримолекулярные взаимодействия. 1ая структура белка разрушается только посредством гидролиза. Действие денатурирующих факторов зависит только от их концентрации и времени воздействия. 1. Физические факторы: температура более 50°С, вибрация, ультразвук, рентгеновское излучение, радиационное излучение… Механизм действия: внесение дополнительной энергии, которая увеличивает амплитуду колебаний атомов - группы атомов - фрагмента полипептидной цепи – ведет к разрыву слабых водородных связей и гидрофобных взаимодействий. Применение: асептика, кварцевание, антисептика, обработка инструментов и перевязочного материала, пастеризация, лазеры – удаление новообразований, УФ-физиотерапия. 2. Химические: концентрированные кислоты и щелочи, хлорамин… Механизм: изменяют ионизацию амино- и карбоксильной групп – разрушение ионных связей Сульфосалициловая – применяется в косметологии, бактерицидное действие, отшелушевание эпидермиса (против морщин и прыщей) Окислители H2O2, KMnO4 – окисляют ОН- и -SH-группы до образования дисульфидных групп. Соли тяжелых металлов (Hg, Pb, Ag -связывание SH- групп белков, с образованием меркаптидов) Соли Ag обладают бактерицидными свойствами 9. Электрофоретическое разделение белков, принцип метода. Понятие «нейтральные, кислые и основные белки». Схемы ионизации белков крови при различных рН среды. Что такое изоэлектическое состояние белков и изоэлектрическая точка. Электрофорез – разделение белков при движении в электрическом поле за счет разности их заряда. Основные белки сыворотки крови делятся на несколько фракций. Быстрее всех движутся к аноду альбумины – это гомогенная фракция. Глобулины делятся на 4 фракции: 1, 2, , [рис. альбуминов и 4-х глобулинов и как они движутся к аноду]. В крови определяется общий белок. Нормальное общее содержание белка, но изменено соотношение его фракций – диспротенемия. При инфекционных заболеваниях увеличивается содержание глобулиновой фракции. При заболеваниях почек снижается содержание альбуминовой фракции, но увеличивается содержание 2 и глобулинов. Также наблюдается парапротеинемия – появление патологических белков, например при некоторых онкологических заболеваниях. 10. Методы разделения смесей белков (ультрацентрифугирование, изоэлектрофокусирование, гельфидьтрация, хроматография). Принципы, лежащие в основе методов разделения белков. Каким образом можно разделить смесь альбуминов и глобулинов. Методы разделения фракций белков плазмы крови и их практическое значение в медицине. Изоэлектрофокусирование – движение белков до значения своей изоэлектрической точки, которые после ее достижения выпадают в осадок. Для этого создают рН градиент от 2 до 11 при помощи растворов амфолитов, а также подключают по обе стороны катод и анод, которые приводят в движение молекулы белка до достижения ИЭТ. Ультрацентрифугирование - 1. Дифференциальное – используют угловые роторы, разделение происходит при разной скорости вращения ротора – при меньшей скорости осаждаются белки с высокой молекулярной массой (послойное осаждение); 2. Зональноскоростное – проводится в (горизонтальных) бакет -роторах – скорость не изменяется- частицы распределяются по плотности, то есть частицы распределяются послойно в завимости от их размеров. Хроматография - для выделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гельфильтрации, ионного обмена, адсорбции, биологического сродства 1. Абсорбционная – разделение белков основано на разной степени сорбции. Колонка заполняется гидроксокатионом или активированным углем. Наливаем раствор белков. Белки, которые плохо адсорбируются – оседают внизу, средние – в середину, те, которые легче и быстрее всего адсорбируются – наверху, затем наливаем элюент, который вымывает белки начиная с низкой степени сорбции. 2. Афинная – разделение белков основано на специальном взаимодействии белков и лиганда. Сначала наливаем антиген, белок начнет присоединяться. Метод основан на избирательности белков к тому или иному лиганду. Это наиболее специфичный метод выделения индивидуальных белков. 3. Ионообменная – разделение белков основано на разном заряде. В колонке носитель, который обладает зарядом (анионно-обменная смола) и раствор белков. В итоге отрицательно заряженные белки в колонке остаются, белки нейтральные (Z0) и основные (Z+) выходят из колонки. Кислые белки вымываются элюентом из колонки. 4. Гельфильтрация - сефадельс-гель обладает определенным размером пор. Разделение белков основано на разной массе и размере белков. В первую очередь элюент вымывает из колонки белки с большей молекулярной массой и размером, затем на уменьшение. 11. Общая характеристика ферментов, их химическая природа, биологическая роль. Строение простых и сложных ферментов. Физический смысл и биологическое значение понятий эффективность, специфичность и регулируемость ферментативного катализа. Ферменты – это биологические катализаторы белковой природы. Старое название ферментов – энзимы, а наука, их изучающая – энзимология. По своей химической природе ферменты – это белки, они имеют несколько уровней структурной организации и обладают всеми другими свойствами белков. Очень большое количество ферментов не имеют 4-ую структуру, т.е. являются олигомерами. Ферменты могут быть простыми и сложными. Простые состоят только из полипептидной цепи, а сложные имеют пептидную (апофермент) и небелковую части (кофермент). Далее идёт рис. [апофермент+кофермент=холофермент – обладает полноценной функциональной активностью]. По отдельности ни апофермент, ни кофермент, не выполняют функции так, как холофермент. Строение ферментов. В пространственной структуре фермента условно выделяют ряд участков, которые выполняют соответствующие им функции. Активный центр (АЦ) – участок в молекуле фермента, где происходит связывание и химическое превращение субстрата (S). Субстрат – вещество, подвергающееся химическому превращению (например, для фермента лактатдегидрогеназы (ЛДГ) субстратом будет молочная кислота). В активном центре выделяется контактный участок и каталитический участок. Контактный участок – это место активного центра, в котором происходит связывание фермента с субстратом по принципу комплиментарности, т.е. именно контактный участок обеспечивает специфическое сродство субстрата ферменту. Образовавшийся комплекс носит название ферментсубстратный комплекс. Каталитический участок (центр) – это место в активном центре фермента, где происходит химическое превращение субстрата [рис. изображён фермент-субстратный комплекс, а именно контактный участок, каталитический участок, активный центр и субстрат]. Если фермент – сложный белок, то обычно простетическая часть находится тоже в активном центре и участвует в формировании активного центра. Активный центр занимает небольшую часть молекулы фермента, обычно располагается в углублении, и в его образовании участвует небольшое число аминокислотных остатков (до 20). Аминокислотные остатки могут быть удалены друг от друга, но при формировании пространственной структуры фермента они располагаются в области активного центра. В формировании активного центра могут участвовать остатки, несущие следующие функциональные группы: NH2 (ЛИЗ, АРГ), COOH (ГЛУ, АСП), OH (СЕР, ТРЕ), SH (ЦИС), имидазольное кольцо (ГИС). В качестве единиц, участвующих в формировании активного центра, могут выступать кофакторы ионы металлов (Cu2+, Fe2+ и т.д.), а также коферменты. В сложном ферменте АК-остатки активного центра создают условия для правильной его конформации и помогают кофакторам в связывании, ориентации, а, следовательно, и в превращении субстрата. Боковые группы остальных аминокислот не участвуют в образовании активного центра, но обеспечивают правильную пространственную конформацию активного центра и влияют на его реакционную способность. Ряд ферментов могут содержать аллостерический центр. [рис. фермента с аллостерическим и активным центрами] Эти ферменты относят к аллостерическим ферментам. К аллостерическому центру присоединяются различные вещества, отличные по строению от субстрата. Эти вещества могут изменять конформацию активного центра, т.е. влиять на связывание и превращение субстрата, они называются аллостерическими эффекторами. Все аллостерические эффекторы делятся на положительные – активаторы, и отрицательные – ингибиторы. Общие черты ферментов и небиологических катализаторов: 1) и те, и другие катализируют только энергетически возможные реакции; 2) увеличивают скорость реакции; 3) не меняют направления реакции; 4) в ходе реакции не расходуются; 5) для обратимых процессов катализируют как прямую, так и обратную реакции, не смещая равновесия, а лишь ускоряя время его наступления. Особые свойства ферментов: 1) высокая каталитическая активность. Металлы увеличивают скорость реакции в тысячи раз, а ферменты в миллионы раз. Например, уреаза ускоряет скорость реакции в 1014 раз. Каталаза ускоряет распад H2O2 в 1 млдр. раз! 2H2O2 2H2O +O2. Без катализатора выделения кислорода не видно. Металлический катализатор увеличивает скорость реакции в 1000 раз, а при добавлении каталазы – бурное вспенивание. 2) специфичность действия – наиболее характерная черта. Строение активного центра фермента, катализирующего реакции, различна. Структура активного центра фермента комплементарна структуре его субстрата, поэтому фермент из множества веществ присоединяет только свой субстрат – субстратная специфичность фермента. Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения. Например, на АК ГИС действуют 2 фермента: гистидаза (отщепляет NH3) и гистидиндекарбоксилаза (отщепляет CO2). Выделяют несколько видов специфичности: а) абсолютная специфичность. Фермент действует только на один единственный субстрат. Пр.: уреаза разрушает мочевину: NH2-CO-NH2 (над стрелкой уреаза, под – вода) 2NH3+ CO2. Аргиназа катализирует распад аргинина. б) групповая специфичность. Фермент действует на определённую связь в разных субстратах. Пр.: пептидазы разрывают пептидные связи [-NH-CH(R)-CO-NH-CH(R)-CO-]. Пепсин действует только на связи, образованные карбоксильной группой ароматических АК (ФЕН, ТИР, ТРИ). Эстеразы разрывают сложно-эфирную связь [-CO-NH-] в различных липидах. Гликозидазы действуют на гликозидную связь. Действие ферментов, обладающих групповой специфичностью, позволяет организму содержать небольшое количество ферментов. в) стереоспецифичность. Фермент действует на определённый стереоизомер (D- и L-, цис- и транс-). Пр.: бутен-2-диовая кислота имеет 2 стереоизомера: транс-изомер или фумаровая к-та, и цис-изомер или малеиновая кислота. COOH H H COOH Малеиновая к-та H COOH HOOC H Ф у м а р о в а я к -т а Фумараза действует на фумаровую к-ту с превращением последней в яблочную. В стереоспецифичности выделяют оптическую специфичность – избирательное действие ферментов на оптические изомеры. Например, под действием ЛДГ разрушается только L-форма молочной к-ты . 3) Влияние температуры (правило Вант-Гоффа). При увеличении температуры на 10 градусов скорость реакции увеличивается в 1,5-2 раза. Но для фермента это правило действует только до 40 градусов, т.к. дальше наступает тепловая денатурация фермента. Большинство ферментов в организме человека имеет оптимальную температуру 2540 градусов [рис. графика: по оси х – температура, по у – процент активности. Рисуем горочку, оптимум – на 37-40°С]. Повышение активности фермента при увеличении температуры объясняется увеличением кинетической энергии реагирующих молекул, что приводит к увеличению числа столкновений между молекулами. При дальнейшем повышении температуры энергия становится чрезмерной, и внутри молекулы разрываются слабые связи – водородные, гидрофильные взаимодействия; происходит нарушение вторичной, третичной, четвертичной структуры фермента. Ряд ферментов термостабильны, например, гликопротеины. 4) Влияние рН. Для поддержания третичной или четвертичной структуры фермента часто может быть необходимо наличие заряда на группе, удаленной от области связывания субстрата. Если же заряд этой группы меняется, то может происходить частичное развертывание белковой цепи, или компактизация, или диссоциация (олигомерные белки). Поэтому при отклонении рН от оптимального значения, фермент может потерять свою нативную структуру, в результате чего не происходит полноценного связывания активного центра с субстратом. Также при изменении рН может происходить изменение заряда на субстрате. [рис. график. По х – рН, по у – процент активности. Рисуем горочку.] Пепсин – 1.5-2, амилаза слюны - 6.8-7.2, трипсин - 7.5-8.6. Для большинства ферментов оптимум рН лежит в среде, близкой к нейтральной. 5) Скорость ферментативной реакции прямо пропорциональна кол-ву фермента (для небиологических катализаторов такой зависимости нет). Недостаток фермента в живом организме, например при неполноценном питании, генетических нарушениях, приводит к уменьшению скорости превращения веществ и наоборот. 6) Ферменты являются регулируемыми катализаторами. Так под действием различных веществ (активаторов и ингибиторов) меняется скорость ферментативной реакции. 12. Сходство и отличие ферментов от химических катализаторов. Свойства ферментов Общие черты ферментов и небиологических катализаторов: 1) и те, и другие катализируют только энергетически возможные реакции; 2) увеличивают скорость реакции; 3) не меняют направления реакции; 4) в ходе реакции не расходуются; 5) для обратимых процессов катализируют как прямую, так и обратную реакции, не смещая равновесия, а лишь ускоряя время его наступления. Особые свойства ферментов: 1) Эффективность. высокая каталитическая активность. Металлы увеличивают скорость реакции в тысячи раз, а ферменты в миллионы раз. Например, уреаза ускоряет скорость реакции в 1014 раз. Каталаза ускоряет кислорода не видно. Металлический катализатор увеличивает скорость реакции в 1000 раз, а при добавлении каталазы – бурное вспенивание. 2) Специфичность действия – наиболее характерная черта. Строение активного центра фермента, катализирующего реакции, различна. Структура активного центра фермента комплементарна структуре его субстрата, поэтому фермент из множества веществ присоединяет только свой субстрат – субстратная специфичность фермента. Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения. Например, на АК ГИС действуют 2 фермента: гистидаза (отщепляет NH3) и гистидиндекарбоксилаза (отщепляет CO2). a) Абсолютная b) Групповая c) Стерео (цис-транс, L и D) 3) Регулируемость с помощью активаторов и ингибиторов 13. Небелковые компоненты ферментов. Кофакторы, коферменты, простетические группы. Примеры. Классификация и номенклатура ферментов. Шифр ферментов. Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах). Кофакторы выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. В некоторых случаях ионы металла служат мостиком между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название металлоэнзимы .Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом: E-Me-S Кофермент, локализуясь в каталитическом участке активного центра,принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов.Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой, так как не отделяется от белковой молекулы (например, FAD, FMN, биотин, липоевая кислота, гемы). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры NAD+, NADP+, кофермент вовлечен непосредственно в энзиматическую реакцию, после - отделяется. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот. Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов. К коферментам относят следующие соединения: 1. производные витаминов; 2. гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов; 3. нуклеотиды - доноры и акцепторы остатка фосфорной кислоты; 4. убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ; 5. фосфоаденозилфосфосульфат, участвующий в переносе сульфата; 6. S-аденозилметионин (SAM) - донор метильной группы; 7. глутатион, участвующий в окислительно-восстановительных реакциях. Витамин РР входит в состав кофермента НАД+ и НАДФ+, который принимает участие в ферментативных реакциях по последовательному механизму. Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода – пример последовательных реакций, продуктом - восстановленная форма NAD, для фермента Е2 - наоборот. Витамин В5 – принимает участие в синтезе кофермента А (Ацетил-КоА). Кофермент А (КоА) — кофермент ацетилирования; один из важнейших коферментов; принимает участие в реакциях переноса ацильных групп. Молекула КоА состоит из остатка адениловой кислоты, связанной пирофосфатной группой с остатком пантотеновой кислоты, соединённой пептидной связью с остатком β-меркаптоэтаноламина. С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты. Витамин В2 – принимает участие в формировании кофактора ФАД и ФМН. Флавинадениндинуклеотид — кофактор, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода. Молекула FADH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATФ. 14. Представления о механизме ферментативного катализа. Суть понятий энергетический барьер и энергия активации. Ход химической реакции в присутствии и отсутствии фермента. Представления теории Кошланда об индуцированном соответствии фермент-субстрат. Современные представления о ферментативном катализе Первая теория ферментативного катализа была выдвинута в начале 20 века Варбургом и Бейлисом. Эта теория предлагала считать, что фермент адсорбирует на себе субстрат, и называлась адсорбционной, но развития она не получила. В основу современной теории положена теория Михаэлеса и Ментена. Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратного комплекса. По этой теории весь процесс катализа можно разделить на 3 этапа: [рис. E+SESES*ES**EPE+P] 1 этап: образование ферментсубстратного комплекса (на рис. до ES включительно). Происходит диффузия субстрата к ферменту и субстрат, в соответствии с принципом комплиментарности, связывается с активным центром фермента – образуется фермент-субстратный комплекс. Реагенты связаны слабыми связями, т.е. водородными, ионными, гидрофобными, в некоторых случаях и ковалентными. Эта стадия непродолжительна, зависит от концентрации субстрата и от скорости диффузии его к активному центру. Энергия активации исходных веществ при этом изменяется незначительно. На этой стадии проявляется эффект концентрирования субстрата на поверхности фермента – эффект ориентации. Энергия активации – это минимальное количество энергии, которое необходимо сообщить молекулам, чтобы преодолеть энергетический барьер, то есть вступить в реакцию (для разрушения химических связей между молекулами исходных веществ) Энергетический барьер – разница между энергией исходных веществ (реагентов) и количеством энергии, необходимой для инициации процесса химического взаимодействия. 2 этап: (на рис. от ES до EP включительно) происходит последовательное преобразование первичного фермент-субстратного комплекса в 1 или несколько активированных. Эта стадия наиболее медленна, ее длительность зависит от величины энергии активации данной реакции. В эту стадию происходит разрыв старых связей и образование новых, при этом энергия активации значительно снижается. По продолжительности эта стадия является лимитирующей для всего процесса. На этой стадии проявляется эффект вынужденного соответствия – эффект «дыбы»: субстрат под действием фермента претерпевает изменения, делающие его более доступным для воздействия каталитического участка активного центра фермента. Одновременно с этим происходит изменение конформации фермента в большей степени в активном центре. (Теория Кошланда: полное соответствие фермента и субстрата наступает в процессе их взаимодействия. Субстрат индуцирует необходимые конформационные изменения фермента, а также субстрата (для быстрого химического превращения), после чего они соединяются. (Гипотеза «рука - перчатка", у Фишера была теория («ключзамок") полного соответствия фермента и субстрата друг к другу) 3 этап: отделение продуктов от активного центра фермента и диффузия их в окружающую среду. Эта стадия непродолжительна, ее скорость определяется скоростью диффузии продуктов в окружающую среду. [график: по оси х – ход реакции, по у – энергия активации; рисуем горизонтальную прямую от середины оси у, затем горочку и опускаемся ниже прямой. пририсовываем меньшую горочку пунктиром] 15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от концентрации субстрата, константа Михаэлиса, ее практическое применение. Уравнение Михаэлиса-Ментен. Зависимость скорости ферментативной реакции от количества субстрата. Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента лимитирующий фактор в образовании продукта. Ферментативный процесс можно выразить следующим уравнением: Е+S. ES. E+P k1 - константа скорости образования ферментсубстратного комплекса; k2- константа скорости обратной реакции, распада фермент-субстратного комплекса; k3 - константа скорости образования продукта реакции; C[фермент] = const Константа Михаэлиса характеризует сродство фермента к субстрату. Константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. Чем меньше Км, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции, и наоборот. Исследование влияния концентрации субстрата на активность фермента позволило во многом объяснить механизм действия фермента. При постоянной концентрации фермента начальная скорость реакции растет пропорционально увеличению концентрации субстрата (реакция первого порядка для низких концентраций субстрата). При высоких концентрациях скорость реакции достигает своего максимального значения (Vmax) и не зависит от концентрации субстрата (реакция нулевого порядка). Эта кривая описывается уравнением Михаэлиса – Ментен: где Кm — константа Михаэлиса, численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. Такая гиперболическая кривая характерна для неаллостерических ферментов, т.е. ферментов, не обладающих четвертичной структурой. Аллостерические ферменты не подчиняются кинетике Михаэлиса – Ментен. С помощью Кm можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Кm, тем больше сродство фермента к данному субстрату. Если Кm высока, то это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно. 16. Влияние неспецифических факторов на скорость ферментативной реакции (температура, рН, концентрация субстрата, ионный состав среды), привести графики зависимости скорости ферментативной реакции от температуры и рН. Практическое значение указанных зависимостей. Зависимость скорости ферментативной реакции от температуры среды. (График А) Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум 36-37°С, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы . Зависимость скорости ферментативной реакции от рН среды (График Б) Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН 17. Специфические факторы, влияющие на активность ферментов. Ингибиторы обратимые и необратимые, конкурентные и неконкурентные, привести примеры. Как определить наличия конкурентного обратимого ингибирования фермента? К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибиторам не относят. В основе действия многих лекарственных препаратов и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса крайне важно для молекулярной фармакологии и токсикологии. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные. Обратимое ингибирование. Обратимые ингибиторы связываются с ферментом слабыми не ковалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. (СДГ и малонат) Необратимое ингибирование. Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента. (ЛДГ и Hg) Конкурентное ингибирование. К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). (Изменение константы Михаэлеса, Км увеличивается, следовательно уменьшается сродство к субстрату, то есть снижается активность фермента). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Для конкурентного типа ингибирования справедливы следующие уравнения: Е + S ⇔ ES → E + P, E + I ⇔ EI реакция не идет (СДГ и малоновая кислота, зарин) Неконкурентное ингибирование. Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции. (Влияет на Vmax) Е + S ⇔ ES+I → ESI → реакция не идет Определение конкурентного обратимого ингибирования Будет заметное снижение скорости ферментативной реакции. Также для определения, так как ингибитор конкурирует с субстратом и при этом сам фермент-ингибиторный комплекс обратим, то если мы увеличим концентрацию субстрата, то получим увеличение скорости ферментативной реакции, следовательно, это и есть способ определения наличия обратимого конкурентного ингибирования. 18. Написать уравнение реакции, катализируемое ацетилхолинэстеразой. Ингибиторы холинэстеразы (привести примеры: схемы строения активного центра ацетилхолинэстеразы и схемы присоединения к нему обратимых и необратимых ингибиторов. Обратимое конкурентное ингибирование прозерином Класс: 3.Гидролазы (делятся на подклассы по типу гидролизуемой связи) Са2+ активатор ацетилхолинэстеразы Эстеразный участок (каталитический участок) – конкурентное необратимое ингибирование (аргинин, фосфор- и фторорганические вещества (ФОС) – дихлофос, зарин) Анионный участок (участок связывания) – конкурентное обратимое ингибирование (прозерин, физиостигмины – лекарственные препараты, карбаматы (производные карбоминовой кислоты)) Применение ингибиторов для ацетилхолинэстеразы в медицине - лечение мышечных дистрофий Необратимые ингибиторы: ФОС, зарин, зоман, табун, хлорофос, дихлофос, фосфакол, препарат армин, пирофос Обратимые ингибиторы: производные карбаминовой кислоты (карбаматы), препараты (прозерин, галантамин, физостигмин) 19. Дегидрогеназы, Строение, дайте характеристику дегидрогеназ (класс, подкласс, тип катализируемой реакции, особенности строения активного центра, биологическая роль.). Написать уравнение реакции для сукцинатдегидрогеназы, на ее примере объяснить действие обратимых и необратимых ингибиторов. Написать три уравнения в общем виде для пояснения действия тиоловых ядов. Класс – 1. Оксиредуктазы Подкласс – 1. Дегидрогеназы Катализируют реакции дегидрирования субстрата с использованием в качестве акцептора водорода любых молекул, кроме О2 Особенности строения активного центра – содержат тиоловые группы цистеина. Биологическая роль: участвуют в ЦТК, в гликолизе и ПФЦ, окислительное фосфорелирование Обратимые: СДГ и малонат Необратимые: СДГ и тяжелые металлы, окислители, йодуксусная кислота Протекторы: (унитиол, глутатион, восстановители - антиоксиданты (аскорбиновая кислота)) Реакции тиоловых ядов С окислителями S-S, с тяжелыми металлами S-Me-S, с йодуксусной кислотой (CH2J-COOH) S-CH3COOH + HJ 20. Какие протекторы и почему необходимо выбрать для защиты от действия окислителей и тяжелых металлов? Окислители – восстановители, антиоксиданты (аскорбиновая кислота) – доноры протонов и электронов Тяжелые металлы – протекторы тиоловых групп (унитиол, глутатион) 21. Активаторы ферментов. Типы активации. Роль ионов металлов, ограниченный протеолиз. Действие протекторов (антидотов) на примере дегидрогеназ. Изменить скорость химического процесса в клетке можно путем: а) изменения количества субстрата или продукта реакции; б) изменения количества фермента (регуляция синтеза белков); в) изменения активности фермента. Ниже будут приведены механизмы регуляции активности фермента. Регуляция активности ферментов Ферменты являются регулируемыми катализаторами. регуляторов могут выступать метаболиты, яды. Различают: В качестве - активаторы – вещества, увеличивающие скорость реакции; - ингибиторы – вещества, уменьшающие скорость реакции. Активация ферментов. Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами субстраты. Типы активации: 1. Медленная: (на генном уровне) - изменение количества фермента - индукция или репрессия синтеза белков-ферментов под действием химических веществ (гормоны, специальные регуляторные белки, метаболиты) – они действуют на ДНК в результате изменения скорости транскрипции, то есть меняется скорость образования мРНК, что приводит к изменению количества фермента. (Если повышается скорость, то увеличивается количество белка - индукция) - появление новых форм фермента – изоферменты 2. Быстрая: Аллостерическая регуляция (активаторы (положительные эффекторы) – субстрат при избытке, Са2+, вторичные посредники; отрицательные эффекторы – продукты реакции (отрицательная обратная связь) Ковалентная модификация Белок – белковые взаимодействия Активация с помощью металлов протекает по различным механизмам: - металл входит в состав каталитического участка активного центра; - металл с субстратом образуют комплекс; - за счет металла образуется мостик между субстратом и активным центром фермента. Субстраты также являются активаторами. При увеличении концентрации субстрата скорость реакции повышается. по достижению концентрации насыщения субстрата эта скорость не изменяется. Если активатор связывается вне активного центра фермента, то происходит ковалентная модификация фермента: 1)частичный протеолиз (ограниченный протеолиз). Таким образом активируются ферменты пищеварительного канала: пепсин, трипсин, химотрипсин. Трипсин имеет состояние профермента трипсиногена, состоящего из 229 АК остатков. Под действием фермента энтерокиназы и с добавлением воды он превращается в трипсин, при этом отщепляется гексапептид. Изменяется третичная структура белка, формируется активный центр фермента и он переходит в активную форму. 2) фосфорилирование – дефосфорилирование: Пр.: липаза+АТФ= (протеинкиназа) фосфорилированная липаза+АДФ. Это трансферная реакция, использующая фосфат АТФ. При этом осуществляется перенос группы атомов от одной молекулы к другой. Фосфорилированная липаза является активной формой фермента. Таким же путем происходит активация фосфорилазы: фосфорилаза B+ 4АТФ= фосфорилаза А+ 4АДФ Также при связывании активатора вне активного центра происходит диссоциация неактивного комплекса «белок-активный фермент». Например, протеинкиназа – фермент, осуществляющий фосфорилирование (цАМФзависимое). Протеинкиназа – это белок, имеющий четвертичную структуру и состоящий из 2-х регуляторный и 2-х каталитических субъединиц. R2C2+2цАМФ=R2цАМФ2+ 2С. Такой тип регуляции называется аллостерической регуляцией (активацией). 22. Общие механизмы регуляции (дайте определение быстрой и медленной регуляции). Быстрая регуляция активности ферментов, виды. Типы активации: 2. Медленная: (на генном уровне) - изменение количества фермента - индукция или репрессия синтеза белков-ферментов под действием химических веществ (гормоны, специальные регуляторные белки, метаболиты) – они действуют на ДНК в результате изменения скорости транскрипции, то есть меняется скорость образования мРНК, что приводит к изменению количества фермента. (Если повышается увеличивается количество белка - индукция) скорость, то - появление новых форм фермента – изоферменты 2. Быстрая: Аллостерическая регуляция (активаторы (положительные эффекторы) – субстрат при избытке, Са2+, вторичные посредники; отрицательные эффекторы – продукты реакции (отрицательная обратная связь) Ковалентная модификация Белок – белковые взаимодействия 23. Аллостерическая регуляция. Особенности строения и действия аллостерических ферментов. Положительные и отрицательные аллостерические модуляторы. Регулирование по типу отрицательной обратной связи (привести схему). Аллостерическая регуляция. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостерическим (некаталитическим) центром молекулы фермента, вызывая ингибирование всей цепи синтетической реакции. Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом: Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта Р, накопление которого выше допустимого уровня оказывает мощное ингибирующее действие на первую стадию процесса и соответственно на фермент E1. Следует, однако, иметь в виду, что модуляторами аллостерических ферментов могут быть как активаторы, так и ингибиторы. Часто оказывается, что сам субстрат оказывает активирующий эффект. Ферменты, для которых и субстрат, и модулятор представлены идентичными структурами, носят название гомотропных, в отличие от гетеротропных ферментов, для которых модулятор имеет отличную от субстрата структуру. Взаимопревращение активного и неактивного аллостерических ферментов в упрощенной форме, а также конформационные изменения, наблюдаемые при присоединении субстрата и эффекторов. Присоединение отрицательного эффектора к аллостерическому центру вызывает значительные изменения конфигурации активного центра молекулы фермента, в результате чего фермент теряет сродство к своему субстрату (образование неактивного комплекса). Аллостерические взаимодействия проявляются в характере кривых зависимости начальной скорости реакции от концентрации субстрата или эффектора, в частности в S-образности этих кривых (отклонение от гиперболической кривой Михаэлиса-Ментен). S-образный характер зависимости V от [ S ] в присутствии модулятора обусловлен эффектом кооперативности. Это означает, что связывание одной молекулы субстрата облегчает связывание второй молекулы в активном центре, способствуя тем самым увеличению скорости реакции. Кроме того, для аллостерических регуляторных ферментов характерна нелинейная зависимость скорости реакции от концентрации субстрата. 24. Быстрая регуляция активности ферментов. Ковалентная модификация. Примеры ковалентной регуляции. Регуляция посредством белок-белкового взаимодействия и ассоциации-диссоциации субъединиц. Привести примеры. Быстрая: Аллостерическая регуляция (активаторы (положительные эффекторы) – субстрат при избытке, Са2+, вторичные посредники; отрицательные эффекторы – продукты реакции (отрицательная обратная связь) Ковалентная модификация Белок – белковые взаимодействия фосфорилирование – дефосфорилирование: Пр.: липаза+АТФ= (протеинкиназа) фосфорилированная липаза+АДФ. Это трансферная реакция, использующая фосфат АТФ. При этом осуществляется перенос группы атомов от одной молекулы к другой. Фосфорилированная липаза является активной формой фермента. Таким же путем происходит активация фосфорилазы: фосфорилаза B+ 4АТФ= фосфорилаза А+ 4АДФ Также при связывании активатора вне активного центра происходит диссоциация неактивного комплекса «белок-активный фермент». Например, протеинкиназа – фермент, осуществляющий фосфорилирование (цАМФзависимое). Протеинкиназа – это белок, имеющий четвертичную структуру и состоящий из 2-х регуляторный и 2-х каталитических субъединиц. R2C2+2цАМФ=R2цАМФ2+ 2С. Такой тип регуляции называется аллостерической регуляцией (активацией). Ассоциация – диссоциация. Этот процесс иногда начинается с ковалентной или нековалентной модификации одной из субъединиц. Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии cAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР 2С + 2(R -сАМР) Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза: АТРс АМР + Н4Р2О7 Белок - белковые взаимодействия: 25. Витамины, определение, биологическая роль. Классификация витаминов, название (буквенное и тривиальное) всех витаминов водорастворимой группы. Экзогенные и эндогенные причины гиповитаминозов. Что такое антивитамины, приведите примеры. Витамины – это группа низкомолекулярных биологически активных органических соединений, разнообразной структуры и состава, которые необходимы для правильного развития и жизнедеятельности организмов, они относятся к незаменимым факторам питания. По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы: Водорастворимые Витамин В1 (тиамин); Витамин В2 (рибофлавин); Витамин РР (никотиновая кислота, никотинамид, витамин В3); Пантотеновая кислота (витамин В5); Витамин В6 (пиридоксин); Биотин (витамин Н); Фолиевая кислота (витамин Вс, В9); Витамин В12 (кобаламин); Витамин С (аскорбиновая кислота); Витамин Р (биофлавоноиды). Жирорастворимые Витамин А (ретинол); Витамин D (холекальциферол); Витамин Е (токоферол); Витамин К (филлохинон). Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма. Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организм наступают характерные и опасные патологические изменения. Большинство витаминов не синтезируются в организме человека. Поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина—гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина— гипервитаминоз. Алиментарный авитаминоз (экзогенный) - заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины. Вторичный авитаминоз (эндогенный) – заболевание, связанное с нарушением процессов пищеварения или нарушением работы органов, связанных непосредственно с пищеварением, поступлением в организм антивитаминов , например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови, особенностями обмена веществ в пожилом и детском возрасте. Гиповитаминоз - болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; тоже, что витаминная недостаточность. Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно: появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит, нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность, сказывается на состоянии отдельных органов и тканей (кожа, слизистые, мышцы, костная ткань) и важнейших функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода, защитные силы организма. Гипервитаминоз — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих лекарствах). Чаще всего, гипервитаминозы вызываются приёмом резко повышенных доз жирорастворимых витаминов. 26. Витамин В1. Строение, биологическая роль, коферментные функции витамина. Содержание в продуктах. Суточная потребность. Клиника b название гиповитаминоза. Тиамин (В1): антиневритный 2-3 мг Содержится в оболочке семян, отрубях, хлебных злаков, рисе, горохе, дрожжах Коферменты: ТПФ (тиаминпирофосфат), ТДФ (тиаминдифосфат) Ферменты: пируватДГ (катализирует окислительное декарбоксилирование), а-кетоглутаратДГ (катализирует окислительное декарбоксилирование а-кетоглутарата), транскетолаза (взаимное превращение кето- и альдосахаров в ПФЦ), обладает ацетилхолиноподобным действием за счет четвертичного азота Гиповитаминоз: Бери-Бери: нарушение ЦНС/ПНС, нарушение ССС (недостаток АТФ в сердце), нарушение ЖКТ и водно-солевого баланса, нарушение углеводного обмена (накопление ПВК и молочной кислоты). 27. Витамин В2. Строение, биологическая роль, коферментные функции. Содержание в продуктах. Суточная потребность. Клиника гиповитаминоза. Рибофлавин (В2): 1,8-2,6 мг Содержится в печени, яйцах, молочных продуктах, рыбе Коферменты: ФАД (флавинадениндинуклеотид), ФМН (флавинмононуклеотид) Ферменты: дегидрогеназы, оксидазы, редуктазы (катализирует ОВР) Гиповитаминоз: поражение слизистых рта (заеды), глоссит, воспаление роговицы, помутнение хрусталика, мышечная слабость, анемия 28. Витамин В3 строение, биологическая роль, коферментные функции. Клиника и название гипоавитаминоза. Суточная потребность. Никотинамид, никотиновая кислота (РР, В3): антиневритный 15-20 мг Содержится в печени, мясных продуктах Коферменты: НАД (никотинамидадениндинуклеотид), НАДФ (никотинамидадениндинуклеотидфосфат) Ферменты: дегидрогеназы, оксидазы, редуктазы (катализирует ОВР) Гиповитаминоз: пеллагра (симметричные дерматиты не открытых солнцу участков), 3Д: дерматит, диарея, деменция. 29. Витамин С, строение, формы витамина аскорбиновой кислоты, биологическая роль, Клиника и название гиповитаминоза. Суточная потребность, продукты, наиболее богатые витамином. Аскорбиновая кислота (С): антиоксидантный, ангиопротекторный 50-75 (100) мг Содержится в шиповнике, черной смородине, облипихе, цитрусовых Коферменты: нет, но выполняет коферментно-косубстратные функции Ферменты: гидроксилирование пролина и лизина для созревания коллагена и процессов регенерации сосудистой стенки, костной ткани, кожи; гидроксилирование тирозина и триптофана для образования биогенных аминов и катехоламинов; гидроксилирование стероидов и образование котикостероидов; гидроксилирование холестерола до образования желчных кислот; гидроксилирование ксенобиотиков совместно с цитохромом Р-450 необходим для детоксикации при лекарственной, алкогольной, химической и наркотической интоксикации; антиоксидант – совместно с биофлавоноидами участвует в реакциях восстановления (+ мембраностимулирующий эффект); стимулирует фагоцитоз, синтез интерлейкинов, обладает антибактериальным, иммуномодулирующим и противовоспалительным действием; для профилактики некоторых нарушений сахарного диабета (ингибирует процесс превращения глюкозы в сорбитол, следовательно происходит процесс торможения гликозилирования гемоглобина); стимулирует хондроитин для суставов и связок Гиповитаминоз: цинга: истончение стенок сосудов, следовательно кровоточат слизистые ротовой полости, десна становятся более рыхлыми, выпадают зубы; снижение упругости кожи, дряблость, появление морщин, сухость кожи. 30. Витамин В6, строение, коферментные функции, роль в обмене веществ (перечислить ферменты, в состав которых входит кофермент, содержащий витамин В6). Клиника авитаминоза. Суточная потребность витамина. Назовите все причины, приводящие к В6 гиповитаминозу. Пиридоксин: антианемический, антиневритный, антидерматитный, ангиопротекторный 2-4 мг Содержится в бобовых, мясе, рыбе, бананах Коферменты: фосфопиридоксаль Ферменты: аминотрансфераза (переносит аминогруппу от аминокислоты на кетокислоту), декарбоксилаза аминокислот (декарбоксилирует аминокислоту для образования биогенных аминов, которые являются нейромедиаторами), участвует в реакции обмена аминокислот; участвует в образовании пуринов, пиримидинов, гема; стимулирует обезвреживающую функцию печени Гиповитаминоз: себорейный дерматит (волосистой части головы), поражения ЦНС (невриты, боли по ходу нервного ствола), судороги, анемия 31. Дайте буквенное и тривиальное название витаминов, при недостаточности которых развиваются дерматиты. Биологическая роль этих витаминов в метаболических процессах (не включая вит В6). Клиника гиповитаминозов. Напишите формулу одного из них В6, В5, В3 32. Дайте буквенное и тривиальное название витаминов, при недостаточности которых развиваются анемия. Биологическая роль этих витаминов в метаболических процессах. Клиника гиповитаминозов. Пишите формулу одного из них. В6, В9, В12 33. Витамин С, строение, свойства, содержание в продуктах, факторы, влияющие на устойчивость, биологическая роль, название и клиника гиповитаминоза. 34. Витамины В5 и В6, Н, название, биологическая роль, клиника гиповитаминоза Напишите структуру вит В6 Пантотеновая кислота (В5): антидерматитный 10-12 мг Содержится в яйцах, икре, рыбе, мясе, синтезируется микрофлорой кишечника Коферменты: Ко-А (участвует в транспорте ацильных остатков) Ферменты: участвует в окислении и биосинтезе жирных кислот, в окислительном декарбоксилировании кетокислот, в ЦТК, в синтезе кортикостероидов, ацетилхолина, нуклеиновых кислот, триглицеридов, фосфолипидов, холестерола и др. Гиповитаминоз: дерматиты, депигментация волос, слабость, утомляемость, мышечные боли, нарушение сна 35. Витамины В2, В9, В12 название, биологическая роль, клиника гиповитаминоза. Напишите структуру витамина В2 Фолиевая кислота (В9): антианемический, ангиопротекторный 0,4 мг, (при беременности увеличивают в 2 раза, при онкологии уменьшают в 2 раза) Содержится в зеленых листьях шпината, свежих овощах, сыре, яйцах Коферменты: тетрогидрофолиевая кислота Ферменты: участвует в переносе одноуглеродных групп (СН3, СНО, СН2ОН) Гиповитаминоз: мегалобластная анемия (образование незрелых эритроцитов): так как нарушается синтез ДНК при эритропоэзе), образуется мегалобластическая диарея, лейкопения, тромбоцитопения Гипервитаминоз: может способствовать новообразованиям Кобаламин (В12): антианемический, антиневритный, ангиопротекторный 0,002-0-005 мг Содержится в печени, почках, синтезируется микрофлорой кишечника Коферменты: 5-дезоксиаденозилкобаламин Ферменты: участвует в реакциях обмена аминокислоты метионина, обмена жирных кислот Гиповитаминоз: анемия, тромбозы, нарушение обмена жирных кислот в головном мозге (головные боли), атрофия слизистой желудка и кишечника (при гиповитаминозе В12 перорально не восполняется) Витамин Н – биотин: антисеборейный Входит в состав ферментов карбоксилазы, в синтезе глюкозы и жирных кислот (источники АТФ) 36. Витамины, участвующие в окислительно-восстановительных реакциях: названия, биохимические функции (названия ферментов и коферментов). Пишите формулу одного из них. В2, В3, С 37. Клинико-диагностическое значение определения белка в плазме крови, причины гипо- ( чаще всего снижение уровня альбуминов - недостаточное потребление белка с пищей, нарушения переваривания и всасывания белков, патология печени, врождённое нарушение синтеза белка, кровопотери, патология почек, у беременных и в период лактации, ожоги, онкологические заболевания (усиленный распад белков), выраженная гипопротеинемия – нефротический синдром(30-40г/л)) и гиперпротеинемий ( относительная: чаще всего связана с обезвоживанием организма, например, при усилении потоотделения, рвоте, диарее, холере, дизентерии, вирусных энтеритах; абсолютная: при миеломной болезни - заболевания костного мозга - появляется дополнительный Белок, при хронических воспалительных заболеваниях). Норма содержания белка в плазме крови (65-85 г/л) . 38. Какими методами можно разделить белки плазмы крови (поясните механизмы действия выбранных методов. Центрифугирование (разделение по молекулярной массе) разделяется на дифференциальное и зональноскоростное. Электрофорез (разделение по молекулярной массе)- данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от их заряда. Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшиемолекулы будут встречать меньшее сопротивление И, соответственно, двигаться быстрее. В результате после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие. Методом электрофореза можно разделить белки и по молекулярной массе. Для этого используют электрофорез ПААГ в присутствии додецилсульфата натрия. Для разделения белков крови используют слабо щелочной буфер pH=8,9 Диализ - отделение белков от низкомолекулярных соединений Гель-хроматография (разделение по молекулярной массе) Выделение индивидуальных белков: Афинная хроматография - Метод основан на способности белков прочно связываться с различными молекулами не ковалентными связями. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных блков. Молекулы веществ (лиганды), с которми специфически связывается определенные белки, ковалентно соединяют с частицами инертного вещества . Смесь белков вносит в колонку ,и искомый белок прочно присоединяется к лиганду . Остальные белки свободно выходят из колонки . Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии лиганд . Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков. Изоэлектрофокусирование - метод основанный на разнице в электрической точке. Камеры заполняется гелем, который пропитан буфером - создаётся градиент Ph, белки движутся под действием электрического тока. Они останавливаются на уровне своей ИЭТ Двухмерный электрофорез представляет собой сочетание изоэлектрофокусирования и электрофореза с ddsNa. Проводят сначала электрофорез в горизонтальном направлении на пластине с амфолином. Белки разделяются зависимости от заряда (ИЭТ). Затем обрабатывают пластину раствором ddsNa и проводят электрофорез в вертикальном направлении. Белки и разделяются в зависимости от молекулярной массы. Значение разделение белков крови используется для диагностики заболеваний. Изменения в соотношении белковых фракций – диспротеинемия. 39. Какие белковые фракции можно определить при проведении электрофореза? Назовите причины снижения содержания альбуминов. Фракции белков: Таблица 1 Норма, f Альбумины 55-65% (не являются гликопротеидами) 40-50г/л Поддержание онкотического давления крови, транспорт гормонов, билирубина, Са2+ (гидрофобных соединений) Источник АК при голодании Глобулины-а1 2-5% (Антитрипсин,транскортин,тироксинсвязывающий белок, протромбин, гликопротеин) Ингибирование протеиназ, транспорт стероидных гормонов, фактор свертывания крови 2 Глобулины-a2 6-11% (Церулоплазмин, гаптоглобин, макроглобулин, вит. Дсвязывающий) Транспорт ионов Cu, связывание гемоглобина, связывание протеиназ, транспорт витамина Д Глобулины-в 11-15% (Трансферрин, С-реактивный белок (острой фазы), фибриноген, гемопексин) Транспорт ионов Fe3+, активация комплементв, фактор свертывания крови 1; носитель гема, предотвращающий его выведение с мочой Глобулины-y 15-22% (синтез Влимфоцитами) IgG, IgA, IgM, IgD, IgI Патология (увеличение) (Утилизируется в основном в почках, печени) Патология (уменьшение) Нефротический синдром(нефроз) (поражение гломерулярного аппарата почек различной этиологии), цирроз печени, недостаток белков, кахексия Белок острой фазы Белок острой Респираторные фазы болезни Опухоли, (новорожденных) болезни печени, нефроз, туберкулёз, ревматизм, острые инфекции, острые некрозы Нефроз, гепатит, атеросклероз, вмиеломная болезнь, застойная желтуха Хронические воспаления, хронический Приобретенные углобулинемии Специфическая гуморальная защита полиартрит, Цирроз печени, у-миеломная болезнь 40. Белки плазмы крови. Как изменяются белковые фракции при остром и хроническом воспалительных процессах (см таблицу 1). Что такое белки острой фазы. Приведите примеры. Плазма крови -сыворотка, лишенная фибриногена. В сыворотке при электрофорезе на бумаге определяется 5 фракций (таблица 1) Белки острой фазы – белки, которые появляются только в острый период заболевания, при хронических инфекциях не обнаруживаются. К ним относятся а1(антитрипсин) и а2 глобулины и С-реактивный белок. 41. Какие изменения фракций белков плазмы крови и активности индикаторных ферментов появляются при заболевании почек > повышение, 》сильное повышение, < понижение, 《 сильное понижение, N норма При заболеваниях почек снижается содержание альбуминовой фракции, но увеличивается содержание 2 и глобулинов Альбумины 《 а1 N а2 > (так как снижается концентрация альбуминов (маленькие), пропорционально (в %) повышается концентрация больших белков. в> у> Такое распределение белковых фракции часто встречается при поражения печени и почек. Это видно из распределения Белковых Фракций: 1. Уровень альбумина в сильно снижен это может быть причиной потери альбуминов так как он имеет наименьшее размеры и при поражении почек возникнет протеинурия (выход альбуминов из почек) при нефрозах. Также понижение уровня альбумина возникает вследствие нарушения синтеза альбумина при хронических заболеваниях печени. 2. Повышение в-глобулина. Во фракцию входит гемопексин, содержание которого повышается в крови при воспалении. Это подтверждает наличие воспалительного процесса 3. Повышение у-глобулинов. Основную фракцию составляют белки, обладающие функциональными свойствами антител. Увеличение содержания иммуноглобулинов наблюдается при инфекционных процессах, а так же при хронических воспалительных процессах, в данном случае менее гепатите или нефрите. Да для подтверждения диагноза необходимо из следовать активность АЛТ и АСТ, сорбитолдегидрогеназу, их активность значительно увеличивается в сыворотке крови при заболеваниях печени. Также органоспецифичными ферментами для печени являются: гистидаза, аргиназа и орнитинкарбомаилтрансфераза, холинестераза, ЛДГ4,5; ГлДГ Органоспецифичные ферменты для почек: трансамидиназа. 42. У человека после контакта с фосфорорганическими соединениями, используемыми как средство борьбы с насекомыми, развилось состояние отравления. Активность каких ферментов нужно исследовать для подтверждения диагноза, какой тип ингибирования имеет место, объясните на примере строения активного центра фермента. ФОС необратимо ингибируют ферменты, содержащие в активном центре -ОН группу серина (пример: ацетилхолинэстераза) 43. Активность каких ферментов нужно исследовать для подтверждения диагноза, при подозрении на действие тиоловых ядов. Какой тип ингибирования имеет место, объясните на примере строения активного центра фермента и подтвердите схемами . Ферменты имеющие тиоловую (-SH) группу цистеина в активном центре. Такие ферменты называются Дегидрогеназы (подкласс оксиредуктаз) Необратимое ингибирование E+I->EI (неактивный фермент-ингибиторный комплекс) Пример: Сукцинатдегидрогеназа Тиоловые яды: люизит, тяжелые металлы (Ag, Hg, Cd, Cr) 44. Какие протекторы Вы выберете и почему для защиты от действия окислителей и тяжелых металлов? Объясните возможные различия в протекторном действии в этих двух случаях. Окислители – антиоксиданты (восстанавливают sh- связи), унитиол и глутатион – забирают на себя тяжелые металлы, восстанавливают sh- группу). 45. Ингибиторы ферментов как лекарственные препараты. Приведите примеры. В основном это конкурентные ингибиторы, такие как «прозерин» конкурентный ингибитор ацетилхолинэстеразы, «сульфаниламидные препараты" – (лечение инфекционных заболеваний верхних дыхательных путей) структурные аналоги ПАБК (парааминобензойной кислоты) конкурентный ингибитор фермента синтеза фолиевой кислоты Ингибиторы трипсина – «контрикал» (получают из легких) при лечении острого панкреатита Ингибитор ангиотензинпревращающего фермента – «эналаприл" лечение ГБ Пример необратимого ингибирования: «Аспирин" – НПВС за счет ингибирования циклооксигеназы (катализирует образование ПГ (простогландинов), также являются медиаторами. 46. Использование ферментов в качестве лекарственных препаратов. Приведите примеры Области применения ферментов в медицине Для скрининг-диагностики — выборочные тесты при подозрении на какое-то заболевание. Для диагностики заболеваний (креатинкиназа и ее изофермент МВ — для диагностики инфаркта миокарда; аланинаминотрансфераза — для диагностики заболеваний печени) и оценки глубины повреждения ткани (ферменты цитоплазмы и митохондрий). Для дифференциальной диагностики (при инфаркте миокарда наблюдается некроз кардиомиоцитов и выход характерных (изо)ферментов в кровь; приступ стенокардии не сопровождается указанными явлениями). Для лечения заболеваний: а) заместительная терапия (при заболеваниях ЖКТ используют пепсин, панкреатин, фестал, панзинорм, мезим-форте); б) для лечения заболеваний и устранения патологических процессов используют ферменты с целью: разрушения омертвевшей ткани (при лечении ожогов, язв, абсцессов — трипсин, химотрипсин, нуклеаза); разжижения вязких секретов при лечении бронхитов (трипсин, химотрипсин, бронхолитин); 47. Изоферменты, особенности строения, роль в диагностике. Клиникодиагностическое значение изоферментного спектра плазмы крови (на примере лактатдегидрогеназы и креатинфосфаткиназы). Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах. Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам Изоферменты -множественные формы одного фермента, отличающиеся физико-химическими свойствами, катализирующие одну и ту же реакцию, но в разных органах и тканях. Лактатдегидрогеназа. Катализирует реакцию превращения молочной кислоты (лактат) в пировиноградную (пируват). Состоит из 4 субъединиц В тканях, где аэробное окисление глюкозы превалирует над анаэробным содержится ЛДГ1 (больше Н-субъединиц, низкое сродство к ПВК) , если наоборот, то ЛДГ5 (больше М-субъединиц, высокое сродство к ПВК) Н-сердечная форма (субъединица), М- мышечная форма (субъединица). Образует 5 изоферментов. В тканях, в которых преобладает аэробный распад глюкозы присутствуют ЛДГ 1 ,ЛДГ2 (низкое сродство к ПВК). В тканях с анаэробным распадом глюкозы присутствуют ЛДГ4, 5. В миокарде главный изофермент - ЛДГ1 . В эритроцитах и лёгких, почки -ЛДГ 1 и ЛДГ2. В плазме крови ЛДГ2. В селезёнке, надпочечниках ЛДГЗ. В скелетных мышцах ЛДГ4, ЛДГ5 В печени ЛДГ5 ЛДГЗ отмечена в лимфоидной ткани, тромбоцитах,опухолях. В недифференцированных эмбриональных тканях преобладают ЛДГ2, ЛДГЗ, ЛДГ4 Креатинкиназа -2 субъединицы-мышечная (М) и бульбарная (В) Изофермент ВВ - ткани мозга, ММ - скелетные мьшщы, МВ - миокард. 48. Принцип, лежащий в основе определения активности ферментов. Методы определения активности ферментов, единицы активности ферментов. Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, которые катализируют идентичные реакции, но отличаются строением и каталитическими свойствами), а также условиями среды (рН, температура, ионная сила раствора) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты реакции, а также конечные продукты в цепи последовательных превращений вещества Ферментативные реакции чувствительны к внешним условиям, в частности к ионной силе раствора и рН среды. Влияние температуры на скорость ферментативной реакции описывается кривой с максимумом, восходящая ветвь которой отражает обычную для химической реакций зависимость, выраженную уравнением Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента. Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться". В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя ферментсубстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением: Е + S ↔ ES ↔ ЕР ↔ Е + Р Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, рН раствора, присутствие регуляторных молекул (активаторов и ингибиторов). Зависимость скорости ферментативной реакции от количества ферментов. При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: Одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов Международная единица ферментативной активности ME связана с каталом следующими равенствами: 1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME, 1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат. В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной тканиопределяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани. Единицы измерения активности Катал — это количество фермента, которое обеспечивает превращение 1 моля субстрата в продукт за 1 секунду. Стандартная единица (U) — это количество фермента, которое превращает 1 мкмоль субстрата в продукт за 1 минуту. 1 U = 16,67 нкатал (нанокатал). В медицине активность ферментов выражают чаще всего в единицах активности на 1 л биологической жидкости. Удельная активность — выражается в единицах активности, рассчитанной на единицу массы белка (чаще всего на 1 мг) 49. Дайте определение индикаторных, секреторных и экскреторных ферментов, приведите примеры для каждой группы. Индикаторные или клеточные - попадают в кровь из тканей, где они выполняют свою определенную функцию в митохондриях, цитозоле, лизосомах. В норме определяются лишь в следовых количествах. При поражении тканей ферменты из клеток вымываются в кровь, их активность резко увеличивается – это и будет индикатором степени и глубины поражения ткани, органа.(инфаркт миокарда: АСТ, ЛДГ1,КК-МВ; гепатит: АЛТ, ЛДГ5; миозиты: КК-ММ, креатинкиназа) Секреторные - синтезируется в печени, в норме выделяются в плазму крови где играют физиологическую роль. Ферменты, участвующие в свертывании крови, сывороточная холинэстераза, ферменты калликреин-кининовой системы Экскреторные – синтезируются пищеварительными железами, их секрет поступает в просвет кишки, при воспалении повышается проницаемость тканей, они попадают в кровь (при холестазе: лейцинаминопептидаза, щелочная фосфатаза, 5-нуклеопептидаза; при панкреатите: амилаза, липаза, трипсин, химотрипсин). В физиологических условиях выделяются с желчью наружу, при воспалениях активность в плазме крови повышается 50. Индикаторные ферменты плазмы крови, приведите примеры. Значение определения активности индикаторных ферментов. Индикаторные или клеточные - попадают в кровь из тканей, где они выполняют свою определенную функцию в митохондриях, цитозоле, лизосомах. В норме определяются лишь в следовых количествах. При поражении тканей ферменты из клеток вымываются в кровь, их активность резко увеличивается – это и будет индикатором степени и глубины поражения ткани, органа.(инфаркт миокарда: АСТ, ЛДГ1,КК-МВ; гепатит АЛТ, ЛДГ5, миозиты: КК-ММ, креатинкиназа) Определяют орган, в котором происходит воспалительный процесс, а также объемы его поражения. 51. Какой ферментативный спектр сыворотки крови характерен для инфаркта миокарда? Индикаторные или клеточные - попадают в кровь из тканей, где они выполняют свою определенную функцию в митохондриях, цитозоле, лизосомах. В норме определяются лишь в следовых количествах. При поражении тканей ферменты из клеток вымываются в кровь, их активность резко увеличивается – это и будет индикатором степени и глубины поражения ткани, органа.(инфаркт миокарда: АСТ, ЛДГ1,КК-МВ) 52. Какой ферментативный спектр сыворотки крови характерен для гепатита (цитолиза клеток печени)? Экскреторные – синтезируются пищеварительными железами, их секрет поступает в просвет кишки, при воспалении повышается проницаемость тканей, они попадают в кровь. При холестазе: лейцинаминопептидаза, щелочная фосфатаза, 5-нуклеопептидаза. Индикаторные или клеточные - попадают в кровь из тканей, где они выполняют свою определенную функцию в митохондриях, цитозоле, лизосомах. В норме определяются лишь в следовых количествах. При поражении тканей ферменты из клеток вымываются в кровь, их активность резко увеличивается – это и будет индикатором степени и глубины поражения ткани, органа.(гепатит: АЛТ, ЛДГ5) 53. Какой ферментативный спектр сыворотки крови характерен для острого панкреатита, Какие отличия будут в активности ферментов при хроническом панкреатите и почему? Экскреторные – синтезируются пищеварительными железами, их секрет поступает в просвет кишки, при воспалении повышается проницаемость тканей, они попадают в кровь. при Панкреатите: амилаза, липаза, трипсин, химотрипсин). В физиологических условиях выделяются с желчью наружу, при воспалениях активность в плазме крови повышается. Если это хроническое воспаление, то есть происходит постоянный цитолиз и клеточная регенерация очень медленная, в итоге происходит замещение ткани органа на соединительную (так как она быстрее пролиферирует). Следовательно будет снижение всех ферментов поджелудочной железы. 54. Динамика (время появления, максимальная активность, время исчезновения) кардиомаркеров в плазме крови. Изобразите график. Значение определения кардиомаркеров в динамике. 1. Миоглобин самый ранний кардиомаркер, определяется через 1,5. Недостаток – содержится во всех мышечных тканях 2. Тропонин Т и I появляется через 3-6 часов, тропонин Т дольше держится, до 24 часов 3. КФК-МВ повышается через 4-6ч 4. АСТ повышается через 8ч 5. ЛДГ1 повышается через 1224ч 55. Какие изменения фракций белков плазмы крови появляются при заболевании печени. Объясните причины изменений. > повышение, 》сильное повышение, < понижение, 《 сильное понижение, N норма При заболеваниях почек снижается содержание альбуминовой фракции, но увеличивается содержание 2 и глобулинов Альбумины 《 а1 N а2 N в> у> Такое распределение белковых фракции часто встречается при поражения печени и почек. Это видно из распределения Белковых Фракций: 1. Уровень альбумина в сильно снижен это может быть причиной потери альбуминов так как он имеет наименьшее размеры и при поражении почек возникнет протеинурия (выход альбуминов из почек) при нефрозах. Также понижение уровня альбумина возникает вследствие нарушения синтеза альбумина при хронических заболеваниях печени. 2. Повышение в-глобулина. Во фракцию входит гемопексин, содержание которого повышается в крови при воспалении. Это подтверждает наличие воспалительного процесса 3. Повышение у-глобулинов. Основную фракцию составляют белки, обладающие функциональными свойствами антител. Увеличение содержания иммуноглобулинов наблюдается при инфекционных процессах, а так же при хронических воспалительных процессах, в данном случае менее гепатите или нефрите. Да для подтверждения диагноза необходимо из следовать активность АЛТ и АСТ, сорбитолдегидрогеназу, их активность значительно увеличивается в сыворотке крови при заболеваниях печени. Также органоспецифичными ферментами для печени являются: гистидаза, аргиназа и орнитинкарбомаилтрансфераза, холинестераза, ЛДГ4,5; ГлДГ Органоспецифичные ферменты для почек: трансамидиназа. 56. У пациента повышена амилаза в крови и моче. О патологии какого органа можно подумать? Какие фермент можно дополнительно определить в сыворотке крови для подтверждения диагноза? Острый панкреатит