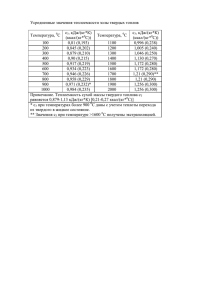
Составитель В.Н.Письмак КОМПЛЕКСНАЯ ПЕРЕРАБОТКА СЫРЬЯ ЛЕГКИХ МЕТАЛЛОВ: Примеры решения задач и контрольные задания/ В.Н.Письмак. Екатеринбург:УрФУ,2011,21с. Примеры решения задач и контрольные задания по курсу "Комплексная переработка сырья легких металлов" предназначены для студентов очной формы обучения специальности 150102 - Металлургия цветных металлов с целью оказания им методической помощи в самостоятельном и углубленном изучении указанного курса. Для повышения эффективности изучения курса предусмотрены индивидуальные контрольные задания по основным разделам в соответствии с рабочей программой. Контрольные задания способствуют освоению теоретического материала и применению его для практических расчетов. Табл.12. Подготовлено кафедрой металлургии легких металлов. © ФГАОУ ВПО «Уральский федеральный университет имени первого Президента России Б.Н. Ельцина», 2011 I. ВВЕДЕНИЕ Большое внимание уделяется комплексной переработке различных видов минерального сырья с целью извлечения всех ценных компонентов, организации экологически безопасной технологии, что позволяет достигнуть и высоких технико-экономических показателей. Важнейшим технологическим процессом в металлургии всех без исключения легких металлов является электролиз расплавленных солевых сред. В металлургии алюминия - это электролиз криолит-глиноземных расплавов; в металлургии магния - электролиз расплавленных хлоридов щелочных металлов, содержащих хлористый магний; в металлургии лития – электролиз хлористого лития и его смесей с хлоридами щелочных металлов и т.д. Для углубленного понимания процесса электролиза необходимы развитые представления о свойствах расплавленных электролитов, динамике изменения свойств в процессе электролиза. Необходимо также умение осуществлять расчеты материального, электрического и энергетически балансов для конкретного электролиза. В настоящей работе приведены примеры таких расчетов для процесса электролиза криолит-глиноземных расплавов. 2. ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ При подготовке к практическим занятиям необходимо по учебникам либо конспектам освежить в памяти теоретическую часть курсов "Комплексная переработка сырья легких металлов", "Теория электрометаллургических процессов". Это позволит осознанно вместе с преподавателем разобрать примеры решения задач. Индивидуальное контрольное задание включает самостоятельное решение каждым студентом задач по 5 темам. Номера вариантов контрольных задач по каждому разделу совпадают с порядковым номером студента в журнале академической группы (подгруппы). При решении задач рекомендуется пользоваться системой единиц СИ. В ходе решения необходимо следить за соответствием размерностей употребляемых величин. Игнорирование последней рекомендации является распространенной причиной грубых ошибок в расчетах. Выполнять контрольное задание рекомендуется в отдельной тетради, периодически по мере выполнения каждого задания сдавать ее для проверки преподавателю. Правильное решение задач по всем разделам является необходимым требованием для получения зачета по курсу "Комплексная переработка сырья легких металлов". 3. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ И ЮНТРОЛЬНЫЕ ЗАДАНИЯ 3.1. Физико-химические свойства криолит-глиноземных расплавов, изменение свойств в процессе электролиза Для улучшения технологических свойств криолит-глиноземных расплавов (к.г.р.) в их состав вводят солевые добавки, снижающие температуру плавления расплава, изменяющие его плотность, электропроводность, вязкость, коррозионную активность. Изменение свойств пропорционально концентрации добавки (в массовых %) и может быть рассчитано по правилу адитивности, используя данные табл.1 и 2. Таблица 1 - Свойства к.г.р. без добавок солей к.о. tпл, оС d, г/см3 3,0 1010 2,11 270 2,75 1,2 2,8 1008 2,09 263 2,60 1,25 2,6 1004 2,07 256 2,45 1,30 χ, см/м ρ , мПа с ΔР, г/ч Таблица 2 - Изменение физико-химических свойств расплавленного криолита с добавками 10масс.% солей при 1000 оС Понижение tпл, оС Изменение плотности, г/см3 Изменение уд.электропроводности, см/м Изменение вязкости, мПа*с Изменение потерь Al на 100г к.г.р., г/ч LiF 80 -0,050 +70 -1,12 0,0 MgF2 59 -0,004 -15 - -0,45 CaF2 25 0,062 -5 +0,13 -0,25 NaCl 44 -0,100 +38 -0,35 +0,10 MgCl2 92 -0,090 -33 -1,25 -0,15 Al2O3 48 -0,070 -70 +0,55 -0,10 Пример. Требуется установить физико-химические свойства криолит~ глиноземного расплава с к.о. = 2,6 при 1000°С, введении в него 4%СаF2, 3%MgF2. В каких пределах изменяются эти свойства в процессе электролиза к.г.р., если содержание AI2O3 ИЗМЕНЯЕТСЯ ОТ 10 до I масс.%. Рассчитываем изменение свойств к.г.р. по заданной концентрации компонентов и данным табл.1,2. Например, при введении в л,г.р. 4 масс.% CaF2 понижение температуры (Δt ) составит: плотности: 0,062 4 10 25∗4 10 = 10°С, изменение = 0,0248 г/см3; изменение электропроводности: -5,0 2см/м; изменение вязкости: 0,13 4 10 алюминия на 100 г расплава: -0,25 4 10 =- = 0,05мПа*с; изменение потерь 4 10 = -0,10 г/ч. Подобные расчеты выполнены для всех добавок, в т.ч. для глинозема. Полученные результаты систематизированы в табл.3. По данным табл.3 и сведениям табл.1 по правилу адитивности устанавливаем свойства рассматриваемых криолит-глиноземных расплавов. Результаты приведены в табл4. Таблица 3- Изменение физико-химических свойств к.г.р. при введении Добавка -Δtпл, оС Δd, г/см3 Δχ, см/м Δρ , мПа с ΔР, г/ч 4% CaF2 10 0,025 -2,0 0,05 -0,10 3% MgF2 17,7 -0,001 -4,5 - -0,14 1% Al2O3 4,8 -0,007 -7,0 0,055 -0,01 10% Al2O3 48 -0,07 -70 0,55 -0,10 Таблица 4 – Физико-химические свойства криолит-глиноземных, расплавов к.г.р. (к.о 2,6) tпл, оС d, г/см3 χ, см/м ρ , мПа с ΔР, г/ч Без добавок 1004 2,07 256 2,45 1,30 4% CaF2 , 3% MgF2 976,3 2,09 250 2,5 1,34 4% CaF2 , 3% MgF2 , 1% Al2O3 971,5 2,08 243 2,56 1,33 4% CaF2 , 3% MgF2 , 10% Al2O3 928,8 2,02 180 3,05 1,24 Т.о., при изменении содержания Al2O3 в рассматриваемом расплаве с 10 до I масс.% температура его плавления повышается с 928,3 до 971,5°С; плотность увеличивается с 2,02 до 2,08 г/см3, удельная электропроводность возрастает со 180 до 243 см/м, вязкость уменьшается с 3,05 до 2,56 мПа*с, а потери алюминия на 100 г расплава возрастут со 1,24 до 1,33 г/ч. ИНДИВИДУАЛЬНЫЕ КОНТРОЛЬНЫЕ ЗАДАНИЯ Рассчитать физико-химические свойства криолит-глиноземных расплавов при 1000°С с определенным криолитовым отношением и содержанием добавок (табл.5). В каких пределах изменяются эти свойства в процессе электролиза, когда содержание глинозема в них изменяется от 6 до 2 масс.% Таблица 5 - Составы криолит-глиноземных расплавов Вариант 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 к.о. 3,0 3,0 3,0 3,0 3,0 2,8 2,8 2,8 2,8 2,8 2,6 2,6 2,6 2,6 2,6 2,6 LiF 1 2 4 1 2 4 1 2 4 - Содержание добавок, масс.% MgF2 CaF2 NaCl 3 3 4 3 3 5 3 6 4 4 4 2 3 3 4 3 3 5 4 6 4 4 4 2 3 3 4 3 3 5 4 6 4 4 4 2 3 3 - MgCl2 4 3.2. Напряжение разложения компонентов криолит-глиноземного расплава, его изменение в процессе электролиза Если известна химическая реакция, протекающая в гальваническом элементе, то, зная термодинамические данные исходных и конечных веществ, можно последовательно найти изменение энтальпия (ΔHpo) и энтропии (ΔSро) реакции для стандартных условии:7 ΔHpo =Σ ΔHконo + Σ ΔHисхo (1) ΔSро = Σ ΔSконo + Σ ΔSисхo (2) изменение энергии Гиббса реакции (ΔGтo): ΔGтo = ΔHpo -Т ·ΔSро (3) и напряжение разложения ( Еот) для чистого компонента ( аi = 1): Еот = ΔGтo/ nF (4) где n - число электронов, участвующих в реакции. Напряжение разложения компонента i в реальных условиях определяется величиной Еот и активностью ai в реальной системе. Ei = Еот + [ 𝑅𝑇 𝑛𝐹 𝑙𝑛𝑎𝑖 ] (5) Для таких компонентов к. г. р., как NaF, LiF, CaF2, MgF2, MgCl2 , активность можно принять мольной доле (Xi): Xi = 𝐶𝑖 𝑀𝑖 1000 − 𝐶𝑖 𝑀к.г.р. 𝐶 + 𝑖 (6) 𝑀𝑖 где Ci - содержание добавки, масc% ; Mi - молекулярный вес добавки; Mк.г.р.- молекулярный вес криолит-глиноземного расплава, равный 210 при к.о.=3,0; 201,5 при к.о.=2,8; 193 при к.о.=2,6 . Величина Xi, а значит, и Ei мало изменяется в процессе электролиза. Активность Al2O3 в насыщенном им расплаве, содержащем 10 масс.% Al2O3 принимается равной 1, что позволяет легко оценить величину напряжения разложения Al2O3 при любом содержании ее в расплаве (CAl2O3 , масс%) по формуле: E Al2O3 = Еот + 𝑅𝑇 𝑛𝐹 ln 10 (7) 𝐶𝐴𝑙2𝑂3 Уравнение (7) позволяет проследить за изменением напряжения разло¬жения глинозема в процессе электролиза. Термодинамические данные для веществ. приведены в табл.б со гласно справочнику В.П.Глушко "Термодинамические свойства индивидуальных веществ". М.: Наука, 1981. Таблица 6 - Термодинамические характеристики веществ при 1300 К Вещество Li (ж) Al (ж) С (тв) F2 (г) Сl2 (г) Na(ж) Na(г) О2 (г) СО (г) СО2 (г) Mg (г) ΔHo, кДж/моль 36,48 45,04 19,59 44,68 45,88 38,69 27,02 42,03 -73,27 -333,62 27,02 S0, Дж/моль·К 77,76 81,96 30,38 254,26 276,38 102,16 184,22 252,77 243,32 283,83 179,15 Вещество LiCl (ж) LiF (ж) NaF (ж) MgF2 (ж) CaF2 (ж) NaCl (ж) MgCl2 (ж) Na3AlF6 (ж) Al2O3 (тв) CF4 (г) Ca (г) ΔHo, кДж/моль -420,5 -537,12 -473,21 -1033,15 -1125,25 -469,69 -503,00 -2874,54 -1537,45 -823,81 24,02 S0, Дж/моль·К 465,41 137,17 160,42 167,58 188,34 183,41 252,99 725,03 213,60 387,46 185,38 Пример. Рассчитаем величины напряжения разложения глинозема на компоненты при 1300 К при содержаниях его в расплаве 10 и 1 масс%. Реакция разложения глинозема на элементы имеет вид: Al2O3 (тв) = 2Al(ж) + 1,5 O2 (г) (8) Согласно табл.6 изменение энтальпии для 2 молей алюминия 90,08 кДж, для 1,5 молей кислорода 63,05 кДж, для моля глинозема -1537,45 кДж. Изменение энтальпии реакции (8) ΔHpo =Σ ΔHконo + Σ ΔHисхo = 90,08+1537,45 = 1690,58 кДж/моль. Энтропия для 2 молей алюминия 163,92 Дж/моль, для 1,5 молей кислорода 379,16 Дж/моль К, для глинозема 213,6 Дж/моль К. Общее изменение энтропии реакции (8) ΔSро = Σ ΔSконo + Σ ΔSисхo =163,92 + 379,16 – 213,6 = 329,48 Дж/моль К. Изменение энергии Гиббса при 1300 К для реакции (8): ΔGтo = ΔHpo -Т ·ΔSро= 1262,26 кДж/моль. Стандартное напряжение разложения Al2O3 находим по уравнению (4): Еот = ΔGтo nF = 1262,3·103 6·96484 = 2,18В Еот отвечает напряжению разложения глинозема при его концентрации в расплаве 10 масс%. При уменьшении концентрации Al2O3 до I масс% величина напряжения разложения в соответствии с уравнением (7) будет равна: Е = Еот + 𝑅𝑇 𝑛𝐹 𝑙𝑛 10 1 = 2,18 + 0,04 = 2,22 В. Т.о., величины напряжения разложения глинозема на элементы при 1300 К при концентрациях его в расплаве 10 и 1 масс% равны 2,18 и 2,22 В. ИНДИВИДУАЛЬНЫЕ КОНТРОЛЬНЫЕ ЗАДАНИЯ Рассчитать величины напряжения разложения при 1230 К компонентов предложенного Вам в задании I электролита по реакциям: 2Al2O3 + 3C = 3CO2 + 4 Al (ж) 4LiF + C = CF4 + 4Li (ж) 2MgF2 + C = CF4 + 2Mg (г) 2CaF2 + C = CF4 + 2Ca (г) 4NaF + C = CF4 + 4Na (г) 2NaCl = 2Na (г) + Cl2 (г) 3.3. Материальный баланс процесса электролиза Материальный баланс работы конкретного электролизера сводится к расчету его суточной производительности, расчету скорости накопления металла, сгорания анода, количества выделившегося на аноде газа, оценке потерь фторсолей с ними. Для расчетов необходимо знать тип (БТ, ВТ, 0А) и производительность (I, токовая нагрузка) электролизера, его рабочие: анодную и катодную плотности тока, катодный выход по току (ηт), состав анодных газов (%СО и СО2), коэффициент осыпаемости анодов К, приблизительно равный 1,2 для БТ, 1,25 для ВТ и 1,05 для 0А, удельный вес жидкого алюминия dAl = 2,3 г/см3 и анодной массы: 1,5 г/см3 для ВТ, 1,6 г/см3 для БТ, 2,0 г/см3 для ОА. Пример. Рассчитать материальный баланс электролизера с верхним токоподводом (ВТ) на 170 кА, работающего с ia = 0,9 А/см2, ik = 0,80 А/см2 с выходом по току 80%, составом анодных газов 60% СО2, 40% СО при коэффициенте осыпаемости анода К = 1,25, удельном весе анодной массы 1,50 г/см3. Суточную производительность электролизера находим по соотношению: P = I·τ·qAl·ηт, где I – токовая нагрузка 170кА, τ – время, ч, (9) qAl – электрохимический эквивалент Al 0,3355 кг/кА·ч, ηт – катодный выход по току. Подставив в уравнение (9) соответствующие значения, получаем значение суточной производительности электролизера по алюминию: P = 170·24 ·0,3355· 0,8 = 1092 кг/сутки Скорость накопления металла на подине электролизера находим по соотношению p = P/S = P·ik/I , где (10) P - суточная производительность электролизера: I - его токовая нагрузка (170 кА); iк - катодная плотность тока (0,8 к/см2) 1092·103 ·0,8 p= 170·103 = 5,14 г/см2·сут Разделив это значение на удельный вес жидкого алюминия (2,3 г/см3), получаем, что за сутки работы рассматриваемого электролизера уровень металла поднимается на 5,14/2,3 = 2,23см, Расход углерода рассчитываем по составу анодных газов и коэффициенту осыпаемости К = 1,25. Для реакции: Электрохимический эквивалент углерода равен: q1 = 𝐴 𝑧1 ·𝐹 = 12 2·26,8 = 0,224 кг/кА·ч Для реакции 2Al2O3 + 3C = 4Al + 3CO2 q2 = 𝐴 𝑧2 ·𝐹 = 12 4·26,8 = 0,112кг/кА·ч? учитывая, что удельный вес этих реакций пропорционален объемному содержанию С0 и СО2, находим суточный расход углерода на электрохимический процесс Pэс= I·τ·ηт(XCO·q1 + XCO2·q2 ) = 170·24·0,80 (0,4·0,224 + 0,6·0,112) = 510 кг. (12) С учетом коэффициента осыпаемости К = 1,25 расход анода составит РС = 510·1,25 = 637 кг, или где 0,637/d = 0,673/1,5 = 0,426 м3, d - удельный вес анодной массы, равный 1,5 т/ м3 . Скорость сгорания найдем, разделив суточный расход анодной масса (0,426 м3) на поверхность анода: HA = PC/SA = PC·ia/I = 0,426·106·0,9/170000 = 2,25 см. Т.о., анод за сутки сгорает на 2,25 см. Расчет, выделившегося в сутки анодного газа ведем исходя из положения, что первичной при электролизе является реакция (12), снижение выхода по току происходит в основном за счет взаимодействия СО2 с Al с образованием С0 и Al2O3 по реакции: 3CO2 + 2Al = Al2O3 + 3СО (13) Реакция (13) приводит лишь к изменению состава анодного газа, но не изменяет его объем. Вес выделившегося CO2 находим по закону Фарадея: PCO2 = I·τ·qCO2, где qCO2 - электрохимический эквивалент СО2 для реакции (12), равный 0,41 г/Ач, кг/кАч ; PСО2 = 170·24·0,41 = 1670 кг. При нормальных условиях такое количество СО2 занимает объем, равный 1670∗103 𝑀𝐶𝑂2 22,4 = 1670∗103 44 22,4 = 850·103 = 0,85·106 л или 850м3 Известно, что парциальное давление паров NaAlF4, над криолитом составляет 0,38 кПа, что составляет 0,38·103/1,013·105 = 3,76·10-3 часть газового потока. Потери NaAlF4 с газом составляют 0,85·106 • 3,76 10-3= 3,20·103 л, что равно 3,20·103 ·МNaAlF4 22,4 =3,20·103·126/22,4 = 18 кг/сут Т.о., в установившемся процессе электролиза с анодными газами уносится в сутки 18 кг NaAlF4. С учетом потерь на гидролиз и пропитку солями элементов конструкции электролиза потери фтор солей более значительны. ИНДИВИДУАЛЬНЫЕ КОНТРОЛЬНЫЕ ЗАДАНИЯ Рассчитать материальный баланс электролизера, а именно, его суточную производительность, скорости накопления металла и сгорания анода, количество выделившегося на аноде газа и потери фтор солей с ними. Таблица 7 - Показатели работы электролизеров Вариант Тип I, эл-за кА Ik, Асм-2 Iа, Асм-2 ηт, % % СО % К СО2 d, гсм3 I. БТ 62,5 0,80 0,90 87 66 34 1,20 1,58 2. БТ 70 0,77 0,85 86 62 38 1,18 1,59 3. БТ 90 0,72 0,80 85 60 40 1,15 1,60 4. ВТ 125 0,75 0,80 87 74 26 1,25 1,51 5. ВТ 140 0.70 0,75 85 70 30 1,20 1,52 6. ВТ 160 0,65 0,70 83 66 34 1,18 1,53 7. ОА 100 0,80 0,85 90 80 20 1,10 2,00 8. ОА 160 0,75 0,80 68 76 24 1,07 2,02 9. ОА 175 0,70 0,75 91 82 18 1,05 2,02 10. ОА 255 0,65 0,70 85 70 30 1,05 2,02 II. БТ 80 0,80 0,85 92 64 16 1,10 1,65 12. БТ 100 0,71 0,60 93 86 14 1,10 1,66 13. ВТ 145 0,70 0,75 91 82 18 1,20 1,55 14. ОА. 175 0,65 0,70 94 ЬЬ 12 1,04 2,10 15. ОА 280 0,60 0,65 93 86 14 1,04 2,10 3.4. Электрические балансы алюминиевых электролизеров Электрический баланс электролизера сводится к расчету составляющих среднего напряжения на электролизере, к оценке изменения их в процессе электролиза. Уравнение электрического баланса имеет вид: Uср = E + ΔUэл + ΔUА + ΔUК + ΔUа.э. + ΔUош + ΔUс где Е - ЭДС поляризации, ΔUэл - падение напряжения в электролите, ΔUА - падение напряжения в аноде , ΔUК - падение напряжения в катоде, ΔUа.э - падение напряжения от анодных эффектов . ΔUош - падение напряжения в ошиновке на электролизере, ΔUс - падение напряжения в серии. ЭДС поляризации представляет собой сумму напряжения разложения глинозема с образованием жидкого алюминия и СО2 (1,13 В) и анодной поляризации при анодной плотности тока 0,9 А/см2: Е = 1,13 + 0,37ia = 1,462 В. При постоянстве величины анодной плотности тока ЭДС поляризации не изменяется в процессе электролиза. Также в первом приближении можно принять постоянными при электролизе величины падения напряжения в катоде, в ошиновке на электролизере и в серии. Значения этих величин для различных типов электролизеров приведены в табл.8 по данным Ветюкова М.М. Таблица 8 - Постоянные составляющие Uср электролизеров разного типа Составляющая ΔUК ΔUош ΔUс БТ 0,398 0,380 0,030 Падение напряжения, В ВТ 0,327 0,382 0,045 ОА 0,350 0,380 0,022 Переменным составляющими среднего напряжения на электролизере является падения напряжения в аноде, электролите, а также от анодных эффектов. Переменная величина падения напряжения в аноде обусловлена постоянным расходованием ("сгоранием") анода, периодической перестановкой штырей для самообжигающихся анодов и периодической заменой огарков на новые оболганные аноды. Для оценки величины ΔUА надо знать максимальное, минимальное и среднее расстояние от подошвы анода до металлических анодных штырей (штанг) (табл.9). Таблица 9 - Расстояние от подошвы анода до металлических штырей (штанг) Расстояние см БТ ВТ ОА Минимальное 10 20 10 Максимальное 30 40 50 Среднее 20 30 30 Ua, среднее, В 0,469 0,562 0,390 0,703 0,750 0,130 (Ветюков и др.) Ua, макс, В Ua, мин, В 0,234 0,374 0,650 ΔU, В 0,469 0,376 0,520 Значения максимального и минимального падения напряжения в аноде рассчитываем по уравнениям: Ua, макс = Ua, ср ·lмакс/lср, Ua, мин = Ua, ср ·lмин/lср, Т.о., в процессе электролиза за счет периодического переключения штырей и непрерывного сгорания анода падение напряжения в нем изменяется для электролизеров БТ - на 0,469 В, для ВТ - на 0,376 В, для ОА на 0,520 В. Переменная составляющая падения напряжения в электролите обусловлена изменением удельного сопротивления электролита по мере изменения в нем концентрации глинозема, а также в результате изменения межэлектродного расстояния ( l ): Uэл = i · l/χ, где i = (ia + ik)/2 , χ - удельная электропроводность электролита (берется по результатам решения задачи 3.1) ia , ik - берутся из условий задачи 3.3. Исходные данные и результаты расчета падения напряжения в электролите приведены в табл.10. Таблица 10 - Падение напряжения в электролите при I = 0,85 А/см2 Состав электролита к.о. %Al2O3 χ, см/м 4% CaF2 + 3% MgF2 4% CaF2 + 3% MgF2 Среднее 2,6 2,6 10 1 180 243 Uэл, при l 4 cм 5см 1,88 2,36 1,40 1,75 1,64 2,05 За счет изменения концентрации глинозема в к.г.р. от I до 10% и увеличения межэлектродного расстояния с 4 до 5 см падение напряжения в рассматриваемом электролите увеличится с 1,40 В до 2,36 В. Падение напряжения от анодных эффектов рассчитывается по формуле ΔUа.э = Uа.э·n·τср/(24·60), где Uа.э - напряжение при анодном эффекте, n - число анодных Эффектов в сутки, τср - их средняя продолжительность, мин. Пусть Uа.э = 40В, а их продолжительность изменяется от О до 4 мин на различных электролизерах. Тогда максимальная величина ΔUа.э = 404/(24·60) = 0,11В. Таким образом, переменная составляющая в рассматриваемых условиях при l = 4 см составит для БТ = 0,469 + 0,48 + 0,11 = 1,059 В (21 уставка); ВТ = 0,376 + 0,48 + 0,11 = 0,966 В (20 уставок); 0А = 0,520 + 0,48 + 0,11 = 1,11 В (23 уставки). Среднее напряжение на рассматриваемых электролизерах приведено в табл.11. Таблица 11 – среднее напряжение Составляющие Uср Е Ошиновка электролизера Анод Электролит, 5см Катод ЭДС поляризации Ошиновка ΔUа.э ΔUср Uср Uр БТ 1,46 0,380 0,703-0,234 1,75-2,36 0,398 1,462 0,030 0-0,11 4,25-5,44 4,85 4,44 ВТ 1,46 0,382 0,750-0,374 1,75-2,36 0,327 1,462 0,045 0-0,11 4,34-5,44 4,89 4,463 ОА 1,46 0,380 0,650-0,130 1,75-2,36 0,350 1,462 0,022 0-0,11 4,09-5,33 4,71 4,308 Видно, что среднее напряжение на электролизерах разного типа изменяется во времени в широких пределах, что необходимо учитывать при автоматическом регулировании, предусматривая необходимое количество установок. В расчетах энергетического баланса используется величина Uср и Uр падение напряжения в электролизере, равное Uср – Uош – Uа.э. ИНДИВИДУАЛЬНОЕ КОНТРОЛЬНОЕ ЗАДАНИЕ Выполнить электрический баланс электролизера, данного Вам в задании 3.3 с учетом сведений задач 3.1 и 3.4. 3.5. Энергетический баланс электролизера Энергетический баланс электролизера выражает равенство прихода и расхода энергии в электролизере в единицу времени. Единственным источником энергии является электрический ток, проходящий через электролизер. Приход энергии рассчитывается по формуле: Qпр = 3,6 ·I·Uр Для БТ задачи 3.4 Qпр = 3,6· 170000·4,44 = 2720·103 кДж.ч-1 . Расход энергии связан с реакциями, протекающими в электролизере (Qр ), с потерями тепла в окружающее пространство, уносимыми извлекаемым из электролизеров алюминием (QAl), анодными газами (Qа.г.), c тепловыми потерями с поверхностей электролизера за счет конвекции и лучеиспускания (Qт.п.). Расход энергии на разложение глинозема находится по уравнению Qр = 3,6 · I·Е = 3,6·170000·1,462 = 895000 кДж.ч-1. Потери тепла с извлекаемым из электролизера алюминием составляют: QAl = РAl·ΔНAl, 1230K РAl - количество молей Al, выливаемых из электролизера в ч. В рассматриваемом электролизере на 170 кА РAl = 1092∗103 24∗27 = 1,68·103 мол/ч , ΔНAl, 1230K = 42,8 кДж ·моль-1 . Получаем QAl = 1,68·103·42,8 = 72·103 кДж/ч , Потери тепла с анодными газами, содержащими 60% СО2 и 40% СО, рассчитываем следующим образом. Исходим из общего количества первичного СО2, равного 1670 кг/сут или 850 м3/ сут, что соответствует 850·103 /22,4 = 37,9 ·103 молей газа, из них 60% - 22,8·103 моля С02, 40% 15,2 ·103 моля СО. Зная часовые количества удаляющихся СО2 (0,95·103,моль/ч) и СО (0,633·103 моль/ч/ и изменение ΔHCО =55,5 кДжмоль-1 и ΔНСО2, 1230K = 38,1 кДж·моль -1 рассчитаем количество тепла, уносимого газами: QСО2 = РСО2 · ΔНСО2 = 0,95·103 ·55,5 = 52,1·103 кДж/ч , QСО = РСО · ΔНСО = 0,633·103 ·38,1 = 24,1·103 кДж/ч . Потери тепла конвекцией и лучеиспусканием находятся суммированием потерь тепла с различных поверхностей (днище, торец, продольная стенка верх анода и т.д.), рассчитываемых по формуле Qi = F(tп – tв)αк.л., где Qi - тепловые потери с i -поверхности, кДж/ч ; F - величина поверхности, м2, tп , tв - температура поверхности и окружающего воздуха, °С , αк.л - суммарный коэффициент теплоотдачи конвекцией и излучением, кДж/м2 град. Величины αк.л (табл. 12) зависят от расположения поверхности (горизонтальная, вертикальная), вида материала (сталь, бетон) и т.д., температуры поверхности: (tп) и охлаждающего воздуха (tв). Таблица 12 - Коэффициенты теплоотдачи конвекцией и лучеиспусканием tв , оС Поверхности . tп,°С αк.л,кДж/м2град.ч Горизонт, пов. анода _ 220-420 0-40 75,36 +0,26(tп- 220) Горизонт, пов-м 100-300 0-40 57,78 +0,22(tп- 100) Горизонт, пов. стальные 60-300 0-40 46,89 +0,20 (tп- 60) Верт.пов.анода, эакр. 220-420 0-40 67,83 +0,24(tп- 220) Верт. по в. стальные 100-260 0-60 47,72 +0,20(tп- 100) Алюминиевая шина анода 120-320 0-60 46,05 +0,13(tп- 120) Расчет теплопотерь - кропотливая и сложная работа. Мы найдем Qт.п. по разности Qпр – Qр – QAl – Qа.г. Qт.п= 2720·103 - 895·103 - 72 ·103 - 52,1·103 - 24,1·103 = 1676,8·103 кДж/ч. На основании приведенных расчетов составляем энергетический баланс электролизера на 170 кА. Приход: Электрической энергии Итого: 2720000 кДж·ч-1 (100%) 2720000 кДж·ч-1 (100%) Расход: На разложение глинозема С вылитым алюминием С анодным газом Потери конвекцией Итого: 895000 кДж·ч-1 (100%) 72000 кДж·ч-1 (100%) 76200 кДж·ч-1 (100%) 1676800 кДж·ч-1 (100%) 2720000 кДж·ч-1 (100%) В энергетических расчетах допускается невязка баланса 3-5%. Видно, что КПД электролизера 32,9%, в основном он работаем как тепловой агрегат. Индивидуальное контрольное задание предполагает проведение расчетов энергетического баланса для Вашего электролизера (задания 3.3; 3.4) .