Рудничный (болотный газ) – без цвета, без запаха
advertisement

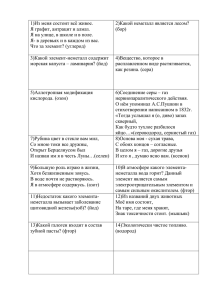
Рудничный (болотный газ) – без цвета, без запаха Ядовитый бесцветный газ с неприятным запахом плесени Mg2Si + 4H+ → 2Mg2+ + SiH4↑ SiH4+2Н2O=SiO2+4Н2 SiH4(г) + 2O2 → SiO2 + 2H2O −1357 кДж Применяют в различных реакциях органического синтеза (получение ценных кремнийорганическ их полимеров и др.), как источник чистого кремния для микроэлектронной промышленности. Аммиак — бесцветный ядовитый газ с характерным удушливым запахом Применение Большое количество аммиака расходуется для получения азотной кислоты, азотосодержащих солей, мочевины, соды.На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильном деле. Жидкий аммиак и его водные растворы используют как жидкие азотные удобрения. 4NH3+302=6Н2О+2N2 + Q Фосфин -бесцветный, очень ядовитый, Применяется довольно неустойчивый газ со специфическим при обеззараживании запахом гнилой рыбы; зернохранилищ защите от клещей и других вредителей при транспортировке особенно зерновых культур. 2PH3 + 4Oурожая, 2 P2O5 + 3H2O - против крыс и мышей в амбарах. В Австралии -в или борьбе с чрезмерно быстро размножающимися PH3 + 2O2 H3PO4 кроликами. ряд гербицидов и инсектицидов содержат фосфорорганические соединения на основе фосфина и PH 3 + HBr = PH4Br – бромид фосфония его производных. в последнее время с ним все чаще приходится иметь дело в связи с широкомасштабным уничтожением PH + 8HNO → 8NO ↑ + H PO + 4H O 3 3(к) 2 3 4 2 химического оружия, предусматривающим обезвреживание отравляющих фосфорорганических Ca 3Ca(OH) + 2PH3↑ 3P2 + 6H 2O = и соединений зарина зомана —2производных фосфина. Mg3P2 + 6HCl = 3MgCl2 + 2PH3↑ Сероводоро́д — бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает металл. Взрывчатая смесь с воздухом 4,5 — 45 %. На воздухе горит синим пламенем: 2H2S + ЗО2 = 2Н2О + 2SO2 при недостатке кислорода : 2H2S + O2 = 2S + 2H2O (на этой реакции основан промышленный способ получения серы). 3H2S + 4HClO3 = 3H2SO4 + 4HCl 2H2S + SO2 = 2Н2О + 3S H2S + I2 = 2HI + S Сероводород из-за своей токсичности находит ограниченное применение: В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод. Сероводород применяют для получения серной кислоты, элементной серы, сульфидов. В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья Хло́роводоро́д (HCl) — бесцветный, термически устойчивый газ с резким запахом, дымящий во влажном воздухе, легко растворяется в воде При нагревании 4HCl + O2 → 2H2O +2Cl2 ↑ R-CH=CH2 + HCl → R-CHCl-CH3 R-C≡CH+2HCl → R-CCl2-CH3 Получение в промышленности H2 + Cl2 ⇌ 2HCl