2. Интермедиаты органических реакций
advertisement
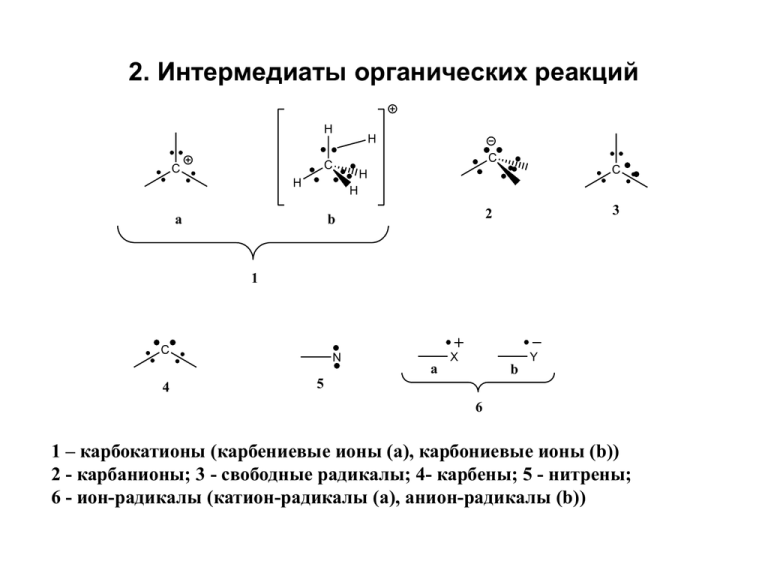
2. Интермедиаты органических реакций H H C C C H C H H a 3 2 b 1 C 4 N X Y a b 5 6 1 – карбокатионы (карбениевые ионы (а), карбониевые ионы (b)) 2 - карбанионы; 3 - свободные радикалы; 4- карбены; 5 - нитрены; 6 - ион-радикалы (катион-радикалы (a), анион-радикалы (b)) Карбокатионы 1. Методы генерирования а) Гетеролитическое расщепление (гетеролиз) связей C-X K1 C X C + C XH X или лучше H+ C X K2 C XH C + XH X = O, N, S, Hal т.е. атомы и группы более электроотрицательные, чем углерод б) Присоединение катионов Y+ к кратным связям Y C Z + Y+ C Z Примеры: C H C H CH2 C H O C N CH2 + H+ H C CH3 H C OH C + R3C H C NH H2 C CR3 в) Протонирование алканов суперкислотами и реакции с кислотами Льиса FSO3H + SbF5 → H[SbF5(SO3F)] и H[SbF2(SO3F)4] FSO3H + SbF5 + SO3 → H[SbF4(SO3F)2] и H[SbF3(SO3F)3] или H[(SbF5)2(SO3F)] Суперкислоты, магические кислоты, кислоты Ола (George Olah, 60-70 г.г.) CH5+ - метаноний катион (трехцентровая двухэлектронная связь) Зафиксирован в масс-спектрах R H + SbF5 R+ SbF5H- г) Неклассические (мостиковые) карбокатионы Положительный заряд делокализуется с участием двойных связей, положение которых отлично от аллильного, или с участием С-Н и С-С s-связей 7-норборненил катион X -X: -X: X SbF5-SO2 -78oC CH2CH2Cl 3 фенониевый ион (зафиксирован ЯМР) SO2ClF R H3C 51.5 F o -80 C R+ 1 5 335.2 ppm 320.6 C 2 4 H H H3C C CH3 47.5 ppm 13.5 ppm NMR 13C, ppm H3C CH3 5.06 4.35 ppm Г.А.Ола Успехи химии, 1975, 44, 793 -90oC 6 -135oC C6 52.2 C2,4 136.9 C3 178.1 C1,5 186.6 J.Am.Chem.Soc. 1979,101,1351 1980,102,7396 -145.9 H Карбанионы R R R C R B H + C BH + R R CH кислоты R = электроноакцеторы Синтетическими эквивалентами карбанионов служат металлорганические соединения - + R M OR'2 R Mg X X R Mg Mg X R OR'2 Порядок устойчивости: фенил > винил > циклопропил > метил > этил > изопропил Типичные условия образования и превращений – основные и сильно полярные среды Свободные радикалы . Порядок увеличения стабильности: первичный < вторичный < третичный CPh2 Ph3C 2 Ph3C H O2N O C NO2 Ph Ph2N N . N N NO2 Дифенилпикрилгидразил . O Нитроксильный радикал Карбены и нитрены синглет C триплет C CHCl3 CH2=N=N R OSO2Ar N B + R N H R N=N=N R N Перегруппировка амидов по Гофману + N2 + BH + ArSO3- Реакции нитренов O O + R R'3C-H внедрение по С-Н связи R NHCR'3 N O COR N + R R'2C CR'2 присоединение N H C R N R перегруппировка CH=NH H R 2 Ar N N + R H Ar R N NH N Ar + R отрыв протона димеризация Реакции образования ион-радикалов Перенос электрона и образование ион-радикалов могут происходить и при электролизе NR2 NR2 -e +e N N Стабильные ион-радикалы семихинон кетилы N NC NC CN NC CN NC C C C C C C C CN NC CN NC CN Донорно-акцепторные взаимодействия. Комплексы с переносом заряда (электроно-донорноакцеторные комплексы ЭДА, молекулярные комплексы) OH NMe2 NC CN O2N NO2 ArH HetH CN NMe2 пикраты NO2 NO2 NO2 p-комплекс + ? H s-комплекс Причины образования молекулярных комплексов D + A D A + A D EDA complexes A D R' R Cl2, Br2, I2, ICl R2O, R3N, R2C=O Ag+, Ni+, Cr(CO)3, Fe(CO)3 R'= NO2, CN R = Alk, OR, NR2, SR Схема переноса электрона от донора к акцептору HOMO (ВЗМО) LUMO (НСМО) p-donor A HOMO (ВЗМО) n-donor D A Донорные свойства молекул определяются «Потенциалом ионизации» (ПИ) – энергия необходимая для отрыва электрона с ВЗМО. Измеряется в эВ с помощью масс-спектрометрии или фотоэлектронной спектроскопии. • Значения первых потенциалов ионизации некоторых орг. ве-в , эВ CH4 12.70 C 2H 4 11.52 C 2H 2 11.40 C6H 6 9.25 C6H5OH 8.50 C6H6NH2 7.69 Нафталин 8.2 C6H5NO2 ? C6H5NO2 9.92 Сродство к электрону Способность атомов, молекул, ионов, свободных радикалов присоединять электрон, превращаясь в анионы или анион-радикалы . Электрон заполняет НВМО, и сродство к электрону является мерой свободной энергии НВМО R + e R. Процесс переноса электрона может идти как с выделением (-E), так и поглощением энергии (+E) (измеряют в эВ). В отличие от потенциалов ионизации данных по СЭ не так много, особенно для органических молекул Атом (молекула) E, эВ H. + e H- 0.75 F. + e F- 3.6 SO2 + e SO2.- 1.1 нафталин + e нафталин.- 0.65