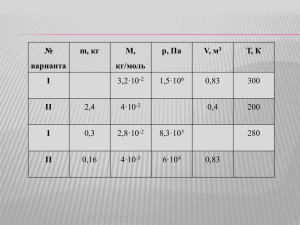
Лабораторная работа ”Изучение газовых законов” Таблица№1 ”Газовые законы” Изотермический
advertisement
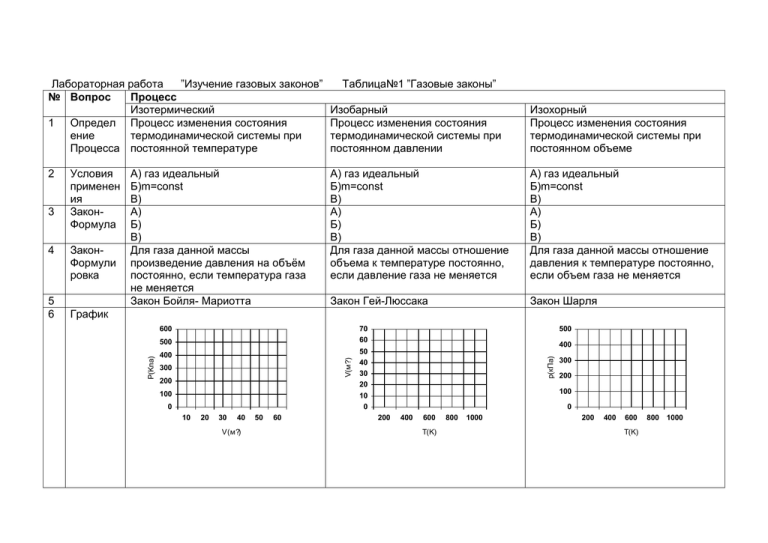
Лабораторная работа ”Изучение газовых законов” № Вопрос Процесс Изотермический 1 Определ Процесс изменения состояния ение термодинамической системы при Процесса постоянной температуре 5 6 ЗаконФормули ровка Изохорный Процесс изменения состояния термодинамической системы при постоянном объеме А) газ идеальный Б)m=const В) А) Б) В) Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется А) газ идеальный Б)m=const В) А) Б) В) Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется Закон Гей-Люссака Закон Шарля График 600 70 60 500 400 300 200 100 500 400 50 40 30 20 p(кПа) 4 А) газ идеальный Б)m=const В) А) Б) В) Для газа данной массы произведение давления на объём постоянно, если температура газа не меняется Закон Бойля- Мариотта Изобарный Процесс изменения состояния термодинамической системы при постоянном давлении V(м?) 3 Условия применен ия ЗаконФормула P(Kпа) 2 Таблица№1 ”Газовые законы” 10 20 30 40 V(м?) 50 60 200 100 10 0 0 300 0 200 400 600 T(K) 800 1000 200 400 600 T(K) 800 1000 Что показыва ет график 7 8 Тип зависимо сти Вид графика Название Положен ие аналогич ных линий Другие сведения Пример проявлен ия Изотерма А) Сжатие воздуха компрессором; Б) расширение газа под поршнем насоса при откачивании газа из сосуда. Изобара Изохора При Т→Таб.нуля , изобары сходятся к точке О, но это не означает, что объём газа обращается в О; газ превращается в жидкость, в которой закон для идеального газа не применим. Расширение газа в цилиндре с подвижным поршнем при нагревании цилиндра. Все изохоры начинаются в точке Т=О, это означает: при абсолютном нуле температуры(Т=О), давление газа равно О (Р=О) Нагревание газа в любой закрытой емкости, например в электрической лампочке при её включении. Работа выполнил:Фамилия________________________________________Класс_______Дата Работа проверена Оценка_____________ Таблица №2 Система координат Процесс P-V 600 70 60 400 V(м?) P(Kпа) 500 300 200 100 500 400 50 40 30 20 10 20 30 40 50 60 400 800 1000 200 300 200 100 40 V(м?) 50 60 800 1000 400 50 40 30 20 300 200 100 10 0 0 600 500 p(кПа) V(м?) 400 30 400 T(K) 70 60 500 P(Kпа) 600 T(K) 600 20 200 0 200 V(м?) 10 300 100 10 0 0 Изобарный p=const V-T p(кПа) Изотермический T=const P-T 0 200 400 600 T(K) 800 1000 200 400 600 T(K) 800 1000 600 70 60 400 V(м?) P(Kпа) 500 300 200 100 500 400 50 40 30 20 p(кПа) Изохорный V=const 10 20 30 40 V(м?) 50 60 200 100 10 0 0 300 0 200 400 600 800 1000 T(K) Вывод Работа выполнил:Фамилия________________________________________Класс_______Дата Работа проверена Оценка______________ 200 400 600 T(K) 800 1000