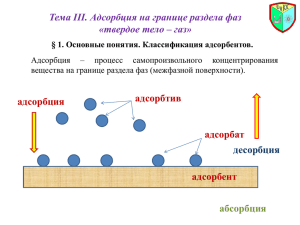
Адсорбция и определение характеристик поверхности
advertisement

Адсорбция и определение
характеристик поверхности
твердых тел
Л. Д. Аснин
ЛИТЕРАТУРА
Грег С., Синг К.
Адсорбция, удельная поверхность, пористость. 1984
Rouquerol F., Rouquerol J., Sing K.
Adsorption by powders and porous solids. 1999
Брунауэр С. Адсорбция газов и паров. 1948
d i di 0
i
– поверхностное натяжение
– химический потенциал
Г – избыточная адсорбция на 1 м2 поверхности
Избыточная адсорбция
Реальная
система
C0
V с0,i ci
m
s
s
уд
C
Система
сравнени
iя
0
Sуд – удельная поверхность
ms – масса адсорбента
поверхность
адсорбента
поверхность
адсорбента
Г
поверхность
адсорбента
Объёмная фаза
Абсолютное содержание в слое конечной толщины
C0
Va C0
q
S
Адсорбционный
слой
поверхность
адсорбента
V0 – объём ад.слоя
S – площадь поверхности
Г – экспериментально определяемая величина
q – модельная величина
qГ
Адсорбция
q = Г(С0) + С0
Г
Концентрация в объёмной фазе
Изотерма Лэнгмюра
Модель монослойной локализованной адсорбции на
гомогенной поверхности в отсутствие латеральных
взаимодействий
A(г) + S(тв) AS(тв)
qmbp
q
1 bp
qm - предельная адсорбция
b – адсорбционный коэффициент
Адсорбция СН4 на слюде при 90К
(I. Langmuir, 1918)
qm = 110 мм3
110 0.11 p
q
1 0.11 p
Тестирование лэнгмюровской модели
Линеаризованное
уравнение
Координаты
p
1
p
q qmb qm
(p/q) vs. p
q
bqm bq
p
(q/p) vs. q
b
p1
/p(1 - ) vs.
q
qm
(p/q) vs. p
(q/p) vs. q
График Скэтчарда
R2=0.9991
График Баррэра
/p(1 - ) vs.
Изотермы адсорбции по классификации ИЮПАК
Допущения модели Лэнгмюра
1. Локализованная адсорбция
2. Гомогенная поверхность
3. Монослойное заполнение
1. Локализованная адсорбция
Молекула теряет: 3 степени свободы поступательного движения
Сохраняет: степени свободы вращения + внутренние
Приобретает: 1 степень свободы колебательного движения
поверхности;
Конфигурационную энтропию –Rln{/(1- )}
Энтропия
адсорбции
S Sv S3D R ln
1
Не зависит от
D.H. Everett, Trans. Faraday Soc. 1950, 46, 943
2. Гомогенная ли поверхность?
Типы поверхностных центров -Al2O3
Г.Д. Чукин, Ю.А. Селезнёв , Кинетика и катализ, 1989, 30, 69
Адсорбция на дискретно гетерогенной поверхности
Допуская, что на поверхности сосуществуют i
адсорбционных центров, которые взаимодействуют с
адсорбтивом независимо и адсорбция на каждом из этих
центров подчиняется закону Лэнгмюра получим
qm ,ibi p
q
i 1 bi p
qm ,i – предельная адсорбция на центрах типа i
bi – адсорбционный коэффициент для центров
типа i
Модель би-Лэнгмюра
qm, I bI C qm, II bII C
q
1 bI C 1 bII C
Адсорбция энантиомеров
N-бензоил-аланина на бычьем сывороточном альбумине
Изотермы адсорбции
1 – L-изомер
2 – D-изомер
Диаграмма Скетчарда
Непрерывно гетерогенная поверхность
qm ,ibi p
q
i 1 bi p
Пусть i
и bi+1 – bi = db = const
Разности db соответствует разность dqm = Qi+1 - Qi,
где Qi – кумулятивная концентрация адсорбционных
центров для всех b (bmin; bi).
dqm
Введём функцию f ln b
d(lnb)
такую что
bi
b
i 1
f (ln b)d ln b qm,i
Непрерывно гетерогенная поверхность
qm ,ibi p
q
i 1 bi p
dqm
f ln b
d(lnb)
q p
bmax
bmin
bp
f (ln b)
dln b
1 bp
q p
bmax
f (ln b)(b,p)dln b
bmin
Пример: Изотерма Ленгмюра-Фрейндлиха
p
q
1 b p
n
LF
n
qm f ln b d (ln b)
Распределение адсорбционных
центров по энергиям
f(lnb)
qm b
LF
bLF
bLF – абсцисса максимума ФР
lnb
Пример: Изотерма Ленгмюра-Фрейндлиха
I. Langmuir (1918) Адсорбция СН4 на слюде
при 90К
p
q
1 b p
qm b
LF
n
LF
n
Аппроксимация уравнением
Ленгмюра-Фрейндлиха
Ленгмюр
qm 110
b 0.115
ЛэнгмюрФрейндлих
119
0.093
3. Монослойное ли заполнение?
Carrot et al., Carbon, 1987, 25, 59
Адсорбция азота на
графитированных
термических сажах при
77К
Модель полимолекулярной адсорбций
Брунауера-Эммета-Теллера
qmCpr
q
1 pr 1 pr Cpr
p
pr
po
E1 EL
С exp
RT
po – давление насыщенного пара
E1 – энергия адсорбции в 1-ом слое
EL – энергия конденсации
Свойства изотермы БЭТ
q
5
4
В точке В заканчивается
3
формирование
монослоя
qB qm
2
B
1
0
0
0.2
0.4
0.6
p/p0
0.8
1
Ёмкость монослоя
По определению qm – концентрация адсорбционных
центров на поверхности
По факту qm – концентрация молекул адсорбата на
поверхности
Зависит
от формы молекул адсорбата
структуры поверхности и взаимодействий
адсорбент-адсорбат (эпитаксия)
взаимодействий адсорбат-адсорбат
Ёмкость монослоя
J. Feder,
J. Theor. Biol., 1980, 87, 237
Распределение твердых
дисков в модели случайной
последовательной
адсорбции
= 0.54
Ёмкость монослоя qm (q*)
X. Jin et al. J. Phys. Chem., 1993, 97, 4256
Покрытие гомогенной
поверхности твёрдыми
сферами в модели
случайной последовательной адсорбции со
случайным распределением активных центров на
поверхности
= 0.33
Связь ёмкости монослоя с площадью поверхности
Sуд = qmNA
NA – число Авогадро
- площадь молекулы
Площадь поперечного сечения молекул
(нм2)
Адсорбтив
Т(К) Литературные
данные
Азот
Аргон
Кислород
CO2
бензол
77
77
77
195
293
0.13 – 0.20
0.10 – 0.19
0.13 – 0.20
0.14 – 0.22
0.25 – 0.51
Теор.
расчёт
Рекомендуемая
величина
0.162
0.138
0.141
0.163
0.307
0.162
0.138
0.141
0.210
0.430
F. Rouquerol et al. Adsorption by powders and porous solids. 1999
Ориентация больших молекул на поверхности
Параллельно
поверхности
0.70 нм
ПОВЕРХНОСТЬ
Перпендикулярно
поверхности
0.59 нм
ПОВЕРХНОСТЬ
Реалии применения изотермы БЭТ
Линейная форма уравнения БЭТ
p p0
1
C 1
p p0
q(1 p p0 ) qmC qmC
Линеаризация экспериментальных данных в координатах
БЭТ обычно достигается на участке р/р0 от 0.05 до 0.30,
хотя известны многочисленные случаи более узких
линейных участков
Реалии применения изотермы БЭТ
Грег, Синг, Адсорбция, удельная
поверхность, пористость
q/qm
Адсорбция N2 на непористых
SiO2 и Al2O3 при 77 К
Теоретическая
изотерма БЭТ
для C = 200-300
○ SiO2
● Al2O3
p/p0
Допущения модели БЭТ
1. Область действия адсорбционных сил не
простирается далее первого слоя
2. Отсутствие латеральных взаимодействий
3. Адсорбция на однородной поверхности
4. Адсорбат распределён на поверхности адсорбента в
виде 2D плёнки
2D плёнка
Конденсированная
фаза
Поры < 2 нм – микропоры
2 – 50 нм – мезопоры
> 50 нм - макропоры
Размер пор и структура адсорбционного слоя
Размер пор
N2, 77K
Микропоры (<2 нм) неадекватные значения
Sуд (БЭТ)
Мезопоры заполняются объёмно при р/ро > 0.4
не влияют на точность оценки Sуд (БЭТ)
F. Rouquerol et al. Adsorption by powders and porous solids. 1999
Эмпирические методы анализа адсорбционных
данных для определения удельной поверхности
t-метод (Lippens & de Boer, 1965)
Допущение: Толщина адсорбционного слоя (t) зависит от
давления, но не от природы адсорбционной системы
Сравнивая величину t на анализируемом образце и
эталонном материале при одинаковом pr можно
определить Sуд образца
Эффективная толщина монослоя
q
t
d
qm
M
d
N A ж
Эффективная толщина монослоя
r
Алгоритм применения t-метода
1. Строится эталонная t-кривая (t – p/po) для образца с
известной удельной поверхностью
2. По этой кривой вычисляются значения t для
анализируемого образца и строится график q = f(t)
3. Линейный участок этого графика экстраполируется на
начало координат. Уд. поверхность рассчитывается из
наклона slopet этой линии
Mr
S уд
slopet
t-кривые адсорбции азота при 77К на образцах
байерита, прокаленных при различных температурах
(de Boer et al. J. Coll. Interface Sci. 1966, 21, 405)
Микропористые образцы
Мезопористый образец
αs-метод (Sing, 1968)
Для построения эталонной кривой вместо величины
(q/qm) используют αs =(q/q0.4),
где q0.4 есть q при р/ро = 0.4
S уд ref
S уд test
slopeS
q0.4 ref
F. Rouquerol et al. (1999)
Непористый
Мезопористый
Микропористый
Изотерма адсорбции
αs-график
q мм3 stp/мг
Непористый
силикагель
Мезопористый
силикагель
р/р0
αs
Bhambhani et al. J. Coll. Interface Sci. 1972, 38, 109
αs-метод и микропористость
Изотермы адсорбции азота (77К) и соответствующие
αS-графики на углеволокне XR602
до и после обработки нонаном
Предадсорбция Sуд(БЭТ)
нонана
м2/г
До
695
315
До После
После
P.J.M. Carrot et al. Carbon 1987, 25, 59
Sуд(αs)
м2/г
319
До 319
После
Выводы:
Метод БЭТ даёт адекватный результаты для макро- и
мезо-пористых адсорбентов,
но НЕ для микропористых
Правильность метода БЭТ ± 20%
Метод БЭТ не даёт информации об объёме пор
Объёмное заполнение
микропор
Классическая ТОЗМ Дубинина
Основана на потенциальной теории Поляни (1914)
В микропорах (< 2 нм) адсорбционные поля
противоположных стенок пор перекрываются, создавая
квазиизотропное адсорбционное поле, обуславливающее
сжатие адсорбата до жидкоподобного состояния
Адсорбция в микропорах осуществляется по механизму
объёмного заполнения. Т.е. весь объём поры заполняется
адсорбатом при достижении определенного значения р/ро
Чем меньше объём поры, тем при меньшем p она будет
заполняться. Предельная величина адсорбции
соответствует p = po (конденсация на плоской поверхности)
Классическая ТОЗМ Дубинина
Движущей силой процесса является выигрыш в
свободной энергии адсорбции -G = A = RT ln(p0/p)
Характеристикой полноты процесса является
объём заполненных микропор W = q/ρад,
а характеристикой ёмкости адсорбента выступает
предельный адсорбционный объём W0
Плотность адсорбата в микропорах часто принимают
равной плотности жидкости при температуре
адсорбции
Изотерма адсорбции Дубинина-Астахова
Дубинина-Радушкевича
(Гауссово распределение
(Распределение
пор по размерам
пор по размерам)
Вейбула)
A n2
W W0 exp
E0
E0 – характеристическая энергия адсорбции для
стандартного вещества (у Дубинина – бензол)
β – коэффициент подобия, учитывающий различия
между данным веществом и стандартом
Уравнение ДР линеаризуется в координатах
lnW – ln2(p0/p)
Адсорбция N2 на микропористых углях при 77К
P.J.M. Carrot et al. Carbon 1987, 25, 59
p/p0
AX21
JF517
lnW
W, мм3 stp
AX21
JF517
CARBOSIEVE
JF005
ln2(p/p0)
p/p0
Адсорбция N2 на угольных сажах при 77К
P.J.M. Carrot et al. Carbon 1987, 25, 59
N2, 77K
Неграфитированная сажа
N2, 77K
Графитированная сажа
Адсорбция бензола на графитированных сажах при 298К
P.J.M. Carrott et al.,
Carbon, 2000, 38, 465
Линейный участок p/p0
между 0.02 и 0.15
Промежуточные выводы
Линейность нарушается с двух сторон
Область высоких
относительных
давлений
Послойная адсорбция в более
крупных порах и на внешней
поверхности
Область низких
относительных
давлений
Дифференциация микропор
по механизму заполнения
Механизм заполнения микропор зависит от соотношения
диаметра молекулы адсорбата () и размера пор (d)
Первичное заполнение: 1 < d < 3
Сразу заполняется весь объём поры с образованием
термодинамически жидкоподобного состояния
Вторичное заполнение: 3 < d < 5
При малых p образуется мономолекулярная плёнка на
стенках пор. При повышении p происходит объёмное
заполнение с участием кооперативных взаимодействий
По отношению к механизму заполнения постоянных
газов микропоры подразделяют на ультрамикропоры
и супермикропоры
УЛЬТРАМИКРОПОРЫ
d < 1.5 нм
Первичное заполнение
СУПЕРМИКРОПОРЫ
1.5 нм < d < 2.0 нм
Вторичное заполнение
Связь механизма заполнения и размера пор для
молекулы азота = 0.31 нм
F. Rouquerol et al. Adsorption by powders and porous solids. 1999
Форма молекулы и форма поры
Крупные молекулы не обладают сферической симметрией
C.E. Webster et al. J. Phys. Chem. B 1999, 103, 1242
C.E. Webster et al. J. Phys. Chem. B 1999, 103, 1242
Форма молекулы
Щелевая пора
Критический размер MIN-1
Цилиндрическая пора
Критические размеры MIN-1 и MIN-2
Влияние формы поры на плотность упаковки молекул адсорбата
Плотность упаковки
(100% соответствует гексагональной плотнейшей упаковке)
Щелевая пора
Цилиндрическая пора
(Ширина поры)/(диаметр молекулы)
P.J.M. Carrott, Colloids and Surfaces, 1991, 58, 385
Влияние ширины поры на плотность упаковки адсорбата
Вид
сверху
Вид
сбоку
F. Rouquerol et al. Adsorption by powders and porous solids. 1999
Анализ экспериментальных изотерм адсорбции на
микропористых адсорбентах
Ультрамикропоры
q
q0(mic)
Mr
W0 (mic ) q0 (mic )
Анализ экспериментальных изотерм адсорбции на
микропористых адсорбентах
Супермикропоры и
внешняя поверхность
q
q0(mic)
Анализ экспериментальных изотерм адсорбции на
микропористых адсорбентах
Микропоры
и мезопоры
q
q0(mic)
Анализ экспериментальных изотерм адсорбции на
микропористых адсорбентах
Адсорбция на неоднородно микропористом образце
Дубинин-Стёкли (1977)
A 2
W W0,i exp
i
Ei
Дубинин (1975)
2
2
A
A
W W0,1 exp W0, 2 exp
E
E
1
2
Ультрамикропоры
Супермикропоры
Применение уравнения Дубинина-Стёкли для определения
распределения микропор по размерам.
Метод молекулярных зондов
1
d0,1
W0,1
2
d0,1 + d0,2
W0,1 + W0,2
3
d0,1 + d0,2 + d0,3
W0,1 + W0,3 + W0,3
n
(d0,i)
(W0,i)
n
n
Распределение микропор по размерам, полученное
методом молекулярных зондов
dW/dd, см3/г/нм
H. F. Stoeckli, Carbon, 1990,28, 1.
d, нм
Анализ экспериментальных изотерм адсорбции на
микропористых адсорбентах
Микропоры + Внешняя поверхность
q = qmic + Sextt
t – толщина полимолекулярного слоя, определяемая
сравнением со стандартным непористым образцом
Микропоры + Внешняя поверхность
q
tg = Sext
W0/Mr = q0(mic)
t
Для расчета Sext Дубинин рекомендует
участок p/p0 = 0.40 – 0.75
Микропоры + Внешняя поверхность
(Пример: адсорбция N2 на микропористом силикагеле)
Bhambhani et al. J. Coll. Interface Sci. 1972, 38, 109
Изотерма адсорбции
αs-график
Определение свойств поверхности по теплоте погружения
(Bansal RC, Donnet JB, Stoeckli F. Active carbon. 1988. pp. 119–162)
E0W0 1 T 1/ 2
im H
hw Sext
2vm
vm – мольный объём адсорбата
- коэффициент термического расширения
hw – энтальпия смачивания внешней поверхности
Определение свойств поверхности по теплоте погружения
E0W0 1 T 1/ 2
im H
hw Sext
2vm
Для микропористых углеродных сорбентов известно
E0(кДж моль-1) = 10.8/d (нм) + 11.4
Smi (м2 г-1)= 2000W0 (см3 г-1)/d (нм)
-4
c
S
+
c
(W
–
c
S
)
+
-iH (Дж-
г-1iH
)=
+
141(W
–
4.110
) + 0.114Sext
-=0.136S
H
=
k
S
+
k
W
+
k
S
mi
0
1
mi
2
0
3
mi
4Smi
ext
i
1 mi
2
0
3 extcS
Для углеродных адсорбентов
Мезопоры
и
капиллярная конденсация
Классификация ИЮПАК изотерм с петлёй гистерезиса
Pure & Appl. Chem., 1985, 57, 603
Уравнение Кельвина
l
p
2 v
RT ln
rK
p0
- поверхностное натяжение
vl – мольный объём жидкой фазы
rK – радиус мениска (радиус Кельвина)
Цилиндрическая пора
rp = rK + t
пар
Щелевая пора
Lр = rK + 2t
тв. фаза
тв. фаза
жидкость
Десорбция
Адсорбция
Простейшая оценка размера мезопор
Гидролитический радиус (rp )
Цилиндрические поры
2W p
rp
S уд
Щелевые поры
2W p
Lp
S уд
Распределение мезопор по размерам
Метод Баррета, Джойнера и Халенды
(BJH: Barrett, Joyner, Halenda)
Уравнение Кельвина справедливо во всем диапазоне
размеров мезопор
Кривизна мениска контролируется формой и
размером пор
Поры имеют правильную и недеформируемую форму
Пористость ограничена только мезопорами
Адсорбция на стенках пор происходит также, как и на
плоской поверхности
Метод Баррета, Джойнера и Халенды
Основан на решении уравнения материального баланса
для объёма пор радиуса ri, соответствующего точке
изотермы (p/p0)i. Понижение давления на небольшой
инкремент приводит к освобождению объёма пор vp(ri)
Пошагово двигаясь от точки полного заполнения мезопор
вдоль десорбционной ветви рассчитывают всю кривую
распределения пор по размерам