kovalentnaya svyas.doc
advertisement

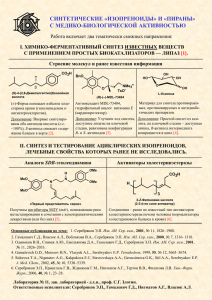
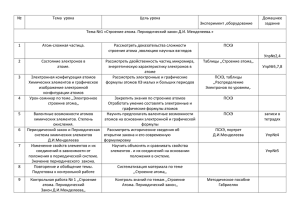
Капранова Ирина Михаиловна Учитель химии МБОУ «Москаленская СОШ» Тема: Ковалентная неполярная химическая связь. Цели: - начать формировать понятие о ковалентной химической связи; -научить учащихся узнавать ковалентную химическую связь и записывать схемы ее образования для H 2,N2 и галогенов; -сформировать понятие о кратности ковалентной связи; -развивать универсальные умения и навыки; -воспитывать культуру учебного труда. Тип урока: урок усвоения новых знаний. Технологии: проблемно-развивающего обучения и ИКТ. Ход урока: I. II. Орг. Этап. Актуализация знаний: 1.Разминка (карточки)---сразу оценки! 2.Уч-ся отвечают на вопросы учителя устно: -что изучали на прошлом уроке? -что такое ионная связь? -что такое ионы? -как возникают ионы? - как узнать количество наружних (валентных) электронов? -какие химические элементы отдают, а какие принимают электроны? 3.Эл. учебник -виртуальная лаборатория (опыт) -повторение ионной связи. 4.Задание на доске: -запишите в тетрадь вещества, в молекулах которых присутствует ионная связь. NaCl, KBr, CaO, Li2O, H2, N2, O3-----проблема! III.Этап постановки проблемы. - какая связь в молекулах H2, N2, O3?---- ОТСЮДА ТЕМА УРОКА-----ЦЕЛЬ (формулируют уч-ся). IV.Этап выхода из проблемной ситуации (изучение н.т.) Цели сформулированы. Этот вид хим. связи - КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ х. с. Наша задача - определить, в молекулах каких веществ и за счет чего она образуется, а также научиться составлять схемы образования этой связи. Эл. учебник ---стр. 3,4,5. Рассматриваем определение ковалентной связи, одинарную, двойную и тройную ковалентную неполярную химическую связь; -учитель поясняет на доске схемы образования Cl2, O2 и N2. 2 ПРАВИЛА: 1.Правило октета: 8- N (N – номер группы, для элементов главных подгрупп); 2. Правило компаса: электроны располагают по 4-м сторонам света, вокруг химического элемента. АЛГОРИТМ составления схемы ковалентной неполярной хим. связи: 1. Найти число внешних электронов хим. элемента и число неспаренных электронов, участвующих в образовании связи; 2. Записать оба хим. знака через + так, чтобы неспаренные электроны были обращены к соседнему знаку. 3. Записать электронную и структурную формулы образования молекул. ЗАПОМНИ: 2+3! V. Закрепление м-ла. Итог урока. 1. Эл. учебник тест (письменно индивид-но в тетрадях) Интерактивные упражнения взаимопроверка-----сразу оценки! № 3,4,5 Сразу проверка! 2. Подведем итоги: Эл. учебник (прослушать правила) VI.Рефлексия. Дом. задание+ инструктаж по его выполнению. & 10 упр.4 (письм.) Выучить правила.