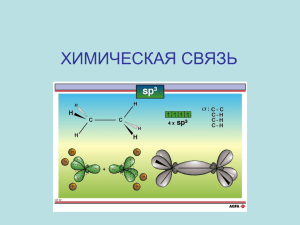
Задание к практике № 3 "Химическая связь и строение молекул".
advertisement
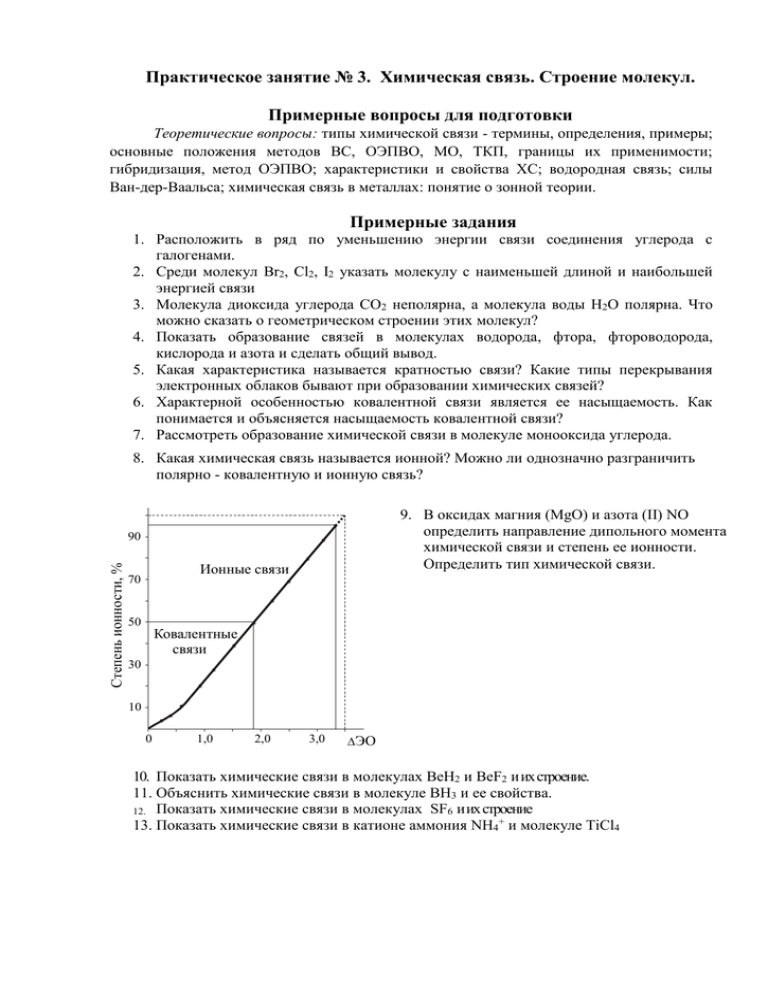
Практическое занятие № 3. Химическая связь. Строение молекул. Примерные вопросы для подготовки Теоретические вопросы: типы химической связи - термины, определения, примеры; основные положения методов ВС, ОЭПВО, МО, ТКП, границы их применимости; гибридизация, метод ОЭПВО; характеристики и свойства ХС; водородная связь; силы Ван-дер-Ваальса; химическая связь в металлах: понятие о зонной теории. Примерные задания 1. Расположить в ряд по уменьшению энергии связи соединения углерода с галогенами. 2. Среди молекул Br2, Cl2, I2 указать молекулу с наименьшей длиной и наибольшей энергией связи 3. Молекула диоксида углерода СО2 неполярна, а молекула воды Н2О полярна. Что можно сказать о геометрическом строении этих молекул? 4. Показать образование связей в молекулах водорода, фтора, фтороводорода, кислорода и азота и сделать общий вывод. 5. Какая характеристика называется кратностью связи? Какие типы перекрывания электронных облаков бывают при образовании химических связей? 6. Характерной особенностью ковалентной связи является ее насыщаемость. Как понимается и объясняется насыщаемость ковалентной связи? 7. Рассмотреть образование химической связи в молекуле монооксида углерода. 8. Какая химическая связь называется ионной? Можно ли однозначно разграничить полярно - ковалентную и ионную связь? 9. В оксидах магния (MgO) и азота (II) NO определить направление дипольного момента химической связи и степень ее ионности. Определить тип химической связи. Степень ионности, % 90 Ионные связи 70 50 Ковалентные связи 30 10 0 1,0 2,0 3,0 ЭО 10. Показать химические связи в молекулах ВеН2 и ВеF2 и их строение. 11. Объяснить химические связи в молекуле ВН3 и ее свойства. 12. Показать химические связи в молекулах SF6 и их строение 13. Показать химические связи в катионе аммония NH4+ и молекуле TiCl4