ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ
advertisement
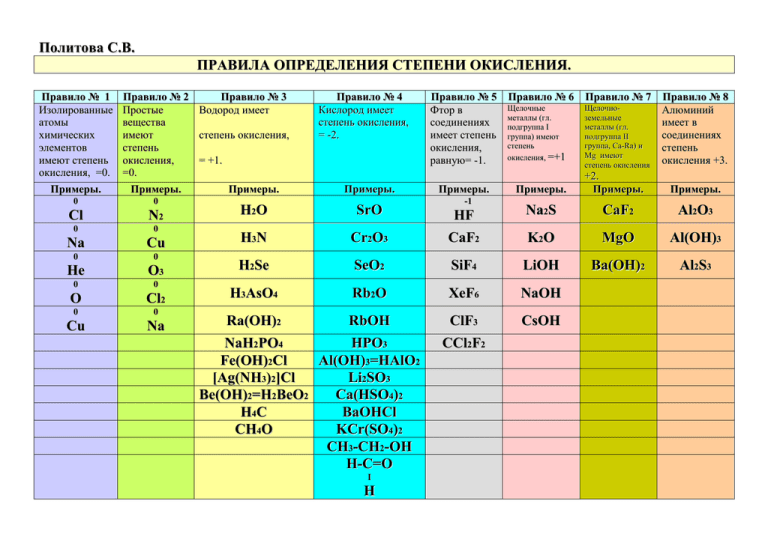
Политова С.В. ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ. Правило № 1 Изолированные атомы химических элементов имеют степень окисления, =0. Примеры. Правило № 2 Простые вещества имеют степень окисления, =0. Примеры. 0 0 Cl N2 0 0 Na Cu 0 0 He O3 0 0 O Cl2 0 0 Cu Na Правило № 3 Водород имеет степень окисления, Правило № 4 Кислород имеет степень окисления, = -2. = +1. Примеры. Примеры. H2O SrO H3N Правило № 5 Правило № 6 Правило № 7 Щелочные ЩелочноФтор в металлы (гл. земельные соединениях подгруппа I металлы (гл. имеет степень группа) имеют подгруппа II степень группа, Са-Ra) и окисления, Mg имеют окисления, =+1 равную= -1. степень окисления +2. Примеры. Примеры. Примеры. -1 Правило № 8 Алюминий имеет в соединениях степень окисления +3. Примеры. Na2S CaF2 Al2O3 Cr2O3 HF CaF2 K2O MgO Al(OH)3 H2Se SeO2 SiF4 LiOH Ba(OH)2 Al2S3 H3AsO4 Rb2O XeF6 NaOH Ra(OH)2 RbOH ClF3 CsOH NaH2PO4 HPO3 Fe(OH)2Cl Al(OH)3=HAlO2 [Ag(NH3)2]Cl Li2SO3 Be(OH)2=H2BeO2 Ca(HSO4)2 H4C BaOHCl CH4O KCr(SO4)2 CH3-CH2-OH H-C=O I H CCl2F2 Исключения. Исключения. Исключения. Исключения. Исключения. Исключения. Исключения. Исключения. +2 Гидриды металлов: OF2-фторид кислорода Н Н +1 -1 MH (KH) -1 Н2О2 -пероксид водорода -1 Е Е +2 -1 MH2(BaH2) -1 M2O2(Na2O2) - перолсиды щелочных металлов -1 -1 MO2(CaO2, Т Т +3 -1 MH3(AlH3) -1 BaO2 ) - пероксиды щелочноземельных металлов -1/2 -1/2 MO2 (NaO2, -1/2 KO2) - надпероксиды щелочных металлов Выводы: высшая положительная степень окисления большинства элементов численно равна номеру группы таблицы элементов, в которой он находится. Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя. АЛГОРИТМ определения степени окисления химического элемента в бинарных соединениях. 1 2 Находим, какой из двух Определяем числовое элементов в соединении значение степени является более окисления для более электроотрицательным. электроотрицательного элемента. (См. правила) Над символом более электроотрицательного элемента ставим знак «минус» (-). Над символом менее электроотрицательного элемента ставим знак «плюс» (+). 3 Определяем общее число отрицательных зарядов в соединении. 4 Находим степень окисления менее электроотрицательного элемента. Для этого степень Для этого общее число окисления более положительных зарядов электроотрицательного делим на индекс у элемента умножаем на данного элемента. его индекс. Помним, что алгебраическая сумма степеней окисления химических элементов в соединении должна быть равна =0. Закрепление: определите степени окисления элементов в заданных формулах бинарных соединений. SiF4, P2O5, As2O5, CaH2, Li3N, OsF8, SiCl4, H3P, SCl4, PCL3, H4C, H3As, SF6, SnBr4, AlN, Sb2O5, CuO, FeO. ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ. Правило № 1 Изолированные атомы химических элементов имеют степень окисления, =0. Примеры. Правило № 2 Правило № 3 Простые Водород имеет вещества имеют степень окисления, степень окисления, =+1. =0. Примеры. Примеры. 0 0 Cl N2 0 0 Na Cu 0 0 He O3 0 0 O Cl2 0 0 Cu Na Правило № 4 Кислород имеет степень окисления, =-2. Примеры. H2O SrO H3N Правило № 5 Правило № 6 Правило № 7 Щелочные ЩелочноФтор в металлы (гл. земельные соединениях подгруппа I металлы (гл. имеет степень группа) имеют подгруппа II степень группа, Са-Ra) и окисления, Mg имеют о к и с л е н и я , = + 1 равную -1. степень окисления +2. Примеры. Примеры. Примеры. -1 Правило № 8 Алюминий имеет в соединениях степень окисления +3. Примеры. Na2S CaF2 Al2O3 Cr2O3 HF CaF2 K2O MgO Al(OH)3 H2Se SeO2 SiF4 LiOH Ba(OH)2 Al2S3 H3AsO4 Rb2O XeF6 NaOH Ra(OH)2 RbOH ClF3 CsOH NaH2PO4 HPO3 Fe(OH)2Cl Al(OH)3=HAlO2 [Ag(NH3)2]Cl Li2SO3 Be(OH)2=H2BeO2 Ca(HSO4)2 H4C BaOHCl CH4O KCr(SO4)2 CH3-CH2-OH H-C=O I H CCl2F2 Исключения. Исключения. Исключения. Исключения. Исключения. Исключения. Исключения. Исключения. +2 Гидриды металлов: OF2-фторид кислорода Н Н +1 -1 MH (KH) -1 Н2О2 -пероксид водорода -1 Е Е +2 -1 MH2(BaH2) -1 M2O2(Na2O2) - перолсиды щелочных металлов -1 -1 MO2(CaO2, Т Т +3 -1 MH3(AlH3) -1 BaO2 ) - пероксиды щелочноземельных металлов -1/2 -1/2 MO2 (NaO2, -1/2 KO2) - надпероксиды щелочных металлов Выводы: высшая положительная степень окисления большинства элементов численно равна номеру группы таблицы элементов, в которой он находится. Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя.


