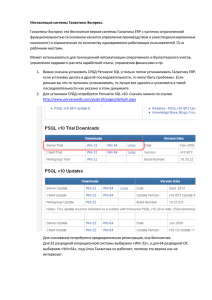
Модулирующее влияние агониста СВ1 рецепторов WIN 55,212-2… Л.В. ШУБИНА , В.Ф. КИЧИГИНА
advertisement

Модулирующее влияние агониста СВ1 рецепторов WIN 55,212-2… 1 Л.В. ШУБИНА1, В.Ф. КИЧИГИНА1,2 Институт теоретической и экспериментальной биофизики РАН, Пущино, Московская обл. 2 Пущинский государственный университет, Московская обл. МОДУЛИРУЮЩЕЕ ВЛИЯНИЕ АГОНИСТА СВ1 РЕЦЕПТОРОВ WIN 55,212-2 НА СУДОРОЖНУЮ АКТИВНОСТЬ Представлены результаты исследования влияния низкой дозы агониста СВ1 рецепторов WIN 55,212-2 на судорожную активность у морских свинок на модели острой эпилепсии (стимуляция перфорирующего пути) и модели эпилептического статуса (введение конвульсанта каиновой кислоты, КА). В 80 % тестов WIN 55,212-2 блокировал развитие острых судорожных разрядов во всех исследуемых структурах. Введение КА животным, которым многократно вводился WIN 55,212-2, не вызывало развитие эпилептического статуса. Эндогенные каннабиноиды (ЭК) – липидные молекулы, являющиеся основными регуляторами синаптической нейротрансмиссии в мозге. Влияния на сигнальные пути посредством ЭК обеспечивают репарацию и выживание клеток. Однако терапевтический потенциал таких влияний исследован недостаточно. В частности, слабо изучена роль ЭК в регуляции судорожной активности на экспериментальных моделях височной эпилепсии – наиболее трудноизлечимой формы различных эпилепсий. В то время как в последние годы проводится активное изучение функционирования ЭК-системы в гиппокампе [1–5], во многих других структурах мозга механизмы действия эндоканнабиноидов практически не исследованы. Целью настоящего исследования было изучение модулирующего влияния агониста СВ1 рецепторов WIN 55,212-2 на острую судорожную активность различных областей мозга и эпилептический статус. Методика Эксперименты проведены в соответствии с международными нормами этического обращения с животными (Experientia. 1995. 51: 1-5). Опыты были поставлены на двух группах бодрствующих морских свинок. За неделю до начала опытов животным вживляли монополярные электроды в поле СА1 гиппокампа (АР = 6,6; L = 3; H = 5), медиальную септальную область (МСО, АР = 12,2; L = 2; H = 7,5; 15°), энторинальную кору (ЭНК, АР = 4,6; L = 5,5; H = 10,5) и центральное ядро амигдалы (ЦАМ, AP = 9,8; L = 5; Н = 10,7) для одновременной регистрации полевых потенциалов (ЭЭГ). В ангулярный пучок имплантировали биполярный электрод для стимуляции перфорирующего пути (ПП, АР = 4,6; L = 4,5; Н = 4). Все микроинъекции фармакологических препаратов производили в левый боковой желудочек через вживленную канюлю (AP = 8,6; L = 2,5; H = 4,7). У всех животных в течение 3-х дней регистрировали исходную ЭЭГ в исследуемых структурах. Затем в течение 3-х дней животным первой группы вводили 2 мкл органического растворителя ДМСО («контроль», n = 2), а животным второй группы – такой же объем агониста СВ1 рецепторов WIN 55,212-2 (2 пкМ, «WIN», n = 4) и регистрировали активность после окончания инъекции. Далее производили электрическую стимуляцию ПП. При этом животным за 2 мин до стимуляции вводили либо ДМСО, либо WIN 55,212-2. После окончания стимуляции исследовали изменения в ЭЭГ указанных структур. Стимуляцию и введения веществ производили ежедневно в течение месяца. После этого вызывали эпилептический статус (конвульсивное состояние); для этого животным обеих групп вводили каиновую кислоту (0,6 мкг/0,6 мкл) и регистрировали активность в течение 3–4 ч. Запись активности и ее спектральный анализ производили с помощью программы Datapac2K2, США, 2005 (частота оцифровки 6 кГц). Для статистического анализа применяли линейную модель одновариантного анализа (one-way ANOVA). Результаты исследований Спонтанная и вызванная стимуляцией ПП активность исследуемых структур мозга. Анализ ЭЭГ бодрствующих морских свинок выявил сходную активность в МСО, гиппокампе, ЭК и амигдале, которая состояла преимущественно из дельта- и тета-волн. Активность в альфа-, бетаи гамма-диапазонах была выражена значительно слабее. Дельта-активность была наиболее выражена в МСО; при этом дельта-волны, как правило, модулировались тета-волнами. В то же время тета-активность в наибольшей степени была свойственна гиппокампу; она отчетливо регистрировалась и в ЭК. В амигдале иногда появлялся альфа-ритм, не характерный для Модулирующее влияние агониста СВ1 рецепторов WIN 55,212-2… остальных структур (рис. 1,А). Введение WIN 55,212-2 и ДМСО не приводило к существенным изменениям спонтанной активности изучаемых структур. Статистический анализ не выявил достоверных различий спектров всех структур (р < 0,05). Не наблюдалось и изменений в поведении животных при инъекции этих веществ. Стимуляция ПП вызывала в регистрируемых структурах потенциалы, переходящие в судорожные послеразряды (СП) (рис. 1,Б,а). В поведении при этом обычно наблюдалось замирание животного и/или непроизвольное жевание. Модуляция судорожной активности под действием WIN 55,212-2. Последующая серия экспериментов показала, что предварительное (за 2 мин) введение WIN 55,212-2 в боковой желудочек мозга в 80 % случаев во всех изучаемых структурах блокировало судорожную активность, вызванную стимуляцией ПП (рис. 1,Б,б). Не наблюдалось и поведенческого ответа на стимуляцию. Резистентность к этому веществу не возникала: после 25–30 дней введения данного агониста его протекторное действие сохранялось. В контрольной группе животных, где вместо WIN 55,212-2 вводилось соответствующее количество органического растворителя ДМСО, блокады острых судорог не происходило (рис. 1,Б,в). Судороги возникали как при первых стимуляциях, так и в большинстве последующих экспериментов. Многократное введение WIN 55,212-2 блокирует эпилептический статус. Дополнительная серия экспериментов была проведена на обеих группах животных после окончания серии со стимуляцией ПП, для исследования влияния WIN 55,212-2 на эпилептический статус. У контрольной группы примерно через 5–7 мин после введения КА развивались конвульсии, которым предшествовали электрографические судороги. У животных, ранее подверженных многократным введениям WIN 55,212-2, КА не вызывала эпилептического статуса; иногда наблюдались лишь электрографические судороги, а также замирание и непроизвольное жевание в поведении. Изменение фоновой активности при многократных введениях WIN 55,212-2. По мере увеличения суммарного количества введенного препарата постепенно происходили изменения в ЭЭГ регистрируемых структур. Они выражались как в увеличении амплитуды полевой активности в целом, так и в изменении ее спектрального состава. Во всех структурах уже после десятого введения препарата увеличивались продолжительность периодов и мощность тета-ритма, что было особенно характерно для гиппокампа. В амигдале и особенно в ЭК возрастала также мощность дельта-активности (рис. 1,В,Г). В то же время в контрольных опытах (при введении ДМСО) изменений тета-активности не обнаружено. Обсуждение результатов Проведенное исследование впервые показало, что внутримозговое системное введение WIN 55,212-2 предотвращает развитие судорожной активности в различных структурах мозга. Необходимо отметить, что явное антиконвульсивное действие WIN 55,212-2 проявлялось при его введении в чрезвычайно низких количествах – 2÷310–12 моль, тогда как другие антиконвульсанты действуют в микромолярных количествах. Недавние исследования показали, что основным механизмом действия ЭК является модуляция ретроградной синаптической коммуникации [6–7] и подавление выделения нейротрансмиттеров посредством активации СВ1 рецепторов на аксонных терминалях нейронов во многих мозговых структурах [8]. Таким образом, ЭК сигнализация может представлять собой ключевой механизм, который контролирует степень пресинаптической активности в ситуациях, когда нейронная возбудимость становится несбалансированной [9]. Обнаружено, что посредством активации CB1 рецепторов может снижаться выделение нервными клетками глутамата, ГАМК и других нейропередатчиков в неокортексе, гиппокампе, базальных ганглиях, среднем мозге и мозжечке [8, 10]. В сумме накопленные данные указывают на то, что ЭК играют внутреннюю протекторную роль в подавлении патологической нейронной возбудимости. Модулирующее влияние агониста СВ1 рецепторов WIN 55,212-2… Рис. 1. Полевые потенциалы, одновремено зарегистрированные в МСО, гиппокампе, ЭНК и ЦАМ: А – фоновая активность; Б – активность, вызванная электрической стимуляцией ПП в контроле (а), после введения ДМСО (б) и WIN55,212-2 (в). Стрелкой показано окончание стимуляции; В – функции спектральной плотности в контроле (а) и после многократного введения WIN55,212-2 (б). Во всех структурах (кроме МСО) усиливается тета- и дельта-ритм; Г – гистограммы спектральных плотностей в дельта- и тета-диапазонах фоновой активности (контроль) и после многократного введения ДМСО или WIN 55,212-2. Различия статистически значимы при p 0,05 и p 0,01 В наших экспериментах во всех структурах вызванные потенциалы и затем судорожная активность вызывались посредством активации глутаматергического ПП, волокна которого иннервируют гиппокамп. Ответы в ЭК возникали путем антидромного распространения Модулирующее влияние агониста СВ1 рецепторов WIN 55,212-2… возбуждения по ПП; кроме этого, они могли модулироваться посредством афферентных проекций от гиппокампа [11]. Очевидно, что в амигдале реакции возникали за счет связей с гиппокампом [12]. Активность в МСО при раздражении ПП, по-видимому, возникает после антидромной активации нейронов энторинальной коры, которая затем передается по кортикально-септальным связям [13]. Таким образом, очевидно, что во всех структурах вызванные ответы и судорожные послеразряды опосредовались глутаматергическими волокнами и, следовательно, протекторное действие WIN 55,212-2 осуществлялось посредством угнетения глутаматергической передачи. Это предположение подтверждается фактами, полученными другими авторами. Так, удаление СВ1 рецепторов на глутаматергических терминалях гиппокампальных нейронов или СВ1 гена у глутаматергических кортикальных нейронов приводило к значительному снижению порога судорог, вызываемых каиновой кислотой [1, 4]. Более того, в нашей работе впервые обнаружено постепенное возрастание тета-ритма при повторных введениях WIN 55,212-2 во всех регистрируемых структурах. Таким образом, активация СВ1 рецепторов защищает мозг от развития эпилептического статуса после введения КА, возможно благодаря возрастанию тета-осциляций. Протекторная роль тета-ритма ранее была показана в работах других авторов в различных моделях эпилепсии [14–17]. Факты настоящей работы согласуются с результатами, полученными ранее на переживающих срезах гиппокампа [18–19], на культуре гиппокампальных нейронов [2–3, 20] и в опытах in vivo [21–22], где показано протекторное значение эндоканнабиноидной системы мозга при развитии судорожной активности. Полученные результаты могут помочь в разработке новых препаратов для лечения височной эпилепсии. СПИСОК ЛИТЕРАТУРЫ 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Marsicano G., Goodenough S., Monory K. et al. // Science. 2003. V. 302. P. 84. Deshpande L.S., Blair R.E., Ziobro J.M. et at. // Eur. J. Pharmacol. 2007. V. 58. P. 52. Deshpande L.S., Sombati S., Blair R.E. et al. // Neurosci. Lett. 2007. V. 411. P. 11. Monory K., Massa F., Egertova M. et al. // Neuron. 2006. V. 51. P. 455. Coomber B., O’Donoghue, F.M., Mason R. // Synapse. 2008. V. 62. P. 746 Wilson R.I., Nicoll R.A. // Science. 2002. V. 296. P. 678. Hashimotodani Y., Ohno-Shosaku T., Kano M. // Neuroscientist. 2007. V. 13. P. 127. Freund T.F., Katona I., Piomelli D. // Physiol. Rev. 2003. V. 83. P. 1017. Lutz B. // Biochem. Pharmacol. 2004. V. 68. P. 1691. Köfalvi A. Cannabinoids and the Brain. – N. York: Springer, 2008. Calderazzo L., Cavalheiro E.A., Macchi G. et al. // Brain Res. Bul. 1996. V. 40. №. 4. P. 12. 13. 14. 15. 16. 17. 18. 19. 20. Cenquizca L.A., Swanson L.W. // Brain Res. Rev. 2007. V. 56. P. 1. Leranth C., Carpi D., Buzsaki G., Kiss J. // Neuroscience. 1999. V. 88. P. 701. Miller J.W., Turner G.M., Gray B.C. // Epilepsy Res. 1994. V. 18. P. 195. Ferencz I., Leanza G., Nanobashvili A. et al. // Neuroscience. 2001. V. 102. P. 819. Colom L.V., Garcia A., Sanabria E.R. et al. // J. Neurophysiol. 2006. V. 95. P. 3645. Kitchigina V.F., Butuzova M.V. // Exp. Neurol. 2009. V. 216. P. 449. Ameri A., Simmet T. // Arch. Pharmacol. 2000. V. 361. №3. P. 265. Koda S., Takeda S., Onimaru H. et al. // Biomed. Res. 2005. V. 26. P. 241. Blair R.E., Deshpande L.S., Sombati S. et al. // J. Pharmacol. Exp. Ther. 2006. V. 317. P. 21. Wallace M.J., Blair R.E., Falenski K.W. et al. // J. Pharmacol. Exp. Ther. 2003. V. 307. 22. Wallace M.J., Wiley J.L., Martin B.R., DeLorenzo R.J. // Eur. J. Pharmacol. 2001. V. 428. 245. 1072. P. 129. P. 51.