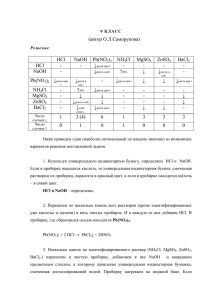
Решения заданий II этапа олимпиады по химии (8 класс)
advertisement

ХИМИЯ – 2014/2015 8 класс очный тур 1. Назовите типы химических реакций. Приведите примеры каждого, используя для составления уравнений реакций только следующие вещества: S, O2, H2O, Ca, H2SO4, Cu(OH)2. Решение Типы химических реакций: соединение, разложение, замещение, обмен. 4 × 1 = 4 балла Реакции соединения: S + O2 = SO2, S + Ca = CaS, 2Ca + O2 = 2CaO. Реакции разложения: При действии электрического тока: 2H2O = 2H2 + O2, При нагревании: Cu(OH)2 = CuO + H2O. Реакции замещения: Ca + 2H2O = Ca(OH)2 + H2, Ca + H2SO4 = CaSO4 + H2. Реакции обмена: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O. 8 × 2 = 16 баллов 20 баллов 2. Студент добавил воду в пробирку с раствором серной кислоты, затем прилил в него раствор хлорида натрия, наклоняя склянку с раствором вверх этикеткой, и нагрел пробирку, держа её в руке, направляя отверстием в сторону своего однокурсника и проверяя при этом запах выделяющихся веществ, наклоняясь близко к отверстию пробирки. Получит ли студент зачёт по лабораторной работе? Ответ мотивируйте, перечислив все случаи нарушения студентом техники безопасности и опишите, как правильно проводить подобный эксперимент. Решение Студент не получит зачёт, так как он несколько раз нарушил технику безопасности. 1 балл 1 Случаи нарушения студентом техники безопасности: 1. Приливание воды в раствор серной кислоты. 2. Нагревание пробирки в руке. 3. Направление пробирки при нагревании отверстием в сторону своего однокурсника. 4. Проверка запаха вещества. 4 × 1 = 4 балла 1. Разбавлять серную кислоту можно, приливая её раствор осторожно в воду, так как кислота тяжелее воды. Иначе более лёгкая вода будет разбрызгиваться и, так как разбавление сопровождается разогреванием раствора, возможны ожоги. 2. При проведении эксперимента необходимо нагревать пробирку, закрепив её в пробиркодержателе. 3. Сначала прогревают всю пробирку, чтобы она не лопнула, а затем нагревают раствор, направляя пробирку отверстием от себя и находящихся рядом людей. 4. Запах вещества определяют, когда пробирка уже не нагревается, и при этом направляют к себе ладонью небольшую порцию газа. 4 × 3 = 12 баллов 17 баллов 3. Одна капля воды занимает объём 10–4 л. Сколько молекул воды будет потеряно в сутки, если водопроводный кран неисправен, и вода капает из него со скоростью 1 капля в минуту (содержащимися в воде примесями пренебречь). Решение Так как вода капает со скоростью 1 капля в минуту, то в сутки будет потеряно: 10-4 × 60 × 24 = 0,144 л. 1 балл Так как вода при нормальных условиях находится в жидком состоянии, то нельзя находить число молекул, используя объём. Плотность воды равна 1 г/мл, то есть 0,144 л = 144 мл весят 144 г. 2 балла Зная массу воды, находим число частиц: N = (m·NA)/M = 144·6,022·1023/18 = 4,8176·1024 молекул 3 балла 6 баллов 2 4. Карбонат какого металла II группы таблицы Периодической системы химических элементов Д.И. Менделеева был взят, если при добавлении избытка раствора соляной кислоты к 30,2 г образца, содержащего 2 % примесей, выделилось 4,48 л углекислого газа? Решение Найдём массу чистого вещества в образце: ω (чистого вещества) = 100 – 2 = 98 % или 0,98. 1 балл m (чистого вещества) = m (образца) · ω (чистого вещества) = 30,2 · 0,98 = 29,596 (г). 1 балл Найдём молярную массу вещества по уравнению реакции: 2HCl + MCO3 = MCl2 + H2O + CO2 или MCO3 = MO + CO2 n(MCO3) = n(CO2) = V/VM = 4,48/22,4 = 0,2 (моль) M(MCO3) = m(MCO3)/n(MCO3) = 29,596/0,2 = 147,98 (г/моль) 2 балла M(MCO3) = М(М) + М(СО32-), тогда М(М) = M(MCO3) – М(СО32-) = 147,98 – 60 = 87,98 (г/моль) 1 балл Этот металл – стронций. Формула карбоната стронция: SrCO3. 2 балла 7 баллов Сумма: 50 баллов 3