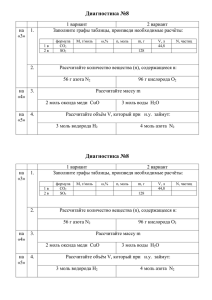
Задачи по химии для учащихся 10 класса 1. Имеется два сосуда
advertisement

Задачи по химии для учащихся 10 класса 1. Имеется два сосуда, заполненных смесями газов: а) Н2 и С12; б) Н2 и О2. Как изменится давление в сосудах при пропускании через эти смеси электрической искры? Ответ. а) Давление не изменится; б) давление уменьшится. 2. При взаимодействии 0,91 г некоторого металла с раствором соляной кислоты выделилось 0,314 л водорода. Определите этот металл. Ответ. Цинк. 3. Газ, полученный при прокаливании 4,9 г бертолетовой соли, смешали в сосуде вместимостью 4 л с газом, полученным при взаимодействии 6 г кальция с водой. Определите давление газовой смеси в сосуде при температуре 27 °С. Ответ. р = 131 кПа. 4. Рассчитайте равновесные концентрации водорода и йода при условии, что их начальные концентрации составляли 0,02 моль/л, а равновесная концентрация HI — 0,03 моль/л. Рассчитайте константу равновесия. Ответ. [Н2]равн = [I2]равн = 0,005 моль/л; Кс = 36. 5. Найдите молярную концентрацию 30% -ной серной кислоты (плотность раствора 1,22 г/мл). Ответ. C(H2SO4) = 3,73 моль/л. 6. Массовая доля сульфата калия в насыщенном при 10 °С водном растворе равна 8,44%. Вычислите массу сульфата калия, которая растворится в 100 г воды при этой же температуре. Ответ. 9,22 г K2SO4. 7. В 100 мл воды растворили 20 г пентагидрата сульфата меди (II). Рассчитайте массовую долю соли в полученном растворе. Ответ. 10,7% CuSO4. 8. Какое количество вещества бария нужно взять, чтобы при его взаимодействии с 1 л воды образовался 2%-ный раствор гидроксида бария? Ответ. 0,119 моль Ва. 9. Какую массу ВаСl2∙2Н2О необходимо добавить к 100,0 мл 40,0% -ного раствора H2SO4 (p = 1,30 г/мл), чтобы получить раствор, в котором массовая доля серной кислоты равна 10,0% ? Ответ. 96,0 г ВаСl2∙2Н2О. 10. Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20% -ной соляной кислоты (плотность 1,1 г/мл) на 4,0 г сульфида железа (II). Ответ. 19,3% FeCl2, 7,3% НСl. 11. К 50 мл раствора карбоната калия с концентрацией 3 моль/л и плотностью 1,30 г/мл медленно добавлено 35,7 мл 17%-ного раствора хлорида цинка с плотностью 1,12 г/мл. Выпавший осадок отфильтрован. Вычислите массовые доли соединений, содержащихся в полученном фильтрате. Ответ. 7,5% КСl, 5,0% КНСО3, 10,4% К2СО3.
![1) Для понижения концентрации [Fe ] до 10](http://s1.studylib.ru/store/data/004531731_1-c9f9271cd2d1cf918ee273e513a5f409-300x300.png)